胃癌组织中ERCC1基因的高甲基化及DNMT1的表达
张 杰,张 梅,姜相君
大连医科大学附属青岛市市立医院消化内二科,山东 青岛 266011
胃癌组织中ERCC1基因的高甲基化及DNMT1的表达
张 杰,张 梅,姜相君
大连医科大学附属青岛市市立医院消化内二科,山东 青岛 266011
目的 探讨人切除修复交叉互补基因1(excision repair cross-complementing gene 1,ERCC1)基因启动子CpG岛甲基化和DNA甲基转移酶1(DNA methyltransferase 1,DNMT1)基因的表达与胃癌发生的关系及临床意义。方法 采用甲基化特异性PCR(MSP)技术检测60例胃癌组织及其相应癌旁正常组织中ERCC1基因启动子区甲基化状态。同时应用逆转录聚合酶链反应(real-time RT-PCR)法和免疫组化(IHC)SP法分别检测ERCC1及DNMT1基因的mRNA和蛋白表达水平。结果 胃癌组织中ERCC1基因启动子CpG岛甲基化阳性率为68.3%,明显高于相应的癌旁正常组织(23.3%)。胃癌组织中ERCC1 mRNA阳性率显著低于癌旁正常组织(31.7%vs71.7%,P<0.05),而胃癌组织中DNMT1 mRNA阳性率明显增高,差异均有统计学意义(78.3%vs16.7%,P<0.05)。ERCC1 mRNA 阴性表达的胃癌组织中基因启动子的甲基化率较ERCC1 mRNA阳性表达者明显升高,差异具有统计学意义(92.7%vs15.8%,P<0.001)。结论 ERCC1基因启动子CpG岛高甲基化及DNMT1基因表达上调可能参与胃癌的发生与发展。DNMT1可能调控ERCC1基因的甲基化。
胃癌;ERCC1基因;甲基化;DNMT1
在消化系统恶性肿瘤中,胃癌是主要的致死疾病之一,大部分患者诊断时已经为晚期,所以胃癌的早期诊断尤为重要。胃癌发生与发展是一个多基因、多步骤参与的复杂过程,其中包括癌基因的过度表达与抑癌基因的表达失活等,表观遗传学机制起着重要作用,而其中最常见就是的DNA甲基化[1]。越来越多的研究[2-4]证实,抑癌基因启动子区CpG岛的高甲基化参与肿瘤的发生、发展过程。DNA甲基化是指在甲基化转移酶的催化下DNA序列中的腺嘌呤(A)或胞嘧啶(C)碱基与甲基发生共价结合的过程[5],DNMT1在甲基化过程中起最主要的、维持甲基化状态的作用[6]。相关研究已经表明:在胃癌组织中ERCC1基因的表达较正常的胃黏膜组织有所降低[7-10]。胃癌组织中ERCC1基因的低表达或许与DNMT1存在一定的关系。本研究采用甲基化特异性PCR检测60例胃癌组织及其相应的癌旁正常组织中ERCC1基因启动子CpG岛甲基化状态;同时应用逆转录聚合酶链反应(real-time RT-PCR)法和免疫组化(IHC)SP法分别检测ERCC1及DNMT1基因的mRNA和蛋白表达水平,并初步探讨其与胃癌发生、发展的相关性。
1 资料与方法
1.1 一般资料收集青岛市市立医院2014年1月-2014年10月普外科切除的新鲜胃肿瘤标本60例,标本经病理组织学确诊为原发性胃癌,术前未行放化疗等抗肿瘤治疗,拥有完整的临床资料。60例患者中男37例,女23例,年龄35~75岁,中位年龄55岁。胃癌组织取自癌灶中央非坏死区域,癌旁正常组织取距离癌组织5 cm以上,经病理证实,组织均正常。所有标本均于术后半小时内获得,液氮速冻后-80 ℃冰箱保存。
1.2 主要试剂基因组DNA提取试剂, DNA甲基化试剂盒,Trizol、RT-PCR反应试剂盒,免疫组化试剂盒。
1.3 方法
1.3.1 组织DNA提取和甲基化修饰:每个样本取30 mg左右组织块进行匀浆处理,参照组织基因组DNA提取试剂盒说明书提取基因组DNA,紫外分光光度仪测定 DNA 浓度和纯度,OD260/OD280 比值在1.8~2.0之间的DNA用于甲基化修饰。各样本DNA取800 ng参照EZ DNA甲基化试剂盒说明书进行甲基化修饰,修饰好的DNA洗脱后保存于-20 ℃冰箱中。
1.3.2 引物设计:根据ERCC1基因启动子区CpG岛DNA序列,设计ERCC1甲基化引物为:M,F:5′-TTTAGGATTATAGAGAGTAGCGCGA-3′,R:5′-CAAAAAAAATAAAAACGATACAACG-3′。非甲基化引物:U,F:5′-TTTAGGATTATAGAGAGTAGTGTGA-3′,R:5′-AAAAAAATAAAAACAATACAACACC-3′。
1.3.3 甲基化特异性PCR(methylation specific PCR,MSP):取修饰后的DNA 2 μl进行MSP反应。反应体系按照PCR试剂盒的推荐量25 μl体系进行,其中PCR混合液12.5 μl,上下游引物各0.5 μl,修饰后的DNA 2 μl,灭菌双蒸水9.5 μl。MSP循环条件为:97 ℃预变性5 min后,95 ℃变性45 s,甲基化引物和非甲基化引物分别在57 ℃、55 ℃退火60 s,72 ℃延伸60 s,共40个循环,最后于72 ℃延伸10 min。扩增后,每种PCR产物取10 μl在2.5%的琼脂糖凝胶上电泳,染色用溴化乙锭,并在紫外光照射下观察分析。
1.3.4 组织RNA提取:取0.5 g组织用研磨棒充分研磨,然后放入Trizol(日本TakaRa公司)1 ml中,按照试剂说明书进行操作,得到的RNA经1%琼脂糖凝胶电泳鉴定其完整性,并用核酸蛋白分析仪检测其浓度及其A值,测得1.8~2.0,符合纯度要求,置于-80 ℃冰箱保存。
1.3.5 逆转录-多聚合酶链反应(real-time RT-PCR):取RNA 1 μg,严格按照逆转录试剂盒(日本TaKaRa公司)说明书操作合成cDNA。用β-actin作为内参进行PCR,其上游引物为:5′-CCTTCCTTCCTGGGCATGGAGTCCTG-3′,其下游引物为:5′-GGAGCAATGATCTTGACTTC-3′;ERCC1上游引物为:5′-TCACACAACCTGCACCCAGACTAC-3′,下游引物为:5′-CTGACTGTCTTTGTTGACTGA-3′;DNMT1上游引物为:5′-CGGTTCTTCCTCCTGGAGAATGTCA-3′,下游引物为:5′-CACTGATAGCCCATGCGGACCA-3′,引物均由上海生工生物工程技术有限公司合成。PCR反应体系为20 μl,由SYBR® Premix Ex TaqTM Ⅱ(×2)10.0 μl,上下游引物(10 μmol/L)各0.8 μl,cDNA模板2.0 μl,ROX Reference Dye(×50)0.4 μl,灭菌蒸馏水6.0 μl。PCR反应参数:95 ℃预变性30 s,95 ℃ 5 s、65 ℃ 30 s、72 ℃ 30 s,共40个循环。PCR产物于2.5%琼脂糖凝胶电泳,Gel ID凝胶图像分析系统摄片并分析测定其光密度。计算各个样本mRNA的表达相对值,表达相对值=ERCC1积分光密度/β-actin内对照积分光密度,积分光密度=条带强度×条带面积。
1.3.6 免疫组化SP法:SP染色按照试剂盒说明书操作,以3%过氧化氢室温孵育15 min消除内源性过氧化物酶活性,抗原热修复,常规IHC标记,DAB染色,苏木素衬染,中性树胶封片,显微镜观察。取已知阳性片在同一条件下染色作为阳性对照,PBS代替一抗作为阴性对照。
1.3.7 IHC结果判定:ERCC1、DNMT1阳性主要位于细胞核中,细胞浆可有少量表达,显微镜下随机观察5个高倍镜视野(400×),着色打分:不着色为0分;淡黄色为1分;棕黄色为2分;褐色为3分。染色细胞所占比例打分:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。两者相乘,0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++),将阴性与弱阳性视为阴性表达,阳性与强阳性视为阳性表达。
1.4 统计学处理应用SPSS 17.0软件进行统计学处理,计量资料数据组间比较采用t检验,计数资料比较采用χ2检验,P为双侧性检验,P<0.05认为差异有统计学意义。
2 结果
2.1 胃癌组织与癌旁正常组织中ERCC1启动子区的甲基化情况胃癌组织中ERCC1基因启动子区甲基化率为68.3%(41/60),明显高于癌旁正常组织(23.3%,14/60),差异有统计学意义(χ2=24.47,P<0.001,见图1、表1)。
2.2 胃癌组织与癌旁正常组织中ERCC1与DNMT1的mRNA表达情况胃癌组织中ERCC1 mRNA阳性率(31.7%,19/60)显著低于癌旁正常组织(71.7%,43/60,P<0.05);而胃癌组织中DNMT1 mRNA阳性率(78.3%,47/60)明显高于癌旁正常组织(16.7%,10/60,P<0.05)。在ERCC1 mRNA表达下调的胃癌组织中DNMT1 mRNA的表达高于ERCC1 mRNA表达正常的组织,差异有统计学意义(χ2=12.26,P<0.05,见表2)。
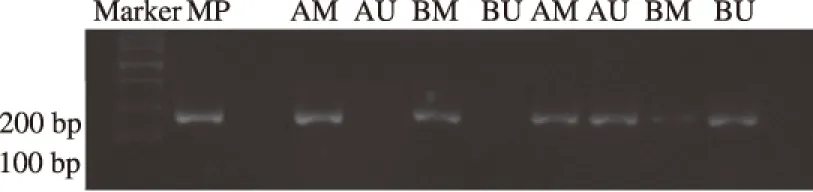
A:胃癌组织;B:癌旁正常组织;MP:甲基化阳性对照;M:甲基化条带;U:非甲基化条带。
图1 ERCC1基因MSP产物的电泳图谱
Fig 1 The electrophoretic pattern of ERCC1 MSP production

表1 胃癌组织的ERCC1蛋白的阳性率和ERCC1基因甲基化[例数(%)]
表2 ERCC1与DNMT1在胃癌组织中表达的相关性
Tab 2 Correlation between ERCC1 and DNMT1 in gastric cancer

ERCC1mRNADNMT1mRNA高表达正常表达χ2值P值低表达36712.26<0.05正常表达711
2.3 胃癌组织与癌旁正常组织ERCC1、DNMT1蛋白表达情况胃癌组织与癌旁正常组织中ERCC1、DNMT1蛋白表达率与mRNA基本一致,ERCC1蛋白在癌旁正常组织中的表达阳性率为93.3%(56/60),明显高于胃癌组织(56.7%,34/60),差异有统计学意义(χ2=21.21,P<0.001)。DNMT1蛋白在胃癌组织中的表达阳性率为71.7%(43/60),明显高于癌旁正常组织(16.7%,10/60),差异有统计学意义(χ2=26.81,P<0.001)。
2.4 胃癌组织中ERCC1基因启动子区CpG岛甲基化状态与ERCC1 mRNA表达之间的关系在41例ERCC1 mRNA阴性表达的胃癌组织中,检测出38例(92.7%)该基因启动子区CpG岛甲基化,而在ERCC1 mRNA表达阳性的19例胃癌组织中,仅检测出3例(15.8%)基因启动子甲基化,差异有统计学意义(χ2=35.48,P<0.001)。
2.5 胃癌组织中ERCC1与DNMT1蛋白表达之间的相关性分析胃癌组织中的ERCC1与DNMT1蛋白的表达呈负相关(r=-0.669,P<0.001,见图2)。

图2 ERCC1积分值与DNMT1积分值相关分析
3 讨论
ERCC1基因位于染色体19q13.2,全长15 kb,含10个外显子,该基因在核苷酸切除修复(NER)途径中起着重要作用,是NER过程中的先导基因[11],该基因编码一种单链DNA核酸内切酶,与化学交联聚乙烯(XPE)形成二聚体,识别损伤切割DNA,使突变的基因得到修复,防止细胞进一步癌变,降低肿瘤的发病风险[12]。
检测肿瘤抑癌基因的甲基化可以用于癌症的诊断与治疗。目前有相关研究发现,DNA甲基化在一定程度上是可逆的,而DNA甲基化需要DNMT的催化,因此可以应用甲基转移酶抑制剂阻断DNA维持甲基化状态,称为去甲基化[5]。大量的体外研究证实,应用5-氮杂-2-脱氧胞苷处理后,抑癌基因表达缺失的胃癌细胞株均重新表达该基因,故通过抑癌基因去甲基化可恢复基因的正常功能,为肿瘤的治疗提供了一个新的方法[13-14]。
本研究发现:胃癌组织中ERCC1启动子区的甲基化率较正常组织明显升高,差异具有统计学意义,推测ERCC1表达的缺失与该基因启动子的甲基化存在一定的关系,抑癌基因高甲基化可能导致表达的降低或缺失,而DNMT1在甲基化的过程中起着维持甲基化的作用。我们对ERCC1的甲基化与DNMT1的关系进行了初步的研究。本研究结果显示:DNMT1蛋白在胃癌组织中的表达较正常组织明显升高,DNMT1与ERCC1蛋白的表达呈负相关,差异具有统计学意义(P<0.05)。综合以上研究结果,初步推测:胃癌组织中DNMT1的mRNA及蛋白表达显著增高,导致抑癌基因ERCC1基因启动子区发生异常甲基化,使抑癌基因mRNA及蛋白表达减少或缺失,失去抑制作用,具体发生机制还有待大样本实验进一步研究证实。
目前胃癌仍是世界上最常见的恶性肿瘤之一,外科手术治疗是目前的主要手段,但是早期诊断及早期手术是降低胃癌病死率的关键。本研究结果有助于进一步完善胃癌发生过程中的表观遗传修饰理论,为胃癌的诊治提供新的思路,为胃癌的预防、早期诊断及治疗提供试验和理论依据。
[1]Goswami UC, Sharma N. Efficiency of a few retinoids and carotenoids in vivo in controlling benzo [a].pyrene-induced forestomach tumour in female swiss mice [J]. Br J Nutr, 2015, 94(4): 540-543.
[2]Kurkjian C, Kummar S, Murgo AJ. DNA methylation: its role in cancer development and therapy [J]. Curr Probl Cancer, 2008, 32(5): 187-235.
[3]Delpu Y, Cordelier P, Cho W C, et al. DNA methylation and cancer diagnosis [J]. Int J Mol Sci, 2013, 14(7): 15029-15058.
[4]Aran D, Sabato S, Hellman A. DNA methylation of distal regulatory sites characterizes dysregulation of cancer genes [J]. Genome Biol, 2013, 14(3): R21.
[5]Deng DJ. DNA methylation and demethylation: current status and future perspective [J]. Hereditas (Beijing), 2014, 36(5): 403-410. 邓大君. DNA 甲基化和去甲基化的研究现状及思考[J]. 遗传, 2014, 36(5): 403-410.
[6]Fukagawa A, Ishii H, Miyazawa K, et al. δEF1 associates with DNMT1 and maintains DNA methylation of the E-cadherin promoter in breast cancer cells [J]. Cancer Med, 2015, 4(1): 125-135.
[7]He J, Xu Y, Qiu LX, et al. Polymorphisms in ERCC1 and XPF genes and risk of gastric cancer in an eastern Chinese population [J]. PLoS One, 2012, 7(11): e49308.
[8]Wei KK, Jiang L, Wei YY, et al. The prognostic value of ERCC1 expression in gastric cancer patients treated with platinum-based chemotherapy: a meta-analysis [J]. Tumour Biol, 2014, 35(9): 8721-8731.
[9]Zhou QR, Qiu H, Hu GY, et al. Expression and clinical significance of ERCC1 and FGFR2 in gastric carcinoma [J]. Cancer Research on Prevention and Treatment, 2012, 39(11): 1344-1348. 周倩茹, 邱红, 胡广原, 等. ERCC1和FGFR2在胃癌组织中的表达及其临床意义[J]. 肿瘤防治研究, 2012, 39(11): 1344-1348.
[10]Liu MR, Wang WB. Expression of ERCC1 and AKT1 in gastric cancer tissues and pericarcinom tissues and their clinical significance [J]. Journal of Shandong University (Health Science), 2010, 48(3): 86-89, 101. 刘美荣, 王潍博. 胃癌组织与癌旁组织中ERCC1与AKT1的表达及临床意义[J]. 山东大学学报(医学版), 2010, 48(3): 86-89, 101.
[11]Li X. Research progress of excision repair cross-complementing gene1 [J]. Journal of Clinical and Experimental Medicine, 2010, 9(22): 1747-1749. 李霞. 切除修复交叉互补基因1的研究进展[J]. 临床和实验医学杂志, 2010, 9(22): 1747-1749.
[12]Han Y. mRNA expression and clinical significance of ERCC1, BRCA1, RRM1, TYMS and TUBB3 in postoperative patients with non-small cell lung cancer [J]. Asian Pac J Cancer Prev, 14(5): 2987-2990.
[13]Wijermans P, Lübbert M, Verhoef G, et al. Low-dose 5-aza-2′-deoxycytidine, a DNA hypomethylating agent, for the treatment of high-risk myelodysplastic syndrome: a multicenter phase II study in elderly patients [J]. J Clin Oncol, 2000, 18(5): 956-962.
[14]Reinhold WC, Reimers MA, Lorenzi P, et al. Multifactorial regulation of E-cadherin expression: an integrative study [J]. Mol Cancer Ther, 2010, 9(1): 1-16.
(责任编辑:马 军)
Promoter methylation of the ERCC1 genes and DNMT1 expression in gastric cancer
ZHANG Jie, ZHANG Mei, JIANG Xiangjun
Department of Gastroenterology, the Affiliated Qingdao Municipal Hospital of Dalian Medical University, Qingdao 266011, China
Objective To investigate promoter methylation of ERCC1 gene,expression of DNMT1 and the relationship between expression of DNMT1 and gastric cancer.Methods Methylation status of the ERCC1 gene in 60 gastric cancer tissues and 60 normal tissues adjacent to cancer were detected by methylation-specific PCR (MSP). RT-PCR was used to detect the mRNA expressions of ERCC1 and DNMT1, immunohistochemistry (IHC) was employed to detect the protein expressions of ERCC1 and DNMT1 in the above samples.Results The positive rate of promoter methylation of the ERCC1 in gastric cancer was 68.3%, higher than that in normal tissues adjacent to cancer (23.3%,P<0.001).The positive rate of ERCC1 expression in gastric cancer was significantly lower than that in normal tissues adjacent to cancer (31.7%vs71.7%,P<0.05). DNMT1 mRNA expression was higher compared with normal tissues adjacent to cancer(78.3%vs16.7%,P<0.05). Methylation rate of ERCC1 mRNA negative expression in gastric cancer was significantly higher than that of ERCC1 mRNA positive expresion in gastric cancer (92.7%vs15.8%,P<0.001).Conclusion The promoter methylation of the ERCC1 gene and high expression of DNMT1 may be associated with the occurrence of gastric cancer.
Gastric cancer; ERCC1 gene; Methylation; DNMT1
张杰,硕士在读,研究方向:消化系疾病。E-mail:zj382506550@163.com
姜相君,教授,博士生导师,主任医师,研究方向:消化系疾病。E-mail:drjxj@163.com
10.3969/j.issn.1006-5709.2016.06.008
R735.2
A
1006-5709(2016)06-0626-04
2015-07-22

