基质金属蛋白酶-11在胃癌组织中的表达及其与临床病理特征的关系
徐 进,王 斌,陈 珺,刘 颖,汪启斌,刘涵翰
湖北医药学院附属人民医院 1.消化内科; 2.胃肠外科; 3.病理科,湖北 十堰 442000
基质金属蛋白酶-11在胃癌组织中的表达及其与临床病理特征的关系
徐 进1,王 斌1,陈 珺1,刘 颖1,汪启斌2,刘涵翰3
湖北医药学院附属人民医院 1.消化内科; 2.胃肠外科; 3.病理科,湖北 十堰 442000
目的 探讨胃癌组织中基质金属蛋白酶-11(matrix metalloproteinase,MMP-11)在胃癌中的表达,分析其与临床病理特征之间的关系。方法 采用免疫组织化学(IHC)和RT-PCR方法检测44例胃癌患者手术标本、癌旁组织标本中MMP-11蛋白及MMP-11 mRNA的表达,分析其与胃癌临床病理特征之间的关系。结果 MMP-11蛋白在胃癌、癌旁组织中的表达阳性率分别为72.7%、11.4%,差异有统计学意义(P<0.05)。MMP-11 mRNA在癌旁组织与胃癌组织中的表达水平差异有统计学意义(P<0.05);MMP-11的表达与胃癌患者性别、年龄、病变部位及病变长度无相关性(P>0.05),而与胃癌浸润深度、分化程度及淋巴结转移具有相关性(P<0.05)。结论 MMP-11在胃癌组织中的表达均随着胃癌进展而增强,提示MMP-11对胃癌的发生和转移有促进作用。
胃癌;基质金属蛋白酶-11;免疫组织化学;反转录聚合酶链反应;预后
侵袭、转移是胃癌恶性生物学行为重要的特征,是多步骤、多因素参与的复杂过程,也是造成胃癌患者预后差的最主要原因[1-2]。研究[3]表明,基质金属蛋白酶(matrix metallo-proteinase,MMP)是一组结构相近、功能复杂的蛋白水解酶,可有效降解细胞外几乎所有基质成分,破坏细胞外基质,促使癌细胞对周围正常组织浸润,导致肿瘤的扩散和转移。我们通过检测胃癌组织与相应的癌旁组织中MMP-11蛋白表达,同时检测MMP-11 mRNA的表达,探讨其在胃癌浸润、转移中的作用及相互关系,对阐明胃癌侵袭转移机理、评估转移的情况和判断预后具有一定的临床意义。
1 资料与方法
1.1 标本来源标本来自2013年1-2014年7月湖北医药学院附属人民医院胃肠外科住院的胃癌患者,所有患者术前均未行放射和化学治疗,全部病例均行手术治疗,留取胃癌组织手术标本,由病理科医师在肿瘤生长良好、无坏死区域的胃癌手术切除标本取材2块,同时在距离肿瘤5 cm远的黏膜组织取材2块,作为对照组。所有标本均分为2份,一份立即固定于4%多聚甲醛溶液中,常规石蜡包埋,切片厚度5 μm,用于免疫组织化学检测;另一份保存于液氮中行RT-PCR检测。
1.2 临床资料收集湖北医药学院附属人民医院胃肠外科胃癌手术患者44例,男26例,女18例,年龄36~71岁,中位年龄56岁;病变长度≤5 cm者21例,>5 cm者23例;依据WHO胃癌组织分型标准,高、中分化15例,低分化29例;根据国际抗癌联盟(UICC)标准,胃癌患者中T1期20例,T2~T4期24例;无淋巴结转移23例,有淋巴结转移21例。肿瘤位于胃窦者19例,胃体者16例,贲门者9例。
1.3 主要试剂鼠抗人MMP-11单克隆抗体、β-actin鼠抗人单克隆抗体及即用型免疫组化染色试剂盒均购自北京中杉金桥生物技术公司;Trizol试剂、RT-PCR试剂盒、Taq酶(TaKaRa公司);引物序列(Invitrogen公司合成)。
1.4 免疫组织化学SP法测定MMP-11蛋白的表达主要步骤:将4 μm石蜡切片脱蜡至水,以3%H2O2处理10 min阻断内源性过氧化物酶,微波修复10 min,以10%山羊血清室温封闭20 min,加MMP-11单克隆抗体(1∶100),4 ℃湿盒中过夜,滴加二抗、三抗,室温湿盒内孵育20 min,二氨基联苯胺显色,苏木精复染,常规脱水,封固。严格按试剂盒说明书操作。采用双盲法,全部切片由2位高年资病理科医师镜下观察并诊断,独立观察每张切片5个具有代表性的高倍视野,组织切片中胞质或胞核染为淡黄色至棕黄色为阳性细胞标志,采用半定量积分法[4],根据肿瘤细胞质或核的染色程度及染色细胞百分率进行分析评分:基本不着色为0分,着色淡者为1分,适中为2分,深者3分;着色细胞占计数细胞百分率≤5%为0分,6%~30%为1分,31%~60%为2分,≥61%为3分,将每张切片着色程度得分与着色细胞百分率得分相乘为其最后得分,0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),6分以上为强阳性(+++)。
1.5 RT-PCR法测定MMP-11 mRNA表达严格按照按Trizol试剂说明书操作进行提取总RNA,紫外分光光度计测定RNA含量及纯度。MMP-11上游引物5′-GGATGACCAGGGCACAGA-3′,下游引物5′-TGAGCACCTTGGAAGAACC-3′,产物长度为477 bp;β-actin上游引物5′-CTCCATCCTGGCCTCGCTGT-3′,下游引物5′-GCTGTCACCTTCACCGTTCC-3′,产物长度为268 bp。参照反转录试剂盒说明书合成cDNA,PCR循环条件:预变性94 ℃ 3 min,变性94 ℃ 1 min;MMP-11退火温度为55 ℃,β-actin退火温度为68 ℃;延伸72 ℃ 30 s;32个循环,末次延伸7 min。扩增产物经1.0%琼脂糖凝胶电泳分离,在紫外灯下观察电泳结果,结合Syngene凝胶成像分析系统和Multi Gauge V3.1软件进行吸光度(A)值分析。
1.6 统计学处理采用SPSS 13.0软件包进行统计分析,免疫组织化学染色(IHC)结果分析采用χ2检验,两组间RT-PCR结果分析采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 MMP-11蛋白及mRNA的表达MMP-11蛋白阳性表达细胞的胞质被染成浅黄色、棕黄色或黄褐色。在胃癌组织中MMP-11阳性细胞呈散在片状或巢状分布,还可见靠近癌间质中也有表达。MMP-11蛋白在胃癌组织中阳性率为72.7%(32/44),在癌旁组织中阳性率为11.4%(5/44),差异有统计学意义(χ2=33.977,P=0.000)。MMP-11 mRNA的扩增产物条带多为阳性或强阳性,在癌旁组织中多为阴性或弱阳性表达。MMP-11 mRNA在癌旁组织与胃癌组织中的表达水平差异有统计学意义(0.238±0.033vs0.484±0.041,P<0.05,见图1~3)。

图1 MMP-11蛋白在胃癌中的表达(400×); 图 2 MMP-11 蛋白在癌旁组织中的表达(400×) ;

注:1:胃癌组织;2:癌旁组织;3:标志物。
Fig 3 The expression of MMP-11 mRNA in gastric carcinoma and adjacent tissues
2.2 MMP-11蛋白和mRNA的表达与胃癌临床病理特征之间的关系MMP-11蛋白和mRNA的表达与胃癌浸润深度、淋巴结转移情况及分化程度具有相关性(P<0.05),与年龄、性别、病变长度、病变部位均无相关性(P>0.05,见表1)。
3 讨论
浸润和转移是恶性肿瘤的主要生物学特征,也是恶性肿瘤患者死亡的主要原因。MMP是一组锌离子依赖性蛋白水解酶超家族,研究[5]表明MMPs通过降解细胞外基质在胃癌的浸润与转移中起重要作用。MMP-11是MMPs家族成员,又称基质分解素-3(strome-
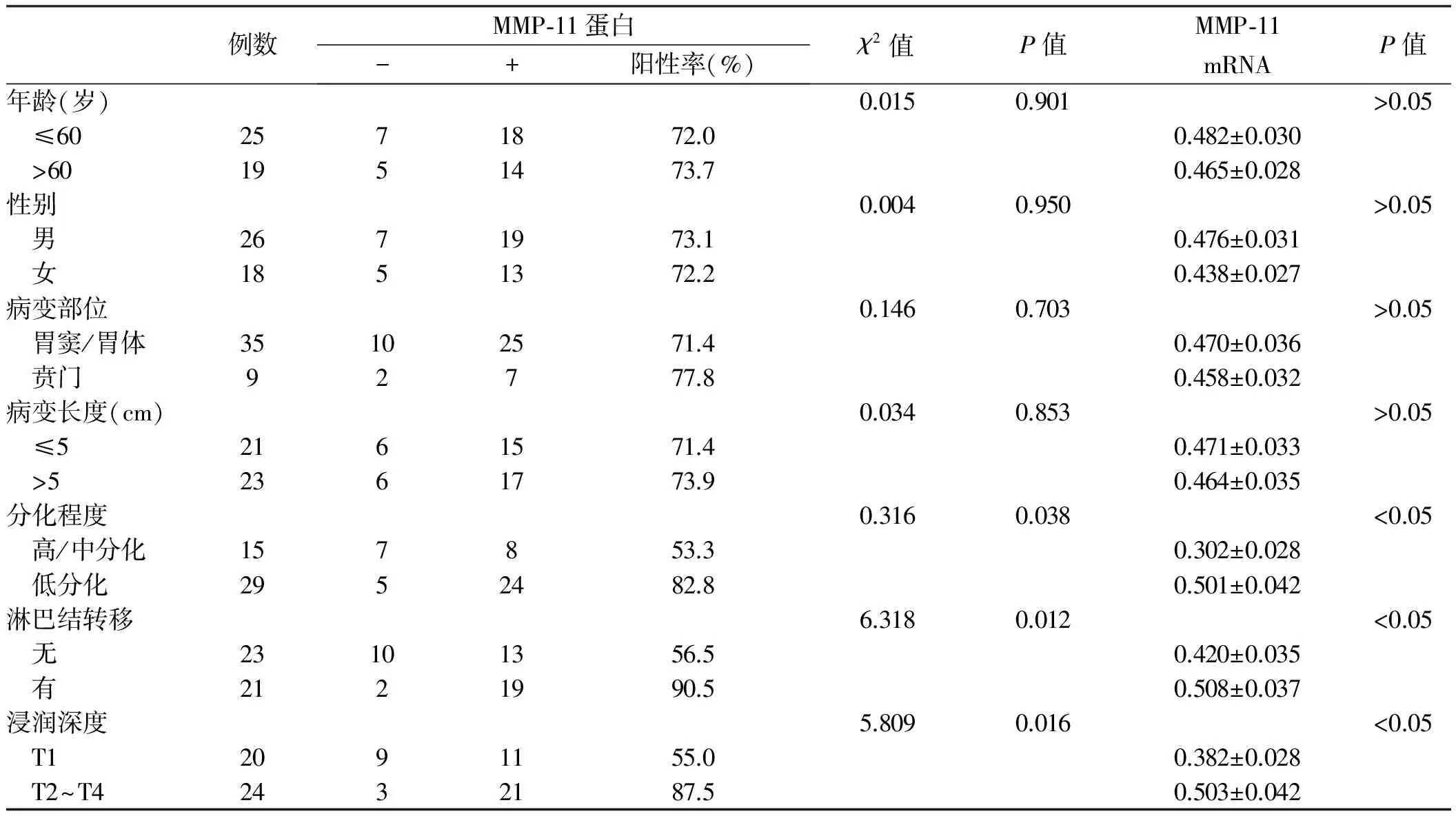
表1 MMP-11蛋白及MMP-11 mRNA表达与胃癌临床病理特征的关系
lysin-3,ST-3),其表达与肿瘤发生以及各种组织重塑有密切关系,与多种肿瘤如胰腺癌[6]、口腔癌[7]、食管癌[8]中均有较强的表达,并认为与肿瘤的发生、发展和预后不良相关[9]。本研究发现,MMP-11蛋白和MMP-11 mRNA的表达在胃癌组织中的表达强度明显增强,明显高于癌旁组织,提示MMP-11参与胃癌的发生过程。同时,本文分析MMP-11的表达与胃癌临床病理特征的关系显示,其与患者的年龄、性别、肿瘤大小等无明显相关性,但与肿瘤的浸润程度、淋巴结转移及分化程度具有相关性,提示MMP-11在肿瘤的浸润、转移方面起到重要作用,提示MMP-11参与胃癌的进展过程,可能是胃癌的不良预后指标。
本研究表明,MMP-11与肿瘤的发生、浸润、转移可能有密切关系,有望成为临床上新的肿瘤标志物,监测MMP-11可作为判断胃癌生物学行为和预后的重要指标,为肿瘤的早期诊断和治疗提供实验依据。但由于本研究纳入病例数少,而且胃癌本身是一个多因素、多环节的疾病,MMP-11具体参与了哪些环节及其机制如何,仍需进一步研究。
[1]Hwang I, Kang YN, Kim JY, et al. Prognostic significance of membrane-associated mucins 1 and 4 in gastric adenocarcinoma [J]. Exp Ther Med, 2012, 4(2): 311-316.
[2]Guo J, Dong B, Ji JF, et al. Myofibrillogenesis regulator-1 overexpression is associated with poor prognosis of gastric cancer patients [J]. World J Gastroenterol, 2012, 18(38): 5434-5441.
[3]Wang HB, Huang X, Wang RZ, et al. Serum matrix metalloproteinase-9 and its changes in patients with gastric carcinoma [J]. Chin J Exp Surg, 2013, 30(12): 2707-2708. 王海斌, 黄昕, 王任之, 等. 胃癌患者血清基质金属蛋白酶-9水平的变化[J]. 中华实验外科杂志, 2013, 30(12): 2707-2708.
[4]Bai L, Hou PZ, Hou XW, et al. Expressions of cyclooxygenase-2, matrix metalloproteinases-9 and Ki67 in tissues of gastric cancer and their clinical significance [J]. Chin J Dig, 2009, 29(3): 183-185. 白龙, 侯培珍, 侯先文, 等. 环氧合酶-2、基质金属蛋白酶-9和核增殖抗原在胃癌组织中的表达及临床意义[J].中华消化杂志, 2009, 29(3): 183-185.
[5]Wang Y, Li YX, Yu SJ, et al. Expression and significance of matrix metallproteinase-25 in gastric carcinoma [J]. Chin J Exp Surg, 2012, 29(10): 1997-1999. 王颖, 李艳霞, 余世界, 等. 基质金属蛋白酶-25在萎缩性胃炎、胃癌组织中的表达及意义[J]. 中华实验外科杂志, 2012, 29(10): 1997-1999.
[6]Jones LE, Humphreys MJ, Campbell F, et al. Comprehensive analysis of matrix metalloproteinase and tissue inhibitor expression in pancreatic cancer: increased expression of matrix metalloproteinase-7 predicts poor survival [J]. Clin Cancer Res, 2004, 10: 2832-2845.
[7]Soni S, Mathur M, Shukla NK, et al. Stromelysin-3 expression is an early event in human oral tumorigenesis [J]. Int J Cancer, 2003, 107(2): 309-316.
[8]Sharma R, Chattopadhyay TK, Mathur M, et al. Prognostic significance of stromelysin-3 and tissue inhibitor of matrix metalloproteinase-2 in esophageal cancer [J]. Oncology, 2004, 67(3-4): 300-309.
[9]Boulay A, Masson R, Chenard MP, et al. High cancer cell death in syngeneic tumors developed in host mice deficient for the stromelysin-3 matrix metalloproteinase [J]. Cancer Res, 2001, 61(5): 2189-2193.
(责任编辑:马 军)
The expression of matrix metalloproteinase-11 in gastric cancer and the relationship with clinicopathological features of gastric carcinoma
XU Jin1, WANG Bin1, CHEN Jun1, LIU Ying1, WANG Qibin2, LIU Hanhan3
1. Department of Gastroenterology; 2. Department of Gastrointestinal Surgery; 3. Department of Pathology, Renmin Hospital, Hubei University of Medicine, Shiyan 442000, China
Objective To investigate the expression of matrix metalloproteinase-11 (MMP-11) in human gastric carcinoma and the correlation with clinicopathological features. Methods The expression of MMP-11 protein in 44 gastric carcinoma surgical specimens and paracancerous tissues was detected by immunohistochemistry (IHC), and the expression of MMP-11 mRNA was detected by reverse transcriptase-polymerase chain reaction (RT-PCR). The correlation with clinicopathological features of gastric cancer was analyzed. Results The positive rates of MMP-11 expression were 72.7%and 11.4%in gastric carcinoma and paracancerous tissues (P<0.05).The expression of MMP-11 mRNA in gastric carcinoma was significantly higher than that in paracancerous tissues (P<0.05). The expression of MMP-11 was not associated with sex, age, location and size of gastric cancer (P>0.05), but correlated with the depth of invasion, the degree of differentiation of gastric cancer and lymph node metastasis (P<0.05). Conclusion The expression of MMP-11 increased along with the progression of gastric carcinoma. MMP-11 may have auxo-action in development and transferation of gastric carcinoma.
Gastric carcinoma; Matrix metalloproteinase-11; Immunohistochemistry; Reverse transcriptase polymerase chain reaction; Prognosis
10.3969/j.issn.1006-5709.2016.06.009
徐进,硕士,主治医师,研究方向:胃肠道疾病的临床与基础研究。E-mail:xujin200725@126.com
王斌,博士,主任医师,研究方向:胃肠道疾病的临床与基础研究。E-mail:wang-bqh@126.com
R735.2
A
1006-5709(2016)06-0630-03
2015-07-22

