肿瘤相关巨噬细胞促进非小细胞肺癌细胞增殖和侵袭的研究
吴奇勇, 戚春建, 陈 晨, 王 勇
(南京医科大学附属常州市第二人民医院, 胸心外科, 肿瘤实验室, 江苏 常州, 213003)
肿瘤相关巨噬细胞促进非小细胞肺癌细胞增殖和侵袭的研究
吴奇勇, 戚春建, 陈晨, 王勇
(南京医科大学附属常州市第二人民医院, 胸心外科, 肿瘤实验室, 江苏 常州, 213003)
摘要:目的研究肿瘤相关巨噬细胞(TAMs)对非小细胞肺癌增殖、转移的影响。方法免疫组化方法分析肺癌组织中巨噬细胞浸润情况。CCK-8法和Transwell法分别检测单核巨噬细胞系THP-1(构建为M2型TAMs后)对肺癌细胞系A549细胞增殖和侵袭能力的影响。结果免疫组化结果显示,TAMs浸润数在肺癌组织中显著多于癌旁组织。激活诱导的TAMs细胞促进A549细胞的增殖和侵袭。结论巨噬细胞浸润增加造成的肿瘤周围炎症微环境可能是肺癌发展的机制之一。
关键词:肿瘤相关巨噬细胞; 非小细胞肺癌; 增殖; 转移
肺癌是发病率第一的恶性肿瘤,大多数患者确诊时已处于晚期,失去手术治疗的机会,非小细胞肺癌是肺癌的主要类型之一。晚期的非小细胞肺癌患者化疗的有效率不足30%,至疾病进展时间为4~6个月,2年生存期约10%,其中癌细胞的广泛转移是非小细胞肺癌死亡率高的重要原因之一[1]。最近的研究[2]发现,在肿瘤微环境中,肿瘤细胞与周围的免疫细胞通过旁分泌促进肿瘤的侵袭。肿瘤相关巨噬细胞(TAMs)是影响肿瘤微环境的重要免疫细胞,它定位于肿瘤上皮组织、间质、坏死区域和肿瘤浸润的边缘,被认为是肿瘤进展的一个重要的生物标志[3]。本研究拟通过构建共培养模型,探讨TAMs对非小细胞肺癌侵袭的作用。
1材料与方法
1.1病例采集及病理诊断
选取2010年1月—2011年3月南京医科大学附属常州第二人民医院心胸外科就诊的非小细胞肺癌患者的石蜡组织,进行常规免疫组化ABC法染色。主要步骤为:切片、脱蜡、水化; Tris-EDTA抗原修复; 3%H2O2灭火内源性过氧化物酶; 10%羊血清封闭;一次孵育一抗CD68(Abcam公司,1∶3 000稀释)、二抗;DAB显色;苏木素复染;常规脱水、透明、封片。巨噬细胞技术:每例随机选取8个不重叠的视野,计数阳性细胞数,对结果进行单因素方差分析。
1.2材料
肺癌细胞株A549以及人单核细胞系THP-1均购置中国科学院上海细胞库,RPMI 1640培养基、PBS、胎牛血清(FCS)及胰酶购置Gibco公司;佛波酯(PMA)购置Sigma公司;Transwell板购置美国corning公司;Matrigel胶购置BD公司。
1.3细胞培养
肺癌细胞株A549和人单核细胞系THP-1均培养于含10% FCS的RPMI 1640培养基中,于37 ℃、5% CO2的培养箱中传代培养。THP-1细胞经800 g离心3 min后换液或传代,须维持细胞圆、亮、单个的悬浮状态。悬浮的THP-1按照1×106/mL接种,PMA 60 nmol/L诱导24 h后细胞贴壁,加入IL-4 20 nmol/L, 继续培养18 h, 即得到体外诱导的TAM细胞。
1.4THP-1与A549共培养处理
由于诱导活化为TAMs后的巨噬细胞为终末细胞,不再具有分裂增殖的能力,所以将其与A549细胞共培养后,CCK-8检测的仅为A549的增殖效应。具体操作如下:将A549与TAMs分别按1∶1、1∶2、1∶3、1∶6的比例接种于96孔板的同一孔中(每孔为1 000个细胞),对照组只接种1份THP-1或1、2、3、6份A549,每组设5个复孔,48 h后检测CCK-8数值。将共培养组的吸光度值(OD)减去单份 THP-1的OD值后与相应的对照组作比较,对结果进 行单因素方差分析。
1.5侵袭实验
基质胶(BD matrigel)4 ℃过夜冻融,使用当天所有耗材预冷,将基质胶按1∶5稀释,向每个transwell小室内铺胶30 μL,置于37 ℃培养箱中至胶完全凝固。分别处理细胞THP-1、A549至密度为2×105/mL, 上室加入200 μL A549,下室加入600 μL TAMs,对照组的下室只加RPMI 1 640培养基。24 h后,弃去上室中培液, PBS洗3遍,固定15 min (固定液为甲醇∶冰醋酸=3∶1的混合液,用前配制)后, 0.1%结晶紫(美国Sigma公司)室温染色2 h,清水洗3遍以上。将小室倒置,镜下拍照,并随机选取5个不重复的400高倍视野来计数,对结果进行t检验分析。
1.6统计学处理
数据处理采用Graph Pad 5.0软件包,进行单因素方差分析和t检验分析处理,P<0.05为差异有统计学意义。
2结果
2.1肺癌组织和肺癌良性组织中TAM浸润情况
本实验所有病例的癌组织中均可见TAM浸润,在间质和癌巢中均可见棕色(CD68+)阳性的TAM分布,30例非小细胞肺癌病理切片中TAM平均浸润密度34.7/高倍镜视眼(HP),中位数为17/HP。见图1。
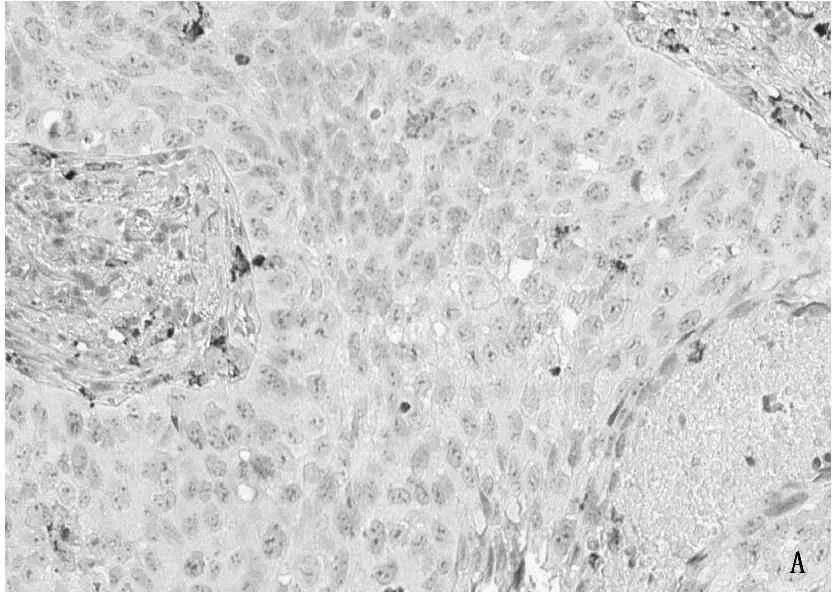

A: 低表达组; B: 高表达组
图1TAM在非小细胞肺癌中的表达
2.2人巨噬细胞的诱导活化和表型鉴定
悬浮的人THP-1单核细胞用PMA处理后,增殖停止并贴壁,CD68表达增高(图2A),被诱导为巨噬细胞。再加入IL-4,活化为TAM细胞。RT-PCR显示诱导分化后细胞高表达IL-10,Arginase (图2B)。

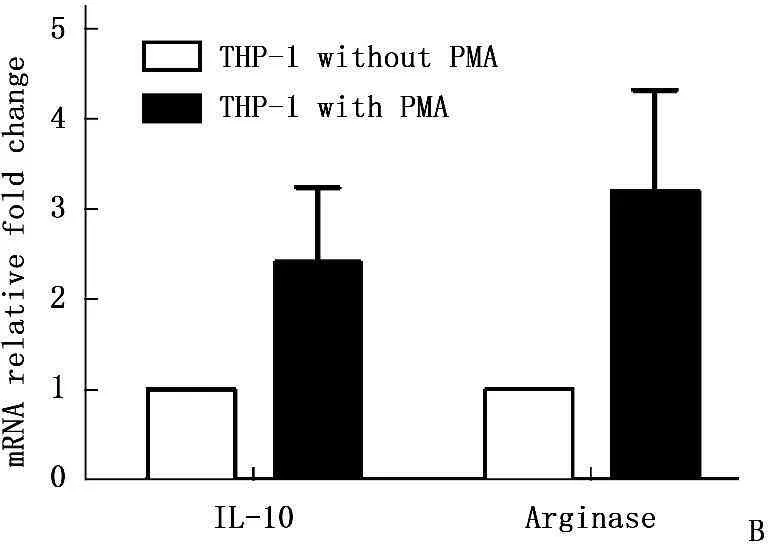
A: 流式细胞术检测CD68的表达(实心图为同型对照, 虚线为THP-1未用PMA激发的细胞,实线为THP-1细胞用PMAs激发后的细胞); B: IL-10, Arginase mRNA的相对表达量
图2TAM诱导活化及鉴定
2.3活化诱导的TAMs细胞促进A549细胞增殖
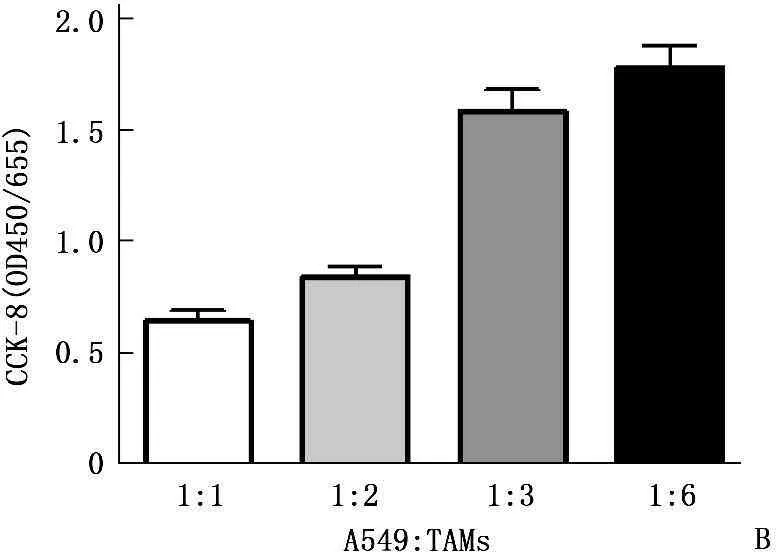
TAMs细胞的培养上清可促进A549细胞增殖, 96 h增殖率为1.785(图3A),将TAMs细胞与A549以不同比例共培养48 h,亦可诱导A549细胞增殖,并且在A549: TAMs达到1∶3时可以诱导A549显著增殖,增殖率为2.136(图3B)。
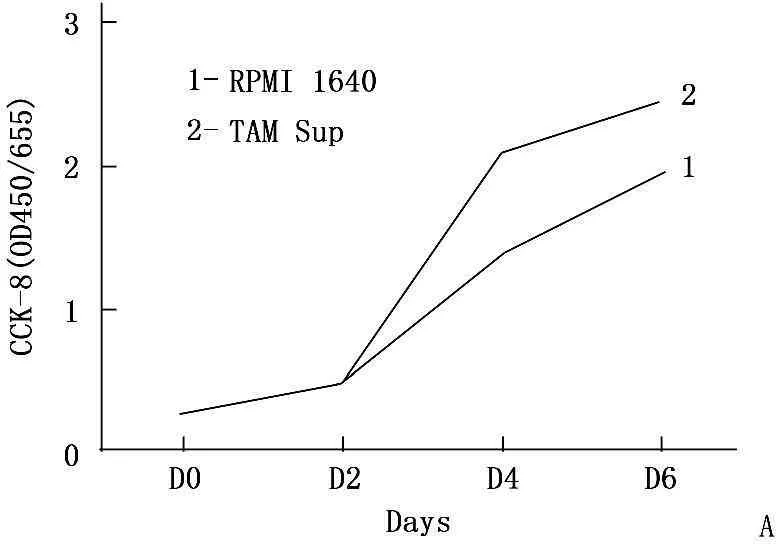
A: TAMs细胞培养上清对A549细胞增殖的影响;
B: 不同比例的A549细胞和TAMs细胞共培养对A549细胞增殖的影响
图3TAMs细胞对A549细胞增殖活性的影响
2.4TAMs细胞促进A549细胞侵袭
如图4所示,TAMs可以促进A549的侵袭,铺过基质胶之后,实验组从transwell上室穿出的A549较对照组穿出的细胞显著增加,穿出的细胞多分布于膜中央,膜边缘的细胞成团分布。


图4TAMs细胞对A549细胞侵袭的影响
3讨论
肿瘤微环境是指由大量各种类型的细胞共同构成的一种肿瘤的局部病理环境。肿瘤相关巨噬细胞(TAM)是大量存在于肿瘤微环境中的白细胞群体[4]。巨噬细胞在体内不同的微环境影响下可分别表现为两种活化类型:M1型巨噬细胞为经典活化的巨噬细胞,M2型巨噬细胞为替代性活化的巨噬细胞[4-6 ]。M1型巨噬细胞可在I型辅助性T细胞因子如γ-干扰素和细菌产物脂多糖的诱导下产生,表现为高表达白细胞介素(IL)-12、IL-23、内源性活性氧(ROS)和一氧化氮,低表达IL-10和IL-4,抗原提呈功能增强,促进T细胞增殖活化,主要起杀伤细菌、抗肿瘤、产生炎性因子、激活免疫应答的作用[2-3,7]。M2型巨噬细胞可由IL-4、IL-10、IL-13等诱导产生,表现为高表达IL-10或IL-4,低表达IL-12,低抗原提呈能力等特征,具有清除碎片,促进血管生成、组织重建及损伤修复作用,在肿瘤发生、发展过程中起促进作用[4-6]。
TAMs的功能作用具有组织特异性和时相性,既在不同肿瘤组织、I-J种肿瘤的不同部位以及在同一肿瘤的不同发展阶段都具有不同的功能[7]。TAMs在癌前阶段只表达iNOS(称为M1型TAMs),肿瘤恶变过程中逐渐丧失表达iNOS,而表达arginase(称为M2型TAMs)。不同类型的TAMs表达细胞因子(如M1型TAMs分泌INF,M2型TAMs则主要分泌TGF-beta)决定肿瘤演进与发展方向预后[8-9]。
TAMs是肿瘤炎症微环境的重要组成,目前发现TAMs与多种恶性肿瘤的发生发展存在直接联系,包括乳腺癌、前列腺癌、结肠癌、甲状腺癌和淋巴瘤等,TAMs具有促进肿瘤的侵袭转移和血管形成等作用。TAMs可以与肿瘤干细胞相互作用,促进肿瘤发生、转移和耐药[10]。
本研究发现在CD68+浸润细胞方面,病变组织的巨噬细胞大,形态不规则,核呈明显的新月形或马蹄形,胞质内有大量的吞噬颗粒,巨噬细胞周围并行大量淋巴细胞,这些都说明病变或癌前病变组织中的巨噬细胞是已活化的,发挥功能作用的细胞。本研究成功地将THP-1细胞诱导出CD68+,IL-10,Arginase高表达的TAMs细胞。关于TAMs对肺癌细胞的作用,本研究发现,TAMs细胞可以促进A549细胞的增殖和侵袭,TAMs的促侵袭转移作用被认为是M2型巨噬细胞有别于M1型的重要方面,也是免疫抑制实现的重要途径[11]。有研究表明在肺癌的肿瘤微环境中,TAMs只有与肿瘤细胞相互作用才有明显的促进肿瘤转移的效应,可能是因为肿瘤细胞与TAMs能够通过旁分泌细胞因子的途径相互作用,通过细胞因子形成旁分泌环,促进肿瘤细胞侵袭转移。
参考文献
[1]Zarogoulidis K, Zarogoulidis P, Darwiche K, et al. Treatment of non-small cell lung cancer (NSCLC) [J]. Journal of thoracic disease, 2013, 5(Suppl 4): S389-396.
[2]Champiat S, Ileana E, Giaccone G, et al. Incorporating immune-checkpoint inhibitors into systemic therapy of NSCLC [J]. Journal of thoracic oncology: official publication of the International Association for the Study of Lung Cancer, 2014, 9(2): 144-153.
[3]Laoui D, Van Overmeire E, De Baetselier P, et al. Functional Relationship between Tumor-Associated Macrophages and Macrophage Colony-Stimulating Factor as Contributors to Cancer Progression [J]. Frontiers in immunology, 2014, 5: 489-498.
[4]Schmieder A, Michel J, SchOnhaar K, et al. Differentiation and gene expression profile of tumor. associated macrophages[J]. Semin Cancer Biol, 2012, 22(4): 289-297.
[5]Shirabe K, Mano Y, Muto J, et al. Role of tumor-associated macrophages in the progression of hepatocellular carcinoma[J]. Surg Today, 2012, 42(1): 1-7.
[6]Wang X F, Wang H S, Zhang F, et al. Nodal promotes the generation of M2-like macrophages and down regulates the expression of IL-12[J]. Eur J Immunol, 2014, 44(1): 173-183.
[7]Chen J J, Lin Y C, Yao P L, et al. Tumor-associated macrophages: the double-edged sword in cancer progression[J]. J Clin Oncol, 2005, 23(5): 953-964.
[8]Redente E F, Dicky D J, Bouchard R J, et al. Tumor signaling to the bone marrow changes the phenotype of monocytes and pulmonary macrophages during urethane-induced primary lung tumorigenesis in A/J mice[J]. Am J Pathol, 2007, 170(2): 693-708.
[9] Mills C D, Kincaid K, Ah JM, et a1. M-1/M-2 macrophages and the Thl/Th2 paradigm[J]. J Immunol, 2000, 164(12): 6166-6173.
[10] Galdiero M R, Bonavita E, Barajon I, et al. Tumor associated macrophages and neutrophils in cancer [J]. Immunobiology, 2013, 218(11): 1402-1410.
[11] Mantovani A, Germano G, Marchesi F, et al. Cancer promoting tumor-associated macrophages: new vistas and open questions[J]. European journal of immunology, 2011, 41(9): 2522-2525.
Effect of tumor-associated macrophages on promotion of proliferation and metastasis of non-small cell lung cancer
WU Qiyong, QI Chunjian, CHEN Chen, WANG Yong
(DepartmentofCardiothoracicSurgery,TumorLaboratory,ChangzhouSecondPeople′sHospitalAffiliatedtoNanjingMedicalUniversity,Changzhou,Jiangsu, 213003)
ABSTRACT:ObjectiveTo investigate the effect of tumor-associated macrophages (TAMs) on promotion of the proliferation and metastasis of non-small cell lung cancer. MethodsThe infiltration of macrophages in the lung cancer tissues was analyzed by immunohistochemical method. The effects of monocyte/macrophage cell line THP-1 (after construction of M2-type TAMs) on the proliferation and invasion of human lung cancer cell line A549 were evaluated by CCK-8 and Transwell methods. ResultsImmunohistochemical results revealed that the quantity of infiltrated TAMs in the lung cancer tissues was significantly than that in the para-carcinoma tissues. The activated TAMs accelerated the proliferation and invasion of A549 cells. ConclusionThe micro environment surrounding the inflammatory microenvironment caused by the infiltration of macrophages may be one of the mechanisms of the development of lung cancer.
KEYWORDS:tumor-associated macrophages; non-small cell lung cancer; proliferation; metastasis
中图分类号:R 734.2
文献标志码:A
文章编号:1672-2353(2016)09-101-04
DOI:10.7619/jcmp.201609029
基金项目:江苏省自然科学基金(BK2012590)
收稿日期:2015-12-20

