沉默Sema6A基因对骨肉瘤细胞U-2OS增殖和转移的影响
赵书杰, 蒋羽清, 丁 寅, 张 强, 周 栋
(南京医科大学附属常州第二人民医院 骨科, 江苏 常州, 213003)
沉默Sema6A基因对骨肉瘤细胞U-2OS增殖和转移的影响
赵书杰, 蒋羽清, 丁寅, 张强, 周栋
(南京医科大学附属常州第二人民医院 骨科, 江苏 常州, 213003)
摘要:目的检测信号素6A(Sema6A)基因在骨肉瘤细胞系中的表达情况,探讨RNA干扰Sema6A基因对骨肉瘤U-2OS细胞增殖、侵袭及迁移的影响。方法实时定量逆转录聚合酶链反应(qRT-PCR)检测骨肉瘤细胞株U-2OS、Saos-2及MG-63中Sema6A的mRNA表达水平。设计并合成针对Sema6A的小干扰RNA(siRNA)3条及阴性对照siRNA, 在Lipofectamine RNAiMAX介导下转染U-2OS细胞,通过qRT-PCR检测Sema6A mRNA水平表达及蛋白质印迹法检测Sema6A 蛋白水平,进而筛选出转染效率高的siRNA,CCK-8检测各组细胞活力,Transwell细胞侵袭和迁移实验检测各组细胞的侵袭及迁移能力。结果骨肉瘤细胞株中,Sema6A mRNA在U-2OS中表达最高。瞬时转染Sema6A siRNA的U-2OS细胞中Sema6A的mRNA及蛋白水平较阴性对照组均下降,与阴性对照组相比,实验组细胞的增殖、侵袭及迁移能力均增强,差异有统计学意义(P<0.05)。结论RNA干扰沉默Sema6A基因可以增强U-2OS细胞的增殖、侵袭及迁移能力。
关键词:Sema6A基因; RNA干扰; U-2OS细胞; 增殖; 转移
骨肉瘤是最常见的骨原发性恶性肿瘤,起源于成骨间叶细胞,好发于青少年,恶性程度极高,约20%的患者在首诊时即存在转移灶,其中最常见的转移部位为肺,预后较差[1]。根据国外文献[2]的报道,骨肉瘤的发病年龄特点呈双峰分布,11~20岁为骨肉瘤发病率的第1个高峰期,而第2个高峰期发生在65岁以后。骨肉瘤治疗策略类似,包括新辅助化疗、手术切除肿瘤并重建肢体功能以及术后化疗的系统疗法。发生转移的骨肉瘤患者5年生存率仅仅为11%~29%[3]。Semaphorins是一个广泛存在于各种生物体内的蛋白超家族,最初是作为轴突导向分子而被发现[4], 在进化上是保守的。目前发现Semaphorin家族至少含有20多个成员,所有家族成员都具有一个保守的由约400个氨基酸组成的结构域[5]。研究[6]表明Sema家族的功能涉及到骨的重塑,参与了成骨细胞和破骨细胞间的信号传递。Sema家族中许多成员与肿瘤有着十分密切的关系,起着促进或者抑制肿瘤发生发展的作用[7-10]。近年来,发现其家族成员 Sema6A参与了多种生物学进程,其可调节神经系统的发育、细胞迁移、形态变化及血管生成的过程。还有研究[11-15]表明Sema6A在韦格氏肉芽肿、黑色素瘤中有着重要的地位。本研究探讨RNA干扰沉默Sema6A基因对骨肉瘤细胞U-2OS增殖以及侵袭、迁移的影响,报告如下。
1材料与方法
1.1材料
人骨肉瘤U-2OS细胞株、Saos-2细胞株、MG-63细胞株(中国科学院上海生命科学研究院细胞资源中心)。McCoy's 5a培养基、EMEM培养基、Opti-MEM培养基、胎牛血清(Gibco公司,美国);Lipofectamine RNAiMAX转染试剂(Intivrogen公司,美国);CCK-8(同仁公司,日本);Transwell小室(Millipore公司,德国);Matrigel基质胶(BD公司,美国);引物合成(上海生工生物工程有限公司);Trizol 总RNA提取试剂(Intivrogen公司,美国);RNA逆转录试剂盒、荧光染料SYBR Premix EX Taq试剂盒(TaKaRa公司,日本);SDS-PAGE凝胶试剂盒、结晶紫(中国碧云天生物技术研究所)β-actin一抗、Sema6A一抗(abcam公司,英国);羊抗兔二抗、羊抗鼠二抗(Intivrogen公司,美国)Sema6A siRNA由上海吉玛制药技术有限公司设计并合成。
1.2方法
siRNA序列设计合成以人Sema6A mRNA全长序列(NC000005.10)为RNAi的靶区设计 3 条 Sema6A siRNA 序列,同时设计阴性对照(NC)序列,由上海吉玛制药技术有限公司合成,具体序列见表 1。干粉 siRNA用DEPC水稀释成20 μmol/L,-20 ℃保存。

表1 用于合成Sema6A siRNA的寡核苷酸序列
1.3细胞培养及 siRNA 转染
人骨肉瘤U-2OS细胞采用含 10% FBS、100 μg/mL 链霉素、100 U/mL青霉素的McCoy′s 5a培养基,置于37 ℃、5% CO2培养箱中培养。瞬转干扰片段 siRNA 用DEPC水溶解并稀释。干扰片段加125 μL的DEPC水,阴性对照加62.5 μL的DEPC水。取对数生长期U-2OS细胞,按 5×104个/孔接种于6孔板。次日按Lipofectamine RNAiMAX试剂说明书进行siRNA 转染。细胞分为4组:阴性对照组( siRNA-NC)、siRNA-1组、siRNA-2组、siRNA-3组。转染8 h后换液,转染后48 h提取mRNA, 72 h提取蛋白检测干扰效率。
1.4实时荧光定量PCR检测 siRNA 转染对U-2OS细胞中Sema 6A mRNA表达的影响
siRNA转染U-2OS细胞48 h后,用Trizol提取细胞总RNA,分别应用TaKaRa逆转录试剂盒和荧光染料 SYBR Premix EX Taq试剂盒进行反转录和目的片段的扩增。内参β-actin上游引物序列为: 5′-CTGGGGCGCCCCAGGCACCA-3′, 下游引物序列为: 5′- CTCCTTAATGTCACGCACGATTTC-3′; Sema6A基因上游引物序列: 5′- ACATTGCTGCTAGGGACCATA -3′, 下游引物: 5′- TCTGCATGTGTCTACATCGGC -3′, 每组均设 3 个重复孔。PCR反应条件参照 TaKaRa PCR试剂盒说明书,以2-ΔΔCt表示目的基因 mRNA 的相对表达水平。
1.5Western blotting检测Sema6A蛋白表达水平
siRNA转染U-2OS细胞72 h后,IP裂解液各组细胞收集总蛋白。取等量总蛋白( 50 μg) 行 10% SDS PAGE,蛋白分离后转印至NC膜,5%脱脂牛奶室温封闭1 h,加入一抗( Sema6A 抗体 1∶ 1 000 稀释,GADPH 1∶ 1 000 稀释) 4 ℃ 孵育过夜,次日TBS漂洗 10 min × 3,荧光二抗(1∶15 000 稀释)室温孵育45 min, TBS漂洗10 min × 3,进行图像扫描,以Tif格式保存图像并运用图像分析软件Image J分析条带灰度值。
1.6CCK-8 法检测Sema6A siRNA 转染对U-2OS细胞增殖的影响
实验分为siRNA-NC组、siRNA-6A组( siRNA-2、siRNA-3),取对数期生长的U-2OS细胞,检测前1 d, 在96孔板中接种转染好的待测细胞(100 μL/孔),每组设3个复孔,每孔接种4 000个细胞,向每孔中加入10 μL试剂,放入CO2培养箱中继续培养1 h, 用酶标仪检测450 nm处的吸光值作为零点,每天同一时间按上述步骤操作,连续检测4 d, 绘制细胞生长曲线。
1.7Transwell迁移实验检测 Sema6A siRNA对U-2OS细胞迁移能力的影响
实验分为siRNA-NC组、siRNA-2组、siRNA-3组,将U-2OS细胞按2.5×105个/孔接种于6孔板,按前述方法转染各组siRNA。收集转染后48 h各组细胞,调整细胞密度至2.5×105/mL, 每上室加100 μL细胞悬液,下室加入700 μL含10% FBS的McCoy′s 5a培养基。根据预实验结果培养24 h后取出小室,PBS浸洗2次,用棉签擦拭小室内膜上附着的细胞, 1%戊二醛溶液固定30 min, 用PBS浸洗外膜2次,待干后0.1%结晶紫染色液染色15 min, 1×PBS洗3次,干燥后于正置显微镜观察拍照。
1.8Transwell侵袭实验检测 Sema6A siRNA对U-2OS细胞侵袭能力的影响
实验分为siRNA-NC组、siRNA-2组、siRNA-3组。制胶前所用枪头、EP管、24孔板、小室等均先在冰上预冷,将Matrigel基质胶与McCoy′s 5a培养基以1∶5稀释,每小室铺100 μL, 37 ℃ 放置2 h, 将U-2OS细胞按2.5×105个/孔接种于6孔板,按前述方法转染各组siRNA。收集转染后48 h各组细胞,调整细胞密度至5×105/mL, 每上室加100 μL细胞悬液,下室加入700 μL含10% FBS的McCoy′s 5a培养基,根据预实验结果培养48 h, 余下步骤同细胞迁移实验。
1.9统计学处理
所有实验均独立重复 3次。采用 SPSS 18.0统计学软件,计量资料以均数±标准差表示,多组间比较采用单因素方差分析,多组间两两比较采用 LSD-t 检验。P<0.05为差异有统计学意义。
2结果
2.1Sema6A在骨肉瘤细胞系中的表达情况
检测骨肉瘤细胞系中Sema6A mRNA的表达水平, qRT-PCR结果显示3种骨肉瘤细胞系中均可检测到Sema6A mRNA的表达,其中U-2OS细胞系表达水平最高(图1)。以上结果提示Sema6A可能参与了骨肉瘤的发生及发展过程,同时作者选择U-2OS细胞系作为后续实验的细胞系。

图1 Sema6A在3种骨肉瘤细胞株的mRNA的表达水平
2.2Sema6A siRNA 瞬时转染U-2OS 细胞后Sema6A的 mRNA表达
siRNA转染U-2OS细胞48 h后qRT-PCR检测 Sema6A mRNA表达(图2),Sema6A siRNA组较NC组不同程度降低,干扰效率分别为siRNA-1(71.3±2.95)%、siRNA-2(85.1±1.91)%、siRNA-3(84.1±2.40)%,其中siRNA-2和siRNA-3组的mRNA相对表达量下降更显著(P<0.05) 。
2.3Sema6A-siRNA瞬时转染U-2OS 细胞后Sema6A的蛋白表达
Western blotting(图3)显示, siRNA转染后各组相对siRNA-NC组Sema6A蛋白表达水平不同程度下调。以上结果表明,3条Sema6AmRNA对 U-2OS细胞Sema6A表达均具有沉默效果,其中siRNA-2和siRNA-3干扰效率较高,与qRT-PCR结果一致,因此选取siRNA-2和siRNA-3序列作为有效序列进行下一步实验。

图2 Sema6AsiRNA在U-2OS细胞中的干扰效率
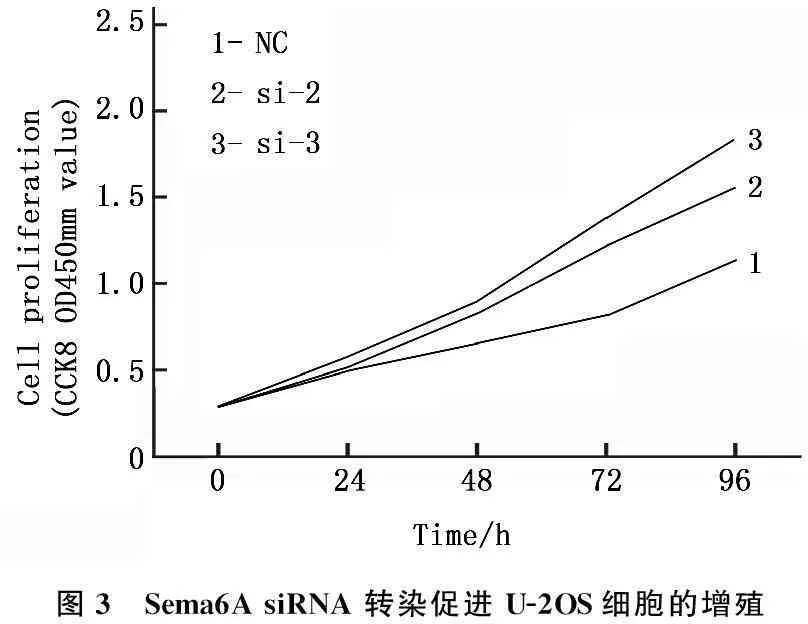
图3 Sema6AsiRNA转染促进U-2OS细胞的增殖
2.4Sema6A沉默促进U-2OS细胞的增殖
CCK8法检测结果显示在48、72及96 h时,siRNA-2和siRNA-3组的增殖情况均显著高于siRNA-NC组(P<0.05),该结果提示沉默Sema6A后可以促进骨肉瘤细胞系U-2OS的增殖。
2.5siRNA沉默Sema6A促进U-2OS细胞的侵袭及迁移
Transwell迁移实验结果显示, siRNA-2和siRNA-3组穿过滤膜的细胞数均显著多于siRNA-NC组[(143.7±20.5)∶(40±8.0),P<0.05; (181.3±20.1)∶(40±8.0),P<0.05)],该结果说明siRNA沉默Sema6A后可以增强U-2OS细胞的纵向迁移能力。Transwell侵袭实验的结果提示siRNA-2和siRNA-3组穿过Matrigel基质胶的细胞数均显著多于siRNA-NC组[(93.3±12.2)∶(25.3±6.1),P<0.05; (116.0±20.1)∶(10.6±6.1),P<0.05)],该实验结果提示siRNA沉默Sema6A后可以增强U-2OS细胞的侵袭能力。
3讨论
骨肉瘤是最常见的原发性恶性骨肿瘤,主要发生部位位于长骨干骺端,仅少部分发生于中轴骨和骨盆。骨肉瘤不仅容易复发,而且早期转移率很高,而一旦发生转移和复发,往往预示着很差的预后[1]。中国骨肉瘤的发病率约为3/100万,在骨肉瘤的传统治疗模式下,患者的5年生存率从20%提升到65%,但同时骨肉瘤的治疗也遇到了瓶颈[16]。一些新的治疗方法尚处于研究阶段,比如基因治疗、免疫治疗及干细胞治疗等[17]。本实验利用siRNA瞬时干扰技术,沉默骨肉瘤细胞Sema6A的表达,观察其对增殖、侵袭及迁移的影响。从多条设计序列中筛选了最有效序列,其干扰效果可达80%以上。siRNA沉默Sema6A表达后,转染组骨肉瘤细胞的增殖、侵袭及迁移能力明显得到增强,表明Sema6A在骨肉瘤发生发展及转移中起到了一定的作用,促进肿瘤细胞自身的增殖与侵袭迁移。
Sema6A基因定位于人染色体的5q23-1,编码的跨膜蛋白在中枢神经系统的发育、细胞形态变化及血管生成的过程起到了重要的作用[12]。有研究[15]表明其与炎症性疾病有着密不可分的关系。但是,当前对于Sema6A基因与肿瘤的研究仍处于起步阶段,既往有研究报道Sema6A与黑色素瘤有着十分密切的关系。Loria等通过对黑色素瘤细胞系进行全基因组分析,筛选出了Sema6A,通过细胞功能发现沉默该基因后,可以导致BRAF突变的细胞株细胞骨架重塑,诱导细胞死亡[16-17]。而对于Sema6A与骨肉瘤的关系,国内外尚无人研究。本实验筛选了干扰效率较高的 Sema6A siRNA序列,同时发现siRNA靶向 Sema6A沉默增强骨肉瘤细胞的增殖、侵袭及迁移能力。但是因为 siRNA 的短效性这一缺陷,只有通过建立sh-RNA及构建一个Sema6A基因敲除的老鼠模型,才能更好地验证Sema6A可能作为一种潜在的抑癌基因而存在,并进一步阐明其在体内的生物学功能。
参考文献
[1]Ottaviani G, Jaffe N. The epidemiology of osteosarcoma[J]. Cancer Treat Res, 2009, 152: 3-13.
[2]Anninga J K, Gelderblom H, Fiocco M, et al. Chemotherapeutic adjuvant treatment for osteosarcoma: where do we stand?[J]. Eur J Cancer, 2011, 47(16): 2431-2445.
[3]Bishop M W, Janeway K A, Gorlick R. Future directions in the treatment of osteosarcoma[J]. Curr Opin Pediatr, 2016, 28(1): 26-33.
[4]Kolodkin A L, Matthes D J, Goodman C S. The semaphorin genes encode a family of transmembrane and secreted growth cone guidance molecules[J]. Cell, 1993, 75(7): 1389-1399.
[5]Potiron V, Nasarre P, Roche J, et al. Semaphorin signaling in the immune system[J]. Adv Exp Med Biol, 2007, 600: 132-144.
[6]Worzfeld T, Offermanns S. Semaphorins and plexins as therapeutic targets[J]. Nat Rev Drug Discov, 2014, 13(8): 603-621.
[7]Ch'ng E S, Kumanogoh A. Roles of Sema4D and Plexin-B1 in tumor progression[J]. Mol Cancer, 2010, 9: 251-259.
[8]Liu H, Yang Y, Xiao J, et al. Semaphorin 4D expression is associated with a poor clinical outcome in cervical cancer patients[J]. Microvasc Res, 2014, 93: 1-8.
[9]Jiang H, Qi L, Wang F, et al. Decreased semaphorin 3A expression is associated with a poor prognosis in patients with epithelial ovarian carcinoma[J]. Int J Mol Med, 2015, 35(5): 1374-1380.
[10]Mishra R, Thorat D, Soundararajan G, et al. Semaphorin 3A upregulates FOXO 3a-dependent MelCAM expression leading to attenuation of breast tumor growth and angiogenesis[J]. Oncogene, 2015, 34(12): 1584-1595.
[11]Dhanabal M, Wu F, Alvarez E, et al. Recombinant semaphorin 6A-1 ectodomain inhibits in vivo growth factor and tumor cell line-induced angiogenesis[J]. Cancer Biol Ther, 2005, 4(6): 659-668.
[12]Segarra M, Ohnuki H, Maric D, et al. Semaphorin 6A regulates angiogenesis by modulating VEGF signaling[J]. Blood, 2012, 120(19): 4104-4115.
[13]Okada A, Tomooka Y. A role of Sema6A expressed in oligodendrocyte precursor cells[J]. Neurosci Lett, 2013, 539: 48-53.
[14]Loria R, Bon G, Perotti V, et al. Sema6A and Mical1 control cell growth and survival of BRAFV600E human melanoma cells[J]. Oncotarget, 2015, 6(5): 2779-2793.
[15]Xie G, Roshandel D, Sherva R, et al. Association of granulomatosis with polyangiitis (Wegener's) with HLA-DPB1*04 and SEMA6A gene variants: evidence from genome-wide analysis[J]. Arthritis Rheum, 2013, 65(9): 2457-2468.
[16]Ottaviani G, Jaffe N. The etiology of osteosarcoma[J]. Cancer Treat Res, 2009, 152: 15-32.
[17]Botter S M, Neri D, Fuchs B. Recent advances in osteosarcoma[J]. Curr Opin Pharmacol, 2014, 16: 15-23.
Effects of siRNA-mediated Semaphorin 6A silencing on proliferation and migration of human osteosaroma U-2OS cells
ZHAO Shujie, JIANG Yuqing, DING Yin, ZHANG Qiang, ZHOU Dong
(DepartmentofOrthopedics,ChangzhouSecondPeople′sHospitalAffiliatedtoNanjingMedicalUniversity,Changzhou,Jiangsu, 213003)
ABSTRACT:ObjectiveTo detect the expression of Semaphorin 6A gene in osteosaroma cell lines, and to explore the effect of RNA interference Sema6A gene on proliferation, invasion and migration of osteosaroma U-2OS cells. MethodsSmall inference RNA targeting different regions of Sema6A gene were transfected into U-2OS cells by Lipofectamine RNAimax. The most effective siRNA in knockdown Sema 6A was screened by quantitative PCR and Western blotting. The changes of cell proliferation, migration and invasion ability after Sema 6A knockdown were examined by CCK-8, Transwell cell invasion and migration assays. ResultsIn osteosaroma cell lines, mRNA Sema6A expressed the highest in U-2OS. The mRNA and protein levels of Sema6A in siRNA U-2OS cells by Transient transfection were significantly lower than the negative control group (P<0.05). Compared with the negative control group, proliferation, invasion and metastasis of cells in the experimental group increased significantly (P<0.05). ConclusionDown-regulation of Sema6A by siRNA can significantly enhance the proliferation and migration of U-2OS cells.
KEYWORDS:Sema6A gene; siRNA; U-2OS; proliferation; migration
中图分类号:R 738.1
文献标志码:A
文章编号:1672-2353(2016)09-088-04
DOI:10.7619/jcmp.201609026
通信作者:周栋 E-mail: zhoudong1012@hotmail.com
收稿日期:2015-12-16

