EVI1基因阳性急性髓系白血病的临床特点与预后分析
李 娟, 谢 静, 李和兰, 石培民, 孙爱宁
(1. 扬州大学附属泰兴市人民医院 血液科, 江苏 泰兴, 225400;2. 苏州大学附属第一医院 血液科, 江苏省血液研究所 卫生部血栓与止血重点实验室, 江苏 苏州, 215000)
EVI1基因阳性急性髓系白血病的临床特点与预后分析
李娟1, 谢静1, 李和兰1, 石培民1, 孙爱宁2
(1. 扬州大学附属泰兴市人民医院 血液科, 江苏 泰兴, 225400;2. 苏州大学附属第一医院 血液科, 江苏省血液研究所 卫生部血栓与止血重点实验室, 江苏 苏州, 215000)
摘要:目的探讨EVI1基因阳性急性髓系白血病(AML)患者的临床特点、预后并与EVI1基因阴性AML患者进行比较。方法观察309例AML病例, 分析EVI1基因阳性AML患者的临床特征、细胞形态学、融合基因、早期死亡(ED)、CR率、总体生存率(OS)、无复发生存率(RFS)、造血干细胞移植效果等, 并与EVI1基因阴性AML患者进行比较。结果EVI1基因阳性AML患者白细胞数显著增高 (P<0.05), FAB分型中M4/M5比例偏高(P<0.05)。EVI1阳性患者的染色体核型主要为预后较差的11q23(MLL基因阳性)、inv(3)/t(3;3)、-7等重现性染色体异常, 而一些预后较好的核型如t(15;17)、t(8;21)、inv(16)发生率较低。EVI1基因阳性AML患者CR率明显低于EVI1基因阴性者(54.3%∶74.1%)(P<0.05)。allo-HSCT可明显提高EVI1基因阳性AML患者OS (P<0.05)。结论EVI1基因阳性AML白细胞数高, 生存期短, 化疗效果差, 预后不良。
关键词:EVI1基因; 急性髓系白血病; 异基因造血干细胞移植
亲嗜性病毒整合位点1(EVIl)基因定位于人类染色体3q26,编码一个相对分子质量 14.5 万道尔顿的锌指蛋白转录因子,此转录因子是一个位点特异的 DNA 结合蛋白,定位于核,参与 RNA 的转录调节。EVI1基因主要控制胚胎的发育,对造血干细胞的增殖和存活起重要作用[1]。在白血病的发病中,EVI1 也是一个重要的转录因子[2]。EVI1最初是作为一个常见的逆转录病毒插入点在小鼠髓系白血病中被首次发现的[3]。在小鼠中,异常的EVI1表达引起髓系增生不良(包括增生过度和全血细胞减少)[4-5]。有研究[6]报道,EVI1阳性患者在初诊AML中发生率大约为10%,在inv(3)(q21q26.2)或t(3;3)(q21;q26.2)异常的AML患者中,异常的EVI1表达是由3q26.2的EVI1基因座附近的断裂点造成的,但在无上述染色体异位的AML中亦发现存在EVI1过表达[7]。作者收集了2011年1月—2013年12月住院治疗的309例原发、初治AML病例,根据骨髓细胞形态、细胞化学、免疫分型、细胞遗传学、PCR检测等确诊,并根据EVI1基因检测结果分为EVI1基因阳性组35例及EVI1基因阴性组274例,回顾性分析EVI1基因阳性患者基本临床特征、治疗效果、allo-HSCT对其预后的影响,并与EVI1基因阴性患者进行比较,现报告如下。
1资料与方法
1.1临床资料
收集2011年1月—2013年12月在苏大一附院住院治疗的初治AML病例共309例。其中男161例,女148例,男女比例1.1∶l。全部病例根据骨髓细胞形态、细胞化学、免疫分型、细胞遗传学、PCR检测等确诊。
1.2细胞形态学检查
全部病例的外周血及骨髓涂片经瑞氏染色后阅片,并结合细胞化学染色结果,进行FAB分型。细胞化学染色包括:过氧化物酶、苏丹黑、特异性酯酶、α-醋酸萘酚酯酶及氟化钠抑制试验、丁酸萘酚酯酶、过碘酸-雪夫、酸性磷酸酶染色。
1.3免疫表型检测
治疗前取骨髓液2~3 mL, 肝素抗凝,常规分离制备单个核细胞悬液。采用活细胞直接免疫荧光法单色标记(美国BD公司产品),FCM(美国BD公司)检测。所用单抗检测的抗原包括: ① 造血干/祖细胞表达抗原: HLA-DR、抗TdT、CD34; ② B细胞表达抗原:CD19、CD20、CD22、CD79a; ③ T细胞表达抗原: CD3、CD7、CD5、CD2、CD1a、CD4、CD8; ④ 髓系细胞表达抗原:CD13、CD33、CD15、CD11b、CD14、CD64、CD117、MPO、GlyA和CD56。上述单抗采用FITC、PE、APC、PerCP标记后上流式细胞仪检测。方案参照欧洲白血病免疫学特征研究组(EGIL)提出的:髓系/巨核系/淋系抗原阳性细胞≥20%, CD34抗原阳性细胞≥10%[8]。
1.4细胞遗传学分析
采集骨髓,肝素抗凝,分离单个核细胞。经短期培养(24 h)后,按常规方法制备染色体标本,R显带,根据《国际人类细胞遗传学国际命名法(ISCN) 》[9]进行核型分析。
1.5巢式RT-PCR检测融合基因
收集患者骨髓标本,采用全血RNA提取试剂盒提取RNA, 将RNA特异性反转录为cDNA, 进行巢式RT-PCR,应用Life ProPCR仪进行2轮PCR反应,每轮均设置8组平行PCR, 使用1~8组多重PCR引物,引物参照文献[7], 具体检测的融合基因见表1。

表1 巢式RT-PCR检测融合基因
1.6治疗方案
1.6.1诱导及巩固化疗方案:非M3型60岁以下者采用IA方案(去甲氧柔红霉素联合阿糖胞苷)为主要诱导方案,60岁以上者采用地西他滨+半量CAG方案(阿克拉霉素、Ara-C、粒细胞集落刺激因子)诱导化疗,复发或难治的病例采用CAG、FLAG(氟达拉宾、Ara-C、粒细胞集落刺激因子)等方案,巩固化疗采用含中大剂量Ara-c为主的方案。M3型低中危患者采用亚砷酸、维甲酸双诱导,高危患者采用亚砷酸、维甲酸联合去甲氧柔红霉素诱导。
1.6.2造血干细胞移植:达完全缓解(CR)的患者中,有移植适应征的行异基因移植配型,根据供者来源不同,配型成功者接受同胞全相合、非血缘或单倍体相合的allo-HSCT。移植前采用改良BUCY方案进行预处理。
1.7疗效判定标准及随访
早期死亡(ED)[10]: 确诊后未化疗或化疗开始后10 d内死亡。CR、复发、OS、RFS定义见张之南等《血液病诊断及疗效标准》第3版[11]。随访资料来源于住院、预住院及门诊病历,自患者确诊之日起进行随访。死亡病例随访至死亡日,依病例记录或对患者家属电话联系加以确认;存活病例随访至2013年12月31日。
1.8统计学方法
应用SPSS 16.0统计分析软件,针对患者不同类型资料选择合适的统计学分析方法,计量资料的比较采用t检验,计数资料的比较采用χ2检验、Fisher确切概率法,OS、RFS生存分析采用Kaplan-Meier法,P<0.05为差异有统计学意义。
2结果
2.1临床特征
EVI1基因重排阳性AML患者共35例(11.3%),其中男19例,女16例,中位年龄44岁。按FAB分型M03例,M15例,M27例,M31例,M412例,M56例,M61例。EVI1基因阴性组患者274例,其中男145例,女129例,中位年龄45岁,按FAB分型M023例,M129例,M2113例,M322例,M449例,M533例,M65例。与EVI1基因阴性AML患者相比,EVI1基因阳性患者的白细胞数明显增高 (P<0.05),FAB分型中M4/M5比例偏高(P<0.05), 而年龄、性别、血红蛋白、血小板二者对比无显著差异(P>0.05)。见表2。

表2 2组患者临床资料比较[n(%)]
与EVI1阴性比较, *P<0.05。
2.2细胞遗传学分析
35例EVI1基因阳性AML患者中,有27例(77.1%)检测到克隆性染色体异常,其中11q23异常者7例(23%),inv(3)/t(3;3)者5例(14%),7号单体(-7)4例(11%),复杂核型2例(6%),t(15;17)者 1例(3%),另有6例为其他染色体异常。可见, EVI1与这些重现性染色体异常如11q23(MLL阳性)、inv(3)/t(3;3)、-7密切相关,而这些染色体异常在遗传学分类中均为不良预后核型;相比较而言, EVI1在一些预后较好的核型如t(15;17)、t(8;21)、inv(16)中发生率较低。
2.3治疗结果
35例EVI1基因阳性AML患者中, 1个疗程获CR者 13例,2个疗程获CR者 6例,总的缓解率54.3%, 其中早期死亡4例; 19例达CR患者中有9例进行了allo-HSCT,存活6例,死亡3例。EVI1基因阴性AML患者中,1疗程获CR者 151例,2个疗程获CR者 52例,总的缓解率74.1%,其中早期死亡26例;203例达CR患者中有146例进行了allo-HSCT。可见,EVI1基因阳性AML患者CR率明显低于EVI1基因阴性患者(54.3%∶74.1%)(P<0.05)。为研究allo-HSCT对EVI1基因阳性AML患者预后的影响,将这35例EVI1基因阳性AML患者按治疗方式分为allo-HSCT组和单纯化疗组,Kaplan-Meier法分析发现,allo-HSCT明显提高了EVI1基因阳性AML患者OS (P<0.05)(图1)。
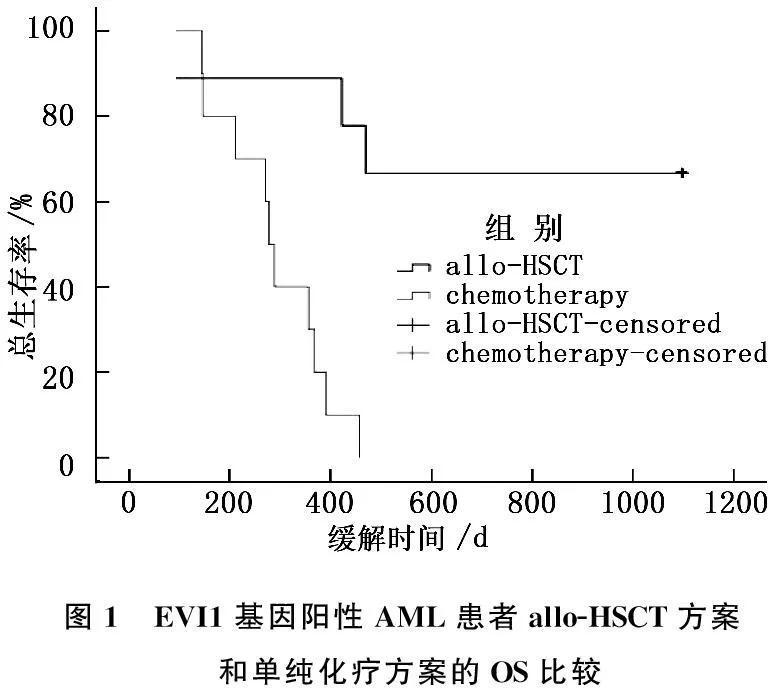
图1 EVI1基因阳性AML患者allo-HSCT方案和单纯化疗方案的OS比较
3讨论
EVI1基因是一个具有DNA结合活性的锌指结构转录因子,该基因可与不同的蛋白如Smad3和CtBP形成复合体,调控一些信号通路中关键基因的转录[24]。EVI1最初是作为一个常见的逆转录病毒插入点在小鼠髓系白血病中被首次发现的。随后,在髓系恶性肿瘤的染色体3q26重排的断裂点区域发现了EVI1基因[25]。基因靶标实验表明EVI1在小鼠造血干细胞的增殖和维持中起关键作用,并且可参与白血病于细胞的产生[14]。尽管 EVI1基因早在 1988 年就已经被发现,然而人们对其本质了解并不多。
早期的研究[15]发现,EVI1 RNA的表达见于3号染色体异常,例如 t (3;3) ( q2l;q26 ) 或 inv (3 )(q2l;q26)。近期研究[16]表明,无3号染色体异常的白血病中也有EVI1的异常表达,在本研究中作者亦证实了这一结果: 35例EVI1基因阳性患者中,inv(3)/t(3;3)仅占14%, 许多患者表现为其他染色体异常。无3q26异常的白血病, EVI1基因过度表达的机制尚不明。Langabeer 等[17]观察到没有3q26异常的326例AML 11% EVI1表达阳性,认为这些病例可能有隐含的3q26的重排,或是反映了向白血病转化的造血前体细胞的EVI1表达状态,也说明在AML白血病形成中EVI1的表达起重要作用。
本研究中作者发现, EVI1基因阳性患者(35例)占AML患者(309例)的11.3%, Gilliland等曾假设AML的发生是由Ⅰ类和Ⅱ类突变共同导致的。Ⅰ类突变导致造血细胞增殖加速,而Ⅱ类突变可导致分化受阻和成熟障碍[18]。在许多其他类型AML的t(8;21)、inv(16)和c-kit等特别的突变存在者非随机的相关性,证实了Gilliland的假设[19]。作者发现在这些EVI1基因阳性患者中,M0-M6型均可见EVI1基因表达,进一步分析发现,M4、M5型的EVI1基因阳性率高于其他亚型。因此,作者认为,EVI1基因的表达可能发生于白血病形成的后期阶段,其表达是一个继发的过程而非原始启动过程。对于EVI1在白血病形成中究竟发挥主导效应还是辅助效应,目前还不得而知。EVI1常与其它融合基因共表达,伴随一些重现性染色体异常。该研究中, 35例EVI1基因阳性AML患者中,存在染色体异常者占77%, 主要为11q23异常、inv(3)/t(3;3)、7号单体以及复杂核型等不良预后核型,而诸如 t(15;17)、t(8;21)、inv(16)等预后良好核型的发生率较低,这也从另一个角度证实了EVI1基因阳性AML预后不良。
关于EVI1 基因的预后价值也是一个有争论的话题。多数文献报道 EVI1基因 异常表达与不良预后相关[20], EVI1基因阳性患者的复发率高,疗效差,生存期短,可能是AML患者预后不良的一个因素。亦有文献[21]比较了3q26正常而EVI1基因阳性和阴性患者的无病生存和总生存期,发现差异无统计学意义,进而指出EVI1在AML中不能作为一个独立预后因素。
近年来, HSCT被广泛应用于白血病等恶性血液病的治疗,尤其是allo-HSCT的广泛应用成功挽救了大量患者的生命,甚至成为一些血液病唯一的根治方法。本研究将35例EVI1基因阳性AML患者分为allo-HSCT组和单纯化疗组,分析发现allo-HSCT明显提高了EVI1基因阳性AML患者OS (P<0.05),表明EVI1基因阳性AML患者接受allo-HSCT可提高其生存率,改善预后,是其治疗的最佳手段。但由于本研究中EVI1基因阳性患者移植的病例数还较少,尚需今后大量移植病例来进一步统计。
综上所述,作者认为EVI1基因阳性AML患者生存期短,化疗效果差,预后不良,allo-HSCT可显著改善其生存。因此,在初诊AML患者中,EVI1的检测显得尤为重要,不仅可评估患者的预后,更好地进行危险分层,而且对于治疗手段的选择也非常重要。对于EVI1基因阳性AML患者,达CR后尽快寻找合适的供体并行allo-HSCT对于改善其生存显得非常重要。近来,有研究[22]认为EVI1基因和CD52过表达密切相关,这可能成为CD52单克隆抗体治疗的靶点。对于EVI1预后不良的机制以及研究新的治疗此类患者的手段还需进一步研究。
参考文献
[1]Goyama S, Yamamoto G, Shimabe M, et al. Evi-1 is a critical regulator for hematopoietic stem cells and transformed leukemic cells[J]. Cell Stem Cell, 2008, 3(2): 207-220.
[2]Maicas M, VazquezI, Vicente C, et al. Functional characterization of the promoter region of the human EVI1 gene in acute myeloid leukemia: RUNX1 and ELK1 directly regulate its transcription[J]. Oncogene, 2012, 32(16): 2069-2078.
[3]Morishita K, Parker D S, Mucenski M L, et al. Retroviral activation of a novel gene encoding a zinc finger protein in IL-3-dependent myeloid leukemia cell lines[J]. Cell, 1988, 54(6): 831-840.
[4]Buonamici S, Li D, Chi Y, et al. EVI1 induces myelodysplastic syndrome in mice[J]. J Clin Invest, 2004, 114(5): 713-719.
[5]Jin G, Yamazaki Y, Takuwa M, et al. Trib1 and Evi1 cooperate with Hoxa and Meis1 in myeloid leukemogenesis[J]. Blood, 2007, 109(9): 3998-4005.
[6]Gröschel S, Lugthart S, Schlenk R F, et al. High EVI1 expression predicts outcome in younger adult patients with acute myeloid leukemia and is associated with distinct cytogenetic abnormalities[J]. J Clin Oncol, 2010, 28(12): 2101-2107.
[7]van Doorn-Khosrovani S, Erpelinck C, van Putten WL, et al. High EVI1 expression predicts poor survival in acute myeloid leukemia: A study of 319 de novo AML patients[J]. Blood, 2003, 101(3): 837-845.
[8]Bene M C, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological characterization of Leukemias (EGIL) [J]. Leukemia, 1995, 9(10): 1783-1786.
[9]Gonzalez Garcia J R, Meza-Espinoza J P. Use of the International System for Human Cytogenetic Nomenclature (ISCN) [J]. Blood, 2006, 108(12): 3952-3953.
[10]Rodeghiero F, Avvisati G, Castaman G, et al. Early deaths and anti-hemorrhagic treatments in acute promyelocytic leukemia. A GIMEMA retrospective study in 268 consecutive patients[J]. Blood, 1990, 75(11): 2112-2117.
[11]张之南, 沈悌. 血液病诊断及疗效标准[M]. 3版. 北京: 科学出版社, 2007: 133-133.
[12]Schildhaus HU1, Krckel I, Lippert H, et al. Promoter hypermethylation of p16INK4a, E-cadherin, O6-MGMT, DAPK and FHIT in adenocarcinomas of the esophagus, esophagogastric junction and proximal stomach[J]. Int J Oncol, 2005, 26(6): 1493-1500.
[13]Wieser R. The oncogene and developmental regulator EVI1: expression, biochemical properties, and biological functions[J]. Gene, 2007, 396(2): 346-357.
[14]Soengas M S, Capodieci P, Polsky D, et a1. Inactivation of the apoptosis effector Apaf-1 in malignant melanoma[J]. Nature, 2001, 409(6817): 207-211.
[15]Louz D, van den Broek M, Verbakel S, et aI. Erythroid defects and increased retroviraIIy-induced tumor formation in Evil transgenic mice[J]. Leukemia, 2000, l4(11): l876-l884.
[16]GoyamaS, Kurokawa M. Pathogenetic significance of ecotropic viraI integration site-l in hematological maIignancies[J]. Cancer Sci, 2009, l00(6): 990-995.
[17]Langabeer S E, Rogers J R, Harrison G, et aI. EVI1 expression in acute myeIoid leukaemia[J]. Br J Haematol, 2001, 112(1): 208-211.
[18]Gilliland D G, Griffin J D. The roles of FLT3 in hematopoiesis and leukemia[J]. Blood, 2002, 100(5): 1532-1542.
[19]Goemans B F, Zwaan C M, Miller M, et al. Mutations in KIT and RAS are frequent events in pediatric core-binding factor acute myeloid leukemia[J]. Leukemia, 2005, 19(9): 1536-1542.
[20]Bou Samra E, Klein B, Commes T, et al. Development of gene expression-based risk score in cytogenetically normal acute myeloid leukemia patients[J]. Oncotarget, 2012, 3(8): 824-832.
[21]Bard-Chapeau E A, Jeyakani J, Kok C H, et al. Ecotopic viral integration site 1(EVI1)regulates multiple cellular processes important for cancer and is a synergistic partner for FOS protein in invasive tumors[J]. Proc Natl Acad Sci USA, 2012, 109(6): 2168-2173.
[22]Saito Y, Nakahata S, Yamakawa N, et al. CD52 as a molecular target for immunotherapy to treat acute myeloid leukemia with high EVI1 expression[J]. Leukemia, 2011, 25(6): 921-931.
Clinical characteristics and prognostic analysis of acute myeloid leukemia patients with positive expression of EVI1 gene
LI Juan1, XIE Jing1, LI Helan1, SHI Peimin1, SUN Aining2
(1.DepartmentofHematology,TaixingPeople′sHospitalAffiliatedtoYangzhouUniversity,Taixing,Jiangsu, 225400; 2.DepartmentofHematology,TheFirstAffiliatedHospitalofSuzhouUniversity,KeyLaboratoryofThrombosisandHemostasisofMinistryofhealth,JiangsuInstituteofHematology,Suzhou,Jiangsu, 215000)
ABSTRACT:ObjectiveTo investigate the clinical characteristics and prognosis of acute myoloid leukimia patients with positive expression of EVI1 gene. MethodsA total of 309 AML cases were retrospectively reviewed. The clinical features, cytomorphology, cytogenetics, early death, complete remission rate, overall survival, relapse-free survival and response to allo-HSCT of AML patients with EVI1 gene positive expression were investigated and compared with patients with EVI1 gene negative expression. ResultsCompared with the EVI1 gene negative expression group, the WBC in EVI1 gene positive expression AML patients increased significantly (P<0.05). Otherwise, the percentage of M4/M5 in these patients was higher according to FAB classification (P<0.05). EVI1 gene positive expression was associated with specific recurrent chromosome abnormalities, including 11q23(MLL gene rearrangement)、inv(3)/t(3;3), monosomy 7, while some favorable risk cytogenetics such as t(15;17), t(8;21)and inv(16) were almost exclusive. The AML patients with EVI1 gene positive expression had lower CR rate compared with EVI1 gene negative expression group (54.3% versus 74.1%)(P<0.05). Among patients with EVI1 gene positive expression, the cases received allo-HSCT had a higher OS (P<0.05). ConclusionCompared with EVI1 gene negative expression AML patients, the patient with EVI1 gene positive expression have higher WBC count, poor response to chemotherapy and poor prognosis.
KEYWORDS:EVI1 gene; acute myeloid leukemia; allo-hematopoietic stem cell transplantion
中图分类号:R 733.7
文献标志码:A
文章编号:1672-2353(2016)09-032-05
DOI:10.7619/jcmp.201609009
通信作者:孙爱宁, E-mail: ainingsun@hotmail. com
收稿日期:2015-12-20

