CT引导肝癌介入中患者有效辐射剂量的研究
房 达 崔雄伟 李京华 赵隶嬴 郑加生 崔石昌
(首都医科大学附属北京佑安医院肝病肿瘤介入治疗中心 乙型肝炎与肝癌转化医学研究北京市重点实验室,北京 100069)
CT引导肝癌介入中患者有效辐射剂量的研究
房达崔雄伟李京华赵隶嬴郑加生崔石昌*
(首都医科大学附属北京佑安医院肝病肿瘤介入治疗中心 乙型肝炎与肝癌转化医学研究北京市重点实验室,北京 100069)
【摘要】目的探讨肝癌患者在5种CT引导介入操作中接受的有效辐射剂量。方法回顾性分析2014年9月至12月在首都医科大学附属北京佑安医院肝病肿瘤介入治疗中心进行CT引导介入诊断和治疗的390次肝癌患者的检查资料。介入操作包括肝穿刺、化学消融、射频消融、微波消融、冷冻消融5种方法。记录患者所接受的介入操作方式、扫描时间、照射量、容积CT剂量指数、剂量长度乘积。有效辐射剂量根据转换公式进行计算。结果肝穿刺、化学消融、射频消融、微波消融、冷冻消融平均扫描时间分别为(49.7±23.4)s、(88.9±21.3)s、(89.5±40.6)s、(106.0±43.5)s和(87.7±27.6)s;平均有效辐射剂量分别(19.5±14.9) mSv、(30.0±10.2) mSv、(34.2±17.6) mSv、(38.1±19.9) mSv和(33.1±13.1) mSv。肝穿刺组患者的有效剂量明显低于消融治疗组。有效剂量与管电流、扫描时间、照射量、容积CT剂量指数均存在明显的正相关关系。结论CT引导下单次介入操作有效辐射剂量相对较小,引起辐射损伤及后续合并症的危险小,是相对安全的;但多次介入治疗累积的有效辐射剂量可能会较大,需要引起重视。
【关键词】计算机断层摄影;介入治疗;辐射剂量;有效剂量
近年来,多种经皮介入微创技术越来越多地用于肝癌的诊断治疗。计算机断层摄影(computed tomography, CT)引导方法具有图像清晰、无盲区、不受肠道积气的影响、可用于肥胖患者等优点,从而得到广泛应用。在CT引导介入操作中,患者不可避免地受到放射辐射。减少放射辐射是放射技师、医师应承担的责任。CT工作站内含自动曝光控制系统,可以显示放射扫描参数自测值:扫描时间、管电压、管电流、照射量、容积CT剂量指数(volume-weighted CT dose index, CTDIvol)、剂量长度乘积(dose-length product,DLP)[1]。照射量(mAs)是管电流(mA)与扫描时间(s)的乘积,用以表述总辐射剂量;CTDIvol常用来表征某种特定检查扫描体积的平均剂量;DLP是在CT扫描总长度上对辐射剂量积分。有效剂量(effective dose,ED)是将组织及器官的当量剂量乘以与其危险度有关的权重因子再求和。ED与生物体辐射效应直接相关,反映整个机体发生随机性效应的危险度。
在临床实践中,放射技师、医师往往重点注意图像质量,而忽视了放射辐射对患者的损伤。本研究拟对2014年9至12月,在首都医科大学附属北京佑安医院肝病肿瘤介入治疗中心进行CT引导下肝癌介入诊断治疗操作患者的CT扫描辐射参数进行统计分析;探讨患者所接受的放射剂量,评价其潜在风险,以引起放射技师和医师的重视,尽量减小放射剂量。
1对象与方法
1.1研究对象
回顾性分析2014年9月至12月在首都医科大学附属北京佑安医院肝病肿瘤介入治疗中心接受CT引导下介入的肝癌患者共390次,其中,男性317次,女性73次;患者年龄为15~87岁,平均年龄58.35岁。
根据临床诊断治疗目的的不同,分为肝活检组、化学消融组、射频消融组、微波消融组和冷冻消融组5组。其中肝活检组为临床怀疑或临床诊断为肝癌患者,需行病理检查者;化学消融组、射频消融组、微波消融组和冷冻消融组为原发性肝癌或转移性肝癌肝动脉化疗栓塞术后患者。
1.2扫描方法
CT引导系统使用东芝Activion 16排CT机行平扫及增强扫描。探测器8 mm(0.5 mm×16层),管电压120 kV,层厚5 mm,层间距5 mm,重组层厚1 mm,间隔1 mm。旋转时间0.75 s/圈。必要时采用层厚 3 mm薄层扫描和适当调整窗宽、窗位的方法,以精确观察穿刺针位置。管电流根据患者体质量和需要观察感兴趣区的清晰程度,选择50、100、150、200 mA。每例患者消融治疗后,即刻进行增强扫描以门静脉期图像观察肿瘤坏死情况、确定消融范围是否覆盖病灶和观察是否有即时合并症。增强扫描采用高压注射器经肘前静脉注入碘克沙醇注射液(320 mg I/mL)100 mL,注射流速3 mL/s。扫描延迟时间为门脉期65~70 s。
1.3数据收集及换算统计
回顾性分析每例患者的CT图像和CT工作站自测值,汇总操作方式、扫描时间、照射量、CTDIvol、DLP等参数。将DLP换算成ED,根据国际放射防护委员会(ICRP)制定的有效剂量转换公式[2]:ED=k×DLP进行计算;其中k为人体不同部位的剂量转换系数,腹部k=0.015[3]。
1.4统计学方法
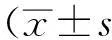
2结果
2.1患者和CT参数基本情况
按降序排列,5种介入操作次数依次是射频消融162次(41.5%)、微波消融130次(33.3%)、冷冻消融55次(14.1%)、肝活检25次(6.4%)和化学消融18次(4.6%)。
CT参数如下:管电流50 mA组50次、100 mA组285次、150 mA组45次、200 mA组10次,平均(101.92±29.4)mA。总扫描时间27.9~240.8s,平均扫描时间(92.2±40.7)s。照射量1 617~38 058 mAs,平均照射量(11 412.8±5 763.9)mAs。CTDIvol 33.6~678.4 mGy,平均(195.3±109.9)mGy。DLP 286.1~8 038.9 mGycm,平均(2 281.1±1 193.5)mGycm。ED 4.3~120.6 mSv,平均(34.2±17.9) mSv。
2.2不同操作方法与总扫描时间、有效剂量的关系
经检验,管电流、总扫描时间、照射量、CTDIvol、ED值均呈偏态分布,统计学差异分析采用独立样本非参数Kruskal-Wallis 检验、Pearson相关性检验。
不同介入操作方法之间,总扫描时间的差异有统计学意义(χ2=51.301,P<0.01),肝活检组小于各消融组;化学消融组、射频消融组、微波消融组、冷冻消融组之间比较,差异无统计学意义(P>0.05, 表1,图1)。
不同介入操作方法之间其ED值的差异有统计学意义(χ2=29.913,P<0.01);肝活检组小于各消融组;化学消融组、射频消融组、微波消融组、冷冻消融组之间差异无统计学意义(P>0.05,表1,图2)。
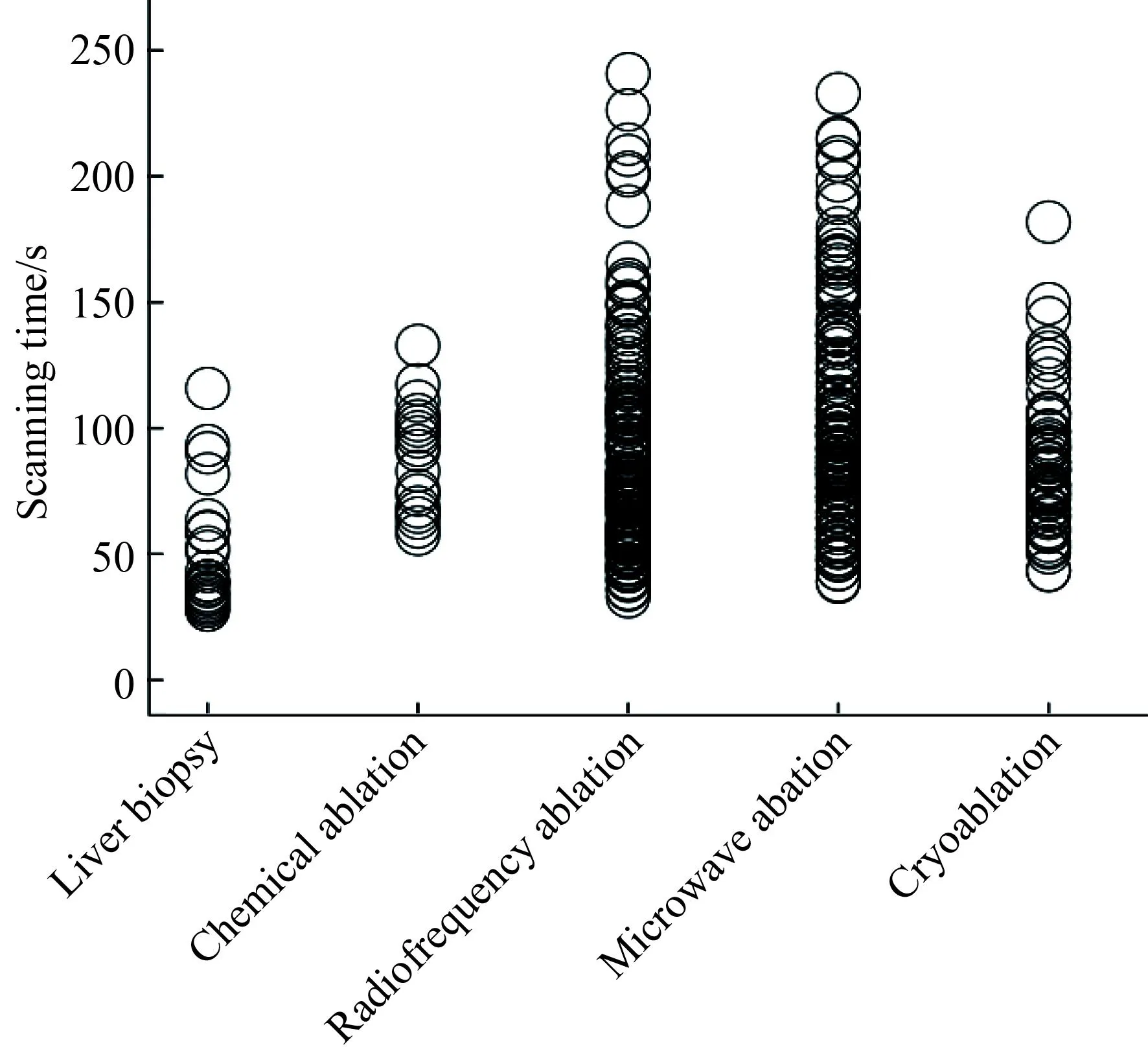
图1 5种操作类型的扫描时间分布
2.3有效剂量与CT参数的关系
ED值与管电流、总扫描时间、照射量、CTDIvol 差异均有统计学意义(P<0.01);均存在明显的正相关关系。随着管电流、总扫描时间、照射量、CTDIvol的增加,ED值随之增加,详见表2。
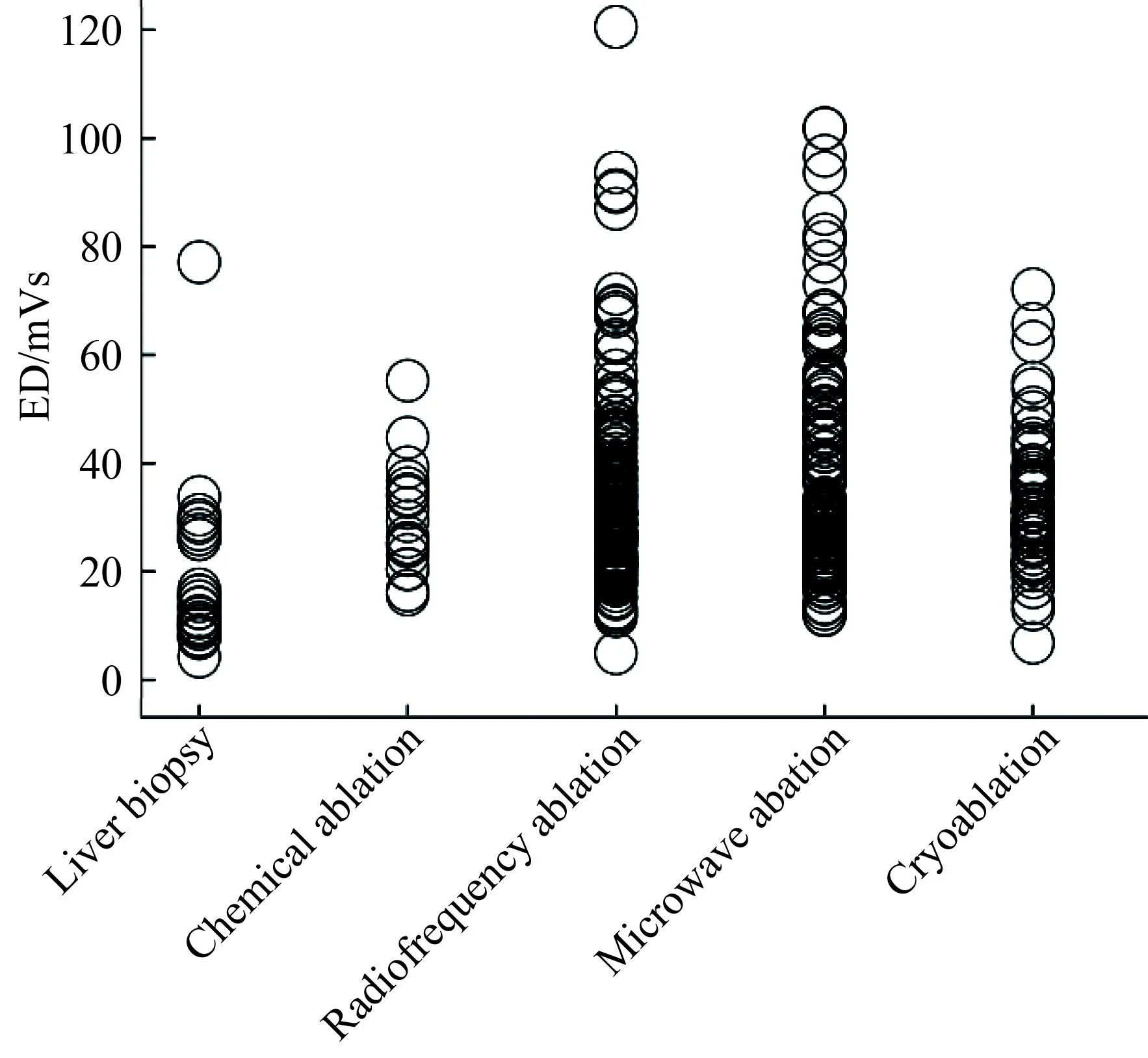
图2 不同操作类型的ED值分布
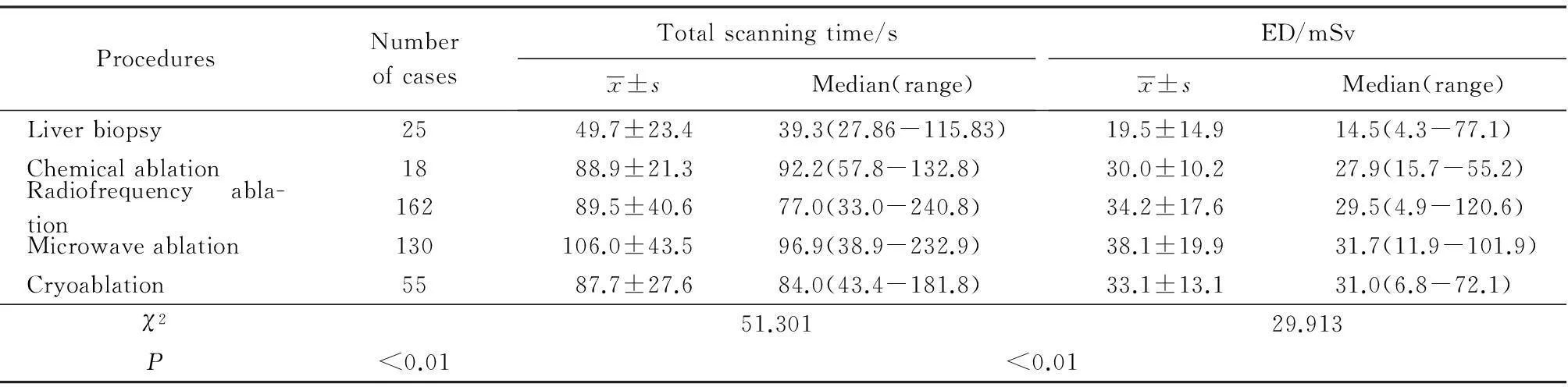
ProceduresNumberofcasesTotalscanningtime/sx±sMedian(range)ED/mSvx±sMedian(range)Liverbiopsy2549.7±23.439.3(27.86-115.83)19.5±14.914.5(4.3-77.1)Chemicalablation1888.9±21.392.2(57.8-132.8)30.0±10.227.9(15.7-55.2)Radiofrequencyabla-tion16289.5±40.677.0(33.0-240.8)34.2±17.629.5(4.9-120.6)Microwaveablation130106.0±43.596.9(38.9-232.9)38.1±19.931.7(11.9-101.9)Cryoablation5587.7±27.684.0(43.4-181.8)33.1±13.131.0(6.8-72.1)χ251.30129.913P<0.01<0.01
ED: effective dose.
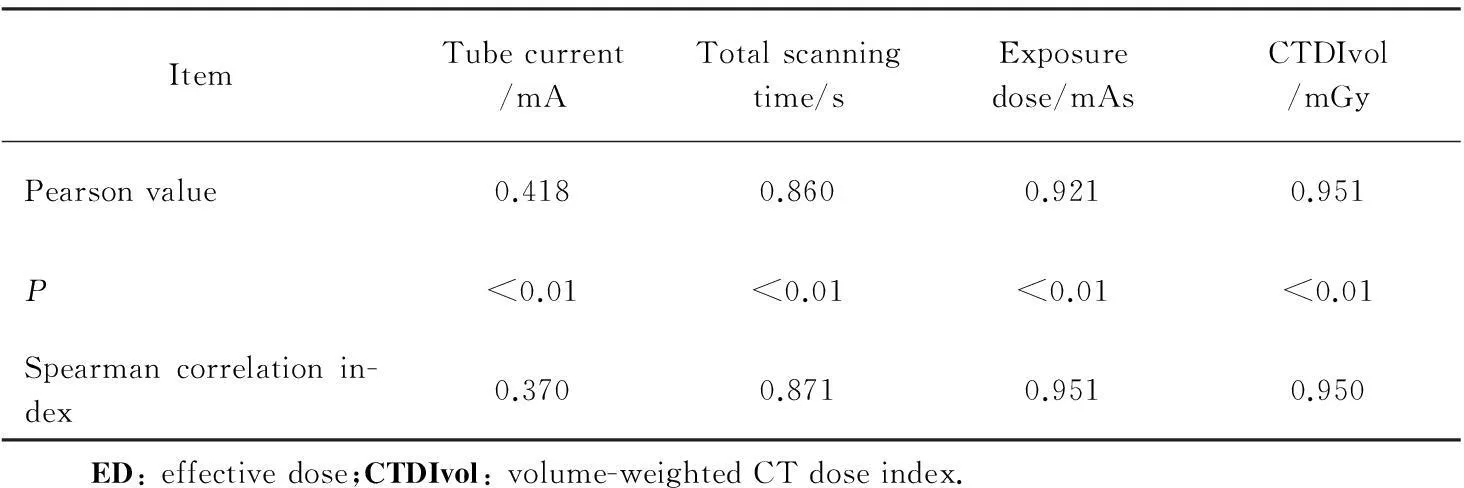
表2 ED与管电流、总扫描时间、照射量、CTDIvol的关系
3讨论
CT引导介入操作具有一定的X线辐射。因为需要反复扫描、穿刺,增加了患者的辐射剂量。术者操作的熟练程度、病变部位、CT机性能及介入操作目的,均可以影响患者所受的辐射剂量。
放射性效应分为确定效应和随机效应。确定效应是指暴露在一定辐射剂量下的生物体必然会产生相应的危害,包括细胞损伤、坏死;随机效应导致基因突变、诱发肿瘤和遗传疾病。辐射剂量限值与致癌性的关系,各家看法不一。根据美国国家科学委员会附设电离辐射生物效应委员会(Biological Effects of Ionizing Radiation, BEIR)[4]在2005年报告中提供的普遍认可的证据,人体接受的辐射剂量>500 mSv的群体中危险为确定效应;在<500 mSv条件下致癌危险为随机效应,但随剂量增长致癌率呈线性增长,呈“线性无阈”特点[4-6]。BEIR根据人体年累积有效剂量,确定了超出人体年允许全身安全有效剂量限值:≤3 mSv为低度辐射;3~20 mSv(含20 mSv)为中度;20~50 mSv(含50 mSv)为重度;>50 mSv为超重度[4]。国际辐射防护委员会(International Commission on Radiological Protection, ICRP)[6]认为:CT扫描的组织吸收剂量已经达到或超过了增加组织致癌可能性的水平。另一方面,美国医学物理师学会(American Association Physicists Medicine,AAPM)的一项声明则认为:不应过分渲染医用X射线对患者的致癌危险。过多考虑其辐射致癌危险,可能使患者失去早期发现和治疗疾病的机会。AAPM[4]进一步指出,一次CT扫描剂量在50 mSv以下,或者短时间累积剂量在100 mSv以下,可以不必过分考虑致癌的危险。国家辐射防护与测量委员会也认为,<100 mSv与肿瘤发生无线性关系。
本研究中,接受CT引导肝穿刺活检的肝癌患者所受辐射剂量为19.5±14.9(4.3~77.1)mSv,大约相当于一次腹部增强CT扫描的剂量,与既往报道[7-9]类似。由于肝活检相对简单,故其扫描时间最短(49.7±23.4)s,ED值最小,大约为消融治疗的1/2。在临床工作中,病变位置越深、越小,穿刺难度越大,穿刺次数也就越多,辐射剂量也就越大[10]。因为每次活检的辐射剂量较小,且对于一个患者很少需要做3次以上的肝穿刺活检,所以每个患者不会因肝活检而接受过多的辐射。
一般认为,CT引导的各种消融治疗,患者接受的辐射剂量高于普通CT扫描,与一次腹部平扫+增强扫描所受辐射剂量或10年所接受的来自自然界辐射剂量大致相当。推测这样的剂量诱发癌症的风险为1/10 000~1/1 000。陈文会等[5]报道射频消融患者所受辐射ED平均值为(18.69±6.39)mVs,中位数18.12 mVs,范围9.90~37.43 mVs;粒子植入ED平均值为(25.62±10.43)mVs,中位数23.44 mVs,范围6.15~51.35 mVs。本研究中,化学消融组、射频消融组、微波消融组和冷冻消融组患者所接受的平均ED值差别不大,分别为(30.0±10.2) mSv、(34.2±17.6) mSv、(38.1±19.9)mSv 和(33.1±13.1)mSv,高于一次腹部增强扫描的剂量[11],低于肝动脉化疗栓塞术76.1(5.8~220.5)mSv[12]。相对于能引起人体确定性危险效应的辐射剂量500 mSv来说,这些辐射都是相当低的,不会导致确定性效应,所以是相当安全的。由于这4种消融治疗方式,患者所受辐射剂量差别不大,所以在医生选择消融治疗方法时主要考虑患者的病情,而不用过多地考虑不同消融方法的辐射剂量的差异。Hansen等[4]回顾性分析了1年内接受6次以上CT检查的300例患者(289 例恶性肿瘤,11例创伤)的情况,平均每例CT检查11.2(7~ 20)次,接受的有效辐射剂量为21.42 mSv,其中198例恶性肿瘤患者检查后在1.5年内死亡,但死亡与辐射剂量无关。又由于肝癌患者一般生存期较短,短于辐射引起肿瘤的潜伏期。因此,少量几次CT引导介入操作与致命性肿瘤的发生并无线性关系,所以操作本身相对安全。但是,对于肿瘤较大的患者,以及反复产生新的病灶患者,需要进行多次反复介入治疗,累积剂量很大,就可能造成确定性辐射损伤;其随机效应也会随辐射剂量增长而呈线性增长[9]。
常用的降低CT辐射剂量的方法有:(1)减少扫描层数、缩短扫描时间:在CT引导下介入操作过程中,先行CT定位扫描,控制扫描长度,尽量减少扫描层面。肝活检中,一般以肿瘤最大截面积为最佳操作部位。消融治疗中,以穿刺点到穿刺目标点区域为操作部位。但有时为了精确观察穿刺针尖的位置,不得不行薄层扫描,从而增加了辐射剂量。(2)降低管电流:管电流与照射剂量(mAs)呈线性相关性,随着管电流毫安值的降低,X线光子数下降,CT图像质量下降。但是在不影响引导效果的情况下,可以通过降低管电流的方式来降低ED值。有研究[11]在30 mAs的条件下对291例患者行CT引导下介入操作,成功率为93.5%。有报道[12],53例肝癌介入治疗后复查患者,低剂量法(120 kV,80 mA)较常规法(120 kV,160 mA)CT扫描剂量减少50%;组织解剖细节分辨率降低,但不影响碘油沉积及肿瘤坏死的图像显示。笔者所治疗的患者大都是先行肝动脉导管化学药物治疗栓塞后再进行消融治疗的患者。高原子序数的碘油在肿瘤内沉积,与周围正常肝组织形成了明显的对比;在CT扫描时,金属的穿刺针与肝癌组织、正常肝组织具有明显的对比;CT扫描主要是引导作用,并不是以影像诊断为目的。因此,降低管电流,图像质量略有下降,但不影响穿刺成功率。在不影响观察的前提下,根据患者体质量、肥胖程度,尽可能使用低电流,分别采用了50、100、150和200 mA,均顺利完成了治疗。
综上所述,CT引导介入诊疗操作是相对安全的。但对于需要反复多次治疗的患者,其累积剂量可能会达到比较大甚至是危险的程度,所以在临床工作中还是需要引起足够的重视,并不断探索和改进操作方法,进一步控制和降低有效辐射剂量。
4参考文献
[1]Huda W, Mettler FA. Volume CT dose index and dose-length product displayed during CT: what good are they? [J].Radiology,2011,258(1):236-242.
[2] Andrew J, Einstein, M D, Javier Sanz M D,et al. Radiation dose and cancer risk estimates in 16-slice computed tomography coronary angiography[J]. J Nucl Cardiol, 2008, 15(2):232-240.
[3] Mark P, Little D, Richard W, et al. Risks associated with low doses and low dose rates of ionizing radiation: why linearity may be(almost) the best we can do?[J]. Radiology, 2009, 251 (1): 6-12.
[4] Hansen J, Jurik A G.Survival and radiation risk patients obtaining more than Six CT examinations during one year[J]. Acta Oncol,2009,48(2):302-307.
[5] 陈文会,江旭,杨继金,等.CT引导介入操作中患者有效辐射剂量的研究[J].介入放射学杂志,2011,21(7):579-573.
[6] Li J,Udayasankar U K,Carew J,et al. CT-guided liver biopsy: correlation of procedure time and radiation dose with patient size,weight,and lesion volume and depth[J].Clin Imaging, 2010,34(4):263-268.
[7] 王志康,孙建忠,赵祖丹.多发伤患者住院期间X射线累积有效剂量研究[J].中华放射医学与防护杂志,2012,32(3):323-325.
[8] 张翼,宋少娟,曲桂莲,等.10种介入诊疗程序中患者的辐射剂量调查[J].中华放射医学与防护杂志,2011,31(4):482-484.
[9] 陈旭兰, 付靖楠,李颖,等. 超声引导下射频消融术联合靶向治疗对晚期肝细胞癌患者免疫功能的影响[J]. 解放军医药杂志,2015,27(5):41-45.
[10] 杨文茹. 肝癌射频消融对机体抗肿瘤免疫状态的影响[J]. 中国煤炭工业医学杂志,2013,16(6):932-933.
[11] 李林静, 叶佳,刘玮玮,等. 射频消融对比经皮无水乙醇注射治疗早期肝癌的Meta分析[J]. 中国医科大学学报,2014,43(11) :1008-1014.
[12] 郭放, 刘永叶,郑振东,等. 超声引导下射频消融治疗原发性肝癌36例[J]. 解放军医药杂志,2014,26(4):68-70.
编辑慕萌
Radiation effective dose received by performing CT-guided interventional procedures in the patients with liver cancer
Fang Da,Cui Xiongwei,Li Jinghua,Zhao Liying,Zheng Jiasheng,Cui Shichang*
(InterventionalCenterforOncology,BeijingYouanHospital,CapitalMedicalUniversity;BeijingKeyLaboratoryforTranslationalMedicineonHepatitisBandHepatocellularCarcinoma,Beijing100069,China)
【Abstract】ObjectiveTotally To explore the effective radiation dose taken during 5 kinds CT-guided interventional procedures to the patients with liver cancer. MethodsTotally 390 case-time inspection records from Sept. to Dec. 2014, of who were diagnosed and treated by the CT-guided interventional procedures, were retrospectively analyzed. The interventional procedures include liver biopsy, chemical ablation, radiofrequency ablation, microwave ablation, and cryoablation. The type of CT-guided interventional procedure, the scanning time, the exposure dose(total mAs),volume-weighted CT dose index(CTDIvol) and the total does-length product (DLP) were recorded. Effective dose(ED) was calculated. ResultsThe average scanning time of liver biopsy, chemical ablation, radiofrequency ablation, microwave ablation, and cryoablation were (49.7±23.4)s,(88.9±21.3)s,(89.5±40.6)s,(106.0±43.5)s and(87.7±27.6)s. The EDs of the five procedures were (19.5±14.9) mSv,(30.0±10.2) mSv,(34.2±17.6) mSv,(38.1±19.9) mSv and (33.1±13.1) mSv, respectively. The EDs in biopsy procedure were significantly lower than those in ablation procedures. It was represented that the ED are positively correlative with the tube current, the scanning time, the exposure dose and the CTDIvol. ConclusionThe effective radiation dose of single CT-guided interventional procedure is relatively lower. Therefore the risk of radiational damage and subsequent complications is lower as well. It should be paid attention that the cumulated effective dose for several times of CT-guided interventional treatments may exceed the acceptable range.
【Key words】computed tomography;interventional treatment;radiation dose;effective dose
(收稿日期:2015-06-18)
【中图分类号】R 73
[doi:10.3969/j.issn.1006-7795.2016.01.019]
*Corresponding author, E-mail:csccln@126.com
基金项目:国家科技支撑计划基金资助项目(2012BAI15B08),北京佑安医院肝病艾滋病科研基金(BJYAH-2011-034)。This study was supported by National Sci-Tech Support Plan(2012BAI15B08),Liver and AIDS Foundation of Beijing Youan Hospital(BJYAH-2011-034).
网络出版时间:2016-01-2718∶00网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1800.020.html
· 临床研究 ·

