乙肝表面抗原阳性的非霍奇金淋巴瘤患者化疗前后T淋巴细胞亚群的变化
范小红,孟亚红,邹 健,王雪莲,孙丽华
(复旦大学附属中山医院青浦分院,上海 201700)
乙肝表面抗原阳性的非霍奇金淋巴瘤患者化疗前后T淋巴细胞亚群的变化
范小红,孟亚红,邹健,王雪莲,孙丽华
(复旦大学附属中山医院青浦分院,上海 201700)

[摘要]目的探讨非霍奇金淋巴瘤(NHL)合并乙肝表面抗原(HBsAg)阳性患者化疗前后T淋巴细胞亚群和辅助性T淋巴细胞(Th)的异常漂移变化,为该病的治疗提供更多依据。方法根据HBsAg是否阳性将82例NHL患者分为阳性组26例和阴性组56例,观察2组的疗效及治疗前后肿瘤坏死因子(TNF)-α、白细胞介素(IL)-10、IL-6、CD3+、CD4+、CD8+、CD4+/CD8+、CD19+、CD4+CD25+Treg和NK细胞水平的变化。结果阳性组的完全缓解率明显低于阴性组(P<0.05)。2组治疗前TNF-α、IL-10、IL-6、CD3+、CD4+、CD8+、CD4+/CD8+、CD19+、CD4+CD25+Treg和NK细胞水平比较差异均无统计学意义(P均>0.05);2组治疗后IL-10、IL-6、CD8+、CD19+、CD4+CD25+Treg均较治疗前明显降低(P均<0.05),CD3+、CD4+、CD4+/CD8+、NK细胞水平均较治疗前明显升高(P均<0.05),而阴性组变化较阳性组更为明显(P均<0.05);治疗后阳性组的TNF-α水平明显高于治疗前和阴性组(P均<0.05)。结论NHL合并HBsAg阳性患者化疗效果明显低于HBsAg阴性患者,其机制可能与HBV加剧机体的细胞和体液免疫紊乱及Th细胞的异常漂移有关。
[关键词]非霍奇金淋巴瘤;乙型肝炎;化疗;T淋巴细胞亚群
非霍奇金淋巴瘤(NHL)是世界七大恶性肿瘤之一,其发病与HIV病毒、人T细胞白血病病毒、幽门螺杆菌和EB病毒感染有关。目前研究表明乙肝病毒(HBV)与淋巴组织具有较高的亲嗜性,HBV可使NHL发病危险增加[1]。NHL是一种免疫性疾病,预后与机体的免疫状态具有密切的关系,可能与辅助性T淋巴细胞(Th)的异常漂移,机体Th1和Th1的失衡等具有明显的相关性。但NHL合并HBV患者预后是否与Th的异常漂移及Th1和Th1的失衡有关报道较少。为此笔者进行了相关研究,以探讨NHL合并乙肝表面抗原(HBsAg)阳性患者化疗前后T淋巴细胞亚群和Th的异常漂移变化,现将结果报道如下。
1临床资料
1.1一般资料选择2013年1月—2015年6月在我院住院的NHL患者82例,均行骨髓穿刺结合辅助学检查符合NHL的诊断。排除化疗前发生肝肾功能异常者,有肝转移灶者,合并有其他病毒类型肝炎者,孕妇或者妊娠者,化疗方案、治疗疗程不符合本研究者,使用对本研究结果有影响药物者,有大三阳者。根据HBsAg是否阳性分为2组:阳性组26例,男14例,女12例;年龄30~60(46.66±10.16)岁;病程2~8(4.12±1.36)年。阴性组56例,男34例,女22例;年龄30~60(45.18±8.98)岁;病程2~8(3.75±1.18)年。2组年龄、性别、病程等资料比较差异均无统计学意义(P均>0.05),具有可比性。
1.2治疗方法2组均采用CHOP方案或CHOP与利妥昔单抗联合方案化疗,治疗前常规给予5-HT受体拮抗剂预防性止吐及质子泵抑制剂护胃治疗。CHOP方案:长春新碱1.4 mg/m2静推,第1天;环磷酰胺 750 mg/m2静推,第1天;阿霉素50 mg/m2静推,第1天;泼尼松100 mg/d口服,第1—5天。利妥昔单抗375 mg/m2静脉缓慢注射,用药前30 min给予甲基泼尼松龙40 mg静脉注射。均以 3 周为1个疗程,连续化疗3个疗程。
1.3观察指标①2组临床疗效。②于治疗前和治疗3个疗程后抽取2组患者空腹静脉血,采用Freedom Evolyzer 2150 型全自动酶标仪以酶联免疫法测定肿瘤坏死因子(TNF)-α、白细胞介素(IL)-10、IL-6水平,用直接免疫荧光标记全血溶血法和流式细胞技术检测CD3+、CD4+、CD8+、CD4+/CD8+、CD19+、CD4+CD25+Treg和NK细胞水平。试剂盒均购自美国R&D公司,所有检测项目均严格按照试剂盒说明进行操作。
1.4疗效评价标准淋巴结无法触及,细胞学检查阴性,CT提示淋巴结直径不超过1 cm,骨髓的形态学和组织学正常,至少稳定保持28 d为完全缓解(CR);可测的病灶较原先缩小50%以上为部分缓解(PR);病灶增大不超过25%或者缩小不足50%为稳定(SD);可测病灶较原先增大超过25%,或者出现新的病灶为进展(PD)。

2结果
2.12组疗效比较阳性组CR率明显低于阴性组(P<0.05)。见表1。

表1 2组疗效比较 例(%)
注:①与阴性组比较,P<0.05。
2.22组治疗前后TNF-α、IL-10和IL-6水平比较2组治疗前TNF-α、IL-10、IL-6水平比较差异均无统计学意义(P均>0.05)。2组治疗后IL-10和IL-6均较治疗前明显降低(P均<0.05),且阴性组降低更为明显(P均<0.05); 阳性组治疗后TNF-α均较治疗前和阴性组明显升高(P均<0.05)。见表2。
2.32组治疗前后CD3+、CD4+、CD8+、CD4+/CD8+水平比较2组治疗前CD3+、CD4+、CD8+、CD4+/CD8+比较差异均无统计学意义(P均>0.05)。2组治疗后CD3+、CD4+和CD4+/CD8+均较治疗前明显升高(P均<0.05),CD8+较治疗前明显降低(P均<0.05),且阴性组升高或降低更为明显(P均<0.05)。见表3。
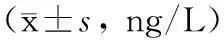
表2 2组治疗前后TNF-α、IL-10和IL-6水平比较
注:①与治疗前比较,P<0.05;②与阴性组比较,P<0.05。

表3 2组治疗前后CD3+、CD4+、CD8+、CD4+/CD8+水平比较
注:①与治疗前比较,P<0.05;②与阴性组比较,P<0.05。
2.42组治疗前后CD19+、CD4+CD25+Treg和NK细胞水平比较2组治疗前CD19+、CD4+CD25+Treg和NK细胞水平比较差异均无统计学意义(P均>0.05)。2组治疗后CD19+、CD4+CD25+Treg均较治疗前明显降低(P均<0.05),NK细胞水平较治疗前明显升高(P均<0.05),且阴性组降低或升高更为明显(P均<0.05)。见表4。

表4 2组治疗前后CD19+、CD4+CD25+Treg和NK细胞水平比较
注:①与治疗前比较,P<0.05;②与阴性组比较,P<0.05。
3讨论
HBV与淋巴组织具有较高的亲嗜性,同时NHL患者由于免疫力低下,导致NHL患者更易被HBV感染。NHL的治疗主要以化疗为主,化疗对机体的免疫功能可能会造成负面影响;而HBV感染也会引起机体的免疫功能下降,导致原癌基因激活,细胞凋亡机制出现紊乱[2-4],且HBV感染单核细胞引起癌基因的转录,可以引发NHL;HBV感染内皮细胞后,导致TNF-α产生,引起淋巴细胞的增殖,从而促进肿瘤的生长[5-7]。
淋巴细胞是免疫系统的主要细胞,根据细胞表面的标记,可以将其分为T细胞、B细胞和NK细胞等。T细胞中CD4+T细胞可协助B细胞进行分化和产生抗体,而CD8+T细胞具有杀伤和抑制作用[8]。CD4+T细胞亚群包括Th1、Th1和调节性T细胞(Treg),其中Th1主要通过分泌TNF-α促进机体的免疫功能[9],而TNF-α能够激活机体的CD8+T细胞和NK细胞释放细胞因子和穿孔素,从而抑制肿瘤细胞的生长。Th1和Treg有免疫抑制作用[10],其中Th1主要通过分泌IL-6和IL-10发挥免疫抑制作用[11-12]。IL-10是一种多功能细胞因子,可以作用于多种免疫细胞亚群,并通过多种方式发挥免疫抑制作用,在机体肿瘤免疫逃逸中起重要作用,其可以抑制单核细胞和巨噬细胞的吞噬作用。IL-6是功能最为广泛的细胞因子,其促进肿瘤生长作用大于机体的保护作用。CD4+CD25+Treg在维持外周自身免疫耐受及免疫应答稳态方面起着关键的作用,其数量或功能异常可引发多种自身免疫性疾病,大量CD4+CD25+Treg的出现使机体处于肿瘤逃逸状态,使肿瘤细胞逃避机体免疫系统的监视和杀伤,促进肿瘤的发生发展,影响预后[13-14]。
本研究结果显示,阳性组CR率明显低于阴性组;2组治疗后IL-10、IL-6、CD8+、CD19+、CD4+CD25+Treg水平均较治疗前明显降低,CD3+、CD4+、CD4+/CD8+、NK细胞水平均较治疗前明显升高,而阴性组降低或升高水平较阳性组更为明显, 阳性组治疗后TNF-α水平明显高于治疗前和阴性组。提示HBV能够引起机体细胞免疫和体液免疫的紊乱,进而导致Th1和Th1紊乱,从而影响化学药物治疗NHL的临床效果。
综上所述,NHL合并HBsAg阳性患者化疗的疗效明显差于HBsAg阴性患者,其机制可能与HBV加剧机体的细胞和体液免疫紊乱及Th细胞的异常漂移有关。
[参考文献]
[1]Dalia S,Suleiman Y,Croy DW,et al. Association of lymphomagenesis and the reactivation of hepatitis B virus in non-hodgkin lymphoma[J]. Cancer Control,2015,22(3):360-365
[2]Hsiao LT,Chiou TJ,Gau JP,et al. Risk of reverse seroconversion of hepatitis B virus surface antigen in rituximab-treated non-Hodgkin lymphoma patients:A Large Cohort Retrospective Study[J]. Medicine (Baltimore),2015,94(32):e1321
[3]Li X,Fan XW,Liu W,et al. Risk factors for damaged liver function after chemotherapy in hepatitis B virus carriers with non-Hodgkin lymphoma[J]. Genet Mol Res,2015,14(1):2647-2653
[4]汪海涓,李刚. 非霍杰金淋巴瘤合并乙肝病毒感染化疗肝功损害的探讨[J]. 吉林医药学院学报,2014,35(5):339-340
[5]杨洪亮,张翼鷟. 淋巴瘤合并乙肝化疗后乙肝病毒再激活研究进展[J]. 山东医药,2014,54(13):90-92
[6]李小亮,王玫玫,朱卫健,等. 利妥昔单抗联合CTOP化疗治疗感染乙肝病毒恶性淋巴瘤的临床观察[J]. 广东医学,2012,33(18):2836-2837
[7]张美霞,徐细明. 乙肝病毒感染与B淋巴瘤患者利妥昔单抗联合CHOP化疗后的临床观察[J]. 山西医科大学学报,2015,46(7):613-616
[8]Steinke FC,Yu S,Zhou X,et al. TCF-1 and LEF-1 act upstream of Th-POK to promote the CD4(+) T cell fate and interact with Runx3 to silence Cd4 in CD8(+) T cells[J]. Nat Immunol,2014,15(7):646-656
[9]Kang EH,Lee YJ,Hyon JY,et al. Salivary cytokine profiles in primary Sjogren’s syndrome differ from those in non-Sjogren sicca in terms of TNF-alpha levels and Th-1/Th-2 ratios[J]. Clin Exp Rheumatol,2011,29(6):970-976
[10] Kerbrat S,Vingert B,Junier MP,et al. Absence of the adaptor protein PEA-15 is associated with altered pattern of Th cytokines production by activated CD4+T lymphocytes in vitro, and defective red blood cell alloimmune response in vivo[J]. PLoS One,2015,10(8):e136885
[11] Li B,Tian L,Diao Y,et al. Exogenous IL-10 induces corneal transplantation immune tolerance by a mechanism associated with the altered Th1/Th1 cytokine ratio and the increased expression of TGF-beta[J]. Mol Med Rep,2014,9(6):2245-2250
[12] Loria-Cervera EN,Sosa-Bibiano EI,Villanueva-Lizama LE,et al. Cloning and sequence analysis of Peromyscus yucatanicus (Rodentia) Th1 (IL-12p35, IFN-gamma and TNF) and Th1 (IL-4, IL-10 and TGF-beta) cytokines[J]. Cytokine,2014,65(1):48-55
[13] Feng H,Yin J,Han YP,et al. Sustained changes of Treg and Th17 cells during interferon-alpha therapy in patients with chronic hepatitis B[J]. Viral Immunol,2015,28(8):412-417
[14] 陈广侠,姜葵,周璐,等. Th17和FOXP3+T 在胃黏膜相关淋巴组织淋巴瘤发病中的意义[J]. 中国肿瘤临床,2012,39(12):834-836
Changes of T lymphocyte subsets in Hepatitis B surface antigen-positive patients with non-Hodgkin's lymphoma before and after chemotherapy
FAN Xiaohong, MENG Yahong, ZOU Jian, WANG Xuelian, SUN Lihua
(Qingpu Branch of Zhongshan Hospital Affiliated to Fudan University, Shanghai 201700, China)
Abstract:Objective It is to investigate the changes of T lymphocyte subsets and helper T lymphocytes (Th) drift in Hepatitis B surface antigen-positive (HBsAg+) patients with non-Hodgkin’s lymphoma (NHL) before and after chemotherapy. Methods 82 patients with NHL were divided into positive group [26 cases, HBsAg(+)] and negative group [56 cases, HBsAg(-)] according to whether HBsAg positive, the efficacy, and the levels of tumor necrosis factor (TNF) -α, interleukin (IL) -10, IL-6, CD3+, CD4+, CD8+, CD4+/CD8+, CD19+, CD4+CD25+ Treg and NK cell before and after treatment were observed and compared in each group. Results The complete remission rate of the positive group was significantly lower than that of the negative group (P<0.05). There was no significant difference in the levels of TNF-α, IL-10, IL-6, CD3+, CD4+, CD8+, CD4+/CD8+, CD19+, CD4+CD25+ Treg and NK before treatment between the both groups (all P>0.05); after treatment, the levels of IL-10, IL-6, CD8+, CD19+ and CD4+CD25+ Treg after treatment were significantly lower and the levels of CD3+, CD4+ and CD4+/CD8+ and NK were significantly higher in the both groups (all P<0.05), and there were significant differences between the both groups (all P<0.05); the level of TNF-α of the positive group were significantly higher compared with before treatment and the negative group (all P<0.05). Conclusion The effect of chemotherapy in NHL patients with HBsAg(+) is significantly worse than that with HBsAg(-), their mechanism may be associated with the disorders of cellular and humoral immune, and the abnormal drift of Th cells by HBV.
Key words:non-Hodgkin’s lymphoma; hepatitis B; chemotherapy; T lymphocyte subsets
[收稿日期]2015-10-25
[中图分类号]R55
[文献标识码]A
[文章编号]1008-8849(2016)09-0920-04
doi:10.3969/j.issn.1008-8849.2016.09.003
[基金项目]复旦大学附属中山医院青浦分院院内基金课题(QYT 2013-01)
[作者简介]范小红,女,主治医师,研究方向为血液恶性肿瘤。[通信作者]孙丽华,E-mail:qpsunlh023@126.com

