象耳豆根结线虫Me—mapk1基因的克隆及RNAi分析
魏丽莎子 龙海波 陈绵才 赵志祥


摘 要 促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是线虫体内信号转导的重要组分,在生长发育过程中具有重要作用。本研究从象耳豆根结线虫中克隆了1个促分裂原活化蛋白激酶基因Me-mapk1 cDNA序列,该序列全长1 369 bp,包含1个1 185 bp的完整开放阅读框,推导编码394个氨基酸,蛋白质分子量为45. 39 ku。同源性搜索比对结果发现,该基因编码的蛋白序列与南方根结线虫MI-MAPK1具有99%的一致性。通过构建原核表达载体pET-32a-MAPK,在IPTG的诱导下得到70 ku左右的特异融合蛋白(包括大小约26 ku的标签序列)。利用RNAi技术对象耳豆根结线虫二龄幼虫Me-mapk1基因进行沉默,线虫诱导番茄根结形成的数量显著减少,推测Me-mapk1基因的下调表达有可能影响象耳豆根结线虫二龄幼虫(J2)的生长发育。
关键词 象耳豆根结线虫;促分裂原活化蛋白激酶;基因克隆;原核表达;RNA干扰
中图分类号 R532.1 文献标识码 A
Abstract Mitogen-activated protein kinases(MAPKs)are important components in signal transduction pathway involving in the process of nematode growth and development. In this study, a MAPK gene(Me-mapk1)from the root-knot nematode Meloidogyne enterolobii was cloned. The Me-mapk1 cDNA sequence consisted of a 1 185 bp open reading frame(ORF)encoding 394 amino acid residues that were franked by a 27 bp 5′-untranslated region(UTR)and a 157 bp 3′-UTR. The protein molecular mass was 45.39 ku. Homology analysis showed that the identity was 99% between Me-mapk1 deduced protein ME-MAPK1 and MI-MAPK1 protein of M. incognita. The recombinant protein ME-MAPK1 with a molecular mass of 70 ku which included tag protein sequence of 26 ku was produced by prokaryotic expression. The number of nematode-induced galls on tomato was significantly reduced after knocking-down Me-mapk1 gene by RNA interference, indicating an important role of the gene to nematode development.
Key words Meloidogyne enterolobii; Mitogen activated protein kinase; Gene cloning; Prokaryotic expression; RNAi
doi 10.3969/j.issn.1000-2561.2016.10.022
象耳豆根结线虫(Meloidogyne enterolobii)是中国热带、亚热带地区作物上广泛发生的一种重要的植物病原线虫,也是世界上公认的危害最大的根结线虫种类之一[1-2]。该线虫最早在海南儋州象耳豆树上被发现,随后在欧洲、美洲和非洲等报道发生,造成的产量损失可达65%以上[3-5]。近年来,象耳豆根结线虫在海南岛迅速蔓延扩散,目前已在海南全岛发生危害,受害作物包括瓜果蔬菜、南药、热带果树等多种农作物,并造成重大经济损失[6]。越来越多的调查结果表明,象耳豆根结线虫正逐渐取代南方根结线虫(M. incognita),成为海南热带水果和反季节蔬菜上的优势根结线虫种类[6-7]。
促分裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)是一种真核生物体内普遍存在且高度保守的丝氨酸/苏氨酸蛋白激酶。MAPK与促分裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase, MAPKK)、促分裂原活化蛋白激酶激酶激酶(mitogen-activated protein kinase kinase kinase,MAPKKK)组成MAPK级联信号通路,接受外界信号刺激并将信号转导至细胞内,调控基因表达、细胞增殖与分化、细胞生存与凋亡等多种生命活动[8-9]。MAPK还被证实与多种植物病原物包括真菌、细菌及类病毒的致病性密切相关[10-12]。迄今,有国内外研究人员已从真菌、哺乳动物和植物中分离克隆了多种MAPK基因,如在拟南芥基因组中鉴定出20余种MAPK基因[13-14]。目前植物病原线虫中关于MAPK的研究较少,仅在南方根结线虫、甘蓝根结线虫和松材线虫中克隆了少量地MAPK基因,其具体功能和作用机制均未开展深入研究。本研究从象耳豆根结线虫中克隆并鉴定出一个新的促分裂原活化蛋白激酶基因Me-mapk1。同时,利用RANi技术对Me-mapk1进行诱导沉默,分析MAPK在象耳豆根结线虫生长发育过程中的功能地位,旨在为防治该线虫提供新的理论依据和防治策略。
1 材料与方法
1.1 材料
象耳豆根结线虫Meloidogyne enterolobii由本实验室培养,在室内用改进的贝尔曼漏斗法分离得到。培养和接种象耳豆根结线虫的番茄品种均为“特级大明星”。
1.2 方法
1.2.1 第一链cDNA的合成 采用Trizol法提取M. enterolobii总RNA,其RNA沉淀用30 μL无RNase 水溶解。取5 μL总RNA为模板,以oligo dT为引物,用反转录酶(TaKaRa PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit)进行反转录,合成cDNA第1链。
1.2.2 Me-mapk1 cDNA末端的序列扩增 以M. enterolobii总RNA为模板,利用GeneRacerTM RACE 试剂盒(Invitrogen)反转录合成获得带3′接头和5′接头的cDNA第一链(RACE模板)。同时,根据实验室已有的象耳豆根结线虫cDNA文库序列信息,设计Me-mapk1基因末端扩增特异引物,结合RACE接头引物,采用巢式PCR分别扩增基因的5′及3′末端序列。其中,5′末端序列扩增第1轮所用引物为GeneRacer5′ primer和M-S1(表1),第2轮PCR以第1轮PCR产物为模板,所用引物为GeneRacer5′ nested primer和M-S2(表1);3′末端序列的扩增第1轮PCR所用引物为GeneRacer3′primer和M-A1(表1),第2轮PCR所用引物为GeneRacer3′ nested primer和M-A2(表1)。PCR扩增产物经电泳检测、纯化、连接、转化并送诺赛基因测序。
1.2.3 Me-mapk1原核表达 以第1链cDNA为模板,用引物M1-Bam HI和M1-Not I扩增Me-mapk1基因的开放阅读框区域。PCR 产物经TA克隆,挑取单克隆,摇菌并进行PCR鉴定,将阳性克隆送诺赛公司测序,并进行序列分析。同时,提取阳性克隆和pET-32a质粒,分别经Bam HI和Not I双酶切后,连接,构建表达重组子pET-32a-MAPK。转化到感受态细胞BL21(DE3)中,涂板培养。挑取转化子接种于含氨苄青霉素的培养液中振荡培养至菌液OD值约为0.6时,加入100 mmol/L IPTG使终浓度为0.8 mmol/L,37 ℃振荡培养4 h后离心收集菌体,向收集的菌体中加入50 μL蛋白上样缓冲液,沸水加热5 min,将样品取出冷却至室温,离心后取8 μL上清于12%分离胶和5%浓缩胶中进行SDS-PAGE电泳分析。以pET-32a空载体诱导表达物作为对照。
1.2.4 Me-mapk1 dsRNA合成 设计在5′端引用T7启动子序列的dsRNA特异引物M-I1和M-I2(表1),以第一链cDNA为模板PCR扩增获得Me-mapk1特异靶标序列。将获得的PCR产物纯化后,随后以该片段为模板结合反转录酶合成Me-mapk1特异的dsRNA序列。反应体系:DNA模板1 μg,10× T7 Reaction Buffer 2 μL,ATP Solution 2 μL,CTP Solution 2 μL,GTP Solution 2 μL,UTP Solution 2 μL, T7 Enzyme Mix 2 μL,补充Nuclease-free Water至总体积20 μL。具体反应步骤参照MEGAascript RNAi kit(Life Technologies)说明书进行。获得的dsRNA产物用微量核酸蛋白检测仪(NanoUV-3000)检测浓度和质量。
1.2.5 Me-mapk1 RNAi效应分析 RNAi采用活体外dsRNA浸泡二龄幼虫法进行,略有修改[15]。浸泡体系为:2 mg/mL dsRNA,0.5%间苯二酚,0.05%明胶,3 mmol/L亚精胺,浸泡溶液用1xPBS缓冲液调节。对照处理分2组,一组为不含dsRNA 的1xPBS缓冲液(含0.05%明胶,0.5%间苯二酚,3 mmol/L亚精胺),一组为清水处理。每处理所用新鲜二龄幼虫数量约20 000条,浸泡时间为24 h,温度为22 ℃,浸泡过程中保持轻微振动。浸泡结束后用灭菌水反复冲洗虫体,在清水中恢复2 h后,每处理取约10 000条二龄幼虫提取总RNA。分别取等量浓度RNA(200 ng/μL)反转录合成cDNA,RT-PCR分析沉默效果,所用引物为M-R1和M-R2(表1)。反应体系:cDNA 1 μL,2× pfu PCR MasterMix(TIANGEN)10 μL,上下游引物各1 μL,补充灭菌双蒸水至总体积20 μL。同时选择内参基因β-actin为扩增对照,引物为Actin-F1和Actin-R1(表1),反应体系不变。将dsRNA浸泡处理(含对照)的二龄幼虫接种至生长30 d番茄苗(cv. 特级大明星)根部,每个处理接种300条线虫,重复8次。接种30 d后收集番茄根系,统计根结数。病情级别和病情指数依据《中华人民共和国国家标准农药田间药效实验准则(二)》中所列方法和公式计算,具体如下:
2 结果与分析
2.1 Me-mapk1 cDNA克隆与序列分析
用RACE技术分别克隆获得了象耳豆根结线虫Me-mapk1 cDNA的5′末端和3′末端序列,其长度分别为960、505 bp,拼接后全长序列为1 369 bp。Me-mapk1 cDNA全长序列包含长度为27 bp的5′非编码区、157 bp的3′非编码区(包括24个碱基polyA尾巴)和1个1 185 bp的完整开放阅读框,推导编码1个含394 aa的蛋白序列。Me-mapk1 cDNA在NCBI GenBank上提交注册登录号为KT380882。
象耳豆根结线虫促分裂原活化蛋白激酶ME-MAPK1蛋白序列由394个氨基酸残基组成,预测分子量大小为45.39 ku,等电点pI=6.39。BlastP同源性搜索及多序列比对显示ME-MAPK1与南方根结线虫M. incognita(ABI96897)促分裂原活化蛋白激酶MI-MPK1有99%的一致性,与甘蓝根结线虫M. artiellia(CAD56894)、松材线虫Bursaphelenchus xylophilus(ACT46908)及马来丝线虫Brugia malayi(XP_001900759)等其它线虫促分裂原活化蛋白激酶具有86%~93%的一致性(图1)。蛋白保守结构域分析结果表明,ME-MAPK1第43~331位氨基酸包含11个保守的丝氨酸/苏氨酸蛋白激酶亚结构域,并且在第VII和第VIII亚结构域间具有胞外信号调节激酶保守的TEY基序序列(图1)。
2.2 ME-MAPK1重组蛋白诱导表达
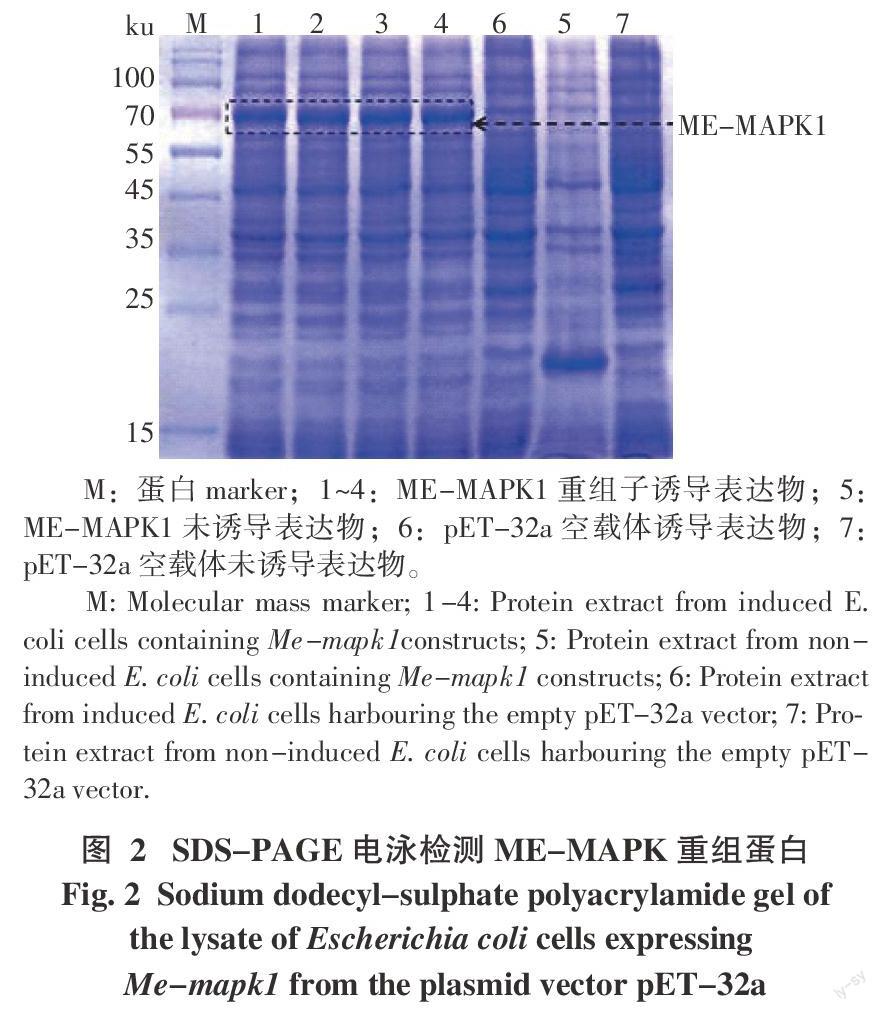
将构建好的重组表达载体质粒pET-32a-MAPK转入大肠杆菌表达菌株BL21(DE3)进行原核表达。SDS-PAGE电泳检测结果表明,在IPTG的诱导下ME-MAPK1融合蛋白成功诱导表达,获得大小约为70 ku的特异条带,与预测大小相符(包括大小约26 ku的标签序列);而未经IPTG诱导的重组子及空载体对照无ME-MAPK1融合蛋白条带(图2)。
2.3 dsRNA对Me-mapk1基因的沉默效果
通过引入T7启动子序列的Me-mapk1基因特异引物M-I1/M-I2扩增获得Me-mapk1靶标片段,随后在反转录酶的作用下合成了长度为332 bp的dsRNA(图3)。分别提取Me-mapk1 dsRNA、不含dsRNA的缓冲液和清水浸泡处理24 h的二龄幼虫总RNA,反转录RT-PCR扩增Me-mapk1和对照基因β-actin。电泳检测结果显示,经Me-mapk1 dsRNA浸泡处理后的二龄幼虫Me-mapk1转录丰度明显低于无dsRNA 和清水浸泡处理后的Me-mapk1转录水平(图4-A),而非靶标基因β-actin经以上3个处理后其转录丰度未发生相对变化(图4-B)。
2.4 Me-mapk1 RNAi效应表型分析
由表2可知,象耳豆根结线虫二龄幼虫经Me-mapk1 dsRNA浸泡处理后导致番茄根结形成数相比对照明显减少,30 d 后其平均根结形成数为21.5±8.9(平均±SD)。不含dsRNA的PBS缓冲液和清水对照处理形成平均根结数分别为61.8±13.5(平均±SD)和63.1±10.6(平均±SD),对照之间差异不显著(表2)。同时,二龄幼虫经Me-mapk1 dsRNA浸泡处理接种后的番茄病情指数为16.7,而不含dsRNA的PBS缓冲液和清水对照处理的番茄病情指数分别为44.4和47.2(表2)。
3 讨论与结论
本研究从象耳豆根结线虫中成功克隆了1个促分裂原活化蛋白激酶基因Me-mapk1,其编码蛋白ME-MAPK与其它线虫的MAPK具有80%以上的一致性,属于典型的丝氨酸/苏氨酸激酶家族成员。结果表明,各生物体MAPK高度相似,都包含有11个保守的丝氨酸/苏氨酸亚结构域,并且在第VII和第VIII亚结构域之间的T-loop环上有1个由苏氨酸(T)、酪氨酸(Y)和X氨基酸组成的TXY基序,是决定MAPK活性的关键位点[16-17]。在植物TXY中的X常为E(谷氨酸)或D(天冬氨酸),而动物和酵母中是E、P(脯氨酸)或G(甘氨酸)。多序列分析比对结果显示象耳豆根结线虫ME-MAPK与其它线虫MAPK的TXY基序均为TEY(图1),表明线虫MAPK对底物特异性的选择上可能具有相似性,而本研究通过原核表达获得的ME-MAPK1融合蛋白也为进一步研究MAPK的生化特性奠定了基础。
Kamath等[18]利用RNA干扰技术对模式秀丽小杆线虫mapk基因诱导沉默后,秀丽小杆线虫出现不育和胚致死等表型,表明MAPK在线虫的生长发育过程中具有重要作用。而陈国华等[19]用体外合成的南方根结线虫mapk-1 dsRNA浸泡卵块,会导致孵化的J2成活率显著降低,同样表明MAPK对于植物寄生线虫的重要性。本研究中,通过体外合成与象耳豆根结线虫Me-mapk1同源的dsRNA片段并刺激J2吞咽取食,成功诱导了Me-mapk1基因的下调表达,表现为Me-mapk1 mRNA的转录丰度降低(图4)。而经Me-mapk1 dsRNA处理的J2接种后诱导番茄根结形成的数量显著减少,病情指数下降。由此推测,Me-mapk1基因的下调表达对象耳豆根结线虫在根内的寄生发育造成了影响。该研究结果表明Me-mapk1可作为抑制象耳豆根结线虫危害的一个候选靶标基因,具有潜在的应用价值。需要注意的是,利用活体外RNA干扰技术对于基因的沉默具有时效性,不能完全抑制靶标基因的表达,在后期靶标基因的表达水平有可能会恢复到正常水平,从而一定程度上影响表型的分析。因此,需进一步构建能在体内稳定持久表达dsRNA的转基因植株实现对根结线虫靶标基因的持续沉默,深入研究MAPK的作用机制和功能地位,为最终提出新的防治象耳豆根结线虫病害策略奠定理论基础。
参考文献
[1] 符美英, 芮 凯, 肖彤斌,等. 海南岛象耳豆根结线虫的种类鉴定及其rDNA-ITS序列分析[J]. 生物安全学报, 2012, 21(1): 79-84.
[2] Castagnone-Sereno P. Meloidogyne enterolobii(M. mayaguensis): profile of an emerging,highly pathogenic, root-knot nematode species[J]. Nematology, 2012, 14(1): 133-138.
[3] Yang B, Eisenback J. Meloidogyne enterolobii n. sp. (Meloidogynidae), a root-knot nematode parasitizing pacara earpod tree in China[J]. Journal of Nematology, 1983, 15(2): 381-391.
[4] Kiewnick S, Dessimoz M, Franck L. Effects of the Mi-1 and the N root-knot nematode-resistance gene on infection and reproduction of Meloidogyne enterolobii on tomato and pepper cultivars[J]. Journal of Nematology, 2009, 41(1): 134-139.
[5] Onkendi E M, Moleleki L N. Distribution and genetic diversity of root-knot nematodes(Meloidogyne spp.)in potatoes from South Africa[J]. Plant Pathology, 2013, 62(6): 1 184-1 192.
[6] 龙海波, 孙燕芳, 白 成,等. 海南省象耳豆根结线虫的鉴定研究[J]. 热带作物学报, 2015, 36(2): 371-376.
[7] 贾本凯, 王会芳, 陈绵才. 海南岛茄果类蔬菜根结线虫种类鉴定[J]. 广东农业科学, 2012, 7(1): 104-106.
[8] Widmann C, Gibson S, Jarpe M B, et al. Mitogen-activated protein kinase:conservation of a three-kinase module from yeast to human[J]. Physiology Review, 1999, 79(1): 143-180.
[9] Rohila J S, YangY N. Rice mitogen-activated protein kinase gene family and its role in biotic and abiotic stress response[J]. Journal of Integrative Plant Biology, 2007, 49(4): 751- 759.
[10] 范永山, 刘颖超, 谷守芹, 等. 植物病原真菌的MAPK基因及其功能[J]. 微生物学报, 2004, 44(3): 547-551.
[11] Hamel L P, Nicole M C, Duplessis S, et al. Mitogen-activated protein kinase signaling in plant-interacting fungi:distinct messages from conserved messengers[J]. Plant Cell,2012, 24(7): 1 327-1 351.
[12] 彭静静. 植物病原真菌中MAPK级联通路研究进展[J]. 江苏农业科学, 2014, 42(1): 11-15.
[13] Ichimura K, Mizoguchi T, Irie K, et al. Isolation of ATMEKK1(a MAP kinase kinase kinase): interacting proteins and analysis of a MAP kinase cascade in Arabidopsis[J]. Biochemical and Biophysical Research Communications, 1998, 253(3): 532-543.
[14] Ren D T, Liu Y D, Yang K Y, et al. A fungal-responsive MAPK cascade regulates phytoalexin biosynthesis in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(12): 5 638-5 643.
[15] Chen Q, Rehman S, Smant G, et al. Functional analysis of pathogenicity proteins of the potato cyst nematode Globodera rostochiensis using RNAi[J]. Molecular Plant-Microbe Interactions, 2005, 18(3): 621-625.
[16] Bardwell A J, Abdollahi M, Bardwell L. Docking sites on mitogen-activated protein kinase(MAPK) kinases, MAPK Phosphatases and the Elk-1 transcription factor compete for MAPK binding and are crucial for enzymic activity[J]. Biochemical Journal, 2003, 370(5): 1 077-1 085.
[17] Colcombet J, Hirt H. Arabidopsis MAPKs: A complex signaling network involved in multiple biological processes[J]. Biochemical Journal, 2008, 413(1): 217-226.
[18] Kamath R S, Fraser A G, Ahringer J, et al. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi[J]. Nature, 2003, 421(1): 231-237.
[19] 陈国华, 肖 罗, 张双庆,等. 南根结线虫促分裂原活化蛋白激酶(MAPK)基因的RNAi效应分析[J]. 植物病理学报, 2008, 38(3): 509-531.

