SSR和AFLP分子标记鉴定巴西橡胶树种质资源的比较研究
钟淦彬 李维国 位明明 郑学项 易晓洁
摘 要 选用178份巴西橡胶树种质材料,采用SSR和AFLP分子标记技术对巴西橡胶树种质资源进行鉴定,探讨2种方法的应用效果并加以比较分析。结果显示:利用多态性强的19对SSR引物,检测到92个等位基因;用25对AFLP引物组,检测到702条有多态性的带。SSR位点的平均多态性信息量(PIC)值为0.46,而AFLP多态性带比例是54.88%,AFLP比SSR分子标记具有更高的多态性。结果说明,AFLP标记比SSR标记更适合于巴西橡胶树种质材料的鉴定和保护,同时进一步验证了在作物遗传资源的研究中,采用多种分子标记方法可以获得更加准确的研究数据。
关键词 巴西橡胶树;SSR;AFLP;分析比较
中图分类号 S794.1 文献标识码 A
Abstract The 178 rubber tree germplasm resources were identified using SSR and AFLP markers and to explore the application effects of two methods by comparing the result of two markers. The results showed that 19 pairs of SSR primers, total 92 polymorphic fragments were detected; 25 AFLP primer combinations(Ecor I/Mse I)were used, and total 701 polymorphic bands were produced. AFLP was higher polymorphic than SSR. The average of polymorphic information content(PIC)was 0.46 for SSRs. Percentage of polymorphic AFLP bands was 54.88%. According to the comparative result acquired in this study, AFLP is more suitable for rubber tree germplasm materials identification and protection than SSR. Meanwhile further validated that in crop genetic resources research, use more kinds of molecular marker method can obtain more accurate data.
Key words Hevea brasiliensis; SSR; AFLP; Comparative analysis
doi 10.3969/j.issn.1000-2561.2016.10.002
20世纪90年代以来,基于PCR技术的分子标记逐步发展起来,如SSR、AFLP等,被广泛应用于动植物种质资源研究。SSR(Simple Sequence Repeats)简单重复序列,最常见是双核苷酸重复,由于串联数目的不同产生其高度的多态性,也称微卫星DNA。SSR检测所需DNA量少,试验操作简便,稳定性好[1]。AFLP(Amplified Fragment Length Polymorphism)扩增片段长度多态性,1992年荷兰Keygene公司科学家Zabeau Mare和Vos Pieter发明并发展起来的一种分子标记方法,是基于PCR技术扩增基因组DNA限制性片段。其重复性强,可靠性好,可信度高,虽然实验成本较高,但也越来越广泛地应用在遗传育种研究领域。进入21世纪以来,分子标记也逐步被应用在橡胶树种资资源的研究中,Saha等[2]用(hmct5、hmct1、hmac4、hmac5)4个SSR标记鉴定了27份橡胶树种质;谢黎黎等[3]用SSR标记构建了87份橡胶树材料的DNA指纹图谱;2007年,王惠君[4]构建了橡胶树初级分子遗传图谱;2010年,龙青姨[5]利用EST~SSR标记研究橡胶树栽培种质的遗传多样性与遗传分化,钟淦彬[6]利用AFLP分子标记方法构建了部分橡胶树种质资源的AFLP指纹图谱。
本试验选用178份巴西橡胶树种质材料,分别采用SSR标记与AFLP标记技术对这些种质材料进行鉴定,探讨2种标记技术的应用效果并加以比较分析。其试验结果可以初探分子标记技术在研究巴西橡胶树种质资源上的作用,理论与实际应用的验证,为进一步使用标记技术研究橡胶树种质材料提供参考。
1 材料与方法
1.1 材料
在海南省儋州市中国热带农业科学院国家橡胶树种质圃中,采摘24号组合[6]淡绿期橡胶树幼叶, 放入冰壶,带回实验室后用清水冲洗吸干,置于超低温冰箱(-70 ℃)保存备用。
1.2 方法
1.2.1 基因组DNA的提取 采取改良CTAB法进行橡胶树叶片基因组DNA的提取。具体步骤参照相关文献进行[7]。
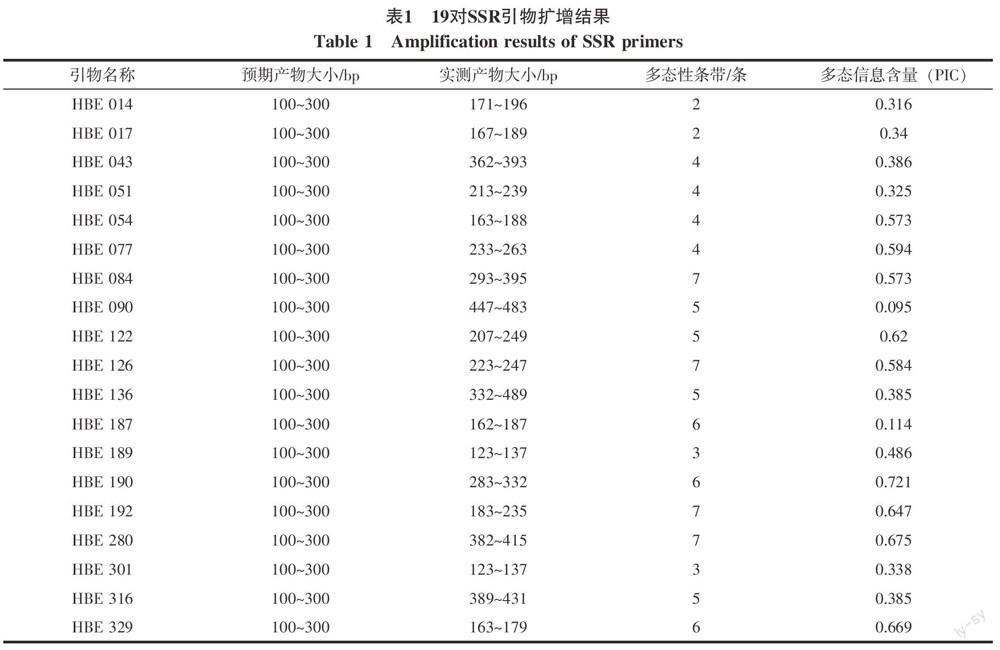
1.2.2 SSR引物选择与分析 SSR标记所用的19对引物全部来源于Feng等[8-9],所用引物由上海生工生物工程技术服务有限公司合成。
SSR分析参照郑学项等[10]的方法。PCR反应采用20 μL体系,具体含量:2×Taq Master Mix 3.86 μL;正向引物、反向引物各0.25 μL;DNA模板2.5 μL;去离子水13.14 μL。PCR扩增反应程序:94 ℃预变性2 min;94 ℃变性30 s,52~57 ℃退火45 s,72 ℃延伸1 min,循环30次;72 ℃延伸5 min;4 ℃保存20 min。获得橡胶树叶片DNA扩增产物。
采用8%非变性聚丙烯酞胺凝胶电泳,电泳缓冲液为1×TBE,100 V恒压电泳1.5~2 h。电泳结束后,采用快速银染法染色,按照张军等[11]的方法。
1.2.3 AFLP引物选择与分析 AFLP标记所用的25对引物全部来源于钟淦彬等[6,12],所用引物由上海生工生物工程技术服务有限公司合成。
AFLP分析参照Vos等[13]、王惠君等[14-15]报道的方法进行。提取总DNA,再进行酶切、连接、预扩增、以及选择性扩增。最后,使用银染法对橡胶树DNA扩增产物进行检测与分析,具体参照陆光远等[16]的方法。
1.3 数据整理与分析
把橡胶树种质的电泳谱带转换成Excel表格数字模式。电泳谱带中,在相同的迁移位置上有带的计为1,无带的计为0,完成1与0的Excel表格,使用软件编辑器转换形成统计软件可以识别的数据模块,SSR标记中形成19对引物的数据矩阵,AFLP标记中形成25对引物的数据矩阵,接着采用Ntsys~pc2.lla(NTsys:Nurnerieal Taxonomy and Multivariate Analysis System)软件[17]进行数据处理,获得UPGMA聚类树状图,分别为SSR标记UPGMA聚类树状图和AFLP标记UPGMA聚类树状图,然后通过这2个聚类树状图进行橡胶树种质材料的聚类分析与亲缘关系分析。最后采用Smith等[18]的方法计算标记位点的多态性信息量PIC值(Polymorphism information content),即:PIC=1~∑fi2,其中fi2为i位点的基因频率。
2 结果与分析
2.1 引物多态性分析
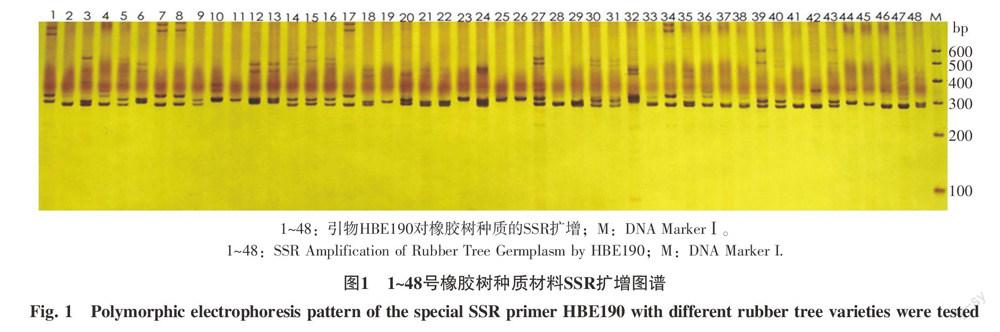
2.1.1 SSR分析 引物HBE190对部分橡胶树种质的SSR指纹图谱见图1,所用的19对SSR引物扩增结果见表1。
对所有的橡胶树种质材料,应用多态性强的19对引物组合[8~9]进行多态性扩增,获得了供试材料的SSR指纹图谱。分析图谱获得如下结果:引物组合多态信息含量在0.095~0.669之间,多态性最好的引物是HBE 329,最差的是HBE 090;引物的多态性条带数在2~7之间,平均达4条,引物HBE 084、HBE 126、HBE 192、HBE 280多态性条带数都有7条。预期产物大小在100~300 bp,实测产物大部分在100~300 bp,只有引物HBE 043、HBE 090、HBE 136、HBE 280、HBE 316产物大小在300 bp以上,总体说明引物设计较为合理,具有一定的代表性。
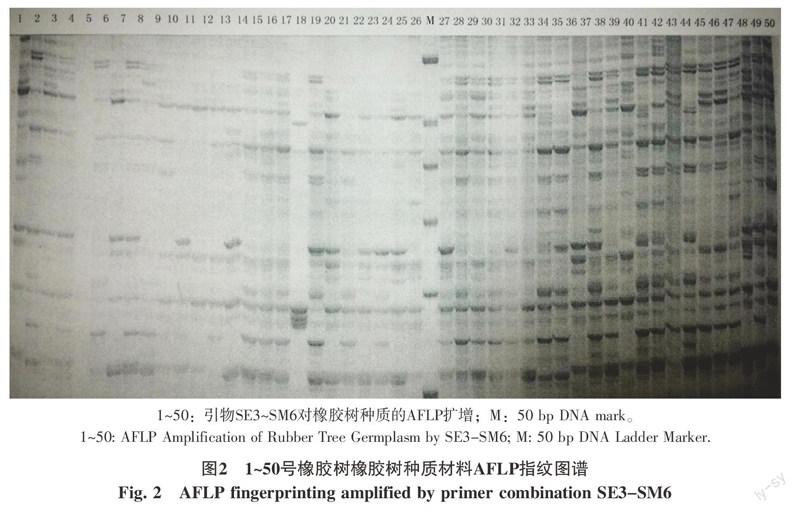
2.1.2 AFLP分析 引物SE3-SM6对部分橡胶树种质的AFLP指纹图谱见图2,25对引物组合扩增的多态性结果见表2。
对所有的橡胶树种质材料,应用多态性强的25对引物组合[6,12]进行多态性扩增,获得了供试材料的AFLP指纹图谱。分析图谱可知:引物组合多态性在39.22%~81.63%之间,多态性最好的引物组合是SE7 SM10,最差的是SE9 SM16;引物组合扩增的谱带数在35~68之间,平均达52条,SE16 SM14 扩增谱带数最多,达68条谱带;SE13 SM11扩增谱带数最少,只有35条。所有引物组合共扩增出701条多态性带,占总扩增带(1 274条带)的55.02%。
2.2 SSR与AFLP标记对供试品种鉴定信息获取量比较
利用多态性强的SSR和AFLP引物,分别对所有供试巴西橡胶树种质材料进行扩增,扩增结果详见表3。
从SSR引物扩增结果可知:引物HBE 084、HBE 126、HBE 192、HBE 280具有最高多态性标记数,为7个,引物HBE 014、HBE 017扩增出的多态性标记最少,只有2个;4对引物表现出特异性标记,可以鉴别其中4份材料;19对SSR引物共扩增出92个多态性标记。
从AFLP引物扩增图谱可以看出:SE7 SM10引物组合多态性最好,扩增出40个多态性标记位点;引物组合SE3 SM9和SE13 SM11扩增的多态性标记最少,只有19个;25对引物组合都表现出特异性标记,可以鉴别其中12份材料;25对AFLP引物组合总计扩增出701个多态性标记。
对比2种标记方法的扩增结果可知,AFLP多态性标记的数量远远多于SSR, AFLP获得的总标记数也远远多于SSR标记;就单引物而言,AFLP揭示的特异性位点明显多于SSR标记。初步表明AFLP标记比SSR标记更适合于巴西橡胶树种质材料间的鉴别、指纹图谱分析等微观系统研究。
2.3 SSR与AFLP标记对供试种质材料鉴别效率的比较
根据SSR标记对所有供试橡胶树材料的遗传相似系数进行UPGMA聚类分析,得到聚类树状图详见图3。
根据AFLP标记对所有供试橡胶树材料的EXCEL表格数据,转换为单匹配数据矩阵,AFLP聚类分析,获得亲缘关系树状图,见图4(UPGMA法)。
2.3.1 AFLP引物组合鉴别橡胶种质材料效率分析
25对AFLP引物分别利用NTsys一pc2.lla 软件进行单独聚类分析,获得25个AFLP聚类树状图。通过分析所有树状图可知:各引物组合鉴别的效率不同,引物组合SE7 SM10鉴别效率最强,可以鉴别其中172份材料,鉴别率达96.62%;其次为引物组合SE4 SM10,可以鉴别165份材料,鉴别率达87.77%;引物组合SE3 SM6鉴别效率最差,鉴别出87份材料,鉴别率只有46.28%。各引物组合的鉴别效率详见表4。
从表3和表4分析可知,SSR与AFLP标记方法的鉴别效率不同。利用SSR标记方法,平均每对引物可以鉴别9.3份材料,单引物最高可以鉴别78份材料,但所有供试材料中有2份材料无法鉴别;利用AFLP标记方法,平均每个引物组合可以鉴别7.1份材料,单引物最高可以鉴别172份材料,且可以鉴别所有供试巴西橡胶树种质材料。再结合AFLP引物组合鉴别效率分析可知,AFLP标记比SSR标记更适于巴西橡胶树种质资源的鉴定。
3 讨论
生物技术日益发达的今天,分子标记技术也在不断地发展与丰富。每种分子标记方法,其技术原理、检测手段都不相同,因此每种标记揭示的微观上遗传与变异也不相同,稳定性与重现性也各不相同,各种标记所揭示的遗传信息量和产出效率也有很大差别。通过本试验对比分析可以看出,在检测巴西橡胶树DNA多态性方面,AFLP比SSR多态性比率更大,更适合其种质资源的鉴定与保护。
SSR分子标记是基于PCR技术的新一代分子标记技术,其克服了RAPD和RFLP标记的不足。SSR多态性产生的机制不是单碱基突变或插入缺失造成的,而是因为DNA复制和修复过程中碱基的错配、滑动和减数分裂过程中姊妹染色单体的不均等交换[19],因而表现出高度的多态性。Pejic等[20]分析比较研究玉米自交系间的遗传差异,得到SSR的多态性信息量是RAPD和RFLP的2倍。AFLP技术,扩增片段长度多态性[21],是基于PCR技术扩增基因组DNA限制性片段,其可通过改变限制性内切酶种类和选择性碱基种类或数目来调节扩增的条带数,因此具有较强的多态分辨能力,是一项新的分子标记技术。AFLP技术检测效率高,每个AFLP 反应能检出多态片段很多,信息量很大,并不是因为每个位点具有丰富的等位基因形式[22],是因为其在一次单个反应中可以检测到大量的片段。本研究SSR标记对所有供试材料进行聚类分析,但所有供试材料中有2份材料无法鉴别,可能是由于橡胶树是异花授粉作物,长期存在自然杂交的现象,不仅在品种间存在着遗传变异,在同一种群内也存在遗传变异,SSR标记多态性还无法完全鉴别所有的供试材料;而AFLP标记可以鉴别所有的供试材料,可见AFLP标记在橡胶树种质资源的研究中表现出更高的多态性。本研究SSR标记和AFLP标记,比较2种标记方法获得的结果可知,其多态性结果与其他作物中表现的情况不尽相同,可能是研究的物种不同,表现出的结果也不尽相同,有待试验进一步验证。因此,从本研究比较结果可以看出,AFLP分子标记技术比SSR更适合于巴西橡胶树种质材料的鉴定和保护。
参考文献
[1] Zhivotovsky L A, Rosenberg N A, Feldman M W. Features of evolution and expansion of modern humans, binferred from genomewide microsatellite markers[J]. Am J Hum Genet, 2003(72): 1171.
[2] Saha T, Roy B C, Nazeer M A. Microsatellite variability and its use in the characterization of cultivated clones of Hevea brasiliensis[J]. Plant Breeding, 2005, 124: 86-92.
[3] 谢黎黎, 黄华孙, 安泽伟, 等. 基于SSR 标记的橡胶树无性系鉴定方法的建立[J]. 热带作物学报, 2009, 30(9): 1 314-1 319.
[4] 王惠君. 橡胶树初级分子遗传图谱的构建[D]. 儋州: 华南热带农业大学, 2007.
[5] 龙青姨. 利用EST~SSR标记研究橡胶树栽培种质的遗传多样性与遗传分化[D]. 海口: 海南大学, 2010.
[6] 钟淦彬. 橡胶树种质材料AFLP指纹图谱的构建[D]. 海口: 海南大学, 2010.
[7] 钟淦彬, 李维国.一种快速高效适于橡胶树叶片AFLP分析的DNA提取方法[J]. 热带农业科学, 2010, 30(5): 1-5.
[8] Feng S P, Li W G, Wang J Y, et al. The elementary application of SSR loci variation for Hevea brasiliensis taxonomic relationgship[J]. Journal of Biotechnology, 2008, 136: s625.
[9] 李维国, 冯素萍, 郑学项, 等. 用EST~SSR标记分析巴西橡胶树的遗传多样性[J]. 热带作物学报.2009, 30(12): 1 711-1 717.
[10] 郑学项, 冯素萍, 李维国. 巴西橡胶树SSR反应体系的优化[J]. 中国农学通报, 2009(1): 47-50.
[11] 张 军, 武耀廷, 郭旺珍, 等.棉花微卫星标记的PAGE/银染快速检测[J]. 棉花学报, 2000, 12(5): 267-269.
[12] 钟淦彬, 李维国, 吴春太, 等. 188份188份巴西橡胶树种质材料AFLP指纹图谱分析[J]. 热带作物学报, 2013, 34(1): 1-9.
[13] Vos P, Hogers R, Bleeker M, et al. A FL P: a new technique for DNA fingerprinting[J]. N uclA cid Res, 1995, 23(21): 4 407-4 414.
[14] 王惠君. 橡胶树AFLP银染体系建立前期的准备[J]. 北京农业,2012(6): 175.
[15] 王惠君, 和丽岗, 夏志强, 等. 橡胶树AFLP银染体系的建立和优化[J]. 生物技术通讯, 2007, 4(18): 631-634.
[16] 陆光远, 杨光圣, 傅廷栋. 一种有效检测油菜种SSR标记的技术体系[J]. 中国油料作物学报, 2003, 25: 79-81.
[17] Rohlf F J, Ntsys P C. Numerical Taxonomy and Multivariate.Analysis System l.80[D]. Exeter Software, NewYork, 1994.
[18] Smith J S C, Chin E C, Shu H, et al. An evaluation of the utility of SSR loci as molecular markers in maize(Zea mays L): Comparisons with data from RFLPs and pedigree[J]. Theor Appl Genet, 1997, 95: 163-173.
[19] Powell W, Mogantc M, Andm C, et al. The comparison of RFLP, RAPD, AFLP and SSR(microsatellite)markers for germplasm analysis[J]. Molecular Breeding, 1996, 2: 225-238.
[20] Pejic I, Ajmone~Marsan P, Morgante M, et al. Comparative analysis of genetic similarity among maize inbred lines detected by RFLPs, RAPDs, SSRs, and AFLPs[J]. Theor Appl Genet, 1998, 97: 1 248-1 255.
[21] 周延清编著. DNA分子标记技术在植物研究中的应用[M]. 北京: 化学工业出版社, 2005.
[22] 袁力行, 傅骏骅, Warburton M, 等.利用RFLP、 SSR、 AFLP和RAPD标记分析玉米自交系遗传多样性的比较研究[J]. 遗传学报, 2000, 27(8): 725-733.

