番木瓜酪氨酸氨基转移酶基因CpTAT的分离与分析
申艳红 陈永萍 杨菲颖 鲁娜

摘 要 番木瓜酪氨酸氨基转移酶(Tyrosine aminotransferase,TAT)是维生素E合成途径中的一个关键酶。在已有番木瓜果实成熟差异基因片段序列的基础上,采用RACE技术克隆了TAT基因的全长cDNA序列,命名为CpTAT。该基因全长包含5′非编码区98 bp,3′非编码区232 bp,开放性阅读框1 266 bp,编码421个氨基酸。序列分析表明,该基因为谷草转氨酶超家族成员,催化活性位点为第253位的赖氨酸,编码蛋白与毛果杨、野草莓、桃、拟南芥和水稻的TAT蛋白同源性分别为83.69%、81.09%、80.76%、78.87%、54.67%。荧光定量分析表明,CpTAT基因在根中的表达量最高,在茎和果实中的表达较低,在叶中的表达量最低。与对照相比,外源乙烯处理能诱导番木瓜果实中CpTAT基因表达量升高,而1-MCP处理则抑制了该基因表达,在果实衰老期表达量升高,该基因可能在番木瓜果实成熟衰老中起作用。
关键词 番木瓜;酪氨酸氨基转移酶;基因克隆;RACE;维生素E
中图分类号 S668.2 文献标识码 A
Abstract Tyrosine aminotransferase(TAT)is one of the most important key enzymes in the vitamin E biosynthesis pathway. The full-length cDNA of TAT was isolated from papaya fruit using RACE-PCR and designated as CpTAT. The primers were designed according to a fruit ripening polymorphic fragment which was obtained from cDNA-AFLP analysis. The CpTAT cDNA sequence contains 5′-UTR of 98 bp, 3′-UTRA of 232 bp, and ORF of 1 266 bp. Sequencing analysis showed that the gene was a member of the aspartate aminotransferase superfamily, which encoding 421 amino acids and having an active site of Lys253. The amino acid sequence was 83.69%, 81.09%, 80.76%, 78.87%, and 54.67% identity with TAT from Populus trichocarpa, strawberry, peach, Arabidopsis, and rice. Real-time PCR analysis revealed that the order of relative expression level of the CpTAT gene in different papaya organs was root, stem, fruit, and leave. In addition, the CpTAT expression was induced by ethylene, inhibited by 1-MCP, and increased in aging period, indicating that CpTAT may be involved in the fruit senescence in papaya.
Key words Carica papaya; Tyrosine aminotransferase; Gene clone; RACE; Vitamin E
doi 10.3969/j.issn.1000-2561.2016.06.015
番木瓜(Carica papaya L.)是熱带、亚热带地区常见果树。番木瓜营养成分多样,除了含有比鲜橙更丰富的维生素C外,还含有丰富的维生素E[1-2]。维生素E是具有抗氧化活性的生育酚和生育三烯酚的总称,其中α-生育酚的活性最高[3]。由于酚基的存在,维生素E极易被过氧化物氧化,是一种较强的脂溶性抗氧化剂。医学证明,维生素E与生殖系统、中枢神经系统、心血管系统和肌肉系统的正常代谢密切相关,是治疗冠心病、动脉粥样硬化、贫血、肝病和癌症等的辅助药物[4]。同时,维生素E还可改善动物肉质,提高动物免疫力[5]。在植物中,维生素E参与清除光合器官中的自由基,保护脂类双层膜免受脂肪氧化酶的攻击,保护光合器官和维持生物膜的完整性[6-7]。酪氨酸氨基转移酶(Tyrosine aminotransferase, TAT)是维生素E合成途径中的一个关键酶,提高该酶的表达可相应地提高维生素E含量[8]。酪氨酸在TAT的催化下形成4-羟苯丙酮酸(4-HPP),4-HPP在4-羟苯丙酮酸双加氧酶(HPPD)催化下生成尿黑酸,生成了维生素E的亲水性头部[9]。2012年,Riewe等人发现,在拟南芥中敲除TAT基因大大降低了维生素E含量,进而证明了TAT在拟南芥维生素E合成中的关键作用[10]。
目前,已经从许多植物中分离克隆了TAT基因,如大豆[11]、拟南芥[12]、黄芩[13]、丹参[14]、紫苏[15-16]等,而关于番木瓜酪氨酸氨基转移酶基因克隆及其功能的研究目前还没有报道。本研究采用RACE技术克隆了番木瓜TAT基因全长序列,对其进行生物信息学分析和转录差异表达分析,旨为进一步研究该基因功能,并利用其进行基因工程提高维生素E含量改良果实品质奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 番木瓜供试品种‘大白8号采自福建闽侯木瓜园。将大小均匀、成熟期一致的绿熟期番木瓜果实进行以下处理:(1)乙烯利处理,将果实浸泡在0.5 g/L乙烯利水溶液中3 min,自然晾干,装箱密封2 h;(2)1-甲基环丙烯(1-MCP)处理,将果实置于1 μL/L 1-MCP气体中18 h;(3)对照,将果实在清水中浸泡3 min,自然晾干,装箱密封2 h。将处理后的果实分别放在25 ℃房间储藏,于处理后6、12、24 h以及3、6 d取样。将果肉切成小块立即投入液氮中,-80 ℃保存备用。采集番木瓜幼嫩的根、茎和完全伸展的叶片,投入液氮速冻后-80 ℃保存备用。
1.1.2 试剂与菌株 ExTaq、pMD18-T、T4 DNA 连接酶载体购自TaKaRa 公司;Super SMARTTM PCR cDNA Synthesis Kit购自BD Biosciences Clontech公司;柱式DNA胶回收试剂盒购自北京天恩泽基因科技有限公司; SYBR ExScriptTM RT-PCR购自TaKaRa公司;引物由上海博尚生物技术有限公司合成。E.coli DH5α菌株由本实验室培养并保存。1-MCP安喜布购自台湾利统股份有限公司,其余为国产分析纯试剂。
1.2 方法
1.2.1 番木瓜CpTAT基因的克隆 采用改良热硼酸小量法提取番木瓜果肉总RNA[17],参照Super SMARTTM PCR cDNA Synthesis Kit说明书,以总RNA为模板合成双链cDNA。根据本实验室已获得的番木瓜果实成熟差异基因片段序列(图1)设计RACE特异引物[18]。用3′RACE特异引物TAT3-1、TAT3-2與3′端接头引物TY-DOWN组成半巢式扩增引物对,扩增基因的3′端。用5′RACE特异引物TAT5-1、TAT5-2与5′端接头引物TY-UP扩增基因的5′端。采用25 μL PCR反应体系:ddH2O 18.3 μL,10×Buffer 2.5 μL,dNTPs 2.0 μL,特异引物与接头引物各0.5 μL,模板1.0 μL,ExTaq酶0.2 μL。PCR扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min 30 s,35个循环;最后72 ℃延伸7 min。经两轮扩增后的PCR产物用1%琼脂糖凝胶电泳检测,并将目的条带割胶、回收,连接pMD18-T载体,转化大肠杆菌E.coli DH5α感受态细胞,挑取阳性克隆送到上海博尚生物技术有限公司测序。将测序获得的3′端和5′端序列拼接,翻译的氨基酸序列与NCBI数据库中的同源序列进行比较,确定基因的编码区,设计开放性阅读框(Open Reading Frame, ORF)的上、下游引物TAT-U和TAT-D。然后以cDNA为模板,扩增该基因的ORF序列,并测序验证。
1.2.2 生物信息学分析 用DNAMAN软件进行引物设计、基因片段的拼接和蛋白质翻译;用Protparam预测编码蛋白的分子式、氨基酸组成、相对分子质量和等电点等理化性质(http://web.expasy.org/protparam/);用SignalP 3.0 Server进行信号肽预测(http://www.cbs.dtu.dk/services/SignalP/);用NCBI网站的CDD(http://www.ncbi.nlm.nih.gov/ Structure/cdd/docs/cdd_search.html)进行氨基酸序列结构域分析;用MEGA 4.0构建分子进化树。
1.2.3 番木瓜CpTAT基因在不同器官以及不同处理果实中的表达分析 提取番木瓜的根、茎、叶、果肉的RNA,分别取1 μg逆转录为cDNA。在CpTAT基因3′端非保守区设计引物qTAT-U和qTAT-D,以番木瓜Actin基因为内参[19],用Bio-RAD进行荧光定量PCR扩增。反应体系为20 μL:SYBR Premix ExTaqTM 10.0 μL,上、下游引物各0.5 μL,cDNA 1.0 μL,双蒸水8.0 μL。扩增程序为:95 ℃预变性3 min;95 ℃变性15 s,55 ℃退火30 s,39个循环。每个样品3次重复,采用2-ΔΔCT法分析数据。以根为对照,分析CpTAT基因在不同组织器官中的相对表达;以清水处理后6 h的果肉为对照,分析该基因在不同处理果实中的相对表达。用SPSS进行邓肯氏多重比较,Excel软件作图。
2 结果与分析
2.1 番木瓜CpTAT基因cDNA全长的获得
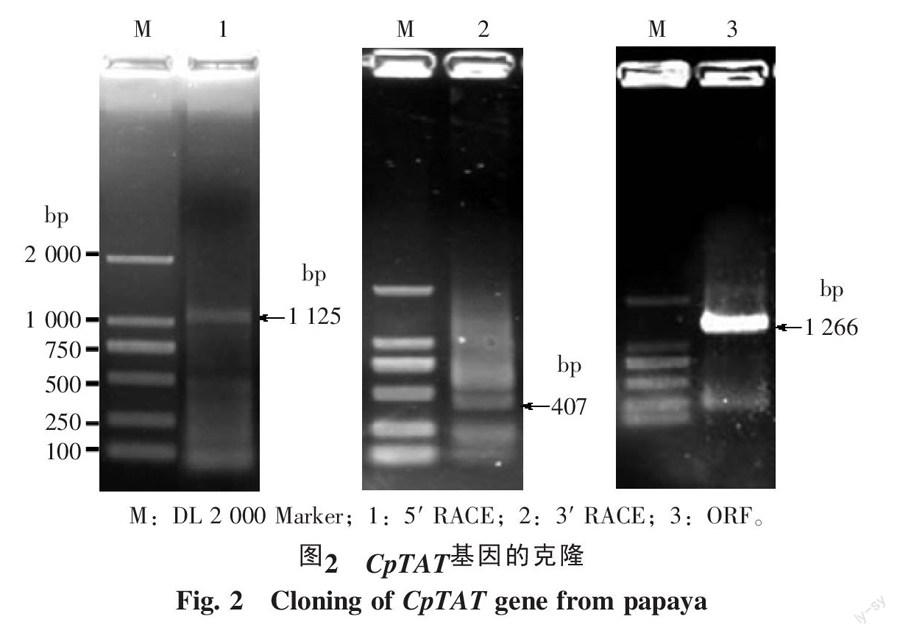
5′RACE第二轮PCR扩增出一条特异条带,见图2中的1泳道,将目的条带割胶回收、转化、测序,获得长度为1 125 bp的片段,与已知差异片段有一个长105 bp的重叠区,可知为TAT基因的5′端。3′ RACE第二轮PCR扩增出一条约为400 bp的条带,见图2中的2泳道,测序后获得长407 bp的序列,与差异片段序列重叠125 bp,是TAT基因的3′端。将3′RACE和5′RACE所测得的序列与已知差异片段序列拼接,获得长1 596 bp的cDNA序列,包含5′非编码区98 bp,3′非编码区232 bp,开放性阅读框1 266 bp。然后根据该序列设计ORF的上、下游引物,以cDNA为模板扩增,最终获得TAT基因ORF序列,见图2中的3泳道。将此序列与该基因的3′-UTR和5′-UTR拼接,获得了番木瓜TAT基因全长cDNA的序列,将其命名为CpTAT,Genbank登录号为KU253441。
2.2 CpTAT基因序列的生物信息学分析
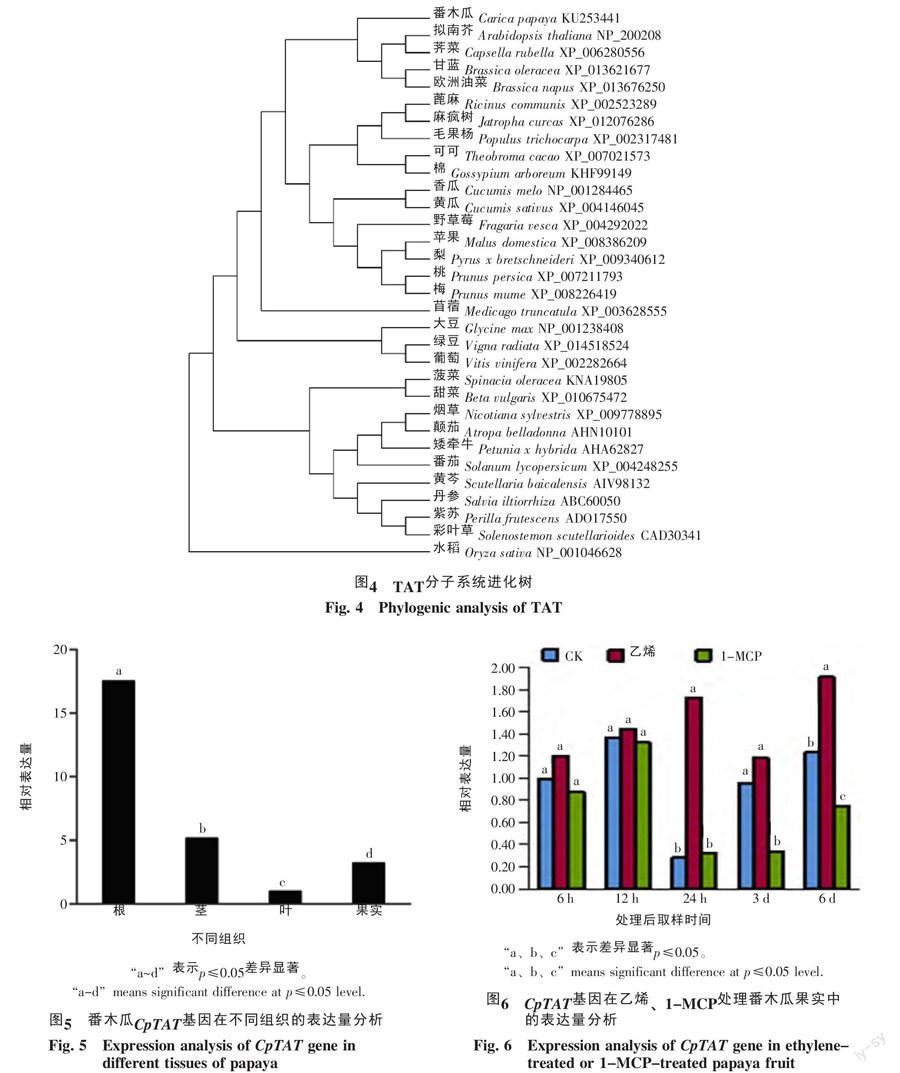
将番木瓜CpTAT基因的cDNA序列翻译成氨基酸序列,编码421个氨基酸。Protparam分析可知,蛋白质分子式为C2 104H3 318N556O600S17,等电点为6.86,分子量约为46.54 ku。用SignalP 3.0 Server进行信号肽预测,发现没有信号肽序列,不是分泌蛋白。用NCBI网站的CDD进行氨基酸序列结构域分析,该基因属于谷草转氨酶超家族成员,催化活性位点为第253位的赖氨酸(图3)。其理论推导的半衰期为30 h,不稳定参数为37.69,属于稳定蛋白。番木瓜TAT氨基酸序列与毛果杨、野草莓、桃、拟南芥、水稻的TAT氨基酸序列有很高的同源性,分别为83.69%、81.09%、80.76%、78.87%、54.67%(图3),说明这个基因比较保守,可推测它们具有相同或相似的功能。系统进化树显示,番木瓜TAT与拟南芥、荠菜等十字花科植物TAT蛋白表现出最小的进化距离,与单子叶植物水稻TAT蛋白进化距离最远(图4)。
2.3 CpTAT基因的表达分析
采用Real-time PCR研究了CpTAT基因在番木瓜不同器官,以及不同处理果实中的表达差异,结果显示,该基因在根、茎、叶和果实中均表达,在根中的表达量最高,在茎和果实中的表达较低,在叶中的表达量最低,达到显著水平(图5)。与对照相比,外源乙烯处理能诱导果实中CpTAT基因表达量升高,特别是在处理后24 h和6 d达到显著水平;而1-MCP处理则抑制了该基因的表达,在处理后的3 d和6 d表达差异达到显著水平。在果实处理后第6天,CpTAT基因在乙烯处理中表达量最高,对照中表达量较低,而1-MCP处理中表达量最低,达到显著水平(图6)。
3 讨论与结论
植物在生长发育过程中会遇到各种各样的生物和非生物胁迫,如干旱、冻害、虫咬食和衰老等。在胁迫中,有氧自由基升高使脂质和叶绿体氧化,破坏细胞[20]。维生素E可清除氧自由基和脂质过氧化原子团以保护光合作用器和脂双层膜。当植物进入衰老期,活性氧自由基和脂类过氧化物自由基增加,同时也会伴随着α-生育酚的增加,以保护细胞不受伤害[21]。TAT是维生素E合成关键酶[8],很多胁迫也诱导TAT基因表达量升高。例如,冠菌素、茉莉酮酸甲酯、12-氧植物二烯酸或创伤均能诱导拟南芥的TAT基因表达量上升[8,12]。在本研究中,外源乙烯诱导CpTAT基因表达量升高,而1-MCP则抑制该基因的表达,特别是在果实处理后第6天,该基因在乙烯处理中表达量最高,对照中较低,而1-MCP处理中最低,达到显著水平。番木瓜是典型的呼吸跃变型果实,外源乙烯促进果实成熟衰老,1-MCP推迟衰老进程[22-23]。果实处理后的第6天,乙烯利处理果实果皮全黄、果肉软化,进入全熟期,对照果實果皮半黄、果肉开始软化,为半熟期,而1-MCP处理果实果皮全绿,果肉硬,还处于绿熟期。CpTAT基因的表达量在不同成熟期果实中表达差异显著,说明该基因与果实成熟有一定相关性,在番木瓜果实成熟衰老中起作用。
本研究在已有番木瓜果实成熟差异基因片段序列的基础上,通过RACE技术成功克隆了维生素E合成关键酶基因CpTAT全长序列,为进一步利用该基因进行基因工程提高维生素E含量,改良果实品质奠定了一定的基础。
参考文献
[1] Aravind G, Debjit B, Duraivel S, et al. Traditional and medicinal uses of Carica papaya[J]. Journal of Medicinal Plants Studies, 2013, 1(1): 7-15.
[2] Krishna K, Paridhavi M, Patel J A. Review on nutritional, medicinal and pharmacological properties of papaya(Carica papaya Linn.)[J]. Natural Product Radiance, 2008, 7(4): 364-373.
[3] Brigelius-Flohe R, Traber M G. Vitamin E: function and metabolism[J]. The FASEB Journal, 1999, 13(10): 1 145-1 155.
[4] Traber M G, Sies H. Vitamin E in humans: demand and delivery[J]. Annual Review of Nutrition, 1996, 16 (1): 321-347.
[5] Rocheford T R, Wong J C, Egesel C O, et al. Enhancement of vitamin E levels in corn[J]. Journal of the American College of Nutrition, 2002, 21(sup3): 191S-198S.
[6] Yamauchi R, Matsushita S. Light-induced lipid peroxidation in isolated chloroplasts and role of α-tocopherol[J]. Agricultural and Biological Chemistry, 1979, 43(10): 2 157-2 161.
[7] Goffman F D, B?hme T. Relationship between fatty acid profile and vitamin E content in maize hybrids(Zea mays L.)[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4 990-4 994.
[8] Sandorf I, Hollander-Czytko H. Jasmonate is involved in the induction of tyrosine aminotransferase and tocopherol biosynthesis in Arabidopsis thaliana[J]. Planta, 2002, 216(1): 173-179.
[9] 郭新波, 唐岳立, 孙小芬, 等. 高等植物维生素C和维生素E代谢调控[J]. 植物生理学报, 2011, 47(8): 731-744.
[10] Riewe D, Koohi M, Lisec J, et al. A tyrosine aminotransferase involved in tocopherol synthesis in Arabidopsis[J]. The Plant Journal, 2012, 5: 850-859.
[11] 胡英考, 李晓晓, 李雅轩, 等. 大豆酪氨酸氨基转移酶基因的克隆与表达分析[J]. 西北植物学报, 2010, 30(6): 1 092-1 098.
[12] Lopukhina A, Dettenberg M, Weiler E W, et al. Cloning and characterization of a coronatine-regulated tyrosine aminotransferase from Arabidopsis[J]. Plant Physiology, 2001, 126(4): 1 678-1 687.
[13] Kim Y B, Uddina M, Kim Y, et al. Molecular cloning and characterization of tyrosine aminotransferase and hydroxyphenylpyruvate reductase, and rosmarinic acid accumulation in Scutellaria baicalensis[J]. Natural Product Communications, 2014, 9(9): 1 311-1 314.
[14] Huang B, Yi B, Duan Y, et al. Characterization and expression profiling of tyrosine aminotransferase gene from Salvia miltiorrhiza(Dan-shen)in rosmarinic acid biosynthesis pathway[J]. Molecular Biology Reports, 2008, 35(4): 601-612.
[15] 呂晓玲, 郝 磊, 王 芳, 等. 紫苏酪氨酸氨基转移酶基因片段的克隆及表达分析[J]. 中国农学通报, 2012, 28(24): 207-212.
[16] Lu X, Hao L, Wang F, et al. Molecular cloning and overexpression of the tyrosine aminotransferase(TAT)gene leads to increased rosmarinic acid yield in Perilla frutescens[J]. Plant Cell, Tissue and Organ Culture, 2013, 115(1): 69-83.
[17] 申艳红, 陈晓静. 改良热硼酸小量法提取番木瓜果肉RNA[J]. 中国南方果树, 2009, 38(2): 7-9.
[18] 申艳红, 陈晓静, 蔡雪玲, 等. 番木瓜半胱氨酸蛋白酶基因CpCP的分离及表达分析[J]. 园艺学报, 2015, 42(9): 1 789-1 797.
[19] 申艳红, 陈晓静, 何玮毅, 等. 番木瓜肌动蛋白CpActin基因的克隆及在果肉中的表达研究[J]. 果树学报, 2010, 27(6): 859-862.
[20] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55: 373-399.
[21] Spiteller G. The relationship between changes in the cell wall, lipid peroxidation, proliferation, senescence and cell death[J]. Physiologia Plantarum, 2003, 119(1): 5-18.
[22] An J F, Paull R E. Storage temperature and ethylene influence on ripening of papaya fruit[J]. Journal of the American Society for Horticultural Science, 1990, 115(6): 949-953.
[23] Fabi J P, Cordenunsi B R, de Mattos Barreto G P, et al. Papaya fruit ripening: response to ethylene and 1-methylcyclopropene (1-MCP)[J]. Journal of Agricultural and Food Chemistry, 2007, 55(15): 6 118-6 123.

