澳洲坚果焙烤过程中挥发性成分的特征分析
静玮 苏子鹏 林丽静


摘 要 利用顶空-固相微萃取-气相色谱质谱联用技术对焙烤澳洲坚果的挥发性成分进行定性定量分析;比较了原料澳洲坚果和130 ℃焙烤10、15、25、35、40、50和60 min,以及市售商品澳洲坚果的挥发性成分的含量差异。分离鉴定得到130 ℃焙烤澳洲坚果中的23种典型的挥发性物质,包括9种醛类、9种吡嗪类、2种呋喃类和3种其他物质。原料澳洲坚果中的挥发性成分比较少,市售澳洲坚果中的调味料香气含量较高,坚果香气物质较少。随着焙烤时间的延长,焙烤香气逐渐增加,其中吡嗪类和呋喃类的含量在130 ℃焙烤处理组之间均差异显著。2-甲基吡嗪和3-乙基-2,5-二甲基吡嗪以及2-乙酰基吡咯也能作为进一步指示10~60 min不同焙烤时间之间焙烤程度差异显著的标志物质,用以规范澳洲坚果焙烤工艺和指导焙烤产品品质分级。
关键词 澳洲坚果;焙烤;挥发性成分;气相色谱-质谱联用
中图分类号 TS255.6 文献标识码 A
Abstract In the present study, the volatile components in roasted macadamia nuts were quantitatively and qualitatively analyzed by Headspace Solid Phase Microextraction (HS-SPME) coupled with Gas Chromatography-Mass Spectrometry; The content difference of the volatile components in natural, roasted macadamia nuts (at 130 ℃ for 10, 15, 25, 35, 40, 50 and 60 min)and commercial macadamia nuts. A total of 23 characteristic volatile compounds were separated and identified, including 9 aldehydes, 9 pyrazines, 2 furans and 3 other compounds. Low contents of volatile components were obtained in natural macadamia nuts. High intensity of spices aromas but low of nutty ones were obtained in commercial macadamia nuts. The roasting aromas gradually increased with the roasting time prolonged. Significant difference of pyrazines and furans were observed within all treatments at 130 ℃. 2-Methylpyrazine, 3-Ethyl-2,5-dimethylpyrazine and 2-Acetylpyrrole could be potential marker compounds that further indicating the statistical significance of roasting degree with the roasting time ranging from 10 min to 60 min, which could normalize the roasting technology and guide the quality grading of roasting products.
Key words Macadamia nuts;Roast;Volatile components;Gas chromatography-mass spectrometry
doi 10.3969/j.issn.1000-2561.2016.06.029
澳洲坚果(Macadamia spp.),又称澳洲胡桃、夏威夷果等,为山龙眼科(Proteaceae)澳洲坚果属(Macadamia F. Muell)常绿乔木树种。果仁富含脂肪特别是不饱和脂肪酸、以及蛋白质、碳水化合物、钙、磷、铁等营养成分,作为一种健康的休闲食品,澳洲坚果有助于降低血小板的粘度,降低心脏病、心肌梗塞等心血管疾病的发生[1-3]。目前,澳洲坚果的产品加工主要是果仁添加或不添加调味剂后,经焙烤得到的即食产品。原料果仁所含的各类营养成分本身没有明显的气味,但经焙烤加工后的果仁被赋予浓郁的焙烤香气和色泽。
焙烤技术被广泛应用于国内外的坚果加工产业,焙烤过程中会引发一系列化学反应,由不同的前体物质合成或分解产生不同种类的香气物质,包括酮类、醇类、醛类、酯类、含硫衍生物、内酯类和酸类,以及杂环类物质(呋喃类、吡嗪类、吡咯类、噻吩类、酚类、吡啶类、噻唑类、恶唑类)[4-7]。目前,国内外关于坚果焙烤工艺和香气方面的研究主要集中在杏仁[8-10]、榛子[4-7, 11-12]、山核桃[13-16]、葵花籽[17-18]、花生[19-21]等坚果,而针对澳洲坚果这一热带作物的研究主要包括:脂肪酸分析[22-24]、营养成分分析[25-26]、干燥工艺[27-28]等,作为一种高油脂含量的高級坚果,通过先进的加工设备和焙烤工艺提高澳洲坚果的商品附加值,赋予其令人愉悦的色香味等感官品质,应该是今后的研究和加工方向。国内外关于澳洲坚果焙烤香气成分在不同焙烤工艺下的差异和变化的研究未曾见报道。本研究在前期实验的基础上,利用优化的检测条件对澳洲坚果焙烤后挥发性香气成分进行定性分析,并对比了不同焙烤工艺下挥发性香气成分的差异变化,为开发澳洲坚果焙烤工艺和产品品质分级提供理论支持。
1 材料与方法
1.1 材料
1.1.1 原料 带壳澳洲坚果(品种:Own Choice;产地:云南德宏),真空袋装;市售商品澳洲坚果果仁(原味、枫糖味和盐烧味),罐装。
1.1.2 试剂 C7-C30饱和正构烷烃标准品(美国SUPELCO公司);正己烷(色谱纯,瑞典Oceanpak公司)。
1.1.3 仪器 SHIMADZU QP-2010 Plus气相色谱质谱联用仪(日本岛津公司);PAL System三合一自动进样器(瑞士CTC公司);50/30 μm DVB/CAR/PDMS萃取头,美国SUPELCO公司;HR1848食品料理机(Philips公司);ABT220-5DM分析天平(德国KERN公司);FP115恒温干燥箱(德国宾德公司)。
1.2 方法
1.2.1 澳洲坚果焙烤处理 参考Wall等[29]用比重法分离得到成熟果仁(相对密度<1),然后称取20 g左右果仁置于食品料理机中进行研磨,得到坚果碎并倒入平底铝盘内,然后放入鼓风干燥箱内恒温焙烤。处理组分为未焙烤原料(RAW)、130 ℃焙烤10、15、25、35、40、50和60 min(分别记为130-10、130-15、130-25、130-35、130-40、130-50和130-60),焙烤后加盖并置于干燥器中自然冷却,待分析用;市售商品澳洲坚果研磨成坚果碎后倒入平底铝盘内,然后加盖并置于干燥器中待分析用。
1.2.2 固相微萃取(SPME)条件 将萃取头设置于三合一自动进样器的加热单元,250 ℃老化1 h。准确称取处理好的澳洲坚果样品4.0 g于20 mL顶空样品瓶内。样品在固相动态萃取单元下于70 ℃下平衡10 min,然后萃取头置于样品瓶内顶空内萃取40 min,转速250 r/min。萃取结束后直接入GC-MS进样口,解析温度250 ℃,时间5 min。
1.2.3 气相色谱-质谱(GC-MS)分析条件 气相色谱条件:色谱柱为VF-WAX ms毛细管柱(30 m×0.25 mm,0.25 μm,美国Varian公司);升温程序:起始温度40 ℃,保持5 min,以3 ℃/min的速度升至170 ℃,然后以20 ℃/min的速度升至240 ℃,保持3 min;载气(He)流速1.0 mL/min,不分流进样,进样口温度250 ℃,进样时间1 min。
质谱条件:电子轰击(EI)离子源:电子能量70 eV;接口温度250 ℃,离子源温度230 ℃;质量扫描(Scan)范围35~350 amu。
1.2.4 挥发性成分的定性与定量分析 定性分析: (1)采用NIST 14 和Wiley 9.0 质谱数据库检索进行定性分析;(2)根据C7-C30 的正构烷烃保留时间计算挥发性成分的保留指数,并与文献中对应物质的保留指数相比较。
定量分析:每个处理组的样品称取3份平行样进行检测,然后按照基本的积分规则对所有色谱峰进行积分,对每一个有效挥发性成分的峰面积进行数据处理。
1.3 数据处理
采用IBM SPSS Statistics 19分析软件进行方差分析(ANOVA)和邓肯氏多重比较法(Duncans Multiple Range Test)在p=0.05的水平下进行检验,结果以峰面积(平均值±标准误)表示。
2 结果与分析
2.1 澳洲坚果焙烤后的挥发性成分定性分析
图1表示的是澳洲坚果经130 ℃焙烤60 min后的挥发性成分的SPME-GC-MS检测总离子流图。图中数字标注的色谱峰是經过谱库检索和保留指数测定得到的焙烤澳洲坚果的典型挥发性香气成分,峰号与表1中列出的化合物逐一对应。在这23种典型香气物质中,包括9种醛类、9种吡嗪类、2种呋喃类和3种其他物质。所有物质首先经谱库检索,相似度均大于85%,然后利用正构烷烃标准物质计算出每一种物质的保留指数,并且与文献中极性相似的色谱柱分离得到相同物质的保留指数值进行对比;由于存在样品种类、测试条件等差异,实验值与文献值存在差异,但色谱柱极性是影响物质出峰顺序的最重要的因素,极性不同,同一物质的出峰时间会有很大差异。表1中还分析了每一种香气成分的香气特征,同一类物质具有相似的香气特征:醛类物质中,2-甲基丙醛、2-甲基丁醛和2-甲基戊醛都具有水果香味;己醛、庚醛、辛醛、壬醛和2-辛烯醛属于脂肪酸醛类,都具有脂肪味、果香味和青草味;苯甲醛具有特殊的苦杏仁味和焦糖味;总体上醛类物质风味比较清淡自然。吡嗪类是含两个氮原子的杂环化合物,具有典型的坚果味、焙烤香味、咖啡味和可可味,被多次报道出现于焙烤过的榛子和花生的香味成分中[30]。呋喃类是含有一个氧原子的杂环化合物,也是焙烤坚果中的典型香气物质,糠醛具有甜味和焦糖味,3(2)H-呋喃酮具有奶油味;很多酮类具有特殊的焙烤香味,2, 3-丁二酮是重要的具有黄油味和肉味的羰基化合物[31]。乙酸几乎存在于所有的植物种子中,具有醋酸味。2-乙酰基吡咯具有典型的甜味、可可味、坚果味和烤面包味。
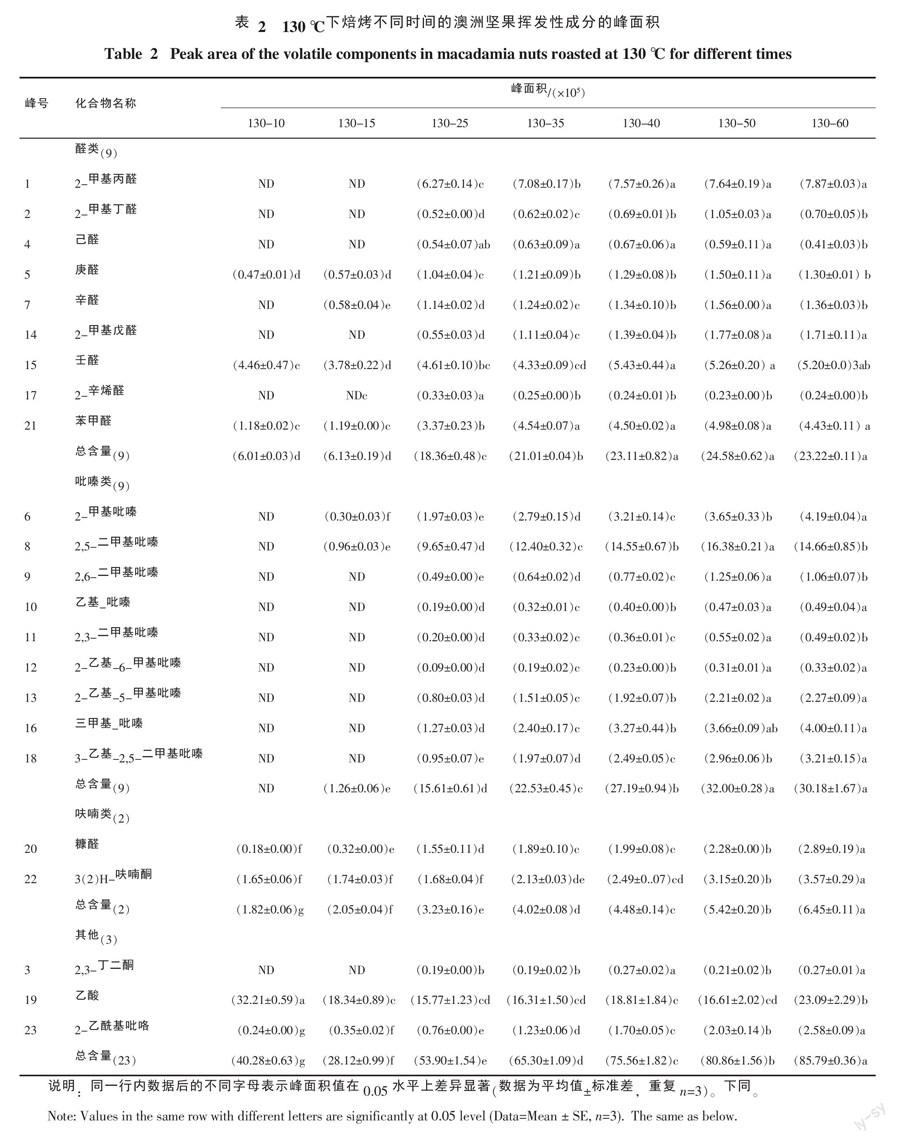
2.2 澳洲坚果焙烤后的挥发性成分定量分析
表2列出了澳洲坚果经130 ℃焙烤不同时间后,挥发性香气成分的峰面积统计比较。随着焙烤时间的延长,挥发性香气成分的总含量呈递增的趋势,峰面积总和从28.12×105升至85.79×105,但是130-10处理组的峰面积和高于130-15处理组,主要是130-10处理组的乙酸含量显著高于130-15及其他处理组,同时该处理条件未能引起挥发性香气成分的大量产生。从焙烤25 min开始,香气成分种类开始增多,含量也显著升高,尤其是具有焙烤坚果味、可可味和咖啡味的吡嗪类物质,以及具有典型焙烤香味的2-乙酰基吡咯。
2.2.1 醛类物质 从峰面积总和上看,130-40、130-50和130-60三个处理组显著高于其他组,组间无显著差异,130-25和130-35两组差异显著,且显著高于130-10和130-15组;其中,130-10和130-15两组可能由于焙烤时间较短,除壬醛外,其他醛类物质的数量和含量均较少;2-甲基丙醛和苯甲醛是含量较高的醛类,随着焙烤时间延长至35 min后,它们的含量开始增加,但是处理组之间差异不显著;130-50和130-60两组的醛类含量较高,但是组间差异基本不显著,可以视为130 ℃处理温度下的深度焙烤,2-甲基戊醛可以反映这两组与其他处理组之间的显著差异,虽然含量较低,但是可以作为15-50 min内不同焙烤时间工艺的指示物质。
2.2.2 吡嗪类物质 从峰面积总和上看,130-50和130-60两组最高,显著高于其他处理组,组间无显著差异。从焙烤40至10 min,随着时间的减少,吡嗪类物质峰面积总和显著降低,130-10处理组中未测到吡嗪类物质。2-甲基吡嗪和3-乙基-2,5-二甲基吡嗪的峰面积在从130-10至130-60的处理组之间均为差异显著,且峰面积比例较高,可以作为10~60 min内不同焙烤时间工艺的指示物质。另外,2,5-二甲基吡嗪、2,6-二甲基吡嗪、乙基吡嗪、2-乙基-6-甲基吡嗪和2-乙基-5-甲基吡嗪的峰面积在从130-15至130-50的处理组之间亦差异显著,可以作为进一步指示从10~50 min内焙烤工艺的物质。与醛类物质相似,130-50和130-60两组的吡嗪类物质含量较高,但是组间差异基本不显著,这表明单从焙烤时间方面已经不能显著改变澳洲坚果的焙烤香气特征,130 ℃、60 min处理甚至会减少2,5-二甲基吡嗪、2,6-二甲基吡嗪和2,3-二甲基吡嗪的含量,这可能与焙烤时间偏长不利于香气成分的保持有关。
2.2.3 呋喃类物质 呋喃类包括糠醛和3(2)H-呋喃酮2种,在所有处理组中都能检测到,峰面积总和在从130-10至130-60所有处理组之间差异显著,整体上可以作为10~60 min内不同焙烤时间工艺的指示物质。呋喃类物质一般是通过葡萄糖或者果糖等糖类的热降解反应产生的[9],虽然澳洲坚果的糖类物质含量较低,但是随着焙烤温度的升高,糠醛和3(2)H-呋喃酮的生成也增加,说明在130 ℃这一焙烤温度下糖类物质的热降解反应易于发生。
2.2.4 其他物质 羰基化合物大多来源于美拉德反应[32],2,3-丁二酮在130 ℃焙烤25 min后才被检测到,但是从130-25至130-60的处理组中差异不显著。乙酸的峰面积在130-10处理组中较高,然后随着焙烤时间的延长,其峰面积逐渐下降,除130-60处理组略高外,其余处理组之间差异不明显。吡咯类是含一个氮原子的杂环化合物,一般是通过美拉德反应或者焦糖化反应生成,130 ℃焙烤澳洲坚果后产生的2-乙酰基吡咯赋予典型的焙烤坚果和面包香味,随着焙烤时间的延长峰面积增大,在从130-10至130-60的全部處理组之间差异显著,可以作为不同焙烤工艺的指示物质。
2.3 未焙烤澳洲坚果与市售商品澳洲坚果挥发性成分定量分析
表3显示的是未经焙烤的原料澳洲坚果和市售商品澳洲坚果的焙烤香气分析。对应表1鉴定的23种挥发性香气物质,这4种坚果样品中除了乙酸这一常见于植物种子中的物质外,只有壬醛、苯甲醛、2-乙酰基吡咯和3(2)H-呋喃酮这4种香气成分被测到;对比原料澳洲坚果,可以发现130 ℃焙烤能产生多种焙烤香气,尤其是吡嗪类、呋喃类等具有典型焙烤香气的物质;一般市售商品澳洲坚果,都是原料带壳开口坚果经过调味料液浸泡、低温(80 ℃)干燥和短时间(10 min)烘焙加工或者直接干燥烘焙的,带壳焙烤可能降低了内部果仁的实际加热效率,所以未能产生更多的香气成分。但是商品澳洲坚果中的壬醛和苯甲醛峰面积要大于130 ℃各处理组,表明这两种物质可能在较低的焙烤温度下即可产生,但随着焙烤温度的升高以及时间的延长,这些物质可能会发生部分挥发,从而含量降低。
另外在市售商品澳洲坚果中,原味坚果未添加调味添加剂,另两款坚果除了添加常规的食用盐、白砂糖阿斯巴甜、安赛蜜和食用香精外,枫糖味坚果还添加了蜂蜜和枫树糖浆,盐烧味坚果加入了盐烧味调味料(包括香菇粉、虾粉、海苔粉、番茄粉和蒜粉),这些都赋予澳洲坚果不同的滋气味,但是通过检测挥发性香气成分,我们发现与未经焙烤和130 ℃不同时间焙烤的坚果相比,枫糖味和盐烧味的坚果中增加了3种高含量的香气成分,分别是茴香脑(辛香味、青草味、薄荷味)、茴香醛(甜味、山楂味)和肉桂醛(辛香味、肉桂香味),尤其是肉桂醛的含量很高,该物质大量存在于肉桂等植物体内,作为食品香料加入面包、蛋糕等烘焙产品,所以笔者认为这3种香气成分应该来自于食用香精和调味料。
3 讨论与结论
顶空-固相微萃取(HS-SPME)作为一种前处理技术,集采样、萃取、浓缩、进样为一体,对样品中的挥发性和半挥发性物质有很强的富集作用,并且无需溶剂提取,绿色环保、快速简捷,与气相色谱质谱联用仪(GC-MS)结合使用来检测挥发性成分的变化,能够对食品加工过程中产品品质和加工工艺进行在线监测。Franca等[33]利用HS-SPME-GC-MS技术检测焙烤咖啡的挥发性物质,并利用挥发性物质的特征分离了生咖啡豆和焙烤咖啡豆,以及分离了不同焙烤程度和焙烤温度的咖啡豆。Toci等[34]通过分析有缺陷的巴西咖啡豆焙烤香气特征,找到了能够区分因不适宜加工条件或者成熟过度而导致缺陷的生咖啡豆和焙烤咖啡豆的指示物质,从而能够追溯咖啡豆原料和加工品的品质。
本研究中,利用130 ℃下不同时间焙烤澳洲坚果能够诱导焙烤香气的产生,通过谱库检索和保留指数定性鉴定得到130 ℃焙烤澳洲坚果中的23种典型的挥发性物质,包括9种醛类、9种吡嗪类、2种呋喃类和3种其他物质,这些物质赋予了澳洲坚果果香味、坚果味和焙烤香味。
市售澳洲坚果中的调味料香气含量较高,主要是茴香脑、茴香醛和肉桂醛,但是焙烤香气物质较少。随着焙烤时间的延长,焙烤香气的种类和含量逐渐增加,其中吡嗪类和呋喃类的含量在130 ℃不同时间的焙烤处理组之间均差异显著,可以指示澳洲坚果在130 ℃下不同的焙烤程度,也反映了澳洲坚果不同焙烤条件下焙烤香气特征的变化,Alasalvar等[35]认为在焙烤过程中增加的挥发性物质形成了焙烤榛子的特征香气,而我们的研究从增加的焙烤香气成分中,找出了不同处理时间下显著增加的香气成分,进一步明确了影响澳洲坚果焙烤香气变化的物质;同时吡嗪类中的2-甲基吡嗪和3-乙基-2,5-二甲基吡嗪以及2-乙酰基吡咯在不同处理组间含量差异显著,也能作为进一步指示130 ℃焙烤10~60 min内焙烤程度差异的标志物质,用以规范澳洲坚果焙烤工艺和指导产品品质分级。
參考文献
[1] 郜海燕, 华 颖, 陶 菲,等. 富含不饱和脂肪酸食品加工过程中的组分变化研究与展望[J]. 中国食品学报, 2011, 11(9): 134-143.
[2] 刘建福, 黄 莉. 澳洲坚果的营养价值及其开发利用[J]. 中国食物与营养, 2005(2): 25-26.
[3] Grag M L, Rudra P, Blake R, et al. Macadamia nut consumption lowers plasma cholesterol levels in hypercholesterolemic men[J]. Journal of Nutrition, 2003, 133: 1 060-1 063.
[4] Burdack-Freitag A, Schieberle P. Changes of Italian hazelnuts (Corylus avellana L. var. Tonda Romana) induced by roasting[J]. Journal of Agricultural and Food Chemistry, 2012, 60(20): 5 057-5 064.
[5] Cordero C, Bicchi C, Rubiolo P. Group-type and fingerprint analysis of roast food matrices (coffee and hazelnut samples) by comprehensive two-dimensional gas chromatography[J]. Journal of Agricultural and Food Chemistry, 2008, 56(17): 55-66.
[6] Cordero C, Liberto E, Bicchi C, et al. Profiling food volatiles by comprehensive two-dimensional gas chromatography coupled with mass spectrometry: advanced fingerprinting approaches for comparative analysis of the volatile fraction of roasted hazelnuts (Corylus avellana L.)from different origins[J]. Journal of Chromatography A, 2010, 1 217(37): 5 848-5 858.
[7] Kiefl J, Cordero C, Nicolotti L, et al. Performance evaluation of non-targeted peak-based cross-sample analysis for comprehensive two-dimensional gas chromatography-mass spectrometry data and application to processed hazelnut profiling[J]. Journal of Chromatogr A, 2012, 1 243(1): 81-90.
[8] Agila A, Barringer S. Effect of roasting conditions on color and volatile profile including HMF level in sweet almonds (Prunus dulcis)[J]. Journal of Food Science, 2012, 77(4): C461-8.
[9] Vázquez-Araújo L, Enguix L, Verdú A, et al. Investigation of aromatic compounds in toasted almonds used for the manufacture of turrón[J]. European Food Research & Technology, 2008, 227(1): 243-254 .
[10] Vázquez-Araújo L, Verdú A Navarro P, et al. Changes in volatile compounds and sensory quality during toasting of Spanish almonds[J]. International Journal of Food Science & Technology, 2009, 44(11): 2 225-2 233.
[11] Nicolotti L, Cordero C, Bicchi C, et al. Volatile profiling of high quality hazelnuts (Corylus avellana L.): Chemical indices of roasting[J]. Food Chemistry, 2013, 138(2-3): 1 723-1 733.
[12] Alasalvar C, Shahidi F, Cadwallader K R. Comparison of natural and roasted Turkish tombul hazelnut (Corylus avellana L.) bolatiles and flavor by DHA/GC/MS and descriptive sensory analysis[J]. Journal of Agricultural and Food Chemistry, 2003, 51(17): 67-72.
[13] 周拥军, 郜海燕, 房祥军, 等. SPME-GC-MS分离鉴定山核桃的挥发性风味物质[J]. 中国粮油学报, 2012, 27(6): 115-119.
[14] 胡玉霞, 王 方, 王昭君, 等. 顶空固相微萃取与气质联用分析山核桃香气成分[J]. 农业机械, 2011(20): 135-138.
[15] 李 丽, 赵 鑫, 高彦祥, 等. 山核桃仁最佳烘烤条件的研究[J]. 食品工业科技, 2012, 33(2): 243-249.
[16] 王丽霞, 盛希茜, 吴峰华, 等. 浙江山核桃油脂香气萃取条件优化及组分分析[J]. 食品与机械, 2010, 26(1): 38-41.
[17] 贾春晓, 毛多斌, 孙晓丽, 等. 烘烤葵花籽的香气成分分析及最佳烘烤条件研究[J]. 食品工业科技, 2006(8): 60-65.
[18] 俞 俊, 谢惠明, 杨 毅, 等. 焦香葵花籽挥发性陈芬的分析[J]. 安徽农业科学, 2008, 36(4): 1 333-1 334.
[19] Chetschik I, Granvogl M, Schieberle P. Comparison of the key aroma compounds in organically grown, raw West-African peanuts (Arachis hypogaea) and in ground, pan-roasted meal produced thereof[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 37-43.
[20] Schirack A V, Drake M A, Sanders T H, et al. Characterization of aroma-active compounds in microwave blanched peanuts[J]. Journal of Food Science, 2006, 71: 513-520.
[21] Didzbalis J, Ritter K A, Trail A C, et al. Identification of fruity/fermented odorants in high temperature cured roasted peanuts[J]. Journal of Agricultural and Food Chemistry, 2004, 52: 4 828-4 833.
[22] Wall M M. Functional lipid characteristics, oxidative stability, and antioxidant activity of macadamia nut(Macadamia integrifolia) cultivars[J]. Food Chemistry, 2010, 121(4): 1 103-1 108.
[23] 楊为海, 张明楷, 邹明宏, 等. 澳洲坚果不同种质果仁粗脂肪及脂肪酸成分的研究[J]. 热带作物学报, 2012, 33(7): 1 297-1 302.
[24] 王文林, 赵 静, 秦斌华, 等. 澳洲坚果脂肪酸成分分析[J]. 热带农业工程, 2013, 37(1): 1-3.
[25] 杜丽清, 曾 辉, 邹明宏, 等. 澳洲坚果果仁氨基酸含量的差异性分析[J]. 经济林研究, 2008, 26(4): 49-52.
[26] 杜丽清, 邹明宏, 曾 辉,等. 澳洲坚果果仁营养成分分析[J]. 营养学报, 2010, 32(1): 95-96.
[27] 邹建云, 郭刚军. 澳洲坚果果仁加工工艺条件研究[J]. 热带作物学报, 2013, 34(11): 2 295-2 300.
[28] 王云阳, 张 丽, 王绍金,等. 澳洲坚果果仁粉水分解吸-吸附等温线的测定与分析[J]. 农业工程学报, 2012, 28(22): 288-292.
[29] Wall M M, Gentry T S. Carbohydrate composition and color development during drying and roasting of macadamia nuts (Macadamia integrifolia)[J]. LWT-Food Science and Technology, 2007, 40(4): 587-593.
[30] Yang J H, Pan Z L, Takeoka G, et al. Shelf-life of infrared dry-roasted almond[J]. Food Chemistry, 2013, 138: 671-678.
[31] Shimoda M, Nakada Y, Nakashima M, et al. Quantitative comparison of volatile flavor compounds in deep-roasted and light-roasted sesame seed oil[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8): 3 193-3 196.
[32] Coghe S, Gheeraert B, Michiels A, et al. Development of Maillard reaction related characteristics during malt roasting[J]. Journal of the Institute of Brewing, 2006, 112(2): 148-156.
[33] Franca A S, Oliveira L S, Oliveira R C S, et al. A preliminary evaluation of the effect of processing temperature on coffee roasting degree assessment[J]. Journal of Food Engineering, 2009, 92(3): 345-352.
[34] Toci A T, Farah A. Volatile fingerprint of Brazilian defective coffee seeds: corroboration of potential marker compounds and identification of new low quality indicators[J]. Food Chemistry, 2014, 153(24): 298-314.
[35] Alasalvar C, Shahidi F, Cadwallader K R. Comparison of Natural and Roasted Turkish Tombul Hazelnut(Corylus avellana L.)Volatiles and Flavor by DHA/GC/MS and Descriptive Sensory Analysis[J]. Journal of Agricultural and Food Chemistry, 2003, 51(17): 5 067-5 072.

