超声波辅助提取诺丽果多糖的工艺研究
许木果 刘忠妹 李海泉 杨焱 徐荣


摘 要 以诺丽果干粉为原料,优化超声波辅助提取诺丽果多糖的工艺,测定多糖的提取总量。在单因素实验基础上,以超声波处理时间、处理温度、处理功率、料液比四因素,三水平进行正交实验,以诺丽果多糖提取率为考察结果。结果表明:诺丽果粉粒度60目、料液比1 ∶ 25、提取功率300 W、提取时间45 min、提取温度70 ℃,提取次数2次为多糖的最佳提取条件。在正交实验基础上,进行了验证试验,结果证明,采用优化后的提取工艺提取诺丽果多糖的效率高,研究结果为提取诺丽果多糖提供了一定实际生产依据。
关键词 诺丽果;多糖;超声波;提取工艺;优化
中图分类号 S567 文献标识码 A
Abstract Dry powder of Morinda fruit was selected as the raw material to determine the gross extraction of polysaccharide by optimize ultrasonic-assisted extraction process of polysaccharide from Morinda fruit. To determine the extraction rate of polysaccharide in Morinda fruit, main technological parameters like ultrasonic treating time, treating temperature, treating power and solid-liquid ratio, were investigated by a single factor method coupled with L9(34)orthogonal array design. The results showed that the optimal conditions of extracting polysaccharide from Morinda fruit was a two-step extract with Morinda fruit powder size of 60, solid-to-liquid ratio of 1 ∶ 25, ultrasonic power 300 W, extracting 45 min at a temperature of 70 ℃. The verification test was carried out based on an orthogonal experiment, it was proved that this extracting technology was efficient, the result provided theoretical parameters for the practical production of the extraction of Morinda fruit polysaccharide.
Key words Morinda; Polysaccharide; Ultrasonic; Extraction process; Optimization
doi 10.3969/j.issn.1000-2561.2016.06.030
诺丽(Morinda cirtifolia L.)为茜草科巴戟天属植物,热带常绿多年生小乔木或阔叶灌木,约80种,中国有12种和2个变种,主要分布于中国西南部到东南部,台湾和香港地区[1-3]。诺丽发源于太平洋南部岛屿,当地居民称之为NONI,被波利尼亚人食用已有2000多年历史,在南太平洋一带素有“仙果”之美称[4]。诺丽果实、叶子、枝干、根部均可入药[5],果实为白色叶茎果,作为一种传统药用植物,药名海巴戟,富含多种微量元素的同时,还含有较为丰富的活性物质,如生物碱、蒽醌类、多酚、脂肪酸类、木脂素、多糖、甾醇和萜类化合物等。在治疗方面,诺丽被证实对多种病症有显著疗效,如抗病毒、抗癌,对治疗自身免疫疾病,阻止和减少急、慢性病痛的发生,对哮喘等呼吸道疾病、糖尿病、肾炎、关节炎、癔症、敏感症、动脉粥样硬化、瘀血、消化系统疾病、多种硬化症、心血管疾病(高血压、心肌梗死)都具有一定疗效[1-3,6-8]。实验表明,从诺丽果中提取的水溶性多糖具有明显的免疫增强作用[9]。Furusawa[10-11]研究小组发现,诺丽果多糖中含有一种关键的抗肿瘤物质,它主要通过调节宿主免疫系统抑制肿瘤的生长,通过对其多糖的分离提纯和药理实验发现,抗肿瘤的成分主要集中在乙醇沉淀的多糖组分中,在肿瘤的临床治疗中,诺丽多糖将是一种重要的药物辅助剂[12]。目前,国内对诺丽多糖的相关研究报道主要集中在其药理作用方面,对于该成分的分離纯化及其活性成分的研究相对较少,本研究主要利用超声波辅助提取工艺,对诺丽果多糖的提取过程进行优化,以期为后续研究奠定一定的基础。
1 材料与方法
1.1 材料
诺丽鲜果采摘于云南省热带作物科学研究所科研试验基地。所用试剂为葡萄糖标准品、乙醚、浓硫酸、苯酚、丙酮、无水乙醇,除葡萄糖标准品为优级纯外(GR),其余试剂均为分析纯(AR)。
KQ500超声波清洗器,昆山舒美超声仪器有限公司;ME204E电子分析天平,梅特勒-托利多(常州)称重设备系统有限公司;2XZ型直联真空泵,上海阳光泵业制造有限公司;SP-722型紫外可见分光光度计,上海光谱仪器有限公司;TDL-5台式离心机,上海安亭科学仪器厂;BGZ-140电热鼓风干燥箱,上海博迅实业有限公司。
1.2 方法
1.2.1 样品制备 诺丽鲜果,清水洗净,切片后放入45 ℃鼓风干燥箱中干燥,高速中药粉碎机粉碎,超临界二氧化碳脱脂,过20、40、60、80、100目筛,得诺丽果干粉样品备用。
1.2.2 诺丽果多糖提取工艺流程 诺丽果干粉样品→以蒸馏水作为提取剂超声提取→抽滤浓缩→加入4倍体积无水乙醇→静置48 h(低温2~6 ℃)→3 000 r/min离心15 min→去漂浮物得沉淀→无水乙醇、乙醚、丙酮各淋洗2次→60 ℃干燥→诺丽果多糖。
1.2.3 供试样品的制备 称取诺丽果干粉样品5 g→按照1.2.2的工艺流程提取诺丽果多糖→称重→加蒸馏水溶解定容至100 mL→再将所定容的多糖溶液稀释50倍→上机测定→计算多糖得率。
1.2.4 单因素实验方案设计 在固定温度60 ℃、时间60 min、料液比1 ∶ 25、超声功率300 W,提取次数3次的条件下,探讨不同颗粒度20、40、60,80、100目对超声提取诺丽果多糖的影响;固定原料颗粒度60目、温度60 ℃、时间45 min、料液比1 ∶ 25、超声功率300 W条件下,研究提取次数对超声提取诺丽果多糖的影响;固定原料颗粒度60目、温度60 ℃、时间45 min、超声功率300 W、提取次数2次的条件下,研究不同料液比对诺丽果多糖提取率的影响;固定原料颗粒度60目、温度60 ℃、时间45 min、料液比1 ∶ 30、提取次数2次的条件下,研究不同提取功率对诺丽果多糖提取率的影响;在固定原料颗粒度60目、温度60 ℃、料液比1 ∶ 30、提取功率300 W、提取次数2次的条件下,研究不同提取时间对诺丽果多糖提取率的影响;在固定原料颗粒度60目、料液比1 ∶ 30、提取功率300 W、提取时间45 min、提取次数2次的条件下,研究不同提取温度对诺丽果多糖提取率的影响。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
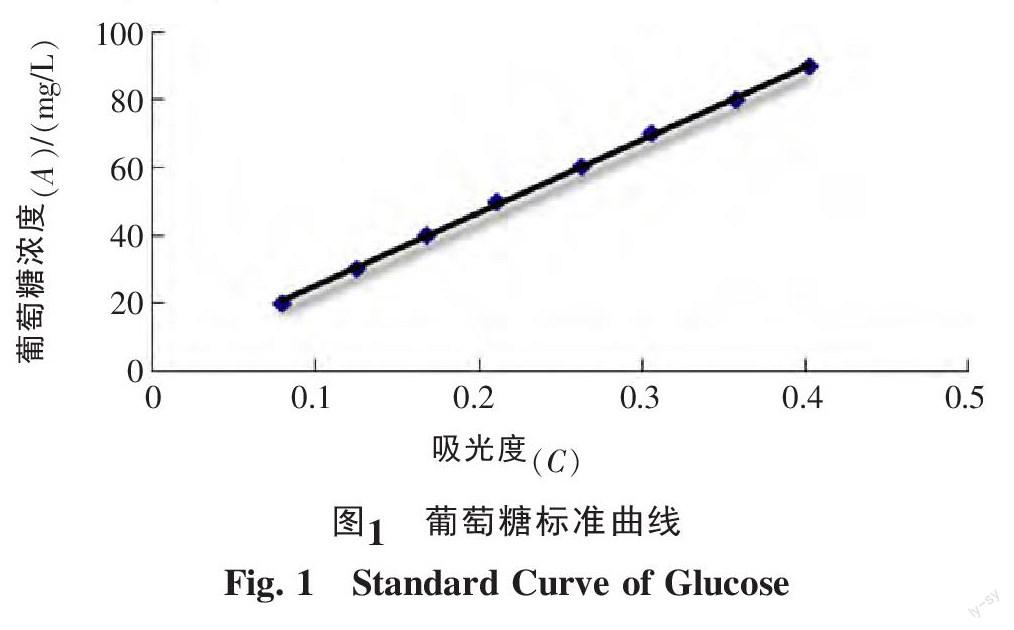
精确称取葡萄糖(105 ℃干燥至恒重)0.020 3 g,以蒸馏水定容至200 mL的容量瓶中,摇匀,得葡萄糖标准溶液。分别准确吸取浓度为100 mg/L的葡萄糖溶液0.2、0.4、0.6、0.8、1.4、1.6、1.8 mL于10 mL刻度试管中,以加入葡萄糖0.0 mL作为空白对照,分别加入蒸馏水至2 mL,然后各加入6%的苯酚溶液1 mL及硫酸5.0 mL,静置5min,摇匀,静置30 min(冷确至室温)。在最大吸收波长为490 nm处测吸光度,以葡萄糖浓度为纵坐标,吸光度值为横坐标,绘制工作曲线图,并计算回归方程为:A=215.7C+3.447,R2=0.999 7,式中A为葡萄糖的浓度,单位为mg/L。结果表明,葡萄糖浓度在10~90 mg/L范围内与吸光度呈良好的线性关系(图1)。
精密度试验:精密吸取对照品溶液1.0 mL,按照“2.1”项所设定的方法测定其吸光度,连续测定6次,吸光度的RSD为0.09%,表明仪器精密良好。
稳定性试验:精密吸取供试液1.0 mL,按照“2.1”项操作,测定其吸光度。每隔10 min测定一次,连续1 h考察其稳定性,吸光度的RSD为1.17%,结果表明样品溶液在1 h内显色稳定。
2.2 换算因素的确定
精密称取所提取的诺丽果多糖0.016 1 g,置于100 mL的容量瓶中,蒸馏水溶解并定容至刻度,得多糖供试液。精密吸取1 mL,按标准曲线下的方法测定吸光度,计算多糖溶液中的葡萄糖含量,并计算出换算因子f=W/CD。式中W为多糖含量,C为多糖溶液中葡萄糖的含量,D为诺丽果多糖的稀释因素。
2.3 超声波提取诺丽果多糖单因素实验
2.3.1 不同颗粒度对多糖提取率的影响 不同颗粒度的提取及测定结果如图2所示。结果表明,在20~60目之间的诺丽果多糖的提取率变化相对明显,在超过60目之后多糖含量增减变化不大,维持相对稳定。综合考虑粉碎不同目数的诺丽果粉的难易程度以及所消耗的能量,选取过60目筛的样品为宜。
2.3.2 提取次数对多糖提取率的影响 提取次数的测定结果如图3所示。由图3可知,在提取次数达到2次以上之后,多糖的提取已较为充分,提取率几乎没有明显变化,保持相对稳定,因此,提取次数选取2次。
2.3.3 不同料液比对多糖提取率的影响 不同料液比提取及测定结果如图4所示。由图4可知,当料液比达到1 ∶ 30时,多糖的提取率达到最大值,超过1 ∶ 30之后,多糖的提取率有下降的趋势,这可能是由于开始提取时细胞内部的多糖浓度比外部环境中的低,当增加水分时内部多糖不断的浸出,当料液比超过1 ∶ 30后,内外浓度几乎相同,多糖浸出量减少。因此,选择1 ∶ 20、1 ∶ 25、1 ∶ 30作为正交实验3个因素水平。
2.3.4 不同提取功率对多糖提取率的影响 不同提取功率下多糖提取率的结果如图5所示。通过图5的分析结果可知,当超声功率达到300 W之后,多糖的提取率呈现了较为明显的下降,这可能是因为超声波在作用时间固定时,超声波的破碎作用主要取决于超声波的功率,其功率越大破碎作用越强,机械振动的强度增大,但当超声强度达到一定范围之后,极有可能造成多糖分子糖苷键的断裂,从而影响多糖的提取效果,导致多糖提取率降低。因此,选择100、200、300 W作为正交实验3个因素水平。
2.3.5 不同提取时间对多糖提取率的影响 不同提取时间下多糖的提取率结果如图6所示。由图6可知,当提取在一定时间范围内,随着超声波作用时间的延长,多糖的提取率逐渐升高,在45 min左右时,提取效果较好。在45~60 min有一个明显的下降过程,这可能是由于随着提取时间的延长,超声波对细胞壁的破坏作用增强,植物细胞进一步破碎,杂质的溶出相应的增多,导致多糖的提取率出现了明显的下降;同时,由于超声波具有较强的机械剪切作用,长时间作用也会造成大分子的多糖键的断裂,从而影响多糖的提取效果;当超声作用时间在60~90 min时,提取率没有明显变化,相对增减的幅度较小。因此,為了进一步验证随时间延长是否会影响诺丽多糖的提取效果,本实验选取45、60、75 min作为正交实验的3个因素水平。
2.3.6 不同提取温度对多糖提取率的影响 不同提取温度对多糖提取率的影响结果见图7。可见,当温度达到50 ℃多糖提取率达到最高,在50 ℃时诺丽果多糖,溶质与浸提剂蒸馏水之间的扩散基本达到平衡。超过50 ℃之后出现了较为明显的下降,这可能是由于温度升高之后,超声波的机械剪切作用增强,对浸出部分的多糖分子造成了破坏,导致提取率的降低;当温度超过70 ℃时,也有明显的一个降幅,这应该是温度过高,导致部分糖蛋白变性沉淀,在抽滤和离心的过程中被去除的缘故。因此,综合考虑不同温度提取条件,选取50、60、70 ℃作为正交实验的3个因素水平。
2.4 正交实验
2.4.1 正交实验方案设计 根据单因素实验的结果,同时参照超声提取多糖的相关文献资料[13-18],选择主要影响多糖提取效率的料液比(g/mL)/A、提取功率(W)/B、提取时间(min)/C、温度(℃)/D为因素,设计4因素、3水平的L9(34)的正交实验,见表1。
2.4.2 正交实验结果 按照表1所设置的条件,根据单因素实验结果及相关文献,为了全面考察多糖的提取工艺参数,设计正交实验,多糖提取的结果如表2所示。
通过各因素极差分析结果可知,对多糖提取率影响大小顺序依次是A、D、B、C,即料液比>提取温度>提取功率>提取时间,最佳方案是A2B3C1D3,即优化条件为料液比1 ∶ 25、提取功率300 W、提取时间45 min、提取温度70 ℃。而在正交试验设计中没有出现这一方案,为了确定、验证上述方案是否为最佳方案,按照A2B3C1D3条件对样品进行超声波提取测定,结果见表3。由表3可知,该方案可行。
2.4.3 正交实验结果方差分析 利用spss19.0软件对正交试验结果进行方差分析,多糖的提取率为因变量,固定因子分别为料液比、提取功率、提取时间、提取温度,其结果如表4所示。方差分析的结果显示,料液比和温度对诺丽果多糖提取率影响起到了最主要的作用,超声时间和提取功率在此实验范围内差异相对较小,与极差分析的结果相吻合,超声优化条件重现性良好。
2.4.4 常规提取诺丽果多糖实验 在已优化后的条件,颗粒度60目、提取次数2次、料液比1 ∶ 25、提取温度70 ℃。延长提取时间为250 min,用常规水提醇沉法提取多糖,除不使用超声仪器外,提取的工艺流程与“1.2.2”相同,此条件下多糖的提取率为6.189%。提取结果如表5所示。
3 讨论
本研究采用超声波辅助提取工艺,水提醇沉法提取诺丽果多糖,苯酚-硫酸法显色测定多糖含量,其过程简单、快速、灵敏、结果重现性好。通过单因素和正交实验结果得到多糖提取的优化条件为颗粒度60目、提取次数2次、料液比1 ∶ 25、提取功率300 W、提取时间45 min、提取温度70 ℃,该条件下多糖的提取率为8.293 1%。并且考察了该方法的可行性和实用性,若确定以诺丽果多糖作为质量检测指标时,该方法可行。比较常规提取方法“2.4.4”和超声提取方法的差异,结果发现超声提取诺丽果多糖具有较高的提取效率:提取时间缩短了5倍以上,收率提高33.97%。
参照相关文献资料[19-22]对植物水溶性多糖的提取及测定方法,本研究在对样品前处理过程中,采用超临界二氧化碳脱脂,有效的排除了相应杂质的干扰;在对水溶性多糖进行提取的过程中,采用了真空泵抽滤分离水溶性多糖,大大加快固、液分离的速度和效率,避免有效成分的流失;用葡萄糖作为标准品,紫外分光光度计对诺丽果粉多糖含量进行测定,标准曲线方程R2=0.999 7,线性关系良好;采用单因素和正交实验的方法,通过极差分析及验证试验结果表明,该工艺稳定性较好。
赵二劳等[23]对南瓜多糖的超声辅助提取结果表明,对于一定频率和一定發射面的超声来说,功率增大,声强随之增强,则声压幅值以及液体中压力亦增大,空化泡崩溃所需的时间将变得更短,从而有利于提取率的提高;但无限制通过增加功率,提高声强,可能会由于声强的过度增大,导致空化泡在声波中压缩相内来不及发生崩溃,从而不利于提取,使提取量减少。另一方面,当温度升高到一定程度时,多糖的提取率出现下降,但Karacabey等[24]认为较高的温度会导致植物组织的软化,破坏多糖与酚类化合物、蛋白质之间的相互作用,使多糖的溶解度上升,提高扩散速率,从而使提取量升高。因此,笔者认为这两种因素有较强的交互作用,在一定的超声强度下,多糖的提取效率随温度变化趋于平缓。对比刘海青等[25]对诺丽果多糖提取过程,本试验所用仪器简单,操作方便,超声仪器自动化程度极高,全过程无需高温,增加提取效率的同时,有效的避免了因高温对糖分子结构的破坏和多糖活性的降低。
目前,植物水溶性多糖提取方法有超声法、微波辅助法、响应面分析法等。从经济实用性考虑,超声具有省时、节能、提出率高等优点,便于大规模生产。由于影响多糖提取率的因素较为复杂,包括:料液比、提取时间、提取温度、提取功率、提取次数、原料的颗粒度、醇沉浓度、醇沉时间等。本研究仅选取前面4个主要因素作为正交试验的优选条件,在今后的工作中还应考虑对多糖的功能性成分进一步纯化分离,以便为后续诺丽果功能性多糖的研究奠定一定的基础。
参考文献
[1] Wang M Y, West B J, Jensen C J, et al. Morinda citrifolia(Noni): a literature review and recent advances in Noni re-search[J]. Acta Pharmacol Sin, 2002, 23(12): 1 127-1 141.
[2] Yanine C B, Fabrice V, Ana M P, et al. The noni fruit(Morinda citrifolia L.): A review of agricultural research, nutritional and therapeutic properties[J]. J Food Composi-tion Anal, 2006, 19: 645-654.
[3] West B J, Jensen C J, Westendorf J, et al. A safety review of noni fruit juice[J]. J Food Sci, 2006, 71(8): 100-106.
[4] Bussmann R W, Hennig L, Giannis A, et al. Anthraquinone Content in Noni(Morinda citrifolia L.)[J]. Evidence Based complementary and Alteernative Medicine, 2013, 25(7): 5.
[5] 顾湘隽. 身价不菲的怪果: 诺丽[J]. 国际市场, 2001(1): 12-13.
[6] Akihisa T, Matsumoto K, Tokuda H Y, et al. Anti-inflam-matory and potential cancer chemopreventive constituents of the fruits of Morinda citrifolia(Noni)[J]. J Nat Prod, 2007, 70(5): 754-757.
[7] Deng S, Palu K, West B J, et al. Lipoxygenase inhibitory constituents of the fruits of Noni(Morinda citrifolia) col-lected in Tahiti[J]. J Nat Prod, 2007, 70(5): 859-862.
[8] Kamiya K, Tanaka Y, Endang H, et al. New anthraquinoneand iridoid from the fruits of Morinda citrifolia[J]. Chem Pharm Bull, 2005, 53(12): 1 597-1 599.
[9] 呂燕宁. 海巴戟中一种具有抗瘤活性的免疫调节性多糖物质[J]. 国外医学中药分册, 2000, 22(6): 341-342.
[10] Hirazumi A, Furusawa E. An immune dulatory polysaccharide-rich substance from the fruit juice of Morinda citrifolia(Noni) with antitumour activeity[J]. Phytother Res, 1999, 13(15): 380-387.
[11] Furusawa E. Hirazumi A, Story S, et al. Antitumour potential of a polysaccharide-rich substance from the fruit juice of Mornda citrifolia(Noni) on sarcoma 180 ascites tumour in mice[J]. Phytother Res, 2003, 17(10): 1 158-1 164.
[12] 许国平, 张眷妮. 诺丽作用机制的研究进展[J]. 医学研究生学报, 2007, 20(9): 974-977.
[13] 刘春兰, 刘海青, 邓义红, 等. 沙棘叶水溶性多糖的分离纯化及体外清除自由基活性研究[J]. 中药材, 2006, 29(2): 151-154.
[14] 李丹丹, 吴茂玉, 宋 烨, 等. 响应面分析法优化枸杞多糖的提取工艺[J]. 中国果菜, 2014 (6): 19-23.
[15] 黄才欢, 李 炎, 王秀芬. 茯苓多糖的提取及其结构表征[J]. 现代食品科技, 2001, 17(3): 13-15.
[16] 钟振声, 孙立杰, 冯 焱, 等. 超声波法提取人参多糖的研究[J]. 化学与生物工程, 2006(6): 30-32.
[17] 李利华. 鱼腥草多糖超声波提取工艺研究[J]. 安徽农业科学, 2010, 38(5): 2 571-2 573.
[18] 丁瑞瑞, 令狐娅, 郭春连, 等. 竹荪多糖提取工艺及其对肿瘤抑制作用的研究[J]. 广州化工, 2014(15): 61-63.
[19] 楚红英, 陈志冉, 李 瑜. 火棘中水溶性多糖的提取及测定[J]. 湖北农业科学, 2014(10): 2 408-2 411.
[20] 马荣池, 彭光华, 李春美, 等. 正交实验法优选马尾松花粉多糖的提取工艺[J]. 食品工业科技, 2007(11): 164-166.
[21] 白红进, 汪河滨, 褚志强, 等. 不同方法提取黑果枸杞多糖的研究[J]. 食品工业科技, 2007, 28(3): 145-146.
[22] 査正其, 刘存昌, 郑文超, 等. 草菇多糖的提取工艺及其保湿性能研究[J]. 长江大学学报自然科学版:石油/农学旬刊, 2014 (6): 52-54.
[23] 赵二劳, 李满秀, 梁兴红. 超声提取南瓜多糖的研究[J]. 声学技术, 2008, 27(1): 58-60.
[24] Karacabey E, Mazza G. Optimisation of antioxidant activity of grape cane extracts using response surface methodology[J]. Food Chemistry, 2010, 119(1): 343-348.
[25] 刘海青, 刘银才, 胡文婷. 海巴戟果水溶性多糖的分离纯化及清除自由基活性[J]. 生物加工过程, 2008(3): 44-47.

