尿激酶对慢性青光眼大鼠视神经保护机制研究
谭 可,谭 蕾,王 莹
(湖北医药学院附属十堰市人民医院,湖北 十堰 442000)
尿激酶对慢性青光眼大鼠视神经保护机制研究
谭可,谭蕾,王莹
(湖北医药学院附属十堰市人民医院,湖北 十堰 442000)

[摘要]目的观察尿激酶对慢性青光眼大鼠视网膜神经节细胞凋亡及bcl-2表达的影响,探讨其保护青光眼视神经的作用机制。方法将36只清洁级雄性SD大鼠以随机数字表格法分为正常组、模型组及尿激酶组,每组12只。模型组与尿激酶组大鼠均以标准巩膜静脉烧灼法制作高眼压大鼠模型,使用压平式眼压计(美国TONO-PEN AVVI)测定大鼠的眼压情况,在1周后眼压趋于稳定时,尿激酶组给予尿激酶腹腔注射,模型组与正常组给予等量生理盐水腹腔注射,连续2周。末次注射后第2天取大鼠眼球行视网膜神经节细胞TUNEL凋亡检测及bcl-2免疫组化检测。结果造模成功后,尿激酶组与模型组大鼠的眼压与术前比较均呈中度升高。正常组大鼠未发现TUNEL阳性细胞,模型组大鼠见大量TUNEL阳性细胞,尿激酶组可见少量TUNEL阳性细胞,3组TUNEL阳性细胞表达情况比较差异均有统计学意义(P均<0.05);正常组可见少量bcl-2阳性表达,模型组bcl-2表达明显增强,尿激酶组bcl-2阳性表达增强最为明显,3组bcl-2阳性表达比较差异均有统计学意义(P均<0.05)。结论尿激酶可以抑制视网膜神经节细胞凋亡,从而保护视神经,这一过程可能是通过上调bcl-2表达来表现的。
[关键词]慢性青光眼;视网膜神经节细胞;尿激酶;大鼠
青光眼是一种眼内压力呈现间断性或者持续性升高的眼科疾病,也是目前主要致盲眼病之一,因为其造成的视神经损害是不可逆的[1]。当前治疗青光眼的主要方法是控制眼压,但不能阻止视神经损害的进展,因此在降压治疗青光眼的同时如何保护视神经一直是研究的重点。当前认为筛板区的视神经乳头是青光眼的原发损害点,该损伤会造成视网膜神经节细胞发生慢性进行性凋亡或者发生逆行性变性,因此阻滞视网膜神经节细胞凋亡是目前保护视神经的一个重要靶点[2-3]。尿激酶是最早被应用到临床上的溶栓药物,毒副作用较小,用于青光眼的治疗可以改善患者视力,并减少视网膜神经节细胞的凋亡[4],但具体的机制尚不清楚。笔者观察了尿激酶对慢性青光眼大鼠视网膜神经节细胞凋亡及bcl-2表达的影响,旨在为尿激酶的临床应用提供论证依据。
1实验资料
1.1动物与分组选取健康雄性SD大鼠36只,周龄8~12周,体质量250~300 g,均由本院动物中心提供(动物合格证号:SCXK(鄂)2013-0005),实验前经检查未发现大鼠有眼前节病变,眼底检查正常,屈光间质较为清晰。按照随机数字表格法将36只大鼠分为正常组、高眼压组与尿激酶组,每组12只。
1.2造模正常组不予处理,模型组与尿激酶组大鼠以标准巩膜静脉烧灼法制作高眼压大鼠模型。首先腹腔注射10%的水合氯醛300 mg/kg进行麻醉处理,随后应用爱尔凯因滴眼液点眼,共滴3次,然后顺角膜缘做一放射形的切口,将外侧剪开后在上方球结膜处分离肌肉与筋膜,用已经加热处理过的大头针对颞上、颞下、鼻上象限2条或3条上巩膜静脉进行灼烧,此时可见近端静脉已经充血怒张,术后对结膜囊使用氯化钠盐水冲洗并予以平复球结膜及涂抹红霉素眼膏,随后使用美国TONO-PENAVVI眼压计测定大鼠眼压,若大鼠眼压在22 mmHg(1 mmHg=0.133 kPa)以上,则可认定造模成功。待造模大鼠高眼压持续1周趋于稳定后,尿激酶组给予尿激酶1 IU /只腹腔注射,正常组与模型组则给予等容量生理盐水腹腔注射,均1次/d,共用2周。分别在造模前以及造模后1,2,3周测量3组大鼠的眼压。
1.3视网膜切片的制备末次注射后第2天,腹腔注射10%的水合氯醛300 mg/kg进行麻醉,0.5%爱尔凯因点眼2次,分离眼肌,立即摘除带视神经2 mm的眼球,使用生理盐水冲洗,去除眼球的多余肌肉与结膜,然后将眼球放置于4%多聚甲醛溶液中,常温固定保持2 h,再顺角膜缘使用1 mL针头打2~3个孔,石蜡包埋,同时注入一定量的固定液,保证眼球继续固定24 h,使用锋利的刀片顺视轴方向轻柔地剖开固定好的眼球,剥掉晶状体,用乙醇棉球填塞,并以纱布包裹好,对眼球标本进行梯度脱水处理,所用脱水乙醇的浓度分别为70%,80%,90%和95%,不同浓度的乙醇脱水时间均为1 h,之后使用99%浓度的乙醇脱水处理30 min,二甲苯Ⅰ透明15 min,二甲苯Ⅱ透明10 min,之后浸蜡1 h,最后予60 ℃石蜡包埋处理。
1.4视网膜细胞凋亡状况的观察取制备好的石蜡切片,进行TUNEL染色,光学显微镜下观察视网膜神经节细胞凋亡情况,每张切片随机选取6个视野,分别计数每个视野中阳性着色细胞数,取平均值。
1.5视网膜组织中bcl-2蛋白表达的观察及半定量分析取免疫组化制备好的切片,高倍镜(×400)下读片,观察细胞质与细胞膜染色情况,若染成棕褐色或棕黄色即为阳性表达。使用Motic图像系统对bcl-2免疫组化切片进行图像处理,对阳性染色细胞予以半定量分析,以平均光密度值作为bcl-2蛋白表达水平。

2结果
2.13组造模前后大鼠眼压比较造模前3组大鼠眼压比较差异无统计学意义(P均>0.05)。造模成功后,尿激酶组与模型组大鼠眼压均较造模前明显升高(P均<0.05),但组间比较差异无统计学意义(P>0.05);造模后1周、2周、3周尿激酶组和模型组大鼠眼压与正常组比较均明显升高(P均<0.05),模型组和尿激酶组比较差异无统计学意义(P>0.05)。见表1。
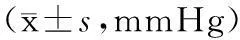
表1 3组造模前后眼压比较
注:①与术前比较,P<0.05;②与正常组比较,P<0.05。
2.23组大鼠视网膜神经节细胞凋亡情况比较TUNEL阳性细胞主要存在于视网膜神经节细胞层中,在内核与外核层很少见。其中正常组大鼠未发现视网膜有TUNEL阳性细胞表达,见图1;模型组大鼠视网膜发现大量TUNEL阳性细胞表达,(8.07±0.90)个/视野,见图2;尿激酶组大鼠视网膜可见少量TUNEL阳性细胞表达,(3.49±1.82)个/视野,见图3。模型组大鼠TUNEL阳性细胞表达量明显高于尿激酶组(P<0.05)。

图1 正常组TUNEL染色表现(×400)

图2 模型组TUNEL染色表现(×400)

图3 尿激酶组TUNEL染色表现(×400)
2.33组大鼠视网膜bcl-2阳性表达情况比较正常组大鼠视网膜bcl-2仅在神经节细胞层有少量的阳性表达,呈现出棕黄色散颗粒状态,其平均光密度值为0.387±0.005, 见图4。模型组大鼠视网膜bcl-2在神经节细胞层上的阳性表达有所增加,bcl-2颜色加深,其平均光密度值为0.399±0.006,见图5。尿激酶组大鼠视网膜bcl-2在神经节细胞层上的阳性表达明显增加,bcl-2除了颜色加深外,还可见大量块状表达,其平均光密度为0.443±0.005,见图6。模型组大鼠bcl-2在神经节细胞层上的阳性表达高于正常组(P<0.05),尿激酶组则显著高于模型组(P<0.05)。

图4 正常组bcl-2阳性表达情况(×400)
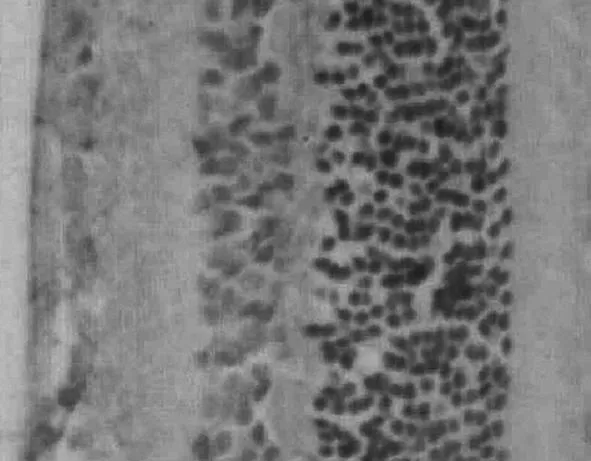
图5 模型组bcl-2阳性表达情况(×400)
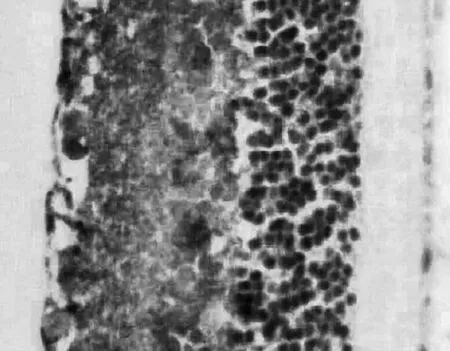
图6 尿激酶组bcl-2阳性表达情况(×400)
3讨论
在对哺乳动物青光眼的研究当中,对于构建青光眼高眼压模型的方法有很多,例如甲基纤维素法、高渗盐水法、透明质酸法、血细胞法、激光诱导法、皮质类固醇法等[5-6]。大量研究表明,青光眼属于一种较为复杂的眼科疾病,因此建模就需要选择最类似人类青光眼发病过程的方法,从而为制作与控制提供更多的方便,用大鼠制造青光眼高眼压模型与其他动物比较具有以下优势:费用小、易于掌握;更为容易改造和繁殖,大鼠的房水外流通道与人类是相同的[7-8]。在本研究中,笔者选择国内外最为常用的建模方法即灼烧巩膜静脉法,这种方法相对简单,操作容易,眼压也有较好地稳定性,且并发症较少,因此是理想的制模方法。
目前对于青光眼神经损伤的具体机制还不够清楚,伴随基础研究的不断深入,发现不管损伤机制是如何形成和发展的,最后都会有一个共同结局即视网膜神经节细胞的凋亡,在不同动物模型以及人类青光眼中都得到了较为充分的证实,可应用TUNEL技术来测定细胞凋亡的情况。本研究发现,正常组大鼠未见TUNEL阳性细胞染色,模型组大鼠有较多的TUNEL阳性细胞表达,尿激酶组中也有少量的表达,模型组大鼠TUNEL阳性细胞明显多于正常组和尿激酶组,这与文献[9-11]研究报道基本一致。
bcl-2蛋白对细胞凋亡的调控有重要作用,其可以与一些细胞凋亡相关细胞结合,影响这些细胞的传导通路最终达到抑制凋亡的目的[12-13]。而诸多研究也证实,通过药物治疗可调节bcl-2蛋白的表达,从而阻止视网膜神经节细胞的凋亡[14]。本研究显示,正常组有少量bcl-2表达,模型组与尿激酶组bcl-2表达均明显增加,且尿激酶组bcl-2表达明显高于模型组,提示尿激酶促进bcl-2表达上调来达到保护视网膜神经的目的。
综上所述,灼烧巩膜静脉法建模稳定,尿激酶的使用可以减少视网膜神经节细胞的凋亡,对视神经有一定的保护作用,同时发现促进bcl-2蛋白表达的上调可能是尿激酶保护慢性青光眼大鼠视神经的机制之一。
[参考文献]
[1]梁静,万新顺. 川芎嗪对慢性高眼压大鼠视网膜神经节细胞凋亡的影响[J]. 眼科新进展,2013,33(8):717-720;728
[2]刘倩,高永峰. 玻璃体腔注射尿激酶对大鼠视网膜血管内皮细胞间occludin蛋白含量的影响[J]. 中华眼底病杂志,2011,27(4):383-388
[3]胡瑛,张丽霞,宿蕾艳,等. 中医疗法防治青光眼视神经损害的临床观察[J]. 中国中医眼科杂志,2012,22(5):340-342
[4]张倩. 尿激酶对慢性青光眼大鼠视网膜神经节细胞的保护作用[D]. 新乡:新乡医学院,2014
[5]Krupin T,Liebmann JM,Greenfield DS,et al. A randomized trial of brimonidine versus timolol in preserving visual function: Results from the low-pressure glaucoma treatment study[J]. Am J Ophthalmol,2011,151(4):671-681
[6]Brandt SK,Weatherly ME,Ware L,et al. Calcium preconditioning triggers neuroprotection irretinal ganglion cells[J]. Neuroscience, 2011,172:387-397
[7]Johnson TV,Bull ND,Martin KR. Neurotrophic factor delivery as a protective treatment for glaucoma[J]. Exp Eye Res, 2011,93(2):196-203
[8]Harper MM,Grozdanic SD,Blits B,et al.Transplantation of BDNF-secreting mesenchymal stem cells provides neuroprotection in chronically hypertensive rat eyes[J]. Invest Ophthalmol Vis Sic,2011,52(7):4506-4515
[9]Sullivan TA,Geisert EE,Hines-BeardJ,et al. Systemic adeno-associated virus-mediated gene therapy preserves retinal ganglion cells and visual function in DBA/2J glaucomatous mice[J]. Hum Gene Ther, 2011,22(10):1-10
[10] Ganapathy PS,White RE,Ha Y,et al. The role of N-methyl-D-aspartate receptor activation in homocysteine-induced death of retinal ganglion cells[J]. Invest Ophthalmol Vis Sic,2011,52(8):5515-5524
[11] Timothy A,Sullivan,Eldon E,et al. Systemic adeno-associated virus-mediated gene therapy preserves retinal ganglion cells and visual function in DBA/2J glaucomatous mice[J]. Hum Gene Ther,2011,22(10):1191-1200
[12] Nagashima M,Fujikawa C,Mawatari K,et al. HSP70,the earliest-induced gene in the zebrash retina during optic nerve regeneration:Its role in cell survival[J]. Neurochem Int,2011,58(8):888-895
[13] Verma P,Pfister JA,Mallick S,et al. HSFI protects neurons through a novel trimerization- and HSP-independent mechanism[J]. Neurosci,2014,34(5):1599-1612
[14] Jung G,Sun J,Petrowitz B,et al. Genetically modified neural stem cells for a local and sustained delivery of neuroprotective factors to the dystrophic mouse retina[J]. Stem Cells Trans Med,2013,2(12):1001-1010
Study on protective mechanism of urokinase on optic nerve in rats with chronic glaucoma
TAN Ke, TAN Lei, WANG Ying
(Shiyan People’s Hospital affiliated to Hubei Medical College, Shiyan 442000, Hubei, China)
Abstract:Objective It is to observe the influence of urokinase on apoptosis of retinal ganglion cells and expression of bcl-2 in rats with chronic glaucoma, and to investigate the mechanism of the protective effect of the optic nerve in glaucoma. Methods Thirty-six SD male rats were selected and randomly divided into normal group, model group and urokinase group with 12 cases in each groups. The rats in model group and the urokinase group were made into high intraocular pressure model by standard scleral vein ablation method, the intraocular pressure in rats were detected by using applanation tonometer. After 1 weeks, as the intraocular pressure tends to be stable, the animals were treated with urokinase injected intraperitoneally in urokinase group, and with normal saline in the model group and normal group, consecutive 2 weeks. On the second day after the last injection, the rat eye were taken for detection of TUNEL apoptosis of retinal ganglion cells and bcl-2 immunohistochemistry. Results After successful modeling, the intraocular pressure (IOP) of rats in the urokinase group and model group showed a moderate increase compared with the preoperative. TUNEL positive cells were not found in normal rats, but a large number of TUNEL positive cells were found in the model group, a small amount of TUNEL positive cells were found in the urokinase group, there were significant differences in the expression of TUNEL positive cells between the 3 groups (all P<0.05). A small amount of bcl-2 positive expression was found in the normal group, and the expression of bcl-2 was significantly increased in the model group, the expression in the urokinase group was the most significant, there were significant differences positive expression of bcl-2 between the 3 groups (all P<0.05). Conclusion Urokinase can inhibit the apoptosis of retinal ganglion cells, so as to protect the optic nerve, this process could be expressed by up regulating bcl-2 expression.
Key words:chronic glaucoma; retinal ganglion cells; urokinase; rat
[收稿日期]2015-11-10
[中图分类号]R-332
[文献标识码]A
[文章编号]1008-8849(2016)15-1626-04
doi:10.3969/j.issn.1008-8849.2016.15.009
[作者简介]谭可,女,主治医师,从事眼视光及青光眼疾病研究。[通信作者]王莹,E-mail:wangying19810214@163.com

