肠复方对裸鼠肠癌微血管密度及血管内皮生长因子的影响
梁 慧,杨 春,曾 伟,尚 姣,谢胜军,李晓萍
( 1. 中南大学湘雅医学院附属肿瘤医院,湖南 长沙 410013;2. 湖南中医药大学,湖南 长沙 410208)
肠复方对裸鼠肠癌微血管密度及血管内皮生长因子的影响
梁慧1,杨春1,曾伟1,尚姣1,谢胜军2,李晓萍2
( 1. 中南大学湘雅医学院附属肿瘤医院,湖南 长沙 410013;2. 湖南中医药大学,湖南 长沙 410208)

[摘要]目的观察肠复方对裸鼠结肠癌原位移植瘤微血管密度(MVD)、血管内皮细胞生长因子(VEGF)的影响,探讨肠复方的抑瘤机制。方法将50只采用HCT116结肠癌细胞成功建立结肠癌移植瘤模型的裸鼠随机分为空白模型组、5-氟尿嘧啶(5-Fu)组和肠复方低、中、高剂量组,分别灌服生理盐水、腹腔注射5-Fu、灌服相应剂量肠复方溶液,共4周。采用SABC免疫方法检测瘤组织中MVD及VEGF的表达情况。结果与空白模型组比较,肠复方高、中、低剂量组及5-Fu组瘤组织中MVD及VEGF表达量均显著降低(P均<0.05),其中肠复方高剂量组表达量最少(P<0.05),肠复方对MVD及VEGF的抑制作用存在量效趋势。结论肠复方能下调VEGF表达,从而减少瘤组织血管生成,这可能是肠复方的抑瘤机制之一。
[关键词]肠复方;大肠癌;血管内皮生长因子;微血管密度;血管生成
血管生成是恶性肿瘤增殖和转移的基础。肿瘤血管生成受肿瘤微环境中促血管生成因子和血管生成抑制因子的动态调控,血管内皮细胞生长因子(VEGF)是已知的血管生成最重要的促进因子[1]。肿瘤代谢的微环境被改变,如缺氧、低血糖、酸性物质堆积等,导致促血管生成因子和血管生成抑制因子的失衡,肿瘤细胞VEGF 表达上调,启动肿瘤血管生成[2]。微血管密度(MVD)是反映肿瘤血管生成的重要指标[3],可直接反映局部组织生成血管能力和局部组织血供的多少。鉴于血管生成是肿瘤增殖和转移的基础, 目前通过调控VEGF的表达进而抗肿瘤血管生成是治疗肿瘤的主要方向[4]。当前大肠癌的治疗方法主要依赖于手术、化疗、放疗以及生物与靶向治疗[5],而中医药在降低大肠癌化疗毒副反应、改善患者临床证候、提高生存质量等方面显示出了一定的优势。肠复方是湖南省肿瘤医院治疗大肠癌的经验方,能明显抑制瘤体生长,延长患者生存期,改善患者生存质量。本实验拟通过观察肠复方对VEGF表达水平和瘤体MVD的影响,寻找肠复方可能的抑瘤机制。
1实验资料
1.1实验细胞人结肠腺癌细胞株HCT-116(编号TCHu99),购自中科院细胞库(上海)。
1.2实验动物BALB/C裸鼠60只,雄性,5~6 周龄,体质量(20±2)g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘) 2011-0003。裸鼠在湖南师范大学医学院动物实验中心SPF条件下饲养并自由饮食,许可证号:SYXK(湘)2014-0006。
1.3实验试剂胎牛血清购自浙江天杭生物科技有限公司;RPMI 1640、PBS青霉素和链霉素混合液、0.25%胰蛋白酶购自Hyclone 公司;DMSO 购自Sigma 公司。SABC免疫组化试剂盒购于北京中杉金桥公司;鼠抗人CD31单克隆抗体和鼠抗人VEGF单克隆抗体购于沈阳万类生物科技有限公司。二氨基联苯胺(DAB)显色液购自北京中杉金桥公司。
1.4实验仪器超净工作台(北京亚泰隆公司),5%CO2培养箱(上海三藤仪器公司),倒置生物显微镜(北京中显恒业仪器仪表有限公司),5702R 型台式低速离心机(德国Eppendorf 公司),MD-U53V 型超低温冰箱(日本SANYO 公司),恒温箱(北京市六一仪器厂),切片机(德国莱卡),IMS 细胞图像分析系统(上海基尔顿生物科技有限公司)。
1.5实验药物中药肠复方所需药材购自湖南省肿瘤医院中药房,由黄芪、党参、白术、薏苡仁、壁虎、土鳖虫、白花蛇舌草等药物组成。取药后每200 g肠复方中药先用清水800 mL浸泡30 min,然后武火煎沸,改文火煎1 h,提取药液,保留药渣再加水400 mL煎煮1 h,提取药液,取2次药液混合,以无菌纱布过滤,浓煎至每毫升含肠复方生药2.6 g/mL,采用人和动物间体表面积折算的等效剂量比值表计算给药剂量,配制2.6,1.3,0.65 g/mL浓度肠复方液,用标示好的消毒玻璃瓶保存,4 ℃ 冰箱冷藏备用。5-氟尿嘧啶注射液(5-Fu)购自上海旭东海普药业有限公司,批号:FA141201,规格:250 mg/支。
1.6实验方法
1.6.1大肠癌细胞悬液制备常规复苏大肠癌HCT-116细胞,将细胞培养于含10%胎牛血清RPMI 1640 培养液中,置于37 ℃、含5%CO2的培养箱内培养并传代, 取对数生长期的细胞,用0.25%胰蛋白酶加0.02% EDTA 的消化液消化收集,使用PBS配制成细胞密度为1×107mL-1的单细胞悬液。
1.6.2瘤源制备取制备好的大肠癌HCT-116 细胞悬液0.1 mL,注射到4只BALB/C 小鼠右腋下,10 d后可长出直径约1 cm 的实体瘤,以此作为瘤源。
1.6.3裸鼠原位移植瘤模型建立先处死皮下瘤源小鼠,皮肤消毒,剥离皮下肿瘤,立即浸入含青霉素、链霉素各100 IU/mL 的生理盐水中,剔除周围结缔组织,取肿瘤中心近边缘处呈鱼肉状的组织,剪碎成1 mm3大小的瘤块备用。将待造模的小鼠分别称质量,5%水合氯醛(40 mg/kg ) 腹腔内注射麻醉后,取仰卧位,固定四肢,碘酒消毒腹部术野,左下腹部切口入腹,显露盲结肠,用4号针头轻轻刮去盲结肠交界处少许浆膜,有血液渗出,随机选取1 粒已制备好的瘤块贴于划破处,轻轻往里推压后于其表面滴1滴OB胶,可见瘤块迅速粘牢(约10 s),观察无活动性出血后将外置肠段回纳入腹,缝合腹壁。待小鼠麻醉清醒后置于清洁级动物房中常规饲养。整个操作过程遵循无菌操作原则。
1.6.4分组及干预按随机数字表法将造模成功的50只裸鼠随机分为空白模型组、5-Fu组和肠复方高、中、低剂量组,每组10 只。造模后第14天开始给药干预:5-Fu组按人腹腔给药剂量500~750 mg折算为1.5 mg/次(约0.1 mL),腹腔注射,每周2次(周一和周四),并予生理盐水0.4 mL灌胃,每天1次,每周5 d;肠复方高、中、低剂量组分别予2.6,1.3,0.65 g/mL浓度肠复方药液0.4 mL灌胃,每天1次,每周5 d,并予生理盐水0.1 mL腹腔注射,每周2次(周一和周四);空白模型组给予生理盐水0.4 mL灌胃,每天1次,每周5 d,并予生理盐水0.1 mL腹腔注射,每周2次(周一和周四)。上述干预均连续4周。
1.6.5标本处理干预4周后停药1 d,以颈椎脱臼法处死小鼠,剖腹剥离移植瘤组织,采用10 %福尔马林溶液固定48 h,乙醇梯度脱水、浸蜡,石蜡包埋,切片,厚度约4 μm。
1.7检测指标
1.7.1MVD免疫组化两步法标记CD31将各组已包埋好的肿瘤组织切片常规脱蜡水化,柠檬酸高温修复抗原。3% H2O2去离子水孵育10 min,以阻断内源性过氧化物酶。磷酸盐缓冲液(PBS)洗2次,每次3 min。滴加鼠抗人CD31单克隆抗体,4 ℃过夜,PBS冲洗,滴加二抗37 ℃孵育20~30 min,PBS 冲洗,DAB显色,苏木精复染,脱水封片。光镜下免疫组化染色呈棕黄色、淡黄色或棕褐色。在低倍镜(×100)下确定3个血管最密集部分,再在高倍镜(×200)下计数每个密集区中 1 个视野的微血管数,以3个区域微血管数的平均数作为MVD,在高倍镜(×400)下拍照。
1.7.2VEGF表达情况采用免疫组化SABC法检测,操作步骤按试剂说明书进行。将各组已包埋好的肿瘤组织切片常规脱蜡水化,柠檬酸高温修复抗原。3%H2O2去离子水孵育 10 min,以阻断内源性过氧化物酶。PBS洗2次,每次3 min,用滤纸吸干PBS液体后滴加5%BSA封闭液,室温20 min,甩去多余液体,不洗。滴加鼠抗人VEGF单克隆抗体,4 ℃过夜,PBS冲洗,滴加二抗37 ℃孵育20~30 min,PBS 冲洗,擦干组织周围的PBS后加上SABC(1∶100稀释),置于37 ℃温箱中20~30 min,PBS洗后行DAB显色,苏木精复染,脱水封片。阳性表达位于细胞质中,呈淡黄色、棕黄色或棕褐色颗粒特异性分布于胞浆,显色较好,非特异性背景染色控制良好。免疫组化结果采用Matern半定量分析方法[6],综合染色强度及染色反应细胞分布范围进行半定量处理。按阳性着色程度评分,无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞所占比例评分,<5%计0分, 5%~10%计1分,11%~50%计2分, 50%~80%计3分,>80%计4分。以两者相加之和为VEGF总分。

2结果
2.1各组瘤体组织中MVD空白模型组瘤体组织内皮细胞中可见多条微血管,肠复方低、中、高剂量组及5-Fu组微血管数明显减少,其中肠复方高剂量组微血管数最少(P均<0.05),肠复方中剂量组与5-Fu组微血管数相当。见图1~5。
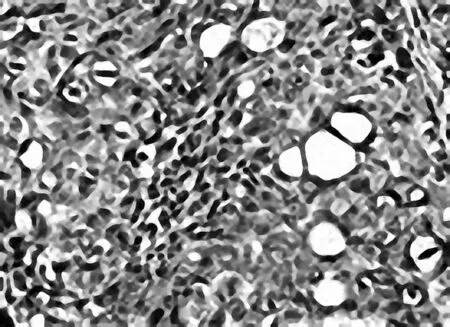
图1 空白模型组瘤组织CD31免疫组化染色表现(DAB,×400)

图2 5-Fu组瘤组织CD31免疫组化染色表现(DAB,×400)

图3 肠复方低剂量组瘤组织CD31免疫组化染色表现(DAB,×400)
2.2各组瘤体组织中VEGF表现情况VEGF主要表达于胞浆中。空白模型组VEGF呈强阳性表达,肠复方低、中、高剂量组及5-Fu组VEGF阳性表达减弱,其中肠复方高剂量组VEGF阳性表达最弱(P均<0.05),肠复方中剂量组与5-Fu组VEGF阳性表达相似。见图6~10。

图4 肠复方中剂量组瘤组织CD31免疫组化染色表现(DAB,×400)

图5 肠复方高剂量组瘤组织CD31免疫组化染色表现(DAB,×400)
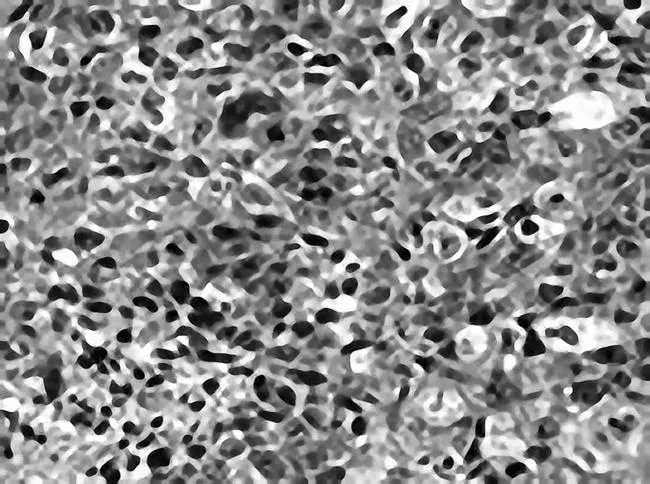
图6 空白模型组瘤组织中VEGF免疫组化染色表现(DAB,×400)

图7 5-Fu组瘤组织中VEGF免疫组化染色表现(DAB,×400)
2.3各组原位移植瘤组织中MVD及VEGF评分比较肠复方低、中、高剂量组及5-Fu组MVD及VEGF评分均明显少于空白模型组(P均<0.05),其中肠复方高剂量组MVD及VEGF评分均明显少于肠复方中、低剂量组和5-Fu组(P均<0.05),肠复方中剂量组与5-Fu组比较差异无统计学意义(P>0.05)。见表1。
3讨论
大肠癌是人类最常见的消化道恶性肿瘤,已被证实肠癌的生长、浸润、转移与肿瘤血管生成密切相关[7],抑制肿瘤血管生成是治疗肠癌的重要策略。MVD是评估肿瘤组织血管形成状态的重要指标,多数恶性实体肿瘤的发生、发展、转移及患者的预后与肿瘤 MVD 密切相关[8]。VEGF是目前发现的作用最强、特异性最高的促血管生成因子[9]。VEGF 与内皮细胞血管生长因子受体结合后促进血管内皮细胞进行有丝分裂,导致内皮细胞的大量增生,从而促进新的血管生成[10]。其中VEGF-A 与其受体VEGFR-2 的特异性结合起了较大的作用,可促进内皮细胞的增殖、迁移、出芽,以及促进血管生长和增加通透性。许多实验证实,肿瘤组织VEGF表达强度与MVD呈正相关[11]。在深入研究肿瘤微环境在肿瘤发生发展中的机制,分析其调控肿瘤生长的关键靶点的基础上,探索中医药是否能够以肿瘤微环境为靶点进行靶向治疗,切断肿瘤与其生长的微环境之间的关系,将会是今后研究的热点[12]。VEGF是肿瘤微环境中重要的药物靶点。为探讨肠复方的抑瘤机制,本研究观察了肠复方对瘤体组织中VEGF和MVD的影响,结果显示:与空白模型组比较,肠复方高、中、低剂量组及5-Fu组瘤体组织中MVD及VEGF表达均显著降低,肠复方对MVD及VEGF抑制作用存在量效趋势,以高剂量组表达最低;肠复方中剂量组对MVD及VEGF的抑制作用与5-Fu组比较差异不明显。提示肠复方可能通过下调VEGF表达,从而减少瘤组织血管生成,这可能是肠复方的抑瘤机制之一。

图8 肠复方低剂量组瘤组织中VEGF免疫组化
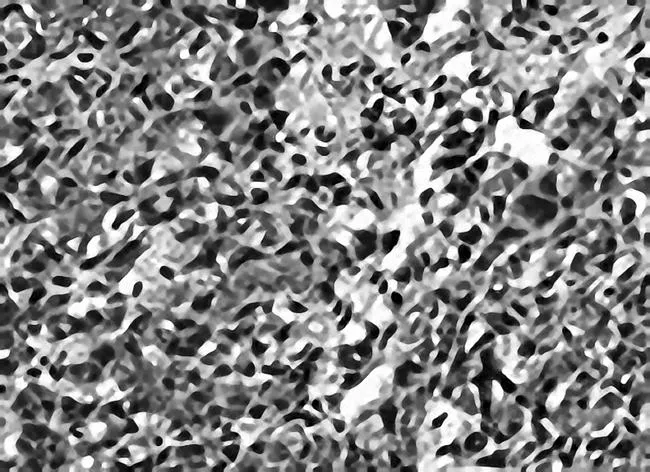
图9 肠复方中剂量组瘤组织中VEGF免疫组化
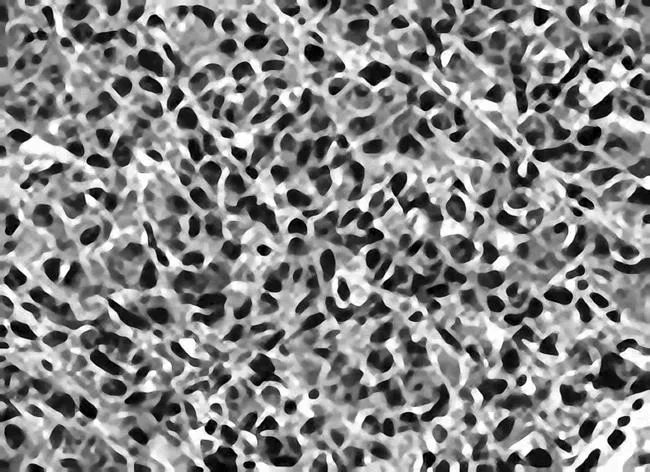
图10 肠复方高剂量组瘤组织中VEGF免疫组化

组别nMVD/条VEGF评分/分空白模型组934.78±2.966.22±0.835-Fu组1026.17±3.75①②4.00±1.15①②肠复方低剂量组929.89±2.95①②5.11±0.78①②肠复方中剂量组1025.23±3.65①②3.90±0.99①②肠复方高剂量组1019.93±3.19①2.00±0.81①
注:①与空白模型组比较,P<0.05;②与肠复方高剂量组比较,P<0.05。
[参考文献]
[1]王静. 血管内皮生长因子与肿瘤关系研究进展[J]. 实用中医药杂志,2012,28(4):337-339
[2]郝希山,魏于全. 肿瘤学[M]. 北京:人民卫生出版社,2014:109-110
[3]涂小煌,王为忠,王烈,等. 微血管密度在直肠癌切除中的意义[J]. 肿瘤防治研究,2008,35(6):422-424
[4]姚依勍,朱惠蓉,张怡,等. 血管内皮生长因子在常见消化系统恶性肿瘤中的表达及中医药治疗研究进展[J]. 河北中医,2014,36(6):943-946
[5]邓珊,胡兵,沈克平. 大肠癌中医病机与治疗研究[J]. 世界科学技术-中医药现代化,2012,14(4):1858-1862
[6]Matern J,Koomagi R,Volm M,et al. Vascular endothelialgrowth factor experssion angiogenesis in non-small cell lungcarcinomas[J]. Int J Oncol,1995,6(5):1059-1062
[7]王炎,刘宣,周利红,等. 丹参酮ⅡA对裸鼠人肠癌血管新生的抑制作用[J]. 中国实验方剂学杂志,2013,19(3):167-171
[8]张宏旭,胡大为. CD44v6、LN、MVD、VEGF 的表达与大肠癌转移及愈后的研究进展[J]. 医学信息,2013,26 (9):633-634
[9]连文,陈转鹏,杨平,等. 直肠癌新辅助化疗前后血清VEGF与VEGFR-2的变化及临床意义[J]. 现代中西医结合杂志,2014,23(3):235-237
[10] 龚晓燕,保永亮,黄金玲. 血管内皮生长因子与肿瘤侵袭转移[J]. 安徽医药,2013,17(1):3-5
[11] 马亚军,钱晓萍,周荣平,等. 参麦注射液对裸鼠皮下移植瘤抗血管生成作用的机理探讨[J]. 山东医药,2011,51(25):26-28
[12] 周航,邓海滨. 中医药调控肿瘤微环境的研究进展[J]. 世界中医药, 2014,11(9):1549-1553
Effect of Intestinal Compound Recipe on vascular endothelial growth factor and microvascular density in nude mice with colorectal orthotopic transplantation tumor
LIANG Hui1, YANG Chun1, ZENG Wei1, SHANG Jiao1, XIE Shengjun2, LI Xiaoping2
(1. Hunan Cancer Hospital, Changsha 410013, Hunan, China; 2. Hunan University of TCM, Changsha 410208, Hunan, China)
Abstract:Objective It is to observe the influence of Intestinal Compound Recipe (ICR) on vascular endothelial growth factor (VEGF) and microvascular density (MVD) of nude mice with colorectal orthotopic transplantation tumor, and investigate its mechanism of inhibited tumor. Methods 50 cases of colon cancer transplantation model of nude mice were successfully established by HCT116 colon cancer cells, and were randomly divided into blank model group, 5-fluorouracil (5-Fu) group, low-, medium-, high-dose ICR groups, and with ten cases in each groups. The animals in these groups were treated with administered gavages of NS, intraperitoneal injection of 5-Fu, and give the corresponding dosage of ICR to fill the stomach respectively for 4-week. The expression of VEGF and MVD in tumor tissues were detected by SABC immunization method. Results Compared with the blank model group, the expression of VEGF and MVD in the low-, medium-, high-dose ICR groups and 5-Fu group were obviously decreased (all P<0.05), the expression in the high-dose ICR group were the least (P<0.05), and the inhibitory effect of ICR on MVD and VEGF has the trend of dose effect. Conclusion ICR can down regulate the expression of VEGF, so as to reduce tumor angiogenesis, this may be one of the mechanisms of the inhibition of the intestinal compound.
Key words:colon cancer; Intestinal Compound Recipe; vascular endothelial growth factor; microvessel density; angiogenesis
[收稿日期]2015-09-15
[中图分类号]R-332
[文献标识码]A
[文章编号]1008-8849(2016)15-1604-04
doi:10.3969/j.issn.1008-8849.2016.15.003
[基金项目]湖南省科技厅科研条件创新专项计划项目(2012TT2034)
[作者简介]梁慧,女,主任医师,博士,研究方向为中西医结合防治恶性肿瘤。

