化痰消瘀方对胃癌前病变大鼠PTEN、FAK及paxillin表达的影响
吴佳慧,刘 皓,郭亚云,魏睦新
(南京医科大学第一附属医院,江苏 南京 210029)
化痰消瘀方对胃癌前病变大鼠PTEN、FAK及paxillin表达的影响
吴佳慧,刘皓,郭亚云,魏睦新
(南京医科大学第一附属医院,江苏 南京 210029)

[摘要]目的观察化痰消瘀方对胃癌前病变大鼠PTEN、FAK及paxillin表达的影响,从分子生物学水平探讨其逆转胃癌前病变的作用机制。方法选择90只4~5周龄SD雄性大鼠,随机取15只作为空白组,其余大鼠均采用N-甲基-N’-硝基N-亚硝基胍综合饥饱失常、浓盐水灌胃的方法制备胃癌前病变大鼠模型。将造模成功大鼠随机分为模型组,中药高、中、低剂量组及维酶素组,每组13只。空白组正常饮食,余均造模成功后,模型组给予生理盐水灌胃,中药高、中、低剂量组分别给予3 mL/kg、2 mL/kg、1 mL/kg化痰消瘀方灌胃,维酶素组给予10 mL/kg维酶素灌胃,均灌胃8周。采用HE染色法观察大鼠胃黏膜病理改变情况,应用免疫组化法检测胃黏膜组织中PTEN、FAK及paxillin的表达情况。结果HE染色显示空白组大鼠胃黏膜无癌前病变改变,模型组均出现不同程度的胃癌前病变改变,中药高、中剂量组和维酶素组胃黏膜癌前病变情况均较模型组明显改善(P均<0.05),且中药高剂量组改善程度高于其他各给药组(P均<0.05)。免疫组化结果显示PTEN在空白组强阳性表达;模型组鲜有表达;中药高、中、低剂量组表达量逐渐降低,但高于模型组(P均<0.05);中药高剂量组PTEN表达量高于其他各给药组(P均<0.05)。FAK、paxillin在空白组极少表达,模型组表达量较空白组显著增加(P均<0.05);中药高、中、低剂量组二者表达量均明显低于模型组(P均<0.05),其中高剂量组表达量明显低于其他各给药组(P均<0.05)。结论中药化痰消瘀方可显著改善胃癌前病变大鼠胃黏膜组织病理学情况,其作用机制可能是激活抑癌基因PTEN,调节 FAK的去磷酸化,通过FAK/Src 信号通路下调paxillin来诱导细胞凋亡。
[关键词]胃癌前病变;化痰消瘀方; PTEN;FAK;paxillin
胃癌是一种全球高发的消化系统恶性肿瘤,《五大洲癌症发病率》第9卷[1]的统计结果显示,中国的胃癌病死率和发病率位于全球前20位,高于全世界平均水平,对人类健康构成严重威胁。我国对早期胃癌的诊断率仅为10%,这主要源于胃癌早期阶段症状缺乏特异性,而中晚期出现明显症状时已错过治疗的最佳时机,从而导致患者生存率不足10%[2]。而大多数早期胃癌都有一个比较漫长的胃癌前期过程,胃癌前期包括胃癌前状态和胃癌前病变(PLGC),前者包括慢性萎缩性胃炎(CAG)、胃腺瘤型息肉、残胃炎、恶性贫血以及慢性胃溃疡;后者指在慢性萎缩性胃炎基础上伴发的不完全型肠上皮化生(IM)和/或中、重度异型增生(Dys)。中医学中并无胃癌前病变的明确概念,而胃癌前病变通常由慢性萎缩性胃炎进一步发展而来,故目前多数学者将胃癌前病变归入中医“胃痞”范畴。胃癌前病变是本虚标实,寒热错杂的病症,病因多为外邪犯胃、饮食伤胃、情志不畅、脾胃素虚;病机关键是脾胃虚弱,痰瘀交阻。魏睦新教授通过大量的临床实践,总结出诊疗胃癌前病变的独特方案,以“化痰活血消瘀法”为核心包括补气健脾治其本,活血祛痰治其标,凝练出了以“二陈汤”为主方加减的化痰消瘀方,随症加减,临床疗效显著,达到化痰活血祛瘀、利水消肿兼以补虚、抗肿瘤、镇痛、促进免疫等作用[3]。本实验目的在于探索化痰消瘀方逆转胃癌前病变的分子作用机制。
1实验资料
1.1实验动物选用4~5周的SD雄性大鼠90只,体质量80~100 g,由南京医科大学实验动物中心提供,动物许可证号:SYXK(苏)2008-0007。
1.2药物化痰消瘀方主要由陈皮12 g、法半夏10 g、猪苓10 g、莪术10 g、紫丹参15 g、炒薏苡仁30 g、白花蛇舌草15 g、半枝莲15 g、仙鹤草15 g等组成,煎煮前将上述中药迅速漂洗,冷水浸泡1 h后,加水没过药材约2 cm,煎煮40 min,过滤药汁后将药渣继续加水煎煮取汁,合并,调节浓度至1 kg/L,-20 ℃保存备用。N-甲基-N’-硝基N-亚硝基胍(N-methyl-N’-nitro-N-nitrosoguanidine, MNNG)5 g,由日本东京化成工业株式会社生产;雷尼替丁0.15 g,江西汇仁药业有限公司生产,国药准字H36021340;维酶素片0.2 g,北海阳光药业有限公司生产,国药准字H45021183。
1.3试剂兔抗人 PTEN、FAK、paxillin单克隆抗体购于 ABcam公司;通用型SP试剂盒、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.4方法大鼠正常饮食适应性喂养1周后,随机选择15只作为空白组,其余大鼠均采用MNNG综合饥饱失常及浓盐水灌胃协同方法造模:配制MNNG浓度为150 μg/mL,避光低温保存,每天造模大鼠自由饮用,以饥饱失常法(每周隔2 d禁食1 d)喂养大鼠0.03%雷尼替丁饲料,同时予15%浓盐水于禁食日灌胃(2 mL/只);同一天空白组予蒸馏水2 mL/只灌胃,正常饮食。分别于第10,16,24周随机抽取2只造模大鼠麻醉取胃,分别从胃窦、胃体处取组织2~3块,中性甲醛溶液固定,乙醇梯度脱水,石蜡包埋,连续4 μm厚度切片,苏木精-伊红(hematoxylin-eosin, HE)染色,中性树胶封片,于实验第24 周在光镜下观察到胃黏膜出现慢性萎缩性胃炎、中重度异型增生、不完全型肠上皮化生,以此确定造模成功。将造模成功后存活大鼠随机分为模型组,中药高、中、低剂量组及维酶素组,每组13只。空白组保持正常饮食;模型组予生理盐水2 mL/只灌胃;中药高、中、低剂量组分别给予化痰消瘀方3 mL/kg、2 mL/kg、1 mL/kg灌胃;维酶素组给予维酶素混悬液10 mL/kg灌胃,均1次/d。灌胃8周后,将全部大鼠麻醉处死取胃组织,按检测造模是否成功方法制备标本。
1.5观察指标
1.5.1一般情况和病理表现观察干预前后各组大鼠精神状态、活动情况、毛色、食欲、粪便及体质量变化。制备好的HE染色标本均由2位病理医师采取双盲法阅片,判断各组大鼠胃癌前病变情况。
1.5.2胃黏膜组织中PTEN、FAK、paxillin表达情况采用免疫组化法检测。配制PTEN一抗工作浓度为1∶300,FAK、paxillin一抗工作浓度均为1∶200,具体实验步骤按照通用型SP试剂盒说明书操作。以PBS代替一抗作为阴性对照,以已知的PTEN、FAK、paxillin胃腺癌组织切片作为阳性对照。结果判读以光镜下细胞质呈棕黄色或棕褐色细颗粒为染色阳性。染色强度评分:无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。每张切片随机选取5个高倍视野,每个视野计数200个细胞,阳性细胞数评分:无阳性细胞为0分;<10%为1分;11%~50%为2分;51%~75%为3分;>75%为4分。根据染色强度和阳性细胞数分别计分,总分为两者之积, 0分计为(-),1~3 分计为(+),4~5 分计为(),≥6 分计为()。

2结果
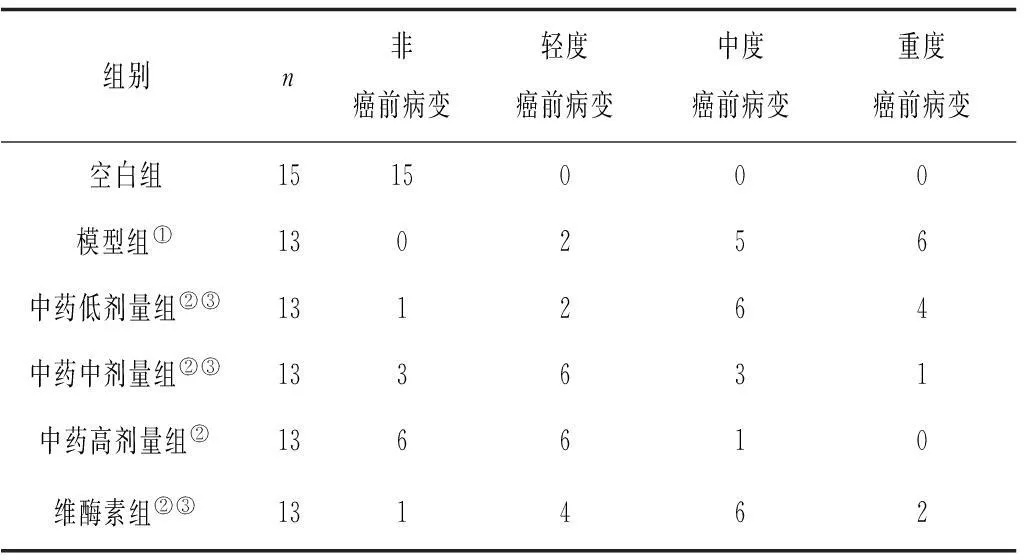
2.1各组大鼠一般情况与空白组大鼠比较,造模大鼠精神差,活动少,被毛枯槁稀疏,食少瘦削,粪便软而不成形。与模型组大鼠相比,各给药组大鼠精神活动可,进食增加,粪便渐而成形,体质量均较模型组显著增加(P均<0.05),其中中药高、中剂量组体质量均明显高于维酶素组(P均<0.05) 。见表1。

表1 各组大鼠干预前后体质量变化情况±s,g)
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05;③与维酶素组比较,P<0.05。
2.2各组大鼠胃黏膜病理表现与空白组相比,模型组胃黏膜充血水肿,有散在的溃疡点,胃窦部黏膜变薄,以白相为主,甚至可见黏膜下血管分布,镜下示大量炎性细胞浸润,固有腺体减少,可见肠上皮腺体,或者不典型增生细胞出现,见图1和图2;与模型组相比,中药高、中剂量组和维酶素组大鼠胃黏膜红润有光泽,黏膜皱襞完整,镜下少见萎缩,少有炎性细胞浸润,偶见腺上皮增生,见图3和图4。各给药组干预后癌前病变得到不同程度的逆转,见表2。
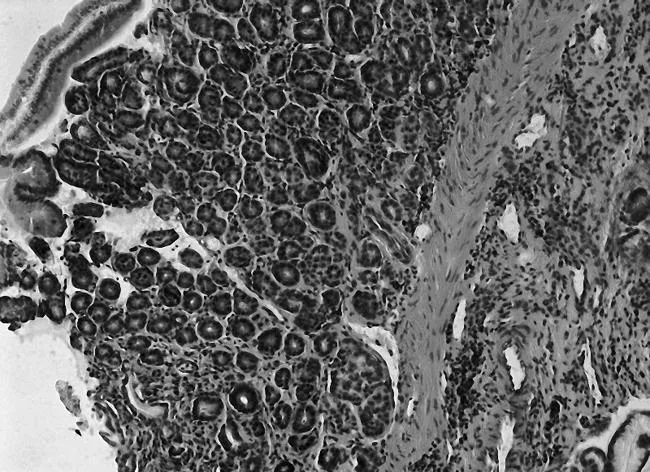
图1 空白组大鼠胃黏膜HE染色表现(×200)
2.3各组胃黏膜组织中PTEN、FAK、paxillin镜下表现空白组PTEN染色深,呈强阳性表达,见图5;模型组鲜有表达,见图6;中药高、中、低剂量组PTEN染色逐渐变浅,阳性表达减少,见图7;维酶素组PTEN染色强度低于中药高剂量组而高于中剂量组,见图8。空白组FAK鲜有表达,免疫组化染色几乎不着色,见图9;模型组FAK强阳性表达,染色呈深棕色,见图10;中药高、中、低剂量组FAK阳性表达增加,免疫组化染色逐渐变深,见图11;维酶素组FAK着色程度介于中药高、中剂量组之间,见图12。空白组paxillin免疫组化染色几乎不着色,见图13;模型组paxillin免疫组化染色呈棕黄色,强阳性表达,见图14;中药高、中、低剂量组paxillin免疫组化染色逐渐变深,阳性细胞数增加,见图15;维酶素组paxillin阳性表达程度介于中药高、中剂量组之间,见图16。
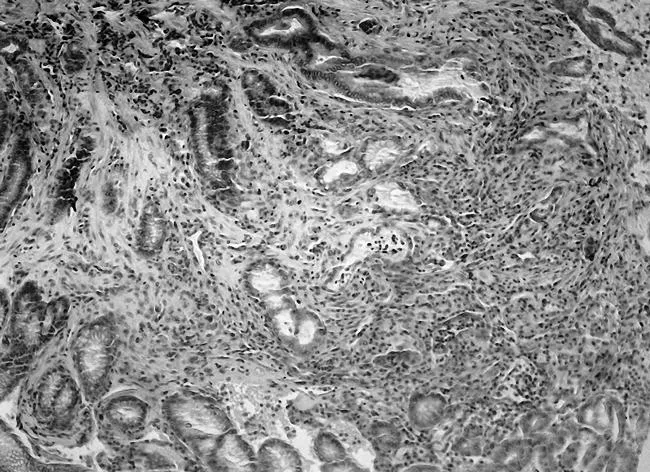
图2 模型组大鼠胃黏膜HE染色表现(×200)
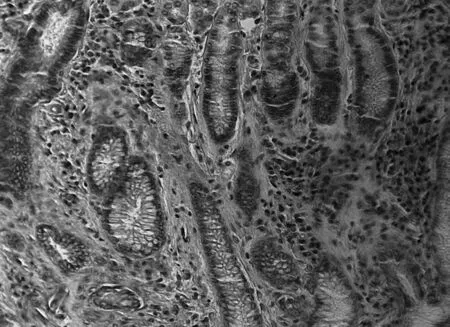
图3 中药高剂量组大鼠胃黏膜HE染色表现(×200)

图4 维酶素组大鼠胃黏膜HE染色表现 (×200)
只
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05;③与中药高剂量组比较,P<0.05。
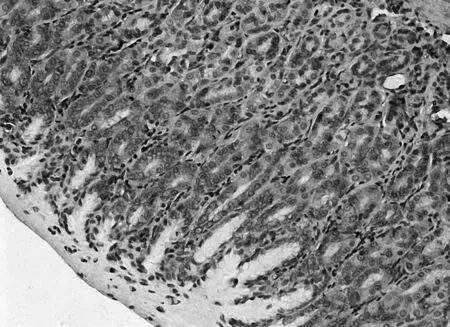
图5 空白组PTEN免疫组化表现(×200)
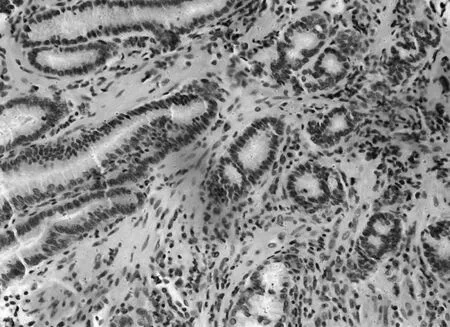
图6 模型组PTEN免疫组化表现(×200)

图7 中药高剂量组PTEN免疫组化表现(×200)
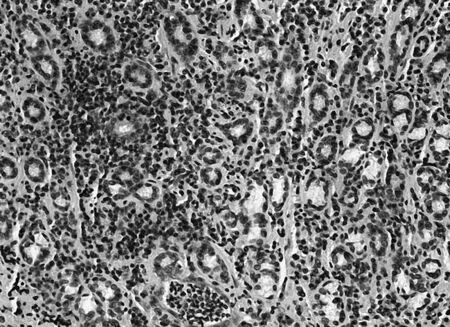
图8 维酶素组PTEN免疫组化表现(×200)
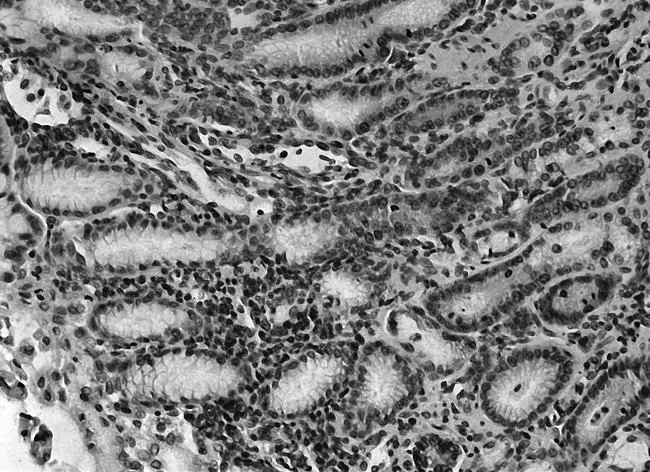
图9空白组FAK免疫组化表现(×200)

图10 模型组FAK免疫组化表现(×200)

图11 中药高剂量组FAK免疫组化表现(×200)
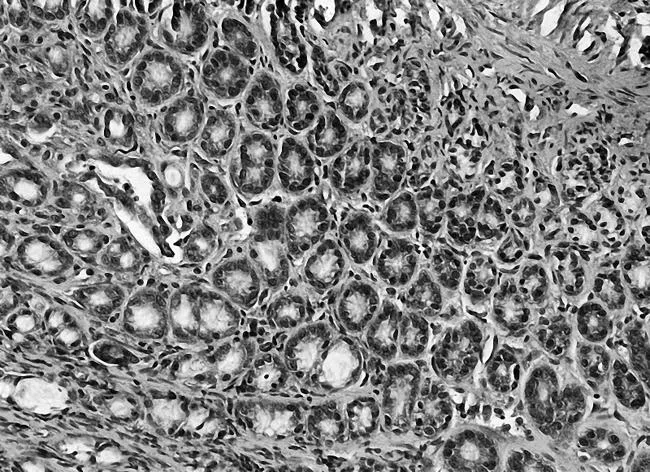
图12 维酶素组FAK免疫组化表现(×200)
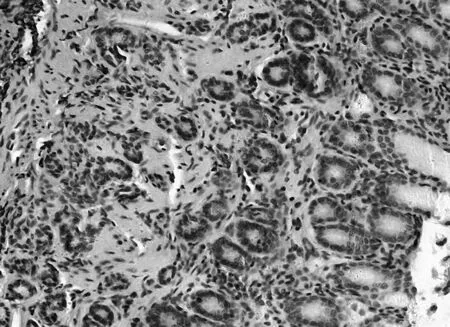
图13 空白组paxillin免疫组化表现(×200)

图14 模型组paxillin免疫组化表现(×200)
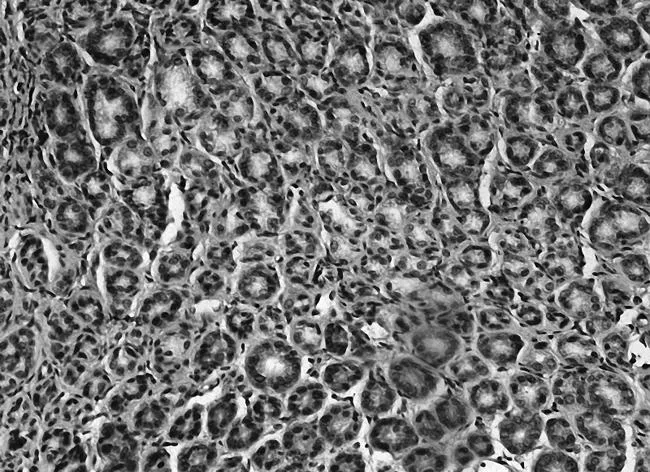
图15 中药高剂量组paxillin免疫组化表现(×200)
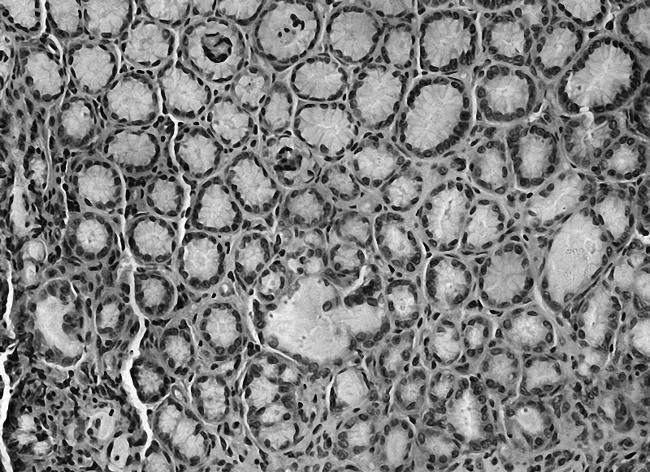
图16 维酶素组paxillin免疫组化表现(×200)
2.4各组胃黏膜组织中PTEN、FAK、paxillin表达情况模型组PTEN表达量明显低于空白组(P<0.05),FAK、paxillin表达量均明显高于空白组(P均<0.05)。中药高、中、低剂量组PTEN表达量表达量逐渐降低,但均高于模型组(P均<0.05);中药高剂量组PTEN表达量高于其他各给药组(P均<0.05)。中药高、中、低剂量组FAK、paxillin表达量均明显低于模型组(P均<0.05),其中中药高剂量组表达量明显低于其他各给药组(P均<0.05)。见表3。

表3 各组胃黏膜组织中PTEN、FAK、paxillin表达情况
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05;③与中药高剂量组比较,P<0.05。
3讨论
现代医学认为由胃癌前病变发展到胃癌是一个多阶段的动态演变过程。早在1975年,Correa等[4]便提出正常胃黏膜历经慢性萎缩性胃炎、中重度异型增生、不完全型肠上皮化生逐步发展到早期胃癌的过程。多数学者认为患者胃黏膜一旦进入胃癌前病变阶段便难以逆转,故现代医学对胃癌的研究焦点聚集在临床中根据胃癌的TNM分期,采取不同的外科手术联合化疗方案综合治疗,主要以缓解症状为主,而对胃癌前病变的防治方法研究甚少。积极探索胃癌前期的防治方法,不仅能有效降低我国胃癌的发病率和死亡率,同时将对全球胃癌的防控做出重大贡献。
中医强调辨病与辨证相结合,在肿瘤的癌前病变时期,中医药发挥治未病的优势,在逆转胃癌前病变方面取得了一定的临床疗效。魏睦新教授指导的课题组近年来在胃癌前病变内在机制研究以及防治策略方面积累了一定的经验,一方面用化痰消瘀方对胃癌前病变患者进行临床治疗,实现了症状改善,病理逆转[5-7];另一方面进行动物实验,证实逆转机制可能与抑制Survivin、Livin表达,促进细胞凋亡[8];上调Caspase-3表达、下调CyclinD1及mTOR表达,调节细胞周期有关[9]。但肿瘤的发生是分子事件,多种基因协同调控细胞内的信号传导通路,调控细胞周期,诱导细胞凋亡,一旦基因表达异常,便会影响细胞的生长发育。
PTEN是第10号染色体上同源缺失性磷酸酶和张力蛋白基因 (Phosphatase and tensin homolog deleted on chromosome ten),定位于人类染色体10q23.3,也称TEP1或MMAC1基因,是使脂类去磷酸化的唯一抑癌基因,在晚期原发性恶性肿瘤中表达多缺失[10]。Bronise 等[11]研究发现通过蛋白磷酸酶的作用,PTEN能使FAK去磷酸化,下调FAK活性,从而达到抑制肿瘤细胞的浸润转移作用。有研究结果显示在癌旁胃黏膜-肠化生-异型增生-胃癌的癌变进展过程中,PTEN的阳性率逐渐降低,且胃癌和异型增生中的阳性率显著低于癌旁胃黏膜和肠化生胃黏膜,提示胃黏膜上皮细胞的恶性转化与PTEN基因的异常遗传学改变相关[12-13]。
FAK是一种非受体酪氨酸激酶,FAK基因定位于人体8q24,生物进化过程高度保守,各物种间的同源性高达90%[14]。Tyr397是FAK自身磷酸化的主要位点[15],与Src家族直接作用。研究发现FAK通过Tyr397活化后,可引起胃癌细胞的增生、迁移和侵袭[16]。诸多研究表明,FAK作为细胞内重要的信号分子,被认为是信号传导的汇聚点,还可以促进细胞的运动和生长,促进细胞失巢凋亡,促使肿瘤细胞的增殖和迁移[17-20]。杨丽敏等[21]研究显示FAK在胃腺癌组织中的表达水平与其分化程度、TNM分期明显相关,且显著高于正常胃黏膜组织。
paxillin基因定位于人类染色体12q24,表达产物是磷酸蛋白,有许多潜在的丝/苏氨酸或络氨酸磷酸化位点,paxillin是黏着斑信号蛋白和细胞黏附分子,其磷酸化是一个动态过程,受同时活化的FAK和Src的共同调控[22]。paxillin分子是介导信号传导的重要位点,源于其含有和多种信号蛋白、结构蛋白结合的结构域,张春宏[23]认为paxillin在正常胃黏膜中表达很少,在慢性胃炎、慢性萎缩性胃炎、中重度异型增生、胃腺癌中的表达呈逐渐增强的趋势。
目前将 PTEN、FAK、paxillin三者一起研究的国内外文献甚少。Herlevsen等[24]和Haier 等[25]研究发现PTEN 与 paxillin有一定的作用关系。Van等[26]进一步研究发现,PTEN调节 FAK 去磷酸化,同时作为 FAK/Src 信号通路下游信号的paxillin被磷酸化激活,因此三者之间的内在关系可能是PTEN通过FAK 而间接调节 paxillin的表达。
本研究结果显示,中药化痰消瘀方能有效改善胃癌前病变大鼠一般状况以及胃黏膜病理情况,在一定程度上逆转胃癌前病变,达到胃癌的二级预防作用。化痰消瘀方可显著上调胃癌前病变大鼠胃黏膜组织中PTEN水平,抑制FAK及 paxillin的表达,且中药高、中剂量组抑制效果优于维酶素组。其作用的分子生物学机制可能为化痰消瘀方激活抑癌基因PTEN,调节 FAK的去磷酸化,通过FAK/Src 信号通路下调paxillin来诱导细胞凋亡。
[参考文献]
[1]Parkin DM,Ferlay J,Curado MP,et al. Fifty years of cancer incidence:CI5 I-IX[J]. Int J Cancer,2010,127(12):2918-2927
[2]郑朝旭,郑荣寿,陈万青. 中国2009年胃癌发病与死亡分析[J]. 中国肿瘤,2013,22(5): 327-332
[3]郭亚云,冷秀梅,魏睦新. 化痰消瘀方用于胃癌癌前病变的疗效观察[J]. 现代中西医结合杂志,2013,22(33):3663-3665
[4]Correa P,Haenszel W,Cuello C,et al. A model for gastric cancer epidemiology[J]. lancet,1975,2(7924):58-60
[5]王平,魏睦新. 胃癌前病变的研究进展及中西医结合防治现状[J]. 中国中西医结合消化杂志,2010,18(5):341-343
[6]范尧夫,魏睦新. 胃癌前病变的研究进展及防治对策[J]. 世界华人消化杂志,2012,20(20):1807-1812
[7]Wu Y,Fan Y,Jiang Y,et al. Analysis of risk factors associated with precancerous lesion of gastric cancer in patients from eastern China: a comparative study[J]. J Cancer Res Ther,2013,9(2): 205-209
[8]冷秀梅,刘皓,冯小可,等. 基于Survivin、Livin凋亡抑制蛋白探讨化痰消瘀方逆转胃癌癌前病变的作用机制[J]. 世界华人消化杂志,2014,22(33):5047-5055
[9]刘皓,王霞,范尧夫,等. 化痰消瘀方对胃癌前病变大鼠Caspase-3、Cyclind1及mTOR表达的影响[J]. 中医学报,2014,29(7):941-944
[10] Zhu XH,Qin X,Fei MG,et al. Combined phosphatase tensin homolog (PTEN) loss and fatty acid synthase(FAS) overexpression worsens the prognosis of Chinese patients with hepatocellular carcinoma[J]. Int J Mol Sci,2012,13(8):9980-9991
[11] Bronise A,Godlewiski J,Wallace JA,et al. Reprogramming of the tumor Microenvironment by stromal PTEN-regulated miR-320[J]. Nat cell Biol,2011,14(2):159-167
[12] 郑华川,陈颖,况立革,等. PTEN编码产物在胃癌发生发展不同阶段中的表达及意义[J]. 中华肿瘤杂志,2003,25(1):13-16
[13] 孙桂彬,杨景国,李永华,等. PTEN、p16和CyclinD1在胃癌及癌前病变中表达的研究[J]. 现代中西医结合杂志,2012,21(15):1614-1616
[14] Mitra SK,Hanson DA,Schlaepfer DD. Focal adhesion kinase: in command and control of cell motility[J]. Nat Rev Mol Cel Biol,2005,6(1):56-68
[15] Hamadi A,Bonuali M,Dontenwill M,et al. Regulation of focal adhesion dynamics and disassembly by phosphorylation of FAK at tyrosine 397[J]. J Cell Sci,2005,118(Pt19):4415-4425
[16] Lai IR,Chu PY,Lin HS,et al. Phosphorylation of focal adhesion kinase at Tyr397 in gastric carcinomas and its clinical significance[J]. Am J Pathol,2010,177(4):1629-1637
[17] Ryu SJ,ChoK A,Oh YS,et al. Role of Src-specific phosphorylation site on focal adhesion kinase for senescence associated apoptosis resistance[J]. Apoptosis,2006,11(3):303-313
[18] Duxbury MS,Ito H,Zinne MJ,et al. Focal adhesion kinase gene silencing promotes anoikis and suppresses metastasis of human pancreatic adenocarcinoma cells[J]. Surgery,2004,135(5):555-562
[19] Mian MF,Kang C,Lee S,et al. Cleavage of focal adhesion kinase is an early marker and modulator of oxidative stress induced apoptosis[J]. Chem Biol Interact,2008,171(1):57-66
[20] Xie P,Kondeti VK,Lin S,et al. Role of extracellular matrix renal tubulo-interstitial nephritis antigen(TINag) in cell survival utilizing integrin(alpha) vbeta3/focal adhesion kinase(FAK)/phosphatidylinositol 3-kinase(PI3K)/protein kinase B-serine/threonine kinase(AKT) signaling pathway[J]. J Biol Chem,2011,286(39):34131-34146
[21] 杨丽敏,王进. Paxillin、FAK 和PTEN在胃腺癌组织中的表达及其临床意义[J]. 胃肠病学,2009,14(12):734-737
[22] Sachdev S,Bu Y,Gelman IH. Paxillin-Y118 phosphorylation contributes to to the control of Src-induced anchorage-independent growth by FAK and adhesion[J]. BMC Cancer,2009,9(1):12
[23] 张春宏. 桩蛋白在胃上皮内瘤变的表达及临床意义[J]. 临床医药实践杂志,2008,17(S3):749-751
[24] Herlevsen M,Oxford G,Ptak C,et al. A novel model to identify interaction partners of the PTEN tumor suppressor gene in human bladder cancer[J]. Biochem Biophys Res Commun,2007,352(2):549-555
[25] Haier J,Nicolson GL. PTEN regulates tumor cell adhesion of coloncarcinoma cells under dynamic conditions of fluid flow[J]. Oncogene,2002,21(9):1450-1460
[26] Van Slambrouck S,Jenkins AR,Romero AE,et al. Reorganization of the integrin alpha2 subunit controls cell adhesion and cancer cell invasion in prostate cancer[J]. Int J Oncol,2009,34(6):1717-1726
Effects of Huatan Xiaoyu decoction on expressions of PTEN, FAK and paxillin in rats with precancerous lesions of gastric cancer
WU Jiahui, LIU Hao, GUO Yayun, WEI Muxin
(The First Affiliated Hospital with Nanjing Medical University, Nanjing 210029, Jiangsu, China)
Abstract:Objective It is to observe the influence of Huatan Xiaoyu decoction (HTXYD) on expressions of PTEN, FAK and paxillin in rats with precancerous lesions of gastric cancer (PLGC), and explore the mechanism of reversing the precancerous lesions of gastric cancer from the level of molecular biology. Methods Ninety male SD rats of 4 to 5-week-old were randomly divided into blank group, model group, high dose Chinese medicine group, medium dose Chinese medicine group, low dose Chinese medicine group, and Vitacoenzyme group. Except for blank group, all the other groups mainly used N-methyl-N’-nitro-N-nitrosoguanidine (MNNG), irregular diet and emotional stimuli to establish PLGC rat models. After successful modeling, the animals in the model group were given normal saline, and different dose HTXYD and Vitacoenzyme in the corresponding treat groups. 8 weeks later, the pathological changes of gastric mucosa was observed by HE staining, and the expressions of PTEN, FAK and paxillin was detected by immunohistochemistry. Results HE staining showed that there was no precancerous lesion in the gastric mucosa of the rats in the blank group, but had different degree of precancerous lesion of gastric cancer in the model group. Compared with the model group, the gastric mucosal precancerous lesion of the high does and the middle dose Chinese medicine group and the Vitacoenzyme group were significantly improved (all P<0.05); and the improvement of the high dose Chinese medicine group was better than that of the other treatment groups (all P<0.05). The immunohistochemistry results showed that PTEN was strongly expressed in the blank group; there was little expression in model group; the expressions of the high does, the medium does and the low dose Chinese medicine group were gradually decreased, but were significantly higher than that of the model group (all P<0.05), and the expression of PTEN in the high dose group was significantly higher than that in the other treatment groups (all P<0.05). Paxillin, FAK was very little expression in the blank group, but the expressions in the model group were significantly increased than that in the blank group (all P<0.05); their expression levels in the high does, the medium does and the low does Chinese medicine group were significantly lower than those in the model group (all P<0.05), and which in the high dose Chinese medicine group was significantly lower than that in the other treatment groups (all P<0.05). Conclusion HTXYD can significantly improve the pathological conditions of gastric mucosa to reverse the PLGC rats, the possible mechanism is to activate tumor suppressor gene PTEN, to regulate the dephosphorylation of FAK, and to down-regulate the paxillin through FAK/Src signaling pathway in aim to induce apoptosis.
Key words:precancerous lesions of gastric cancer; Huatan Xiaoyu decoction; PTEN; FAK; paxillin
[收稿日期]2015-12-15
[中图分类号]R-332
[文献标识码]A
[文章编号]1008-8849(2016)15-1611-06
doi:10.3969/j.issn.1008-8849.2016.15.005
[基金项目]江苏省中医药局科技基金资助项目(YB2015163);江苏省中医药管理局基金资助项目(JD11040)
[作者简介]吴佳慧,女,硕士研究生,主要从事中西医结合治疗消化病的基础和临床研究。[通信作者]魏睦新,E-mail: weimuxin@njmu.edu.cn

