炎性细胞因子对人肾小管上皮细胞C3a受体表达的调控
张志诚 赵文紧 刘志红 郑敬民
炎性细胞因子对人肾小管上皮细胞C3a受体表达的调控
张志诚 赵文紧 刘志红 郑敬民
目的:为更好了解肾脏组织中C3aR表达调控因素,我们研究了多种炎性细胞因子对人肾小管上皮细胞(HK2细胞)C3a受体(C3aR)表达的调控作用。 方法:用多种炎性细胞因子[干扰素γ(IFN-γ)、C3a、白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)、转化生长因子β(TGF-β)]刺激HK2细胞,利用荧光定量PCR、免疫组化及免疫印迹的方法检测HK2细胞C3aR表达水平。 结果:炎性细胞因子IFN-γ能够显著促进HK2细胞C3aR的表达上调[与正常对照组相比,C3aR mRNA表达水平的约增长5倍(P=0.001),蛋白水平表达上调大约1.6倍(P=0.046)],且HK2细胞C3aR mRNA水平表达上调与IFN-γ呈剂量及时间依赖关系;而其他的炎性细胞因子如TNF-α、TGF-β、IL-1β甚至生物活性多肽C3a均未观察到对HK2细胞C3aR表达造成影响。 结论:肾小管上皮细胞表面可表达生物活性肽段C3aR,而且炎症细胞因子IFN-γ能够明显增强肾小管上皮细胞C3aR表达,预示C3a/C3aR轴可能参与了肾脏局部炎症反应的调节并且与肾脏疾病的发生、发展有一定的相关性。
炎症细胞因子 干扰素γ 肾小管上皮细胞 C3a受体
C3a受体(C3aR)是补体C3裂解产物C3a特异性结合的G蛋白偶联受体,该受体最先发现在骨髓源性的骨髓及淋巴细胞上表达,包括单核巨噬细胞、中性粒细胞、树突状细胞、嗜酸/碱性粒细胞及肥大细胞等;近来研究发现,在脑、肺、心、肝脏、软骨以及肾脏等器官组织细胞中均能检出C3aR的表达[1]。在三种途径的补体活化过程中,C3被C3转化酶裂解为C3a和C3b,C3b进一步参与补体活化的级联反应,最终形成膜攻击复合物(C5b-9),而C3a则通过激活C3aR,可趋化并激活外周血白细胞,促使白细胞脱颗粒和分泌多种炎性介质,在机体炎症反应和免疫应答过程中发挥着重要作用[1-2];而白细胞分泌的多种炎性细胞因子又对不同组织细胞中C3aR的表达起着调控作用[3-5]。如在软骨细胞中,肿瘤坏死因子α(TNF-α)能显著增加C3aR 的mRNA表达水平[3];TNF-α和C3a则可介导肌腱组织细胞C3aR表达上调[4];树突状细胞在细菌脂多糖(LPS)、干扰素(IFN-α、IFN-γ)、或前列腺素E2的刺激下,均能使其C3aR的表达显著上调[5];白细胞介素1(IL-1)促进单核巨噬细胞表达C3aR[6]等。在肾脏中虽然仍有一定的争论[7],有关C3aR在肾小管上皮细胞中的表达也有报道[8],但确切的生理机制仍不清楚。既往我们发现在糖尿病肾病(DN)患者肾组织中C3aR表达上调[9],但其上调的机制未知,有研究表明,DN患者肾组织中炎性细胞因子浓度增高[10]。我们认为炎性因子可能促进肾组织C3aR的表达,为了更好地了解肾脏组织中C3aR表达调控因素,我们研究了多种炎性细胞因子[IFN-γ、C3a、IL-1β、TNF-α、转化生长因子β1(TGF-β1)]对人肾小管上皮细胞(HK2细胞)C3aR表达调控作用。
材料与方法
材料和试剂 HK2细胞购于美国美国模式培养物保藏所(ATCC),DMEM/F12培养基、胎牛血清(Gibco 美国),TRIZOL试剂(Invitrogen 美国),逆转录试剂盒、荧光定量PCR试剂盒(Takara 日本),C3aR、18S RNA引物(金维智生物科技有限公司),抗人C3aR抗体(Santa Cruz 美国),GAPDH单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG(Bioworld 中国),重组人TNF-α、IFN-γ、TGF-β1(R&D system 美国);重组人IL-1β(SIGMA 美国);重组人活性C3a多肽(Merck 美国);HRP标记的二抗及显色试剂盒(珠海市泉晖企业有限公司),细胞裂解液、ECL显影剂(碧云天),PVDF膜。
实验方法和步骤
HK2细胞的培养及分组 HK2细胞以含10%胎牛血清的DMEM/F12培养基培养。将HK2细胞以1×105/孔的密度接种于12孔板中,放入37℃、5%CO2细胞孵育箱进行培养,待孔内细胞密度长至80%融合时换成含0.1%胎牛血清的DMEM/F12培养基同步化12~18h。根据相关文献,浓度梯度组中各个炎症细胞因子组分别如下:IFN-γ(10 ng/ml、50 ng/ml、100 ng/ml)、TGF-β1(1 ng/ml、5 ng/ml、10 ng/ml)、TNF-α(1 ng/ml、10 ng/ml、50 ng/ml)、IL-1β(1 ng/ml、10 ng/ml、50 ng/ml)、C3a(0.1 μg/ml、1 μg/ml、10 μg/ml)以及IL-1β+TNF-α(1 ng/ml、10 ng/ml、50 ng/ml),刺激时间24h;在时间梯度刺激组中,各炎症细胞因子浓度为:IFN-γ(100 ng/ml)、TGF-β1(10 ng/ml)、TNF-α(10 ng/ml)、IL-1β(10 ng/ml)、C3a(1 μg/ml)及IL-1β+TNF-α(各10 ng/ml),时间分组为6h、12h、24h及48h组。每组每个观察指标设3个重复。
细胞爬片的制作 将对数生长期的细胞接种于盖玻片上,置于37℃、5%CO2细胞孵箱中培养,待长至60%~70%融合时换成含0.1%胎牛血清的DMEM/F12培养基同步化12~18h后,细胞爬片随机分为正常对照组及IFN-γ刺激组(100 ng/ml),刺激24h后进行固定,置-20℃冰箱保存备用。
HK2细胞蛋白提取 将对数生长期的细胞接种于六孔细胞培养板中,放入37℃、5%CO2细胞孵育箱进行培养,待细胞密度长至80%融合时换成含0.1%胎牛血清的DMEM/F12培养基同步化12~18h,细胞随机分为正常对照组及IFN-γ刺激组(10 ng/ml、50 ng/ml、100 ng/ml),每组每个观察指标设3个重复,24h后提取HK2细胞蛋白,置-80℃冰箱备用。
细胞总RNA的提取和荧光定量PCR分析 细胞总RNA的提取采用TRIZOL试剂;cDNA合成按试剂盒说明进行。荧光定量PCR按试剂盒说明书进行,以18S RNA为内参于ABI公司的7900型荧光定量PCR仪上进行。PCR扩增条件是95℃ 1 min,然后进行如下40循环:95℃ 15s,60℃ 30s。所用引物序列见表1。
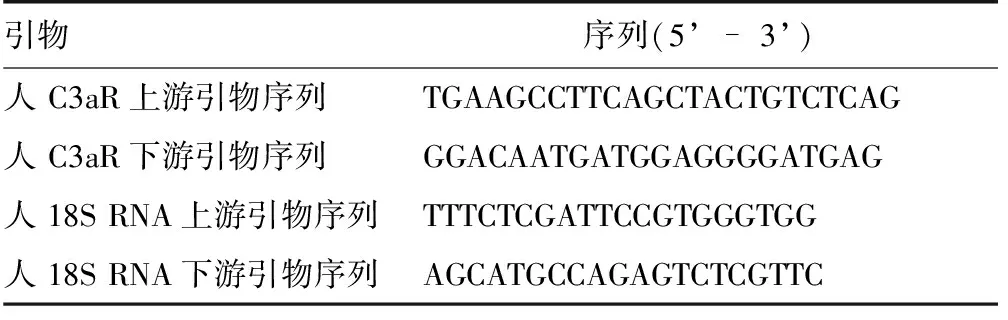
表1 荧光定量PCR分析引物序列
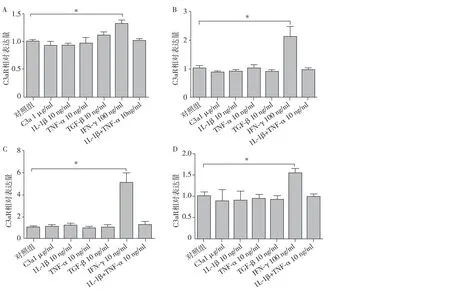
图1 炎症细胞因子通过不同时间的刺激对HK2细胞C3aR mRNA表达调控IL-1β:白细胞介素1β;TNF-α:肿瘤坏死因子α;TGF-β:转化生长因子β;IFN-γ:干扰素γ;A:各种炎症细胞因子刺激6h组; B:各种炎症细胞因子刺激12h组;C:各种炎症细胞因子刺激24h组;D:各种炎症细胞因子刺激48h组;*:与对照组相比,P<0.05
免疫组化染色 从冰箱中取出细胞爬片升至室温并风干, PBS润洗一遍,透膜5 min,用3%H2O2PBS溶液孵育10 min灭活内源性过氧化物酶,再用3% BSA 封闭30 min,以抗人C3aR抗体室温孵育2h(阴性对照组用等体积3%BSA封闭液代替),PBS洗3遍(5 min/遍)后,滴加HRP标记的二抗孵育20 min,PBS洗3遍(5 min/遍)后,底物显色,最后以苏木素复染10 min,脱水、透明、封片并放于显微镜下观察。
Western Blot蛋白免疫印迹 用BCA法测定蛋白样品浓度,加入蛋白上样缓冲液煮沸,蛋白上样每孔20 μg,电泳分离,转膜,5%BSA室温封闭,TBST洗膜,一抗(C3aR 1∶ 3 000、GAPDH1∶ 10 000)4℃摇床孵育过夜,TBST洗膜,HRP标记的二抗(1∶ 10 000)室温孵育1~1.5h,TBST洗膜,ECL显色液曝光,采用Western印迹自动成像仪扫描并获得显影图像,其结果用Image J进行定量分析。
统计学处理 采用SPSS 21.0 软件进行统计分析。组间两两比较采用独立样本t检验,定量数据以均数±标准差表示;定性指标以百分比表示,组间比较采用Χ2检验。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
IFN-γ促进HK2细胞C3aR mRNA表达 各种炎症细胞因子通过不同时间的刺激对HK2细胞C3aR mRNA表达调控分析。在IFN-γ浓度为100 ng/ml条件下,刺激6h、12h、24h及48h组中HK2细胞中C3aR mRNA表达较正常对照组均明显升高(P均<0.05),其中在24h之内,HK2细胞C3aR mRNA相对表达量随着时间的增加而升高,在24h组HK2细胞C3aR mRNA表达上调最明显[(5.08±1.545)vs(1.00±0.231),P=0.011],然而长时间的培育刺激(48h)则使C3aR mRNA相对表达量与24h组相比有所下降[(1.53±0.192)vs(1.00±0.170),P=0.022],而其余炎症细胞因子的4个时间组中HK2细胞C3aR mRNA表达水平与正常对照组先比未见明显增高(图1)。表示各种炎症细胞因子在同一刺激时间下(24h)不同浓度对HK2细胞C3aR mRNA 表达调控分析,研究发现,低浓度到高浓度(10 ng/ml~100 ng/ml)IFN-γ均能显著上调HK2细胞中C3aR mRNA表达(P均<0.05),且C3aR mRNA表达水平随着IFN-γ浓度增高而增加,其中在IFN-γ浓度为100 ng/ml组中HK2细胞C3aR mRNA表达水平最高[(5.15±0.708)vs(1.00±0.202),P=0.001],其余炎症细胞因子低浓度到高浓度组中HK2细胞C3aR mRNA表达水平与正常对照组相比未见明显增高。HK2细胞C3aR mRNA表达结果显示IFN-γ能够明显促进HK2细胞中C3aR mRNA表达,且在一定的范围内HK2细胞C3aR mRNA表达水平随着IFN-γ刺激浓度或刺激时间的增加而上调(图2)。
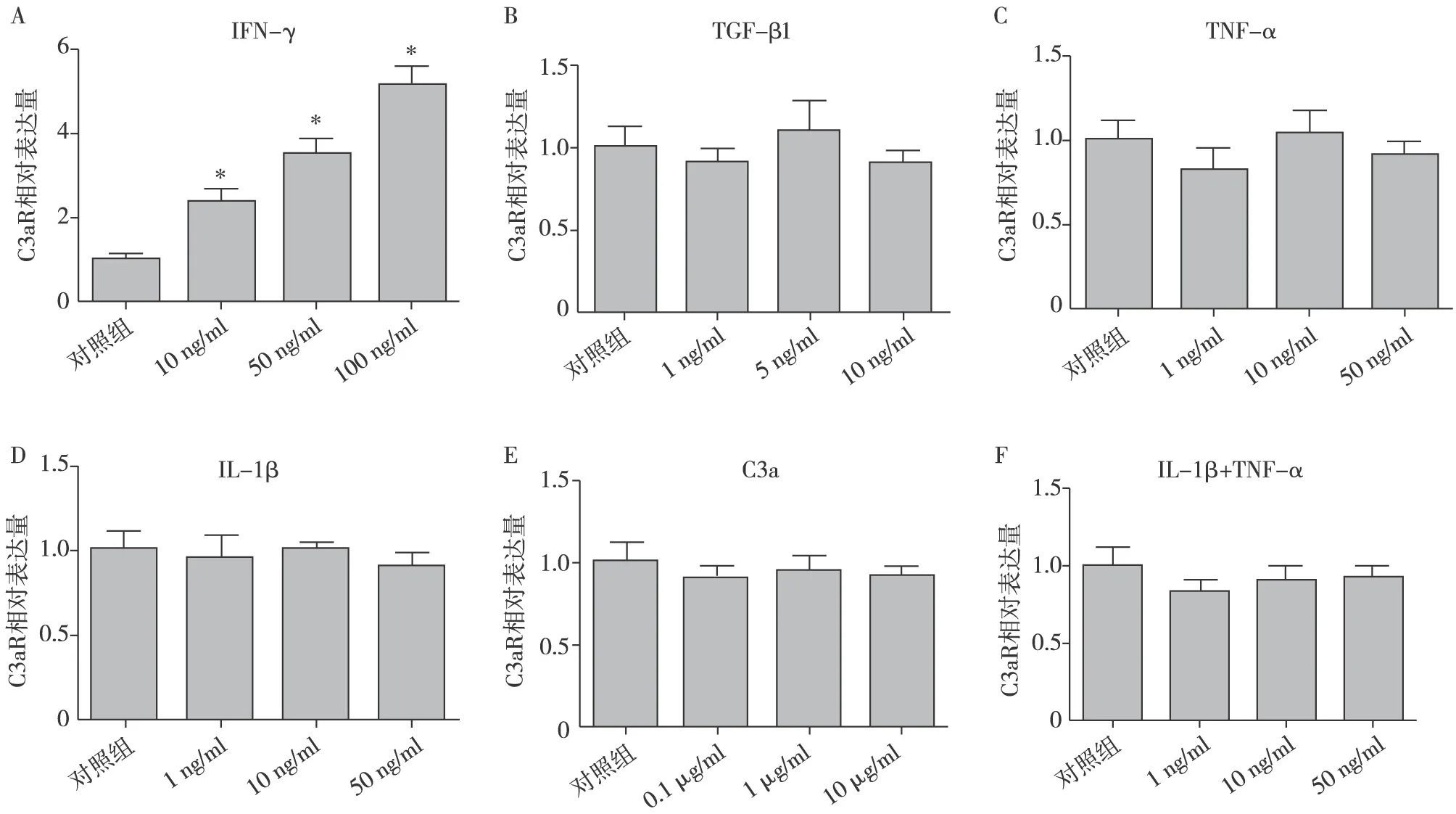
图2 不同浓度炎症细胞因子刺激对HK2细胞C3aR mRNA表达调控IL-1β:白细胞介素1β;TNF-α:肿瘤坏死因子α;TGF-β:转化生长因子β;IFN-γ:干扰素γ;A:IFN-γ浓度组(10 ng/ml、50 ng/ml、100 ng/ml); B:TGF-β1浓度组(1 ng/ml、5 ng/ml、10 ng/ml);C:TNF-α浓度组(1 ng/ml、10 ng/ml、50 ng/ml);D:为IL-1β浓度组(1 ng/ml、10 ng/ml、50 ng/ml);E:C3a浓度组(0.1 μg/ml、1 μg/ml、10 μg/ml);F:IL-1β+TNF-α浓度组(1 ng/ml、10 ng/ml、50 ng/ml);*:与对照组相比,P<0.05
干扰素γ促进HK2细胞C3aR蛋白表达 为了进一步探究IFN-γ 对HK2细胞中C3aR 蛋白水平表达调控,我们利用细胞免疫组化的方法对IFN-γ 组的HK2细胞及正常对照组细胞进行染色。基于染色结果显示(图3),与正常对照的HK2细胞相比, IFN-γ组HK2细胞中针对C3aR免疫染色明显增高;而且Western Blot检测结果显示,HK2细胞C3aR蛋白表达上调与IFN-γ成剂量依赖关系;且与对照组相比,在IFN-γ 100 ng/ml浓度组中HK2细胞C3aR蛋白表达上调明显(约增加1.6倍,P=0.046)(图4),说明IFN-γ能够明显增强HK2细胞中C3aR 蛋白水平表达。

图3 IFN-γ组HK2细胞中针对C3aR免疫染色明显增强 (IH,×200)A:阴性对照;B:HK2对照细胞(未用IFN-γ刺激);C:经IFN-γ 100 ng/ml刺激24h后的HK2细胞

图4 不同浓度干扰素γ(IFN-γ)刺激对HK2细胞C3aR蛋白表达调控
讨 论
补体系统主要经过经典途径、旁路途径和甘露糖结合凝集素途径而被激活,再经过一系列级联反应生成C3a[8]。作为一种促炎性介质,C3a通过与表达在各种细胞细胞膜上的特异性受体(C3aR)结合来发挥不同的生物学作用[11]。如在内毒素休克中,C3a对机体而言起着保护性作用,Kildsgaard等[12]研究发现,在小鼠盲肠结扎穿刺的脓毒症模型中,C3aR-/-小鼠的死亡率明显高于野生型小鼠;而在关节炎大鼠模型中,C3a则会加重大鼠的炎性反应,Hawlisch等[13]发现C3aR-/-小鼠能够减轻由卵清蛋白引起的气道高反应性及早期的支气管收缩,证明C3aR的过量表达会促进哮喘的疾病进展。因此,C3aR作为一个重要的G蛋白偶联受体家族成员,其在非免疫细胞中的功能非常值得研究。
一些研究显示在不同种疾病中能观察到C3aR的表达异常。如脑膜炎患者其C3aR过表达于反应性星型胶质细胞、小胶质细胞及浸润于脑组织中的巨噬细胞和中性粒细胞上,相反,在正常的脑组织切片中未检出C3aR的表达; Benoist等[14]则发现在过敏性皮肤炎或者过敏性接触性皮炎患者中,其CD4+和CD8+T细胞中能够检出C3aR的表达,而其他亚型的T细胞则无该受体的表达。而在前期研究中,我们发现C3aR在DN肾小管上皮细胞中高表达并于DN的病理进程具有一定的相关性[9,15],但具体机制尚不明确。为了更好地了解DN患者肾脏组织中C3aR表达调控因素,本实验研究了多种炎性细胞因子对HK2细胞C3aR表达的调控作用。多种炎症细胞因子刺激HK2细胞后,利用荧光定量PCR、免疫组化及Western Blot的方法来检测HK2细胞C3aR表达变化,结果显示IFN-γ能够显著的促进HK2细胞C3aR的表达上调,且HK2细胞C3aR的表达上调与IFN-γ成剂量及时间依赖关系;而其他的炎性细胞因子如:TNF-α、TGF-β1、IL-1β及C3a均未观察到对HK2细胞C3aR表达影响。
DN是一种进展性的肾脏疾病,是糖尿病常见的并发症,能增加糖尿病患者的死亡率[16]。既往认为代谢及血流动力学因素是DN肾脏损害主要原因[17],然而近几年的研究显示,炎性反应在DN的发生发展过程中发挥重要作用。有文献报道DN患者肾组织能够检测到巨噬细胞的浸润[18],Wu等[19]研究也证明Th1细胞的激活及其活化引起的细胞免疫反应介导DN患者肾组织损害。作为一种重要的炎性细胞因子,IFN-γ属于干扰素家族中一员,主要由Th1细胞、巨噬细胞等炎症细胞分泌,在机体的炎性反应中发挥重要的作用[20-21]。本研究发现,IFN-γ能够明显增强HK2细胞C3aR表达,我们推测,DN患者肾脏组织免疫细胞(T细胞、巨噬细胞)的浸润和激活促进肾小管上皮细胞C3aR的表达上调,也预示着C3a/C3aR轴在DN中参与了肾脏局部的炎症反应的调节,并与DN的发生、发展有一定的相关性。另外,有文献报道在肾小管细胞上可以检测到高表达的IFN-γ特异性受体[22],Gerritsma等[23]研究也证明IFN-γ能够激活肾小管上皮细胞,促进小管上皮细胞分泌补体系统成分(补体C2、C4、H因子等)和趋化因子[IL-8、单核细胞趋化蛋白1(MCP-1)]。我们推测HK2细胞IFN-γ受体激活而使自身活化可能参与其C3aR表达的上调,然而,IFN-γ增强HK2细胞C3aR表达的具体机制仍不清楚,需要我们进一步研究探索。
1 Mueller-Ortiz SL,Morales JE,Wetsel RA.The receptor for the complement C3a anaphylatoxin (C3aR) provides host protection against Listeria monocytogenes-induced apoptosis.J Immunol,2014,193(3):1278-1289.
2 Niebuhr M,Bäumer W,Kietzmann M,et al.Participation of complement 3a receptor (C3aR) in the sensitization phase of Th2 mediated allergic contact dermatitis.Exp Dermatol,2012,21(1):52-56.
3 Schulze-Tanzil G,Kohl B,El Sayed K,et al.Anaphylatoxin receptors and complement regulatory proteins in human articular and non-articular chondrocytes:interrelation with cytokines.Cell Tissue Res,2012,350(3):465-475.
4 Busch C,Girke G,Kohl B,et al.Complement gene expression is regulated by pro-inflammatory cytokines and the anaphylatoxin C3a in human tenocytes.Mol Immunol,2013,53(4):363-373.
5 Li K,Fazekasova H,Wang N, et al.Expression of complement components,receptors and regulators by human dendritic cells.Mol Immunol,2011,48(9-10):1121-1127.
6 Takabayashi T,Shimizu S,Clark BD,et al.Interleukin-1 upregulates anaphylatoxin receptors on mononuclear cells.Surgery,2004,135(5):544-554.
7 Tschernig T,Kiafard Z,Dibbert C, et al.Use of monoclonal antibodies to assess expression of anaphylatoxin receptors in rat and murine models of lung inflammation.Exp Toxicol Pathol,2007,58(6):419-425.
8 Danobeitia JS,Djamali A,Fernandez LA.The role of complement in the pathogenesis of renal ischemia-reperfusion injury and fibrosis.Fibrogenesis Tissue Repair,2014,7:16.
9 郑敬民,朱小东,张明超,等.高表达C3aR的肥大细胞在糖尿病肾病患者肾组织中的分布及病理意义分析.生物化学与生物物理进展,2011,38(3):262-268.
10 Navarro-González JF,Mora-Fernández C,Muros de Fuentes M,et al.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy.Nat Rev Nephrol,2011,7(6):327-340.
11 Schaefer M,Konrad S,Thalmann J,et al.The transcription factors AP-1 and Ets are regulators of C3a receptor expression.J Biol Chem,2005,280(51):42113-42123.
12 Kildsgaard J,Hollmann TJ,Matthews KW,et al.Cutting edge targeted disruption of the C3a receptor gene demonstrates a novel protective anti-inflammatory role for C3a in endotoxin-shock.J Immunol,2000,165(10):5406-5409.
13 Hawlisch H,Wills-Karp M,Karp CL,et al.The anaphylatoxins bridge innate and adaptive immune responses in allergic asthma.Mol Immunol,2004,41(2-3):123-131.
14 Benoist C,Mathis D.Mast cells in autoimmune disease.Nature,2002,420(6917):875-878.
15 郑敬民,朱小东,张明超,等.过敏毒素受体(C3aR)在db/db糖尿病肾病小鼠肾脏中的表达及病理意义分析.生物化学与生物物理进展,2010(8):847-854.
16 Caramori ML,Mauer M.Diabetes and nephropathy.Curr Opin Nephrol Hypertens,2003,12(3):273-282.
17 Gross JL,de Azevedo MJ,Silveiro SP,et al.Diabetic nephropathy:diagnosis,prevention,and treatment.Diabetes Care,2005,28(1):164-176.
18 Prodjosudjadi W,Gerritsma JS,van Es LA,et al.Monocyte chemoattractant protein-1 in normal and diseased human kidneys:an immunohistochemical analysis.Clin Nephrol,1995,44(3):148-155.
19 Wu CC,Chen JS,Lu KC,et al.Aberrant cytokines/chemokines production correlate with proteinuria in patients with overt diabetic nephropathy.Clin Chim Acta,2010,411(9-10):700-704.
20 Hertzog P,Forster S,Samarajiwa S.Systems biology of interferon responses.J Interferon Cytokine Res,2011,31(1):5-11.
21 Pollard KM,Cauvi DM,Toomey CB,et al.Interferon-γ and systemic autoimmunity.Discov Med,2013,16(87):123-131.
22 Farrar MA,Schreiber RD.The molecular cell biology of interferon-gamma and its receptor.Annu Rev Immunol,1993,11:571-611.
23 Gerritsma JS,Gerritsen AF,De Ley M,et al.Interferon-gamma induces biosynthesis of complement components C2,C4 and factor H by human proximal tubular epithelial cells.Cytokine,1997,9(4):276-283.
(本文编辑 青 松)
Inflammatory cytokines regulate the expression of receptors for complement C3a on human renal tubular epithelial cells
ZHANGZhicheng,ZHAOWenjin,LIUZhihong,ZHENGJingmin
NationalClinicalResearchCenterofKidneyDiseases,JinglingHospital,SouthernMedicalUniversity,Nanjing210016,China
ZHENGJingmin(E-mail:zhengjingmin@yahoo.com);LIUZhihong(E-mail:liuzhihong@nju.edu.cn)
Objective:In previous work,we found that the increased expression of C3aR in renal tissue from patients with diabetic nephropathy,but the mechanism by which factor induces C3aR expression increased is not fully understood. Here,in order to better understand the regulatory factors for expression of C3aR in renal tissues,we studied the regulation of expression for C3a receptors in human renal tubular epithelial cells (HK2 cells) by multiple inflammatory cytokines. Methodology:Multiple inflammatory cytokines(IFN-γ、C3a、IL-1β、TNF-α、TGF-β) were used to be co-cultivation with HK2 cells. Levels of messengers and protein for the C3a receptor (C3aR) in HK2 cells were shown by fluorescence quantitative-polymerase chain reaction、immunochemical staining and Western blot. Results:We discovered that inflammatory cytokine interferon-gamma (IFN-γ) can significantly promote the expression of C3aR in HK2 cells (Compared with control group,C3aR mRNA expression levels increase about 5 times,P=0.001<0.05,protein levels were up-regulated approximately 1.6-fold,P=0.046<0.05) and the up-regulation of C3aR on mRNA levels was dose- and time-dependent for it. However,other cytokines such as: TNF-α、TGF-β1、IL-1β and even biologically active polypeptide C3a were not observed visible impact on the expression of C3aR in HK2 cells. Conclusion:This present study not only proved tubular epithelial cell surface expressed C3a receptor (C3aR),but also proved that inflammatory cytokine interferon-γ could significantly enhance the expression of C3aR in HK2 cells,indicating that the C3a/C3aR axis may be involved in the regulation of renal local inflammatory reaction. It also suggested that C3a/C3aR axis was a certain degree of correlation with the occurrence and development of diabetic kidney disease.
inflammatory cytokines interferon-gamma renal tubular epithelial cells C3a receptor
10.3969/cndt.j.issn.1006-298X.2016.02.007
国家自然科学基金项目(81370828)
南方医科大学金陵医院(南京军区南京总医院)肾脏科 硕士研究生(张志诚),国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
郑敬民(E-mail:zhengjingmin@yahoo.com);刘志红(E-mail:liuzhihong@nju.edu.cn)
2016-02-17
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有

