慢性肾脏病患者血清人附睾蛋白4与疾病进展的关系
杨晓霞 柏 明 刘丽敏 张 磊 张玉明 孙世仁
慢性肾脏病患者血清人附睾蛋白4与疾病进展的关系
杨晓霞1柏 明1刘丽敏2张 磊1张玉明1孙世仁1
目的:探讨人附睾蛋白4(HE4)在慢性肾脏病(CKD)患者血清中的表达水平及其与CKD进展的关系。 方法:前瞻性收集了112例CKD患者的临床资料及血清标本,用酶联免疫吸附(ELISA)法对血清HE4水平进行检测。 结果:CKD组血清HE4明显高于正常对照组[(82.42±46.29) pmol/Lvs(29.85±15.18) pmol/L,P<0.001]。CKD各分期之间血清HE4的表达水平有显著差异(P<0.01),但在各病因之间血清HE4水平差异无统计学意义(P>0.05)。HE4表达水平与估算的肾小球滤过率(eGFR)呈负相关(r=-0.712,P<0.001),与患者年龄、肌酐、尿素氮、胱抑素C及肾间质纤维化的比例呈正相关(r=0.377,r=0.476,r=0.561,r=0.612,r=0.487,P<0.01)。生存曲线分析表明循环中较高水平的HE4与较低的肾脏存活率相关。多因素分析可知,血清HE4水平为CKD独立的预后因子(HR=1.032,P=0.001)。 结论:血清中高表达的HE4与CKD患者的肾脏不良预后相关,表明HE4可能是CKD进展的一个血清生物学标志物。
慢性肾脏病 人附睾蛋白4 血清 预后
慢性肾脏病(CKD)起病隐匿,发病率高,知晓率低,已成为一个全球性的公共健康问题[1-2]。各种原因引起的CKD,随着病程的进展最终都会引起胶原蛋白和细胞外基质的过多集聚,导致肾脏纤维化,尤其是肾间质纤维化[3-4]。血清肌酐水平、肾小球滤过率及蛋白尿水平是临床中常用的对CKD进展监测及反映疾病严重性的指标[5-6],然而这些指标并不足够敏感可以早期反映疾病进展的迹象[5]。尽管很多研究已经表明Snail蛋白、结缔组织生长因子、α平滑肌动蛋白可作为肾脏纤维化及疾病进展的生物学标志[7-9],然而要用于临床实践还需要大量的研究数据支持[10]。因此,积极寻找早期、无创、灵敏的血清生物学指标对CKD进展监测、治疗及预后仍然有着极其重要的作用。
人附睾蛋白4(HE4)蛋白为WAP-4-二硫化物核心结构域2(WAP four-disul-fide coredomains-2,WFDC2)基因编码的产物,其分子量约为25 kD,WFDC2是乳清酸性蛋白(WAP)的结构域蛋白质家族的一员[11]。HE4是一种蛋白酶抑制剂,通过其重复的4-二硫化物核心结构域或WAP基序发挥自然免疫作用,并在生长和分化中发挥重要作用[12]。近年研究表明,在纤维化的肾脏组织中HE4表达上调,可编码丝氨酸蛋白激酶抑制剂,在不同的小鼠肾脏病模型中注入HE4中和抗体,可抑制肾脏纤维化,延缓CKD的进展[13]。然而,HE4在CKD患者循环中的水平及其与疾病进展的关系并不清楚。本研究用ELISA法检测CKD患者血清中HE4的表达水平,探讨其能否作为CKD进展及预后的血清生物学标志物。
对象和方法
研究对象 选取2011年1月~2012年1月在第四军医大学第一附属医院肾脏内科病房就诊的CKD患者。诊断符合K/DOQI指南[14]规定,有下面一项异常即能诊断CKD:(1)肾脏损伤(血、尿成分异常、或影像学检查异常、或病理学检查异常) ≥3个月,有或无估算的肾小球滤过率(eGFR)异常;(2) eGFR<60 ml/(min·1.73m2)≥3 个月,有或无肾脏损伤证据。
纳入标准:符合CKD的诊断标准并且经活检病理证实肾脏有纤维化改变(肾小管间质纤维组织增生≥5%标本总面积)。排除标准:(1)合并严重感染或者严重的免疫功能缺陷;(2)伴严重的心脑血管疾病;(3)合并恶性肿瘤。符合入组条件者共112例,作为CKD组。选取同期体检的健康人60例作为对照组,对照组肾功能正常[eGFR>90 ml/(min·1.73m2)],均无高血压、糖尿病、心脑血管等疾病。
方法 所有对象均清晨空腹静脉采血3 ml,以3 000 r/min离心20 min后分离血清样本于冻存管中,-80 ℃保存待检。采用ELISA法检测血清HE4含量,检测试剂盒由北京诚林生物科技有限公司提供,具体操作严格按说明书进行。eGFR的计算采用CKD流行病学合作研究(CKD-EPI)公式[15]。
随访 临床对本组所有患者进行电话随访或者门诊随访,随访时间为5~48个月。随访终点为肾功能下降:eGFR下降≥基线值的30%或者患者进入终末期肾病阶段(需要透析或肾移植等替代治疗)。所有患者随访至2015年5月,如果随访期间患者失访或者死亡,则采用末次随访所记录的信息。
统计学处理 采用SPSS 17.0软件进行统计学分析,计量资料用均数±标准差表示,两组间比较采用t检验,样本均数多组间的比较采用方差分析(ANOVA)。Spearman法分析其浓度与临床肾功能指标及组织学参数的相关性。Kapla-Meier(KM)法生存曲线评估了肾脏的长期存活率,曲线间的差异用Log-rank分析。COX比例风险回归模型用来评估独立预后因素。以α=0.05为检验水准,以P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
一般临床情况 CKD组112例,平均年龄(43.2±16.8)岁。其中IgA肾病46例,特发性膜性肾病18例,狼疮性肾炎14例,过敏性紫癜性肾炎6例,其他28例(淀粉样变性5例、糖尿病肾病5例、乙型肝炎相关性肾炎5例、IgM肾病4例、ANCA相关性系统性血管炎性肾损害5例、结缔组织病肾损伤4例)。根据K/DOQI指南[16]将CKD分为5期,其中CKD 1~2期共62例,CKD 3期32例,CKD 4~5期共18例。对照组60例,平均年龄(38.0±9.4)岁。两组在年龄及性别方面差异无统计学意义。
两组受检者血清HE4水平的比较 CKD患者组血清HE4水平为(82.4±46.3) pmol/L,显著高于正常对照组(29.9±15.2) pmol/L,差异有统计学意义(P<0.001)(图1A)。
不同临床病理类型CKD患者血清HE4水平比较 IgA肾病、膜性肾病、狼疮性肾炎、紫癜性肾炎的血清HE4水平分别为(85.1±55.5) pmol/L、(79.2±32.2) pmol/L、(113.2±46.0) pmol/L、(79.4±44.6) pmol/L,显著高于健康人(29.9±15.2) pmol/L,但是各种病理类型之间并无统计学差异(表1)。

表1 血清HE4的表达水平与CKD不同病理类型的关系
*:淀粉样变性肾病、糖尿病肾病、乙型肝炎相关性肾炎、IgM肾病等
不同临床分期CKD患者血清HE4水平比较 不同分期的CKD患者随着病情的进展,血清HE4水平升高,CKD 1~2期、3期及4~5期的血清HE4水平分别为(56.6±24.3) pmol/L、(91.1±36.1) pmol/L及(155.8±36.0) pmol/L。3期及4~5期的血清HE4水平明显高于1~2期,差异有统计学意义(图1B)。
血清HE4水平与CKD患者临床肾功指标的相关性 为了说明HE4参与或者在CKD进展中发挥作用,我们对其在血清中的表达水平与临床肾功指标进行相关性分析。结果表明,HE4的表达水平与eGFR呈明显的负相关(图2A),与年龄、血清肌酐、尿素氮、胱抑素C呈正相关(r=0.377,P=0.004;r=0.476,P<0.000;r=0.487,P<0.001;r=0.612,P<0.001,图2B,C)。但是,HE4的表达水平与血压及尿蛋白定量间并无明显的相关性(表2)。
血清HE4浓度与肾小管间质纤维化的关系 CKD患者血清HE4浓度与肾小管间质纤维化的比例呈正相关(r=0.514,P<0.01),差异有统计学意义(图2D)。

图1 A:CKD患者及健康对照组血清HE4浓度;B:CKD各期血清HE4浓度及其与健康对照组的比较CKD:慢性肾脏病;HE4:人附睾蛋白4;**:P<0.01;***:P<0.001

图2 CKD患者血清HE4浓度与eGFR(A)、SCr(B)、BUN(C)、TIF(D)的相关性CKD:慢性肾脏病;HE4:人附睾蛋白4;eGFR:估算的肾小球滤过率;SCr:血清肌酐;BUN:血清尿素氮;TIF:肾小管间质纤维化

表2 HE4的表达水平与临床参数及肾功指标的相关性
HE4:人附睾蛋白4;eGFR:估算的肾小球滤过率;a数据为均值±标准差或者是中位数和四分位间距
血清HE4浓度与CKD患者预后的关系 在对本组112例患者平均42个月的随访期中,28例(25%)患者到达终点事件。将CKD患者按照HE4的平均值分为两组,血清HE4水平≥82.42 pmol/L组24例(21%)患者到达终点事件,而HE4水平<82.42 pmol/L组4例(4%)患者到达终点事件(P<0.001)。将血清HE4水平作为一个分类变量进行COX单变量分析,结果表明在血清HE4水平≥82.42 pmol/L组到达终点事件的风险明显高于HE4水平<82.42 pmol/L组(HR=7.33,95%CI:1.64~32.83,P=0.002)。生存曲线分析表明血清HE4水平≥82.42 pmol/L组肾脏存活率明显低于HE4水平<82.42 pmol/L组(P<0.001,图3)。多因素分析进一步得知,血清HE4水平为CKD独立的预后因子(HR=1.032,95%CI:1.01~1.05,P=0.001)。为了评估HE4对CKD进展的预测价值,我们做了预后ROC曲线分析并与eGFR进行比较(图4),在48个月时,HE4曲线下面积(AUC)为0.835,对CKD的进展有一定的预测价值。
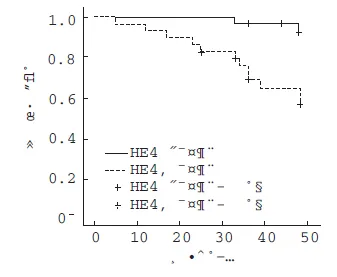
图3 不同血清HE4水平患者的肾脏存活率曲线
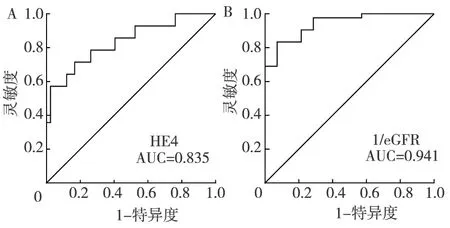
图4 ROC曲线预测CKD患者预后的效能HE4:人附睾蛋白4;eGFR:估算的肾小球滤过率;CKD:慢性肾脏病;A:HE4,AUC=0.835,P<0.001;B:eGFR,AUC=0.941,P<0.001
讨 论
本研究主要表明CKD患者循环中HE4水平随着肾功能的下降逐渐上升,与eGFR呈明显的负相关。此外,我们也发现血清中较高水平的HE4对CKD的长期预后有一定的预测价值,表明HE4可能是CKD进展的一个新的血清生物学标志物。
HE4最早发现于人类附睾上皮,随后发现在多种癌组织中高度表达,如卵巢癌[17]、肺癌[18]、子宫内膜癌[19]等,被作为肿瘤的一个血清生物学标记。近年来,研究发现在犬及小鼠的肾脏纤维化模型中HE4的表达显著上调[20-21]。LeBleu等[13]研究发现在CKD患者肾组织中HE4的表达主要在肌成纤维细胞,HE4作为肌成纤维细胞的衍生物介导了肾脏纤维化。尽管如此,HE4在CKD患者血清中的表达水平及与疾病进展的关系依然不清楚。
本研究发现,HE4在各种病理类型的CKD患者血清中的表达水平都显著高于健康对照组(P<0.01)。随着病情的进展及肾功能的减退,HE4的表达水平进一步升高。CKD 4~5期患者血清HE4的水平明显高于CKD 1~2期,其表达水平与eGFR呈明显的负相关,这与Bunnag等[22]研究结果一致。Bunnag等[22]研究发现在肾脏移植组织中,HE4表达水平上调,其转录水平与较低水平的eGFR相关。此外,Escudero等[23]研究发现,在没有恶性疾病的患者中,肾功能减退是HE4异常表达最常见的原因,我们的数据也发现血清HE4浓度与肾小管间质纤维化的比例呈正相关,与肾功指标血清肌酐、尿素氮、胱抑素C也有明显的相关性,这些结果提示HE4的表达水平可能与CKD的进展相关。但是,其表达水平与24h尿蛋白定量间并未发现明显的相关性,这可能提示与肾小球相比,HE4对肾小管间质的影响更大。综上,CKD患者血清中HE4水平升高与CKD的进展及肾功能的恶化密切相关。
HE4在循环中的水平与CKD的肾脏预后也明显相关。我们的研究表明与低于均值水平的HE4组患者相比,高表达HE4组患者进入终末期肾病的风险更大。此外,在多因素分析中调整了各种临床变量后,较高水平的HE4与CKD的不良预后相关。这些发现与之前的结果均表明,随着CKD的进展,HE4的表达水平逐渐上升,且对CKD的预后有一定的预测价值。
CKD进展的终末期结果是肾脏纤维化,主要特征包括肾小球硬化和肾小管间质纤维化。无论基础疾病如何,CKD一旦进展,肾脏的正常组织结构逐步被Ⅰ型胶原蛋白和其他的一些细胞外基质蛋白所取代[3,24]。Ⅰ型胶原蛋白的沉积会导致肾实质结构和功能的改变,最终引起肾衰竭。目前已有许多研究表明,肌成纤维细胞产生的Ⅰ型胶原蛋白形成瘢痕是肾脏纤维化的一个发病机制[25-26]。LeBleu等[13]研究发现在来自肾间质纤维化组织中的肾间质肌成纤维细胞中,HE4被确定为α平滑肌动蛋白的一个下游靶点,同时也证实了在单侧输尿管梗阻的小鼠模型中,HE4在肌成纤维细胞中强烈表达。本研究发现,在各种病理类型的CKD患者血清中,HE4表达水平明显上调,且与肾间质纤维化的比例也呈明显的正相关,表明高表达的HE4是肾脏纤维化一个共同的下游信号通路。其可能机制是在纤维化的肾脏组织中,肾间质肌纤维细胞中HE4大量表达,血清中分泌型HE4表达水平增加,升高的HE4基因可编码丝氨酸蛋白激酶抑制剂,抑制多种蛋白激酶的活性(包括丝氨酸蛋白酶和金属基质蛋白酶),并且特异性地抑制了它们降解胶原蛋白Ⅰ的能力,加速了Ⅰ型胶原蛋白在肾脏的沉积,引起CKD的进展,最终加速了肾脏纤维化。给单侧输尿管梗阻的小鼠注射HE4中和性抗体,与未注射抗体组比较,肾间质纤维化程度明显减轻,在5/6肾切除的大鼠及肾毒血清性肾炎模型中也发现了同样的现象[13]。这些结果提示,动态监测患者血清HE4水平可帮助判断CKD患者病情的进展及预后。
总之,血清生物学标志物检测因其无创、客观、简便的优势在疾病诊治过程中起到很好的辅助作用。本研究发现随着CKD进展及肾功能的恶化,循环中HE4的表达水平升高且对CKD的肾脏预后有一定的预测作用,表明HE4可作为CKD进展及预后的又一潜在血清生物学标记物。由于本研究中样本量相对较少,故研究结果有待于更大规模的临床研究进一步验证,确定合适的HE4参考区间及不同临床分期CKD患者血清中HE4的浓度范围。
1 Bello AK,Nwankwo E,El Nahas AM.Prevention of chronic kidney disease:a global challenge.Kidney Int Suppl,2005,(98):S11-17.
2 Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey.Lancet,2012,379(9818):815-822.
3 Zeisberg M,Neilson EG.Mechanisms of tubulointerstitial fibrosis.J Am SocNephrol,2010,21(11):1819-1834.
4 Boor P,Ostendorf T,Floege J.Renal fibrosis:novel insights into mechanisms and therapeutic targets.Nat Rev Nephrol,2010,6(11):643-656.
5 Fassett RG,Venuthurupalli SK,Gobe GC,et al.Biomarkers in chronic kidney disease:a review.Kidney Int,2011,80(8):806-821.
6 Stevens LA,Schmid CH,Greene T,et al.Factors other than glomerular filtration rate affect serum cystatin C levels.Kidney Int,2009,75(6):652-660.
7 Shanahan CM,Weissberg PL,Metcalfe JC.Isolation of gene markers of differentiated and proliferating vascular smooth muscle cells.Circ Res,1993,73(1):193-204.
8 Imai T,Horiuchi A,Wang C,et al.Hypoxia attenuates the expression of E-cadherin via up-regulation of SNAIL in ovarian carcinoma cells.Am J Pathol,2003,163(4):1437-1447.
9 Krishnamachary B,Zagzag D,Nagasawa H,et al.Hypoxia-inducible factor-1-dependent repression of E-cadherin in von Hippel-Lindau tumor suppressor-null renal cell carcinoma mediated by TCF3,ZFHX1A,and ZFHX1B.Cancer Res,2006,66(5):2725-2731.
10 Wong MG,Pollock CA.Biomarkers in kidney fibrosis:are they useful? Kidney IntSuppl (2011),2014,4(1):79-83.
11 Kirchhoff C.Molecular characterization of epididymal proteins.Rev Reprod,1998,3(2):86-95.
12 Ranganathan S,Simpson KJ,Shaw DC,et al.The whey acidic protein family:a new signature motif and three-dimensional structure by comparative modeling.J Mol Graph Model,1999,17(2):106-113,134-136.
13 LeBleu VS,Teng Y,O′Connell JT,et al.Identification of human epididymis protein-4 as a fibroblast-derived mediator of fibrosis.Nat Med,2013,19(2):227-231.
14 National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification.Am J Kidney Dis,2002,39(2 Suppl 1):S1-266.
15 Levey AS,Stevens LA,Schmid CH,et al.A new equation to estimate glomerular filtration rate.Ann Intern Med,2009,150(9):604-612.
16 Stevens PE,Levin A.Evaluation and management of chronic kidney disease:synopsis of the kidney disease:improving global outcomes 2012 clinical practice guideline.Ann Intern Med,2013,158(11):825-830.
17 Lawicki S,Będkowska GE,Gacuta-Szumarska E,et al.The plasma concentration of VEGF,HE4 and CA125 as a new biomarkers panel in different stages and sub-types of epithelial ovarian tumors.J Ovarian Res,2013,6(1):45.
18 Jiang Y,Wang C,Lv B,et al.Expression level of serum human epididymis 4 and its prognostic significance in human non-small cell lung cancer.Int J ClinExp Med,2014,7(12):5568-5572.
19 Moore RG,Brown AK,Miller MC,et al.Utility of a novel serum tumor biomarker HE4 in patients with endometrioid adenocarcinoma of the uterus.GynecolOncol,2008,110(2):196-201.
20 Bielesz B,Sirin Y,Si H,et al.Epithelial Notch signaling regulates interstitial fibrosis development in the kidneys of mice and humans.J Clin Invest,2010,120(11):4040-4054.
21 Greer KA,Higgins MA,Cox ML,et al.Gene expression analysis in a canine model of X-linked Alport syndrome.Mamm Genome,2006,17(9):976-990.
22 Bunnag S,Einecke G,Reeve J,et al.Molecular correlates of renal function in kidney transplant biopsies.J Am SocNephrol,2009,20(5):1149-1160.
23 Escudero JM,Auge JM,Filella X,et al.Comparison of serum human epididymis protein 4 with cancer antigen 125 as a tumor marker in patients with malignant and nonmalignant diseases.Clin Chem,2011,57(11):1534-1544.
24 Okada H,Strutz F,Danoff TM,et al.Possible mechanisms of renal fibrosis.ContribNephrol,1996,118:147-154.
25 Meran S,Steadman R.Fibroblasts and myofibroblasts in renal fibrosis.Int J ExpPathol,2011,92(3):158-167.
26 Grgic I,Duffield JS,Humphreys BD.The origin of interstitial myofibroblasts in chronic kidney disease.PediatrNephrol,2012,27(2):183-193.
(本文编辑 律 舟 凡 心)
Significance of serum human epididymis protein 4 levels in patients with chronic kidney disease
YANGXiaoxia1,BAIMing1,LIULimin2,ZHANGLei1,ZHANGYuming1,SUNShiren1
1DepartmentofNephrology,FirstAffiliatedHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China2StateKeyLaboratoryofCancerBiologyFourthMilitaryMedicalUniversity,Xi’an710032,China
SUNShiren(E-mail:sunshiren11@sina.com)
Objective:To investigate the expression levels of HE4 in the serum of CKD patients and the relationship to CKD progression. Methodology:We prospectively collected the clinical data and serum samples of 112 CKD patients and serum HE4 concentration of the participants were tested using ELISA. Results:CKD patients had significantly higher serum HE4 concentration than the health controls (82.42±46.29vs29.85±15.18,P<0.001). Serum HE4 levels were significantly different among CKD stages (P<0.01), but were not significantly different among various pathological types of CKD(P>0.05). HE4 levels in the serum were inversely correlated with estimated glomerular filtration rates (eGFRs) (r=-0.712,P<0.001). In addition, positive correlations were found between serum HE4 levels and age, serum creatinine, blood urea nitrogen, cystatin C and the proportions of tubulointerstitial fibrosis(r=0.377,r=0.476,r=0.561,r=0.612,r=0.487,P<0.01; respectively). Kaplan-Meier survival curves showed that higher serum HE4 level was associated with shorter renal survival duration. Cox multivariate analyses further demonstrated that serum HE4 concentration was an independent prognostic factor for CKD patients (HR=1.032,P=0.001). Conclusion:Our study showed that high circulating HE4 levels were associated with adverse kidney disease outcome, suggesting that HE4 is a novel biomarker for CKD progression.
Chronic kidney diseases Human epididymis protein 4 Serum Outcome
10.3969/cndt.j.issn.1006-298X.2016.02.006
国家自然科学基金(81170670,81400699),陕西省自然科学基金(2014JZ007)
1第四军医大学第一附属医院肾内科(西安,710032);2第四军医大学国家肿瘤生物学重点实验室
孙世仁(E-mail:sunshiren11@sina.com)
2016-01-27
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有

