黄芩中黄芩苷提取的工艺研究
何自强,张惠玲,李传坤
(武汉生物工程学院 化学与环境工程系,湖北 武汉 430415)
黄芩中黄芩苷提取的工艺研究
何自强,张惠玲,李传坤
(武汉生物工程学院 化学与环境工程系,湖北 武汉 430415)
摘要:以黄芩为原料、甲醇为提取剂,采用醇提酸沉法从黄芩中提取黄芩苷.通过单因素试验和正交试验探讨了甲醇浓度、提取温度、提取时间、料液比4个醇提条件对黄芩苷提取率的影响,结合直观分析和方差分析,确定最佳提取条件:甲醇浓度为65%,提取温度为80 ℃,提取时间为2.5 h,料液比为1∶10,黄芩苷提取率可达到23.03%.该方法提取率高,纯度高,重现性好.
关键词:黄芩苷;提取;醇提酸沉法;单因素试验;正交试验
黄芩(RadixScutellariae)为唇形科植物黄芩(ScutellariabaicalensisGeorig)的干燥根[1],其主要活性成分为黄芩苷、黄芩素、汉黄芩素、汉黄芩苷等[2-4].其中黄芩苷(baicalin)是从黄芩根中提取分离出来的一种黄酮类化合物,别名黄芩甙,淡黄色针晶或粉末,分子式为C21H18O11,熔点223~225 ℃[5-7].
黄芩苷具有一定的脂溶性,在不同的溶剂中溶解度差异较大[6].黄芩苷易溶于N,N-二甲基甲酰胺(DMF)、吡啶,微溶于甲醇、乙醇、热冰醋酸,难溶于甲酸、乙酸、丙酮,几乎不溶于水、乙醚、苯、氯仿等溶剂[6-7].黄芩苷有羧基呈酸性,可溶于NaHCO3、Na2CO3和NaOH等碱性溶液,但在碱性溶液中不稳定,渐变成暗红色[6-7].
黄芩苷具有显著的生物活性,具有清热解毒、抑菌抗炎、降压、镇静、利尿、利胆、抗变态反应、抗癌等作用,在临床医学已占有重要的地位[8-10].同时,黄芩苷还能吸收紫外线,清除氧自由基,抑制黑色素的生成,可作为一种功能性原料用于化妆品中[9,11].因此,黄芩苷具有较高的开发前景.
目前,黄芩苷的提取方法主要有溶剂提取法、超声波提取法、微波提取法和超临界流体提取法等[10,12].从目前已发表的文献看,溶剂提取法以乙醇作提取剂居多,但甲醇提取未见报道,而黄芩苷在甲醇中溶解度高于乙醇[6].
笔者以黄芩为原料、甲醇为提取剂,采用醇提酸沉法从黄芩中提取黄芩苷.以黄芩苷提取率为评价指标,重点探讨了醇提过程中甲醇浓度、提取温度、提取时间、料液比4个单因素对黄芩苷提取率的影响,再以单因素试验结果为依据进行正交试验,结合直观分析和方差分析确定最佳工艺条件.
1材料与方法
1.1材料与试剂
黄芩,购于武汉市阳逻心连心大药房;黄芩苷标准品(HPLC≥98%),上海伊卡生物有限公司.甲醇、无水乙醇、HCl、NaOH均为分析纯.
1.2仪器与设备
AUY120电子天平,日本岛津公司;TU-1810 紫外可见分光光度计,北京普析通用仪器有限责任公司;TG16-WS台式高速离心机,长沙湘智离心机仪器有限公司;RE-52 AAA旋转蒸发器,上海嘉鹏科技有限公司;DHG-9053A型电热恒温鼓风干燥箱,上海一恒科技有限公司;XT-4双目显微熔点测定仪,北京泰克仪器有限公司.
1.3实验方法
1.3.1黄芩苷的提取工艺
1.3.1.1黄芩苷的提取[10,13]
称取5.0 g黄芩粗粉,置于圆底烧瓶中,加入一定体积的某浓度(体积分数)的甲醇溶液,浸泡过夜;将黄芩粗粉液回流提取一定时间后,抽滤,滤液减压蒸馏,得浓缩液;将浓缩液加热至80 ℃,用10%的HCl溶液调节pH为1.5~2.0,保温30 min后,室温静置12 h,离心机离心5 min,转速为7 500 r·min-1,弃去上清液;将沉淀移入烧杯中,加入10倍水,充分搅拌使成为均匀的混悬液,滴加20%NaOH溶液调pH至6.5~7,静置15 min后,离心,弃去沉淀;将上清液加热至40 ℃,搅拌下加入等体积与浸泡液浓度相同的甲醇溶液,混合均匀,静置10 min,离心,弃去沉淀;将上清液用HCl溶液调节pH为1.5~2.0,放置析出沉淀.抽滤后,沉淀用蒸馏水洗2~3次,抽干,60 ℃以下干燥,得粗制黄芩苷,称重,计算提取率.
1.3.1.2黄芩苷的精制[14]
称取黄芩苷粗品,加10倍量水搅拌均匀,20%NaOH溶液调pH为 6.5~7,黄芩苷全部溶解后,加活性炭适量拌匀,80 ℃水浴保温30 min,抽滤除去活性炭,滤液用浓HCl调至pH为1~2,加入等体积95%乙醇(黄芩苷在甲醇和乙醇中的溶解度分别为1.569 mg·mL-1和1.458 mg·mL-1[4],黄芩苷在乙醇中的溶解度比甲醇小.因此,重结晶时选用乙醇),50 ℃水浴保温30 min,析出沉淀,放置过夜,抽滤,少量乙醇洗涤沉淀,抽干,60 ℃以下干燥,得精制黄芩苷,测其熔点.
1.3.2黄芩苷最大吸收波长的确定[15-16]
精确称取黄芩苷标准品20 mg,溶于20 mL 50%(体积分数)乙醇溶液中.准确移取5 mL上述溶液,置于10 mL容量瓶中,用50%乙醇定容,配成质量浓度为0.5 mg·mL-1的黄芩苷标准溶液.
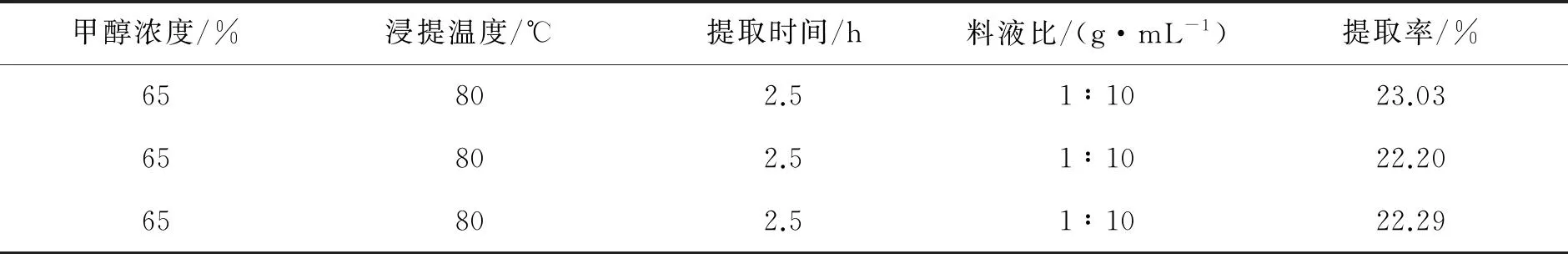
准确移取黄芩苷标准溶液0.1 mL,用50%乙醇定容至10 mL容量瓶中.以50%乙醇溶液作为参比液,测其吸光度,得最大吸收波长为278 nm(见图1).
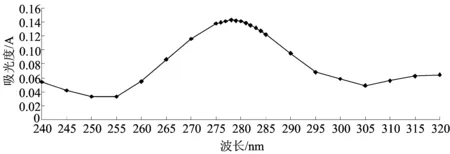
图1黄芩苷标准溶液波长与吸光度的关系
Fig.1The relationship between wavelength and absorbance of standard solution of baicalin
1.3.3黄芩苷标准曲线的绘制[16]
分别移取0.1,0.2,0.3,0.4,0.5 mL的黄芩苷标准溶液于10 mL容量瓶中,用50%的乙醇定容后,在278 nm波长下测吸光度,以质量浓度C(μg·mL-1)为横坐标,吸光度A为纵坐标,绘制标准曲线(见图2).该标准曲线的回归方程为:A=0.041 3C+0.065 6,R2=0.998 9.

图2黄芩苷标准曲线
Fig.2The standard cure of baicalin
1.3.4黄芩苷含量的测定
准确称取30 mg黄芩苷产品,50%乙醇溶液溶解后,定容至10 mL容量瓶中,然后,精确移取0.05 mL于10 mL容量瓶中,定容、摇匀,在278 nm波长下测其吸光度.根据标准回归方程计算黄芩苷含量,再求出黄芩苷产品提取率.
黄芩苷含量和提取率的计算公式如下
(1)
(2)
其中:X为黄芩苷的含量(%);Y为黄芩苷的提取率(%);C为样品溶液的质量浓度(μg·mL-1);V为测量液的体积(mL);n为样品稀释的倍数;m1为测吸光度所用的黄芩苷产品的质量(mg);m2为黄芩苷产品的质量(mg);m0为黄芩粗粉的质量(mg).
2结果与讨论
2. 1甲醇浓度对黄芩苷提取率的影响
称取黄芩粗粉5 g,分别用40%,50%,60%,70%,80%的甲醇溶液浸泡过夜后回流提取,固定其他3个因素:料液比1∶10、提取时间2 h、提取温度80 ℃.按1.3.4的方法测定提取物含量,计算黄芩苷提取率,考察甲醇浓度对黄芩苷提取率的影响.结果如图3所示.
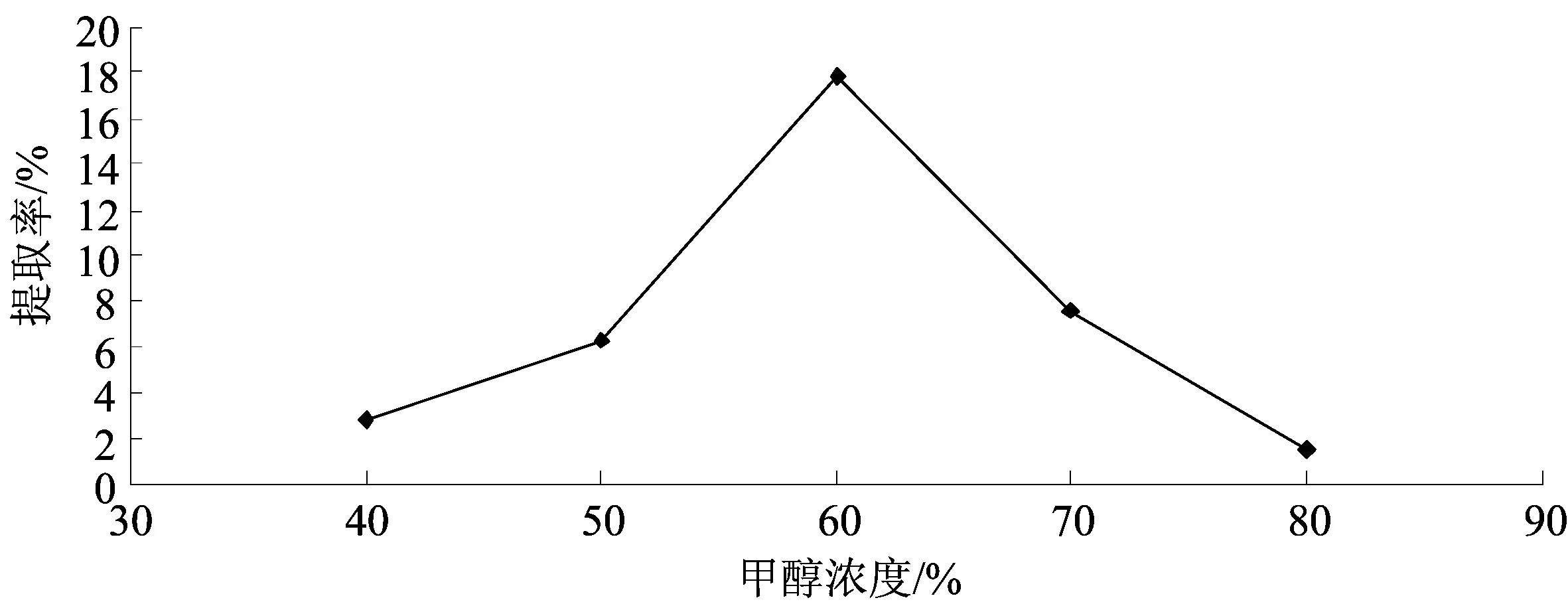
图3甲醇浓度对黄芩苷提取率的影响
Fig.3Effect of methanol concentration on the extraction rate of baicalin
由图3可知,甲醇浓度为40%时,黄芩苷提取率仅2.78%,随着甲醇浓度增大,提取率迅速提高;甲醇浓度为60%时,黄芩苷提取率达到最大值;继续增加甲醇浓度,黄芩苷提取率下降.低浓度时,甲醇极性较大,鞣质、蛋白质、黏液等高分子水溶性杂质的溶出量增加,黄芩苷提取率较低;甲醇浓度达到60%,甲醇水溶液极性与黄芩苷极性相近,利于黄芩苷的溶出;甲醇浓度高于60%时,甲醇溶液极性较小,黄芩苷溶出量急剧下降.综合考虑各因素,确定最佳甲醇浓度为60%.
2.2提取温度对黄芩苷提取率的影响
称取黄芩粗粉5 g,提取温度分别为50,60,70,80,90 ℃,固定其他3个因素:甲醇溶液浓度60%,回流提取2 h,料液比1∶10.按1.3.4的方法测定提取物含量,计算黄芩苷提取率,考察提取温度对黄芩苷提取率的影响.结果如图4所示.
图4提取温度对黄芩苷提取率的影响
Fig.4Effect of extraction temperature on the extraction rate of baicalin
由图4可知,提取温度低于70 ℃,黄芩苷提取率随温度升高而下降,70 ℃后提取率迅速增加;80 ℃时提取率达到最大值.说明在80 ℃时,黄芩苷在溶液中的溶解度最大;而高于80 ℃时,可能造成黄芩苷部分分解,导致提取率下降.综合考虑各因素,确定最佳提取温度为80 ℃.
2.3提取时间对黄芩苷提取率的影响
称取黄芩粗粉5 g,提取时间分别为1,2,3,4,5 h,固定其他3个因素:甲醇溶液浓度60%,料液比1∶10,提取温度80 ℃.按1.3.4的方法测定提取物含量,计算黄芩苷提取率,考察提取时间对黄芩苷提取率的影响.结果如图5所示.
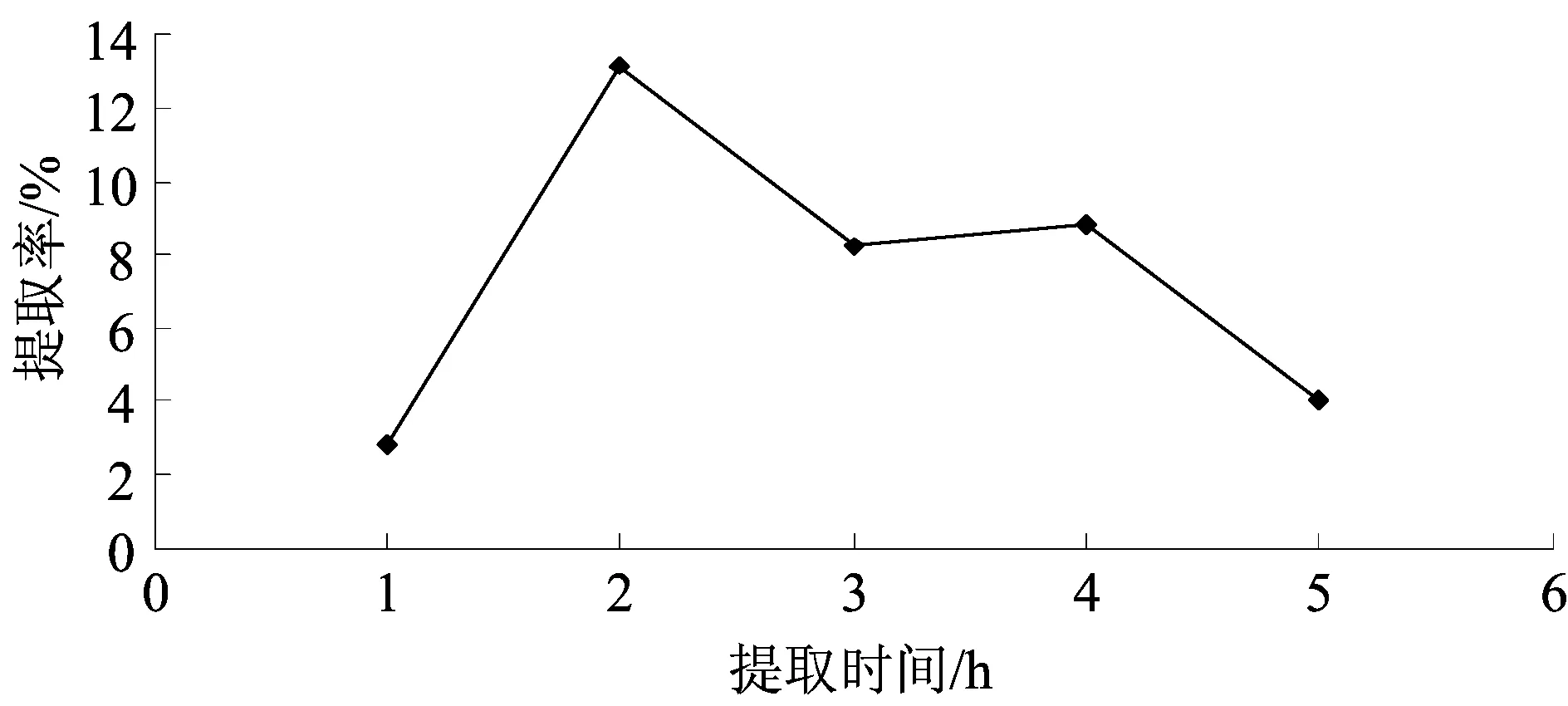
图5提取时间对黄芩苷提取率的影响
Fig.5Effect of extraction time on the extraction rate of baicalin
由图5可知,提取时间在1~2 h时,黄芩苷提取率增幅较大,2 h时达到最大值.超过2 h,黄芩苷提取率迅速下降.可能随着提取时间的增加,黄芩中的鞣质、蛋白质、黏液等高分子水溶性杂质的溶出量增加,将黄芩苷分子包裹起来,阻止了黄芩苷向溶液中扩散,导致黄芩苷提取率下降.
2.4料液比对黄芩苷提取率的影响
称取黄芩粗粉5 g,料液比分别为1∶8,1∶9,1∶10,1∶11,1∶12,固定其他3个因素:甲醇溶液浓度60%,回流提取2 h,提取温度80 ℃.按1.3.4的方法测定提取物含量,计算黄芩苷提取率,考察料液比对黄芩苷提取率的影响.结果如图6所示.

图6料液比对黄芩苷提取率的影响
Fig.6Effect of solid-liquid ratio on the extraction rate of baicalin
由图6可知,料液比在1∶8~1∶11之间时,黄芩苷提取率逐渐增大,因为料液比越大,黄芩粗粉与有机溶剂的接触面积越大,有利于黄芩苷的析出.料液比达到1∶11时,提取率最大,说明在此料液比下,大部分黄芩苷已被浸提出来.继续增大料液比,黄芩苷提取率缓慢下降,可能是鞣质、蛋白质、黏液等高分子水溶性杂质溶出,料液比过大,消耗的溶剂量增多,浓缩、干燥能耗增加,生产成本增大.综合考虑各因素,确定最佳料液比为1∶11.
2.5最佳工艺条件的选择
选取甲醇浓度(A)、提取温度(B)、提取时间(C)、料液比(D)作为参考因素,设计3水平,以黄芩苷提取率为考察指标设计L9(34)正交试验,通过直观分析和方差分析确定黄芩苷提取的最佳工艺.因素水平表见表1,正交试验直观分析结果见表2,方差分析结果见表3.

表1 正交因素水平表

表2 正交试验设计L9(34)及直观分析结果

续表2

表3 黄芩苷提取率方差分析结果
注:F0.01(2,2)=99,F0.05(2,2)=19,F0.1(2,2)=9.
由表2直观分析结果可知:影响黄芩苷提取率的因素按影响程度由大到小排列为RA>RB>RC>RD,并得到最佳提取工艺为A3B2C3D1,即为甲醇浓度65%,提取温度80 ℃,提取时间2.5 h,料液比1∶10.由表3方差分析结果可知:F0.01(2,2) 直观分析结果与方差分析结果一致. 2.6黄芩苷提取工艺的验证实验 以黄芩苷提取的最佳工艺进行3次平行实验,验证提取工艺的稳定性.即称取黄芩粗粉5 g,用浓度65%的甲醇溶液浸泡、回流提取,提取温度80 ℃,提取时间2.5 h,料液比1∶10.按上述工艺提取黄芩苷,结果见表4. 表4 黄芩苷提取工艺验证实验 由表4可知,以最佳工艺条件进行验证实验,黄芩苷的提取率稳定,重现性好. 3结束语 笔者以黄芩为原料、甲醇为提取剂,采用醇提酸沉法从黄芩中提取黄芩苷,通过单因素试验和正交试验考察了甲醇浓度、提取温度、提取时间、料液比4个因素对黄芩苷提取率的影响,结合直观分析和方差分析结果,确定最佳提取条件:甲醇浓度为65%,提取温度为80 ℃,提取时间为2.5 h,料液比为1∶10,黄芩苷提取率最大达到23.03%.雷燕妮等[1]以乙醇提取黄芩苷,提取率为12.32%;周芳等[6]采取醇提酸沉法提取黄芩苷,提取率为18.39%;马爽等[15]以乙醇为提取剂,采用超声波法提取黄芩苷,提取率为10.05%.与已报道的文献相比,该方法简单可行,黄芩苷提取率较高,且重现性好. 黄芩苷在甲醇中的溶解度高于乙醇[6],以甲醇作提取剂可提高黄芩苷的提取率.黄芩苷几乎不溶于水,而甲醇可与水以任意比例互溶,因此粗制的黄芩苷可通过多次水洗去除提取时残留的甲醇.精制后的黄芩苷,用XT-4双目显微熔点测定仪测其熔点为219~223 ℃,与理论值223~225 ℃[4]相近,说明该工艺条件下,提取后的黄芩苷纯度较高.如用于工业化生产,后处理较简单,可直接用于后续研究. 参考文献: [1]雷燕妮, 张小斌. 中药黄芩苷的提取工艺研究[J]. 陕西农业科学, 2012 (6): 121-124. [2]石俊英, 张小伟, 张会敏. 正交试验法优选黄芩苷提取纯化工艺[J]. 山东中医药大学学报, 2008, 32 (5): 413-415. [3]雷泞菲, 彭书明, 周嘉峪, 等. 黄芩中黄芩苷提取工艺的研究[J]. 时珍国医国药, 2007, 18 (11): 2664-2666. [4]莫金钢. 黄芩苷的提取分离与结构修饰[D]. 长春:东北师范大学生命科学学院,2007. [5]莫金钢, 赵骥明, 张黎丽. 黄芩苷提取工艺的研究[J]. 长春:东北师范学院学报 (自然科学版), 2008, 27 (2): 47-50. [6]周芳, 池汝安. 黄芩苷制备工艺的优化[J]. 湖北农业科学, 2006, 45 (6): 814-816. [7]郑必胜, 王能青, 赵欣. 黄芩苷的水提法工艺研究[J]. 现代食品科技, 2008, 24 (1): 48-51. [8]王玥, 杜守颖, 吴清, 等. 黄芩中黄芩苷的闪式提取工艺研究[J]. 北京中医药大学学报, 2014, 37 (4): 269-272. [9]韩忠明, 郭洪丽, 常波, 等. 黄芩中黄芩苷微波提取工艺研究[J]. 时珍国医国药, 2011, 22 (12): 2840-2841. [10]李升林, 张东向, 孙岩. 提取溶剂对黄芩苷提取率影响的研究[J]. 林区教学, 2012, 178 (1): 122-123. [11]马爽, 赵岩, 赵晓红, 等. 中心组合设计-响应面分析法优选黄芩中黄芩苷的超声提取工艺[J].中国医药导报, 2014, 11 (9): 142-145. [12]李景松, 张贵君, 张智圆, 等. 黄芩药材中活性成分黄芩苷的研究概况[J]. 世界中医药, 2013, 8 (4): 469-471. [13]翟保同, 王莹. 黄芩苷提取工艺研究[J]. 中国医药导报, 2007, 4 (23): 91-93. [14]李炳奇, 廉宜君. 天然产物化学实验技术[M]. 北京: 化学工业出版社, 2012: 71-75. [15]庄瑞. 黄芩苷提取条件的实验设计[J]. 数理医药学杂志, 2008, 21 (3): 336-337. [16]何自强, 张惠玲, 张新欢. 超声波辅助乙醇-氨水提取茶皂素的工艺研究[J]. 湘潭大学自然科学学报, 2015, 37 (2): 80-85. (责任编辑于敏) Research on extracting technology of baicalin fromScutellariabaicalensisGeorgi HE Ziqiang, ZHANG Huiling, LI Chuankun (Department of Chemical and Environmental Engineering, Wuhan Bioengineering Institute, Wuhan 430415, China) Abstract:Taking Radix Scutellariae as raw material and methanol as extracting agent, baicalin was extracted from Scutellaria baicalensis Georgi by methanol extraction and acid precipitation method. The influences of concentration of methanol, extraction temperature, extraction time and solid-liquid ratio were studied through the single factor test and orthogonal test. The optimum extraction conditions were determined as follows: concentration of methanol 65%, extraction temperature 80 ℃, extraction time 2.5 h and ratio of solid-to-liquid 1∶10, combining with visual analysis and analysis of variance. The extraction rate was 23.03% under these conditions. High extraction rate, high purity and good reproducibility can be got. Key words:baicalin; extraction technology; methanol extraction and acid precipitation method; single factor test; orthogonal test 中图分类号:O658,TQ041 文献标志码:A 文章编号:1000-2162(2016)03-0073-07 作者简介:何自强(1976-),男,湖北随州人,武汉生物工程学院讲师. 基金项目:武汉市教育局资助项目(2011077);校级教研项目(2013JY Ⅱ04) 收稿日期:2015-05-23 doi:10.3969/j.issn.1000-2162.2016.03.012