建立大鼠原位肝移植模型的手术技巧
黄戎娟 刘洋 张聪
400038 中国人民解放军第三军医大学实验动物中心
建立大鼠原位肝移植模型的手术技巧
黄戎娟刘洋张聪
400038中国人民解放军第三军医大学实验动物中心
【摘要】目的采用“二袖套法”建立稳定的大鼠原位肝移植模型,为临床试验提供依据,并探讨手术技巧。方法在Kamada的“二袖套法”基础上进一步改进,供体经腹主动脉行肝脏冷灌注,用缝合法吻合肝上下腔静脉, 用袖套法吻合门静脉与肝下腔静脉, 胆道采用支架法重建。对200只SD大鼠进行原位肝移植,记录各项操作时间以及术后存活率、并发症情况,专人对数据统计分析。结果共对200只大鼠采用改良的“二袖套法”行原位肝移植。手术成功率为90.00%(180/200)。部分大鼠死亡原因包括出血、肝下腔静脉血栓、肝上下腔静脉回流不畅、袖套扭转、脱落、胆瘘、胆道梗阻、肝功能衰竭以及肝脓肿。结论能熟练进行显微外科操作,并且手术精确是缩短操作过程以及减少术后并发症发生的前提。而受体大鼠的术后存活情况又与无肝期时间密切相关。
【关键词】肝移植;模型;并发症;显微外科术
近年,医治终末期肝病的唯一办法就是进行肝移植手术。随着需要行肝移植患者数目的持续增长与供肝数量缺少越加明显的冲突,霹裂式肝移植与活体肝移植的产生成功地缓解了这一冲突[1]。但是此类肝移植,尤其是活体肝移植,出于对供体的安全性考虑,被移植的供肝可能与受体会出现重量或体积不匹配的情况,从而导致小体积综合征(SFSS)[2]。大鼠原位肝移植模型作为深入研究小体积综合征的重要模型,可用在研究肝脏的缺血再灌注损伤、移植排斥反应、原位肝脏移植中器官的保存和免疫耐受机制等各个方面的问题,已经被国内外移植中心广泛接纳并进行大量改进。在建立模型的初期,动物存活的概率极低,直至使用了Kamada等[3]创建的“二袖套法”,才大大提高了大鼠术后的存活率。但是,就手术本身操作来说,难度较大。本研究通过采用“二袖套法”对 200只大鼠进行原位肝移植,对肝移植术操作的方法以及预防并发症的发生等问题进行分析讨论,希望能构建稳定、可靠的大鼠原位肝移植模型。
资料和方法
一、材料
200只六周龄的雄性清洁级SD大鼠(购于第三军医大学实验动物中心)。大鼠于清洁级饲养室喂养2周,饲养条件符合SPF标准。待体质量增至200~300 g时配为供受体。受体(相差约为10 g)的体质量稍稍比供体的重些,手术前一晚禁食不禁水。单人操作MC-M900型手术显微镜进行操作,并采用乙醚持续开放麻醉以及相对无菌技术。
二、手术方法
(一)获取供肝吸进乙醚持续麻醉之后,取大鼠仰卧位,腹部正中切口,逐层进行分离,随后进入腹腔。棉签浸湿后钝性分离,用盐水小纱布辅助暴露,注意操作轻柔谨慎。按逆时针的方向将肝脏周围韧带逐一分离,先后断开左三角韧带和肝镰状韧带,将左膈静脉以及肝和食管之间血管交通支结扎并断开。随后暴露肝门,游离出胆总管,把前壁剪开, 把硬膜外导管制成的胆囊内支撑管从切口向近端插入,再用5-0丝线把胆总管固定于支架管的浅槽里。将门静脉游离。将幽门静脉断离。一般情况下,不需要结扎脾静脉,以防止吻合的时候过长或者扭曲。把250 IU肝素的生理盐水通过阴茎背静脉注入,肝素化供体大鼠的血液。在近腔静脉处把右肾上腺静脉进行结扎并切断。向左侧移动肠管,暴露左肾静脉水平以下的腹主动脉,并向近心端穿刺其前壁,置入导管以灌注。之后剪开膈肌,把胸主动脉用钳夹剪断。将0℃~4℃的10 mL乳酸林格氏液通过腹主动脉导管注入,同时迅速把膈上下腔静脉切断,引流出灌注液,并不断地用4℃的乳酸林格氏液浇淋供肝表面,让供肝均匀降温。最后贴住膈肌环将肝上下腔静脉断开。把肝动脉结扎、切断,于门静脉与脾静脉汇合处将门静脉断离,在左肾静脉的上方把肝下腔静脉断离。获取供肝,保存在4℃保存液里。
(二)修整供体肝操作在4℃乳酸林格氏液中进行。由14号与16号聚乙烯静脉穿刺套管针的套管制作而成的门静脉与肝下腔静脉套管。把外翻的门静脉与肝下腔静脉套于血管套管后并固定。配备血管袖口时,一定要确保套管安装在正确的位置上。在修正的时候,要不断修剪肝上、下腔静脉旁的膈肌,并剪去其腔静脉环水平多余的下腔静脉。
(三)受体肝切除手术之前,受体肌肉注射0.03 mg的阿托品和抗生素。麻醉的方法、手术的体位、切口与供体一致。但是在固定四肢时,为防止针头刺伤肢体,需借助橡皮筋。按逆时针方向逐个游离肝周韧带。结扎肝固有动脉的起始部,并从近肝端将肝固有动脉切断。斜形剪开胆总管在左右肝管汇合之处,在远端放入临时使用的胆管内支撑管,扩张备用,并用丝线结环扎固定。把后腹膜剪开,肾血管的平面上的肝下腔静脉后面使用显微镊游离,同时结扎右肾上腺静脉。注意保护被结扎的右肾上腺静脉不被断离,以作为受体即将要切断的肝下腔静脉固定的支撑点。使用血管夹按照肝下腔静脉(临近右肾静脉)、门静脉(临近幽门静脉)依次夹闭,确保受体进入无肝期。降低吸入麻醉的剂量。在门静脉的分叉处用5号针头穿刺,随后注入2 mL的生理盐水,待肝脏转为土黄色。使用膈肌钳和小儿Satinsky钳将肝上下腔静脉钳夹,并紧贴着肝脏断离。再在门静脉分叉处剪断门静脉。最后上提肝脏,将肝下腔静脉断离,并且注意留少量肝组织以确保下腔静脉断端保持张开状态。移出受体肝脏。
(四)原位肝移植把供肝放在原来的位置,将小纱布垫置在肝后,调整纱布,把供肝与受体的相应血管调整到最吻合的位置。用弯头显微持针钳和8-0血管缝线连续缝合供肝与受体的肝上下腔静脉。把门静脉上的套管柄用显微止血钳钳夹,并用胶泥固定后者。将胶泥位置和血管钳方向谨慎调整后,确保供肝门静脉套管与受体的门静脉距离最小,将后者套于套管,采用丝线固定。随后松开受体的静脉阻断夹,待肝脏迅速变红后,松开Satinsky钳,结束无肝期。用胶泥辅助固定,采用相同方法吻合肝下腔静脉。可见右肾的外观很快变为正常,否则,则提示下腔静脉可能回流受阻。将用于固定受体胆总管支撑管插管的丝线活结打开,拔出胆总管内的支撑管,清洗其切口处的血凝块,并把供肝的胆总管里支撑管外侧的1/2插进受体的胆总管。因为需要重新建立胆管血供并避免胆漏,应把大网膜围绕在吻合口。最后逐一关腹。
三、术后护理
手术后缓慢注射2 mL乳酸林格氏液于阴茎背静脉以补充血容量,纠正酸中毒。把大鼠放在保温灯下进行照射并让其连续吸入氧气,等其完整清醒并可以照常活动后,置入单笼喂养1 d,当日饮用10%葡萄糖。次日标记后与其它动物合笼,正常饮食。若要采血检查,则需进行采血后补液。
结果
一、各项操作时间统计
本研究采取改良后的“二袖套法”行手术200次。其中获取供肝的手术时间(29.52±5.34) min;修整供肝时间(11.31±3.37) min;受体操作时间(包括肝切除和原位肝移植)共(44.24±5.54) min,无肝期(18.45±2.59) min。
二、并发症情况与存活率
术后2 d内共死亡20例,其中8例因出血,6例因肝下腔静脉血栓,4例因肝上下腔静脉回流不畅,2例因袖套扭转、脱落。手术成功率(术后2 d存活率)为90.00%(180/200)。术后1周内共死亡41例,除去前2 d内死亡者,1例因肝下腔静脉血栓,1例因肝上、下腔静脉回流不畅,4例因胆漏,6例因胆道梗阻,8例因肝功能衰竭,1例因肝脓肿。1周存活率为79.50%(159/200)。3个月内共死亡56例,除去前1周内死亡者,11例因胆道梗阻,3例因肝功能衰竭,1例因肝脓肿。3个月存活率为72.00%(144/200)。至发文时,术后存活时间最长的大鼠已超过16个月。详见表1。
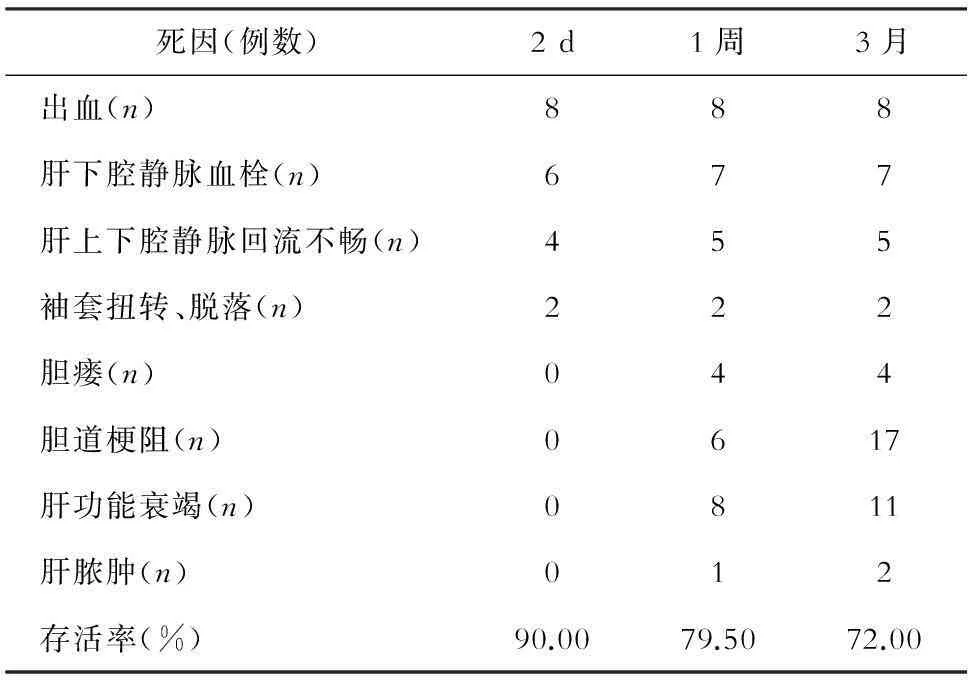
表1 各阶段大鼠死亡原因及存活率情况
讨论
一、手术操作技巧
供体与受体在手术前1晚不需禁食,不过,在手术前受体需要肌注0.03 mg的阿托品,用于减少呼吸道产生过多分泌物以及预防窒息等。
供体与受体都采取在腹部正中切口的方法,可以防止在操作横切口的时候出血过多,另外还有手术创伤小、恢复得快等优点[4]。在供体与受体肝脏游离时,都按逆时针方向逐步分离,可避免因多次翻动肝脏而造成刺激,同时规范了操作的步骤也节省了时间。在受体进行分离肝脏手术时,肝上、下腔静脉的后方要预留牵引线,便于钳夹与分离肝上、下腔静脉的时候将肝脏牵引向下。
供体经腹主动脉行肝脏冷灌注。游离供肝后,通过用乳酸林格氏液(含肝素100 U)10 mL经腹主动脉进行肝脏冷灌注,外加4℃的乳酸林格氏液浇淋供肝表面,以使供肝尽快进入冷缺血状态。进入腹主动脉之后的灌注液,大多数通过各器官循环进到门静脉,最后灌注肝脏,小部分则通过肝动脉立刻灌注到肝脏,既使肝脏有了双重灌注,也能确保门静脉适当压力,保证得到的供肝热缺血时间靠近零,且质量较好[5]。 Kashfi A等[6]研究发现,跟以往的经门静脉灌注后行肝脏冷灌注相比,经腹主动脉灌洗具有更均匀和彻底等诸多优点。此外,研究发现肝素化供体血液比单纯经阴茎背静脉注射纯肝素250 IU的效果好,且便于移植肝在复流后的微循环恢复。
修整供肝时,要使用温度处在4℃的保存液。进行套血管袖口时,右肾静脉结扎线与门静脉属支的结扎线可用作辨别血管方向的标记,确保套管柄在肝下腔静脉与门静脉前方[5]。把套管体部里血管的旁边清除整洁,防止留在脂肪组织或者结扎线头。部分研究提出在修剪肝上、下腔静脉的时候留下少许膈肌,防止缝合血管时产生撕裂现象[7]。但我们发现,在手中修剪肝所有膈肌后,由于无膈肌的存在,血管的可塑性会变得更好,还确保吻合口的大小足够,只要小心操作,就不会造成血管撕裂。
在血管重新建立的过程中,本研究全部采用“二袖套法”吻合血管,即将肝下腔静脉与门静脉以袖套法吻合,而肝脏上、下腔静脉则以缝合法吻合,结果令人满意。同时,还可通过移动胶泥的位置与使用辅助小纱布来调整供体与受体之间的血管处于最佳吻合位置。研究人员发现[8],受体的无肝期不应该超过26 min。而本组无肝期为(18.45±2.59) min,虽然有6例大鼠的无肝期长达30 min,术后3个月内仍有4例移植成活。但我们也认为受体大鼠的无肝期长短是手术是否成功的关键。另外,在吻合肝上、下腔静脉时,因为其壁薄,操作应轻柔细致,争取一次成功。
二、术后并发症的预防
出血:本组共有8例动物由于术后出血死亡,通过尸检发现部分是因两拐角处缝合不牢靠造成,部分则因为缝合时进针缘距过大,导致静脉壁因受力不均而撕裂。因此,熟练地运用显微缝合技术,缝合过程中小心谨慎,并确保吻合口无张力是预防术后出血的重要之处。而静脉缝合后不需要再检查吻合口,以免撕裂静脉[9]。
血栓形成:本组共发生肝下腔静脉血栓7例。研究表明,肝下腔静脉血栓常发生于术后早期,根据经验,在进行血管重建时,应仅用显微镊夹血管外膜,而尽可能避免损伤血管内皮。在吻合之前,放出部分受体大鼠血管里近心端淤阻的高凝血液与血凝块。此外,尽可能缩短受体操作的手术时间也是预防本并发症的关键。
胆道梗阻:与血栓不同,胆道梗阻多发生在术后晚期,且对受体大鼠肝原位肝移植后长期存活的影响很大。本组共发生胆道梗阻17例,尸检可见,胆道插管被泥沙样的结石堵塞,管长多长于5 mm。这提示可能因插管过长导致胆汁流出不畅,加上插管时容易损伤胆管内壁引发炎症,最终形成结石堵塞胆管。因此管长不应过长,直径要和胆总管的直径相匹配,同时还要防止因钳夹使胆管变形,并在插入胆管前冲洗管内血液。
综上所述,许多因素都能够对原位肝移植模型存活产生影响,因此,必须重视操作中所有细节。能熟练进行显微外科操作,并且手术精确是缩短操作过程以及减少术后并发症发生的前提。而受体大鼠的术后存活情况又与无肝期时间密切相关。细致耐心的操作与反复训练则是肝移植成功的关键所在。而良好的麻醉控制,稳定的血液动力学,以及移植后立刻恢复体温、保持呼吸道通畅等也能够让手术成功率大大提高。
参考文献
1Hori T, Nguyen JH, Zhao X,et al.Comprehensive and innovative techniques for liver transplantation in rats: a surgical guide. World J Gastroenterol, 2010,16:3120-3132.
2严佶祺,张明钧,杜志勇,等.大鼠部分肝移植模型建立的技术要点.肝胆外科杂志, 2010,18:217-219.
3Kamada N, Calne RY. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 1979,28:47-50.
4李宗狂,马毅,许赤,等.大鼠原位肝移植术近期并发症的预防.肝胆胰外科杂志,2003,15:223-225.
5Tian Y, Jochum W, Georgiev P, et al. Kupffer cell-dependent TNF-alpha signaling mediates injury in the arterialized small-for-size liver transplantation in the mouse. Proc Natl Acad Sci USA, 2006,103:4598-4603.
6Kashfi A, Mehrabi A, Pahlavan PS, et al. A review of various techniques of orthotopic liver transplantation in the rat. Transplant Proc. 2005, 37: 185-188.
7振杰,何晓顺,陈规划,等.大鼠原位肝移植胆道外引流模型的建立.中华肝胆外科杂志,2002,08:667-669.
8马毅,何晓顺,陈规划.大鼠原位肝移植模型的手术技巧及并发症的预防.中华显微外科杂志,2003,26:45-47.
9王轩,杨甲梅,严以群,等.大鼠原位肝移植不同术式的探讨.中华器官移植杂志,1998,19:76-78.
(本文编辑:易玲)
(收稿日期:2015-08-10)