关于“碳酸钙性质”的探究及教学思考
田长明


摘要:文章从质疑碳酸钙饱和溶液能否使酚酞试液变色入手,就变色的本质进行了探讨,对碳酸钙的溶解性和稳定性进行了适当的拓展和延伸,并对课堂教学提出了自己的看法。
关键词:问题质疑;本质探讨;知识拓展;教学反思
文章编号:1008-0546(2016)08-0009-02 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2016.08.003
在提倡培养学生核心素养的今天,培养学生的批判性思维是其中重要的一环,要培养学生的批判性思维,教师首先必须具有批判性思维。而教师批判性思维的立足点应该是课堂教学,有教师就关于“碳酸钙性质”提出了如下质疑。
一、问题的质疑
有质疑,才会有创新思维。质疑是创新思维的首要条件,是获得创见的第一步。小疑则小进,大疑则大进。爱因斯坦说过:“提出一个问题往注比解决一个问题更重要。”
为了证明大理石高温下分解产生氧化钙,很多老师会做如下实验:
实验1:将大理石在酒精喷灯上煅烧一段时间,然后将煅烧后的石灰石投入盛有水的烧杯中,在烧杯中滴加2滴酚酞,发现溶液变红,因此得出结论:大理石高温煅烧分解产生氧化钙。理由:CaCO3CaO+CO2↑, CaO+H2OCa(OH)2。反应后溶液呈碱性。
有些老师对上述实验证明过程提出了质疑,他们的理由如下:
实验2:在试管中加入少量碳酸钙粉末,并加入2mL水,振荡摇匀,制成碳酸钙的悬浊液,在试管中滴加2滴酚酞,结果发现浊液变红。
没有高温煅烧的碳酸钙,加水制成饱和溶液后,滴入酚酞,溶液也会变红,因此上述证明过程存在缺陷。
笔者对照上述两个实验,发现了两个问题,其一是物质的状态不同,一个是块状,一个是粉末状,其二是两者纯度不同,石灰石含有杂质,而碳酸钙是分析纯。为了弄清上述问题,笔者又做了如下两个实验:
实验3:在试管中加入几块石灰石,并加入2mL水,振荡,在试管中滴加2滴酚酞,长时间放置,结果溶液不变红。
实验4: 在试管中加入研磨细的大理石,并加入2mL水,振荡,在试管中滴加2滴酚酞,结果浊液变红。
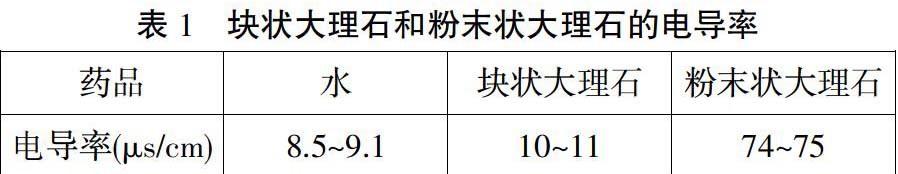
为了定量地说明上述问题,有教师利用传感技术来分别测定上述两溶液的电导率。装置如图1:
测得的数据如下:
由此可见,石灰石加入水后,滴加酚酞,浊液是否变红,溶液导电能力的大小跟大理石的聚集状态有着很大的关系。
二、本质的探讨
碳酸钙悬浊液滴加酚酞后为什么会变红?笔者查阅了相关资料并进行了相关计算。
碳酸钙的Ksp=8.7×10-9,根据Ksp=c(Ca2+) c (CO32-)[1],则溶液中c(Ca2+)=c(CO32-)=9.33×10-5mol·L-1。
碳酸的Ka1=4.30×10-7;Ka2=5.61×10-11[1]。
CaCO3的水解常数为:Kh=Kw/Ka2=10-14/5.61×10-11=1.78×10-4。饱和碳酸钙溶液中氢氧根离子浓度为c (OH-)==1.29×10-4 mol·L-1,pOH=3.89,pH=10.11。
酚酞的变色范围如下:
所以饱和碳酸钙溶液能使酚酞变红。
三、知识的拓展
拓展延伸是课堂教学当中很重要的一个组成部分。我们要在尊重学生学好教材、立足课堂的基础上有效地拓宽,以实现学生学习上质的飞跃——超越教材、超越课堂,真正达到学为我用的目的。
拓展1:碳酸钙悬浊液滴加酚酞后加热,红色会变深吗?
对于上述问题很多老师认为红色会加深,理由如下:
(1) 随着温度的升高,碳酸钙的溶解度会增大,溶液中碳酸根离子浓度增大。
(2) 随着温度的升高,碳酸根离子的水解度会增大,溶液中氢氧根离子浓度增大,从而导致浊液的碱性增加,因此红色会加深。
实验5:在试管中加入少量碳酸钙,并加入2mL水,振荡摇匀,制成碳酸钙的悬浊液,在试管中滴加2滴酚酞,浊液变红,如果将溶液加热,红色逐渐变淡。
这是什么原因造成的呢?根据文献知碳酸钙溶解度数据如下:
通过表3可知,碳酸钙的溶解度是随着温度的升高而降低的。影响溶液碱性强弱的因素有两个,一是碳酸根离子的浓度,二是碳酸根离子的水解度,当温度变化时,这两个因素中碳酸根离子浓度的影响是主要因素,因此碳酸钙悬浊液滴加酚酞后加热,会出现红色变淡的情况。
拓展:2:为什么碳酸钙高温会分解,而碳酸钠却很难分解
一般碱金属碳酸盐具有较高的热稳定性,碱土金属碳酸盐不稳定,按下式分解:MCO3MO(s)+CO2(g)↑。这是什么原因呢?碳酸盐的热稳定性我们可用离子极化观点来说明:在MCO3中,既存在中心C原子对周围O2-的作用,也存在M2+对O2-的作用。
阳离子半径愈小,极化力愈强,愈容易从CO32-中夺取O2-,成为MO。同时放出CO2,表现为MCO3的热稳定性愈低,最易发生分解。部分碳酸盐的分解温度如下:
另一方面,阳离子所带的电荷数越高,极化力愈强,离子+2价的碱土金属离子,电荷较高,极化力强于同周期的碱金属离子。碳酸钠高于1000℃时会分解,当温度高于1200℃时也只是部分分解。可见碳酸钠的热稳定性非常高。
四、教学的反思
现在很多年轻教师对教材的研究很肤浅,笔者认为教师对教材知识的研究分四个层次,第一层次是“是什么”,第二层次是“为什么”,第三层次是“怎么办”,第四层次是“还有什么”。笔者以苯酚的化学性质为例:第一层次是“苯酚有哪些物理和化学性质”,第二层次是“苯酚和苯化学性质相比,为什么容易发生取代,为什么具有弱酸性,为什么不能使紫色石蕊试剂变色等”,第三层次是“如何利用苯酚的性质分离苯和苯酚”,第四层次是“苯酚具有还原性,是否可以发生银镜反应,过量的浓溴水能不能将苯酚氧化等”。不少年轻教师对教材知识点的研究仅限于“是什么”和“怎么办”。课堂教学时只注重外在的形式,有精美的课件,有生动的表情,有师生的互动,但研究讨论的知识只是蜻蜓点水,这样的课堂教学感觉缺乏内涵,没有深度。有些课堂教学则太功利,纯粹的讲和练,一切都是为了提高分数。
笔者希望我们教学不要太浮躁、太功利,教师应该加强对教材的研究,敢于质疑,勤于探究,让课堂教学充满好奇和理性的光辉。
参考文献
[1] Handbook of Chemistry and Physics[M]. 1982-1983:B-242,D-173

