同位素稀释高效液相色谱-串联质谱法测定面粉及面制品中的联二脲
阮莎莎,刘桂华,刘素纯*,朱 舟,刘建军
(1.湖南农业大学 食品科学技术学院,湖南 长沙 410128;2.深圳市疾病预防控制中心,广东 深圳 518055)
同位素稀释高效液相色谱-串联质谱法测定面粉及面制品中的联二脲
阮莎莎1,刘桂华2*,刘素纯1*,朱舟2,刘建军2
(1.湖南农业大学食品科学技术学院,湖南长沙410128;2.深圳市疾病预防控制中心,广东深圳518055)
摘要:建立了面粉及其制品中联二脲的同位素稀释高效液相色谱-串联质谱检测方法。采用纯水超声提取,含油脂的样品加正己烷脱脂,所得样液进行高效液相色谱-串联质谱测定。以乙腈与纯水为流动相,梯度洗脱,经Waters XBridge BEH Amide(3.5 μm,4.6 mm×150 mm)色谱柱分离,MS/MS采用电喷雾电离正离子(ESI+),多反应监测(MRM)模式检测,同位素内标法定量。方法的线性范围为0.2~100 μg/L,相关系数为0.999 9;在面粉、馒头、面包、油条和面条5种基质中的平均加标回收率为82.0%~113.6%,相对标准偏差(RSD)为2.1%~9.3%;方法定量下限(LOQ)为20 μg/kg。应用该方法对136份市售的面粉及面制品进行检测,在42份样品中检出联二脲,检出率为30.88%。其中面粉检出4份,含量为43.7~564 μg/kg;馒头未检出;面条检出2份,分别为70.8 μg/kg与9 840 μg/kg;油条检出1份,含量为2 480 μg/kg;面包表层检出15份,含量为27.4~8 730 μg/kg;面包内芯检出20份,含量为64.3~18 100 μg/kg。该方法操作简单、灵敏快速、准确可靠,适用于面粉及其制品中联二脲的测定。
关键词:高效液相色谱-串联质谱法;同位素内标;面粉;面制品;联二脲
偶氮甲酰胺(Azodicarbonamide,ADC)具有氧化与漂白的双重功能[1-2],添加到面制品中能增强筋度,改善弹性、韧性及均匀性[3-4]。在面制品禁止使用溴酸钾[5]后,ADC成为最广泛使用的面粉改良剂之一。近年来研究表明,在面制品加工过程中,ADC可经小麦蛋白还原成联二脲(Biurea,HDC),HDC经高温作用进一步降解为氨基脲(Semicarbazide,SEM)[6-7]。SEM已被证明具有致癌性与致突变作用[8-10]。在高温特别是湿度较大的情况下,ADC也可直接转化为HDC[11]。欧盟已禁止使用ADC作为面粉添加剂[12],我国GB2760-2014《食品添加剂使用卫生标准》规定小麦粉中ADC的最大使用量为0.045 g/kg[13]。考虑到其转化产物SEM的毒性效应,有必要监测食品中HDC的存在水平,这对使用ADC的食品的安全性评价有着重要意义。
目前,食品中HDC的定量分析方法主要为高效液相色谱法(HPLC)与高效液相色谱-串联质谱法(HPLC-MS/MS)。Bechtold等[14]最早利用HPLC检测HDC。HDC的HPLC-MS/MS定量分析可直接测定或衍生后测定。如Mulder等[15]直接测定了含有面制品涂层的禽肉与海产品中HDC的含量;袁红丽等[16]采用纯水提取后固相萃取净化测定了馒头中的HDC含量,但该方法只针对馒头中的HDC进行研究,并未涉及其他面制品;王雅等[17]使用高锰酸钾将HDC氧化成ADC,利用对苯亚磺酸钠将ADC衍生为对苯磺酰氨基脲,再进行HPLC-MS/MS检测,该方法的定量下限可达5 μg/kg,此方法虽然灵敏度较高,但需要衍生化,操作较为繁琐。
本研究对面粉及面制品中的HDC进行直接测定,采取纯水直接提取,离心后取上清液,含油脂样品加入正己烷脱脂,同位素内标法定量,以期得到简单高效、灵敏度高的HDC检测方法,为检测面粉及面制品中的HDC提供技术支持。
1实验部分
1.1仪器与试剂
AB SCIEX 4500 QTRAP三重四极杆串联质谱仪(美国应用生物系统公司),配有Turbo-V离子源、蠕动泵以及Analyst 1.6.2数据处理系统,气源为纯度大于99.999%的高纯氮气;Shimadzu LC-20A 超快速液相色谱仪(日本岛津公司);Waters XBridge BEH Amide色谱柱(150 mm×4.6 mm×3.5 μm,美国Waters公司);分析天平(XS205,瑞士Mettler Toledo公司);Milli-Q plus超纯水制备系统(美国Millipore公司);Beckman Coulter AllegraTMX-22R高速冷冻离心机(美国Beckman公司);KQ-250DV 超声清洗仪(昆山市超声仪器有限公司);IKA A-11 basic研磨机、IKA-MS3旋涡混合器(德国IKA公司);0.45 μm有机系微孔滤膜。
HDC标准品(纯度大于99%,美国Sigma-Aldrich公司),13C2,15N2-HDC标准品(纯度98.8%,加拿大Toronto Research Chemicals公司)。实验所用甲醇、乙腈、甲酸、乙酸均为色谱纯,购自德国Merck公司。实验用水(电阻率>18 MΩ·cm)均由Milli-Q plus超纯水制备系统临用现制。实验用面粉及面制品购自深圳市各大超市。
1.2标准溶液的配制
称取HDC标准品10 mg(精确至0.01 mg),加水超声辅助溶解,配成200 mg/L的标准储备溶液,4 ℃避光保存,有效期180 d;根据实际需要用甲醇稀释标准储备液,获得相应质量浓度的标准工作液。称取13C2,15N2-HDC标准品10 mg(精确至0.01 mg),用超纯水配成200 mg/L的溶液,置于4 ℃冰箱避光保存,有效期180 d;根据需要用甲醇稀释成相应质量浓度的内标标准工作液。
1.3色谱-质谱分析条件
液相色谱条件:色谱柱为Waters XBridge BEH Amide 色谱柱(3.5 μm,4.6 mm×150 mm),柱温35 ℃;流动相为超纯水(A)和乙腈(B),流速为0.6 mL/min;梯度洗脱程序:0~0.5 min,75% B,0.5~2 min,75%~55% B,2~5 min,55% B,5~8 min,75%B;进样量20 μL。
质谱条件:离子源为电喷雾离子源(ESI),采用正离子模式;扫描方式为多反应监测(MRM);离子喷雾电压(IS)为5 500 V;离子源温度(TEM)为650 ℃;气帘气(CUR)压力35 psi;雾化气(GS1)压力45 psi;辅助加热气(GS2)压力65 psi;碰撞气(CAD)中等;去簇电压(DP)、入口电压(EP)、碰撞电压(CE)、碰撞室出口电压(CXP)等参数见表1。

表1 HDC与13C2,15N2-HDC的MRM参数
*quantitative ion
1.4样品前处理
面粉样品直接称取,面制品粉碎均匀取样。准确称取样品2.00 g(精确至0.01 g),分别加入0.1 mL13C2,15N2-HDC同位素内标(10 mg/L)和10 mL超纯水,超声提取15 min,转出上清液;残渣再用10 mL超纯水提取1次,合并上清液;于8 000 r/min离心5 min,取上清液100 μL,用初始流动相稀释至1 mL,0.45 μm有机系微孔滤膜过滤后采用LC-MS/MS测定;对于油条等油脂含量较高的样品,提取液用初始流动相稀释后加入2 mL乙腈饱和的正己烷,涡旋混匀30 s,于8 000 r/min离心5 min,取下清液过膜后测定。
2结果与讨论
2.1质谱条件的优化
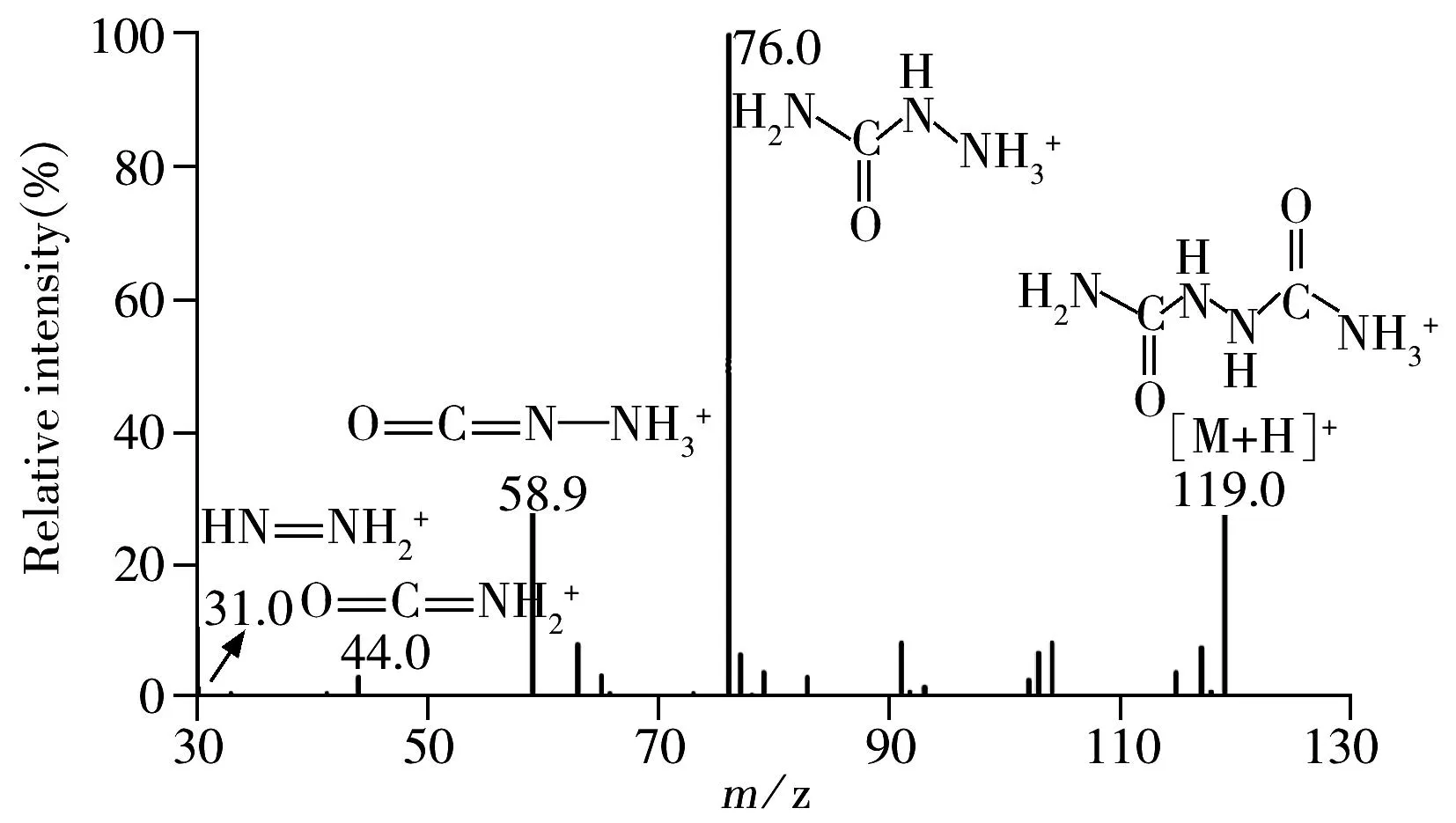
将10 mg/L的HDC与13C2,15N2-HDC标准溶液以针泵注射器恒流进样,分别在正、负离子模式下进行全扫描,选择最佳的电离方式及监测离子。结果表明,在正离子模式下,[M+H]+为响应度最强的离子,[M+Na]+次之。确定母离子后进行二级质谱扫描,选取丰度较强的碎片离子作为定量离子和辅助定性离子,并进一步优化碰撞能量、去簇电压等质谱参数,优化的质谱采集参数见表1。扫描质谱图及碎片裂解途径解析见图1。
2.2流动相的优化
本实验选择乙腈与纯水为流动相。在HPLC-MS/MS中,适量添加易挥发性酸可调节流动相pH值,优化峰形,并在质谱检测中提高待测物质的电离效率,从而提高检测灵敏度。考察了流动相中添加不同体积分数的甲酸和乙酸(0.1%,0.2%,0.5%,1.0%)对HDC电离效果与检测灵敏度的影响。实验显示未添加酸时灵敏度最高,该结果与文献[16]的研究结果一致。因此最终选用乙腈与纯水为流动相。

图2 不同洗脱方式对HDC色谱峰的影响Fig.2 Effect of different elution patterns on MRM chromatograms of biurea
对流动相的洗脱方式进行了优化。因氨基柱的键合官能团易水解,其有机相含量常保持在50%~95%。在此范围内改变有机相的变化速率,以获得最佳色谱峰形与检测灵敏度。最终优化的梯度程序如“1.3”所示。在其他分析条件相同的情况下,与袁丽红等[16]选用乙腈-水(70∶30)的等度洗脱相比,该梯度洗脱程序下HDC的出峰时间更早,信噪比为等度洗脱的3倍。图2为上述2种洗脱方式下100 μg/L HDC的色谱峰比较图。
2.3样品前处理条件的优化
2.3.1提取剂的优化食品中亲水性污染物的常用提取溶剂主要有甲醇、乙腈或水溶液[18-19],HDC的提取剂有纯水[16-17]与二甲基甲酰胺[15]。考察了纯水、50%乙腈水溶液、50%甲醇水溶液、10%二甲基甲酰胺水溶液作为提取剂的提取效率。分别称取不含HDC的空白基质(面粉、馒头、面包、油条、面条) 2.00 g,添加100 μg/kg的HDC标准品,比较不同提取剂的提取效率,结果见表2。结果显示,纯水作为提取剂时,提取效率最高。
由于提取剂在溶解提取待测物的同时会引入样品基体中的其他杂质,这些杂质对目标物质响应值的影响称为基质效应。不同的提取剂引入的杂质不同,产生的基质效应也不同。本实验对空白基质进行预处理,采用处理后的基质液配制基质匹配标准曲线。利用基质匹配标准曲线与溶剂稀释标准曲线中对应点绝对响应值的比值来衡量基质效应。比值小于1,说明基质对待测物的响应值有抑制作用;比值大于1,则说明基质对待测物的响应值有增强作用;比值越接近1,基质对待测物响应值的影响越小。结果显示,以纯水作为提取剂时,基质效应在0.95~1.13,10%二甲基甲酰胺水溶液作为提取剂时,基质效应在0.51~0.63,50%乙腈水溶液与50%甲醇水溶液的基质效应分别为0.79~0.88与0.74~0.80。因此,10%二甲基甲酰胺水溶液作为提取剂时,对HDC质谱响应值有较强的抑制作用。此结果可合理解释HDC更易溶于二甲基甲酰胺,因此10%二甲基甲酰胺水溶液的提取效率更低。综合考虑提取效率与基质效应,最终选用纯水作为提取剂。
表2不同提取剂对HDC提取效率的比较
Table 2Comparison between extraction efficiencies of different solvents for biurea
(μg/kg)

ExtractionsolventFlourSteamedbunNoodleBreadDeep-frieddoughsticksWater74.579.278.281.773.710%Dimethylformamide55.743.254.149.347.350%Acetonitrile54.362.154.943.851.550%Methanol43.152.237.051.743.2
2.3.2提取方法的优化利用加标面粉分别研究了不同提取方式、提取时间和提取次数对提取效率的影响。在不同提取方式中,超声提取的加标回收率为76.5%,远大于旋涡振荡提取的回收率(32.4%),因此本实验选择超声提取。比较了超声时间分别为10,20,30 min时对提取效率的影响,获得其加标回收率分别为65.2%,76.5%和79.1%,因此,实验选择最佳超声时间为30 min。在提取次数的基础上,同体积的提取剂分2次提取的回收率为87.9%,单次提取的回收率为67.3%。对于其他基质也获得了一致的结果。综合考虑提取时间与提取次数,最终选定的提取方式为超声提取,提取2次,每次15 min。
2.4同位素内标的应用
由于面制品种类繁多,性质差异大,采取基质匹配方法配制标准曲线,工作复杂繁琐。而检测物的同位素内标与检测物的色谱行为与质谱行为均一致。在样品进行前处理时即将同位素内标加入,不仅可以消除基质效应,也可校正操作带来的损失与误差。本实验选用稳定同位素内标物13C2,15N2-HDC,比较了加标样品分别采用内标法与外标法定量计算的回收率。结果显示,内标法定量的回收率为82.0%~113.6%,外标法定量的回收率为62.4%~74.3%。因此本实验最终采用内标法进行定量。
2.5方法性能
2.5.1线性范围与检出限取适量的标准储备液用初始流动相稀释成质量浓度为 0.2,0.5,1.0,2.0,5.0,10.0,20.0,50.0,100 μg/L 的系列浓度标准工作液进行HPLC-MS/MS分析。以HDC与内标的浓度比为横坐标,HDC与内标的峰面积比值为纵坐标,进行线性回归分析。结果表明,HDC在0.2~100 μg/L范围具有良好的线性,相关系数(r)为0.999 9。
分别称取不含HDC的空白基质(面粉、馒头、面包、油条、面条),添加HDC标准品,按照优化后的最终方法进行检测,以3倍信噪比(S/N)对应的质量浓度作为检出限(LOD),10倍信噪比对应的质量浓度作为定量下限(LOQ)。结果表明,HDC的LOD为5 μg/kg,LOQ为20 μg/kg。
2.5.2回收率与精密度选取经测定不含HDC的面粉、馒头、面包、油条、方便面5种空白基质,分别按照50,500,2 000 μg/kg 3个浓度水平进行加标回收实验,每个加标水平做6个平行样品,计算平均回收率与相对标准偏差(RSD),结果见表3。HDC的平均回收率为82.0%~113.6%,RSD为2.1%~9.3%。

表3 加标面粉及面制品的回收率与精密度测定结果(n=6)
2.6实际样品的测定
应用本方法对市售的面粉(31份)、馒头(12份)、面条(19份)、油条(10份)、面包(32份)进行检测。其中面包取样时分为表层与内芯,共获得实际检测样品136份。42份样品中检出HDC,检出率为30.88%。其中部分面制品样品的检出水平超出线性范围,据第一次检测值提高稀释倍数,再次进行测定。4份面粉样品中检出HDC,含量水平为43.7~564 μg/kg;馒头中未检出HDC,2份面条检出HDC,含量分别为70.8 μg/kg与9 840 μg/kg;1份油条检出HDC,含量为2 480 μg/kg;15份面包表层检出HDC,含量水平为27.4~8 730 μg/kg,20份面包内芯检出HDC,含量水平为64.3~18 100 μg/kg。不同基质实际样品的提取离子流色谱图见图3。面包样品中,同一样品内芯的HDC水平均高于表层,部分样品内芯中检出HDC,但表层中未检出。推测其原因为面包焙烤时,表层温度更高,部分HDC受热降解所致。


3结论
本文建立了面粉及其制品中HDC的同位素稀释高效液相色谱-串联质谱检测方法。样品基质中的HDC采用纯水超声提取,提取液稀释后测定。方法无需衍生化,操作简便快速,灵敏度高,检测范围广,能够满足日常分析的要求,为面粉及面制品监控提供了有力的技术支持。
参考文献:
[1]Wang Y C,Ren L Y,Zhang P T.J.Chin.CerealsOilsAssoc.(王远成,任凌云,张鹏涛.中国粮油学报),2001,16(1):32-35.
[2]Li Y,Li X G.CerealsOils(李晔,李晓光.粮食与油脂),2003,(5):6-8.
[3]Li Q L,Ke H L.CerealFeedInd.(李庆龙,柯惠玲.粮食与饲料工业),1998,(9):7-8.
[4]Wang M W,Pan C D,Fang W A,Cui J,Qi M X.CerealFeedInd.(王明伟,潘从道,房伟安,崔娟,祁明霞.粮食与饲料工业),1999,(2):1-3.
[5]Chen J W,Fan N N,You Y M,Yin Q G,Gong X.ModernFlourMillingIndustry(陈井旺,凡哪哪,游玉明,尹青岗,龚霄.现代面粉工业),2009,(2):6-8.
[6]Becalski A,Lau B P Y,Lewis D,Seaman S W.J.Agric.FoodChem.,2004,52(18):5730-5734.
[7]Noonan G O,Begley T H,Diachenko G W.J.Agric.FoodChem.,2008,(56):2064-2067.
[8]Gao S,Ru S G.Res.Environ.Sci.(高素,汝少国.环境科学研究),2013,26(6):637-644.
[9]Long B,Shan J,Yang L J.FoodRes.Dev.(龙彪,单军,杨立军.食品研究与开发),2012,7:236-238.
[10] Hirakawa K,Midorikawa K,Oikawa S,Kawanishi S.Mutat.Res.,2003,(536):91-101.
[11]Russell P R,Strachan A N.J.Chem.Soc.PerkinTrans.,1978,323-326.
[12]Ye J,Wang X H,Sang Y X,Liu Q.J.Agric.FoodChem.,2011,59(17):9313.
[13]GB 2760-2014.National Food Safety Standards-Standards for Uses of Food Additives(食品安全国家标准 食品添加剂使用标准) .
[14]Bechtold W E,Shopp G M,Cheng Y S.J.Anal.Toxicol.,1988,12(2):89-93.
[15]Mulder P P J,Beumer B,Van Rhijn J A.Anal.Chim.Acta,2007,586(1/2):366-373.
[16]Yuan L H,Ding H L,Chen Y,Yao W R.Sci.Technol.FoodInd.(袁丽红,丁洪流,陈英,姚卫蓉.食品工业科技),2013,34(10):73-76.
[17]Wang Y,Wang J S,Xiang L,Xi C X,Chen D D,Peng T,Wang G M,Mu Z D.Chin.J.Chromatogr.(王雅,王俊苏,向露,郗存显,陈冬东,彭涛,王国明,母昭德.色谱),2014,32(5):513-518.
[18]Huang F,Ma Y F,Wu H Q,Huang X L,Deng X,Luo H T,Zhu Z X,Lin X S.J.Instrum.Anal.(黄芳,马叶芬,吴惠勤,黄晓兰,邓欣,罗辉泰,朱志鑫,林晓珊.分析测试学报),2013,32(3):271-274.
[19]Wang H,Peng X K,Xia L X,Zhang J H,Li S,Zhou T C.J.Instrum.Anal.(汪辉,彭新凯,夏立新,章建辉,李莎,周探春.分析测试学报),2014,33(7):804-809.
Determination of Biurea in Flour and Flour Products by Isotope Dilution High Performance Liquid Chromatography-Tandem Mass Spectrometry
RUAN Sha-sha1,LIU Gui-hua2*,LIU Su-chun1*,ZHU Zhou2,LIU Jian-jun2
(1.College of Food Science and Technology,Hunan Agricultural University,Changsha410128,China;2.Shenzhen Center for Disease Control and Prevention,Shenzhen518055,China)
Abstract:An isotope dilution high performance liquid chromatography-tandem mass spectrometric(HPLC-MS/MS) method was established for the determination of biurea in flour and flour products.The biurea in certain matrices was extracted with ultrapure water,defatted with n-hexane when necessary,and then analyzed by HPLC-MS/MS.LC separation was performed on a Waters XBridge BEH Amide column(3.5 μm,4.6 mm×150 mm) using ultrapure water and acetonitrile as mobile phase by gradient elution.Identification was achieved by electrospray ionization(ESI+) in positive mode using multiple reaction monitoring.Quantification was performed by isotope labeled13C2,15N2-biurea internal standard calibration.The calibration curve of biurea showed a good linearity in the range of 0.2-100 μg/L with a correlation coefficient of 0.999 9.The average recoveries of biurea in flour,steamed bun,bread,deep-fried dough stick and noodle matrices(six aliquots for each level) at three spiked levels ranged from 82.0% to 113.6%,with RSDs of 2.1%-9.3%.The LOQ of the methed was 20 μg/kg.The optimized method was successfully applied in the analysis of 136 real samples collected from local markets in Southern China,while biurea residues were found in 42(30.88%) samples,of which 43.7-564 μg/kg of biurea existed in 4 flours,70.8-9 840 μg/kg in 2 noodles,2 480 μg/kg in 1 deep-fried dough stick,27.4-8 730 μg/kg in 15 breads-crust and 64.3-18 100 μg/kg in 20 breads-interior.This method is applicable for the determination of biurea in flour and different flour products due to its operation convenience,high sensitivity and good accuracy.
Key words:high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS);isotope labeled internal standard;flour;flour products;biurea
收稿日期:2015-09-23;修回日期:2015-10-15
基金项目:2014年深圳市科技研发资金基础研究项目(JCYJ20140410164217367)
*通讯作者:刘素纯,博士,教授,研究方向:营养与食品卫生学,Tel:0731-84617007,E-mail:liusuchun@163.com
doi:10.3969/j.issn.1004-4957.2016.04.008
中图分类号:O657.63;TQ225.261
文献标识码:A
文章编号:1004-4957(2016)04-0420-06
刘桂华,硕士,主任技师,研究方向:食品安全与残留物检验,Tel:0755-25601549,E-mail:gliu_686@hotmail.com

