超高效液相色谱-质谱联用法测定蔬菜中多杀霉素等4种农药残留
占绣萍,陈建波*,马 琳,黄兰淇,赵 莉,余淑红
(1.上海市农业技术推广服务中心,上海 201103;2.上饶市农产品质量安全检测中心,江西 上饶 333400)
超高效液相色谱-质谱联用法测定蔬菜中多杀霉素等4种农药残留
占绣萍1,陈建波1*,马琳1,黄兰淇1,赵莉1,余淑红2
(1.上海市农业技术推广服务中心,上海201103;2.上饶市农产品质量安全检测中心,江西上饶333400)
摘要:采用固相萃取/超高效液相色谱-串联质谱(SPE/UPLC-MS/MS)建立了多种蔬菜中4种农药残留量的分析方法,并对净化方法、色谱及质谱条件进行优化。蔬菜样品经乙腈提取、提取液经盐析后,取上清液经PC/NH2(或NH2)固相萃取小柱净化,浓缩后,用甲醇定容并过膜,采用超高效液相色谱-串联质谱多反应监测(MRM)正离子模式进行外标法定量测定。结果表明,4种农药在5~500 μg/L范围内线性关系良好(r≥0.999 2),在8种蔬菜中的检出限和定量下限分别为0.033~0.167 μg/kg和0.10~0.50 μg/kg 。在10,50,250 μg/kg 3个浓度加标水平下,4种农药的回收率为70.9%~123.4%,相对标准偏差(RSD)小于15%。方法准确、灵敏、简单、快速,适用于多种蔬菜中多杀霉素等4种农药残留的同时测定。
关键词:超高效液相色谱-质谱联用;固相萃取;农药残留;蔬菜
21世纪以来,受气候、种植制度、栽培方式、生态环境等因素的综合影响,植物上的病虫害暴发频繁,危害程度加重,防控压力增大,严重威胁农业生产安全。特别是随着设施农业的迅速兴起,农作物上的病虫害不断加重,许多新的设施病虫害不断发生。当下食品安全越来越受到人们重视,高效低毒低残留农药的推广应用必将成为趋势。多杀霉素、氟硅唑、噻虫嗪、茚虫威4种农药是近年上海市蔬菜作物重点推荐和补贴的农药新品种,在上海乃至全国范围内得到了广泛应用。 为了保证蔬菜质量安全,各国对这些农药残留实施了严格的监测,我国仅规定了这4种农药在几种蔬菜中的限量值,欧盟等发达国家的限量值比较完整,如欧盟规定氟硅唑在所有蔬菜中的限量值均为0.01 mg/kg;多杀霉素的限量值为0.02~10.0 mg/kg;噻虫嗪的限量值为0.05~10.0 mg/kg;茚虫威的限量值为0.02~3.0 mg/kg。目前,这些农药残留的检测方法主要包括气相色谱[1-2]、液相色谱[3-5]、气相色谱-质谱联用[6-7]、液相色谱-质谱联用[8-11]等,但这些方法的适用范围小,对于复杂基质的农药残留测定干扰大,不能同时进行这4种农药的多残留检测。
本文通过反复比较4种SPE柱(不同淋洗液)和3种QuEChERS净化剂的净化效果,选择2种蔬菜对UPLC-MS/MS检测中的基质效应、提取效率、回收率进行评估研究,优化了空心菜、芹菜、豇豆、黄瓜、番茄、卷心菜、大白菜、丝瓜8种蔬菜中多杀霉素等4种农药的前处理方法,发现SPE净化法适合不同品种、大批量样品的快速检测,且该方法的检出限、回收率以及相对标准偏差均能满足农药残留分析要求,能够较好地为蔬菜中多杀霉素等用量较大的农药残留监测及农产品质量控制提供科学依据和技术支持。
1实验部分
1.1试剂与材料
标准品:多杀霉素、氟硅唑、噻虫嗪、茚虫威(纯度>99.0%),均为德国Dr.Ehrenstorfer公司提供的有证标准物质。
试剂:氯化钠(分析纯),甲醇、乙腈、甲酸(色谱纯),Milli-Q高纯水,十八烷基键合硅胶(C18)吸附剂(43~60 μm),N-丙基乙二胺(PSA)吸附剂(25~100 μm),石墨化碳黑吸附剂(Carbon SPE bulk sorbent),无水硫酸镁,石墨碳黑-氨基串联(PC/NH2)固相萃取柱(500 mg/500 mg/6 mL),氨基(NH2)固相萃取柱(500 mg/6 mL),十八烷基键合硅胶(C18)固相萃取柱(500 mg/6 mL),弗罗里硅土(Florisil)固相萃取柱(1 000 mg/6 mL)。净化小柱和净化填料由天津博纳艾杰尔科技有限公司和美国安捷伦公司提供。
1.2仪器
Agilent1290 UPLC-Agilent 6460 MS超高效液相色谱-三重四极杆串联质谱联用仪:配ESI源(美国安捷伦公司);T25DS25高速匀浆分散器(德国IKA公司);GB11240-89电热恒温水浴锅(上海医疗器械五厂);AC-40氮吹浓缩器(安徽黄山医疗器械厂);国华SHAC恒温振荡器(常州国华电器有限公司);TDL-5-A离心机(上海安亭科学仪器厂);Milli-Q制水机。
1.3样品前处理
取不少于1 000 g样品(空心菜、芹菜、豇豆、黄瓜、番茄、卷心菜、大白菜、丝瓜),去除杂物,取可食部分,将样品缩分至500 g,经制样机处理后密封,于4 ℃冷藏保存。
1.3.1样品提取蔬菜样品:准确称取10 g样品(精确至0.01 g)加入到100 mL离心管中,加入20 mL乙腈,高速匀浆1 min,以5 000 r/min离心5 min,上清液转移至加入3~5 g 氯化钠的50 mL离心管中,剧烈振摇1 min,室温下静置1 h。
1.3.2样品净化空心菜、芹菜、豇豆、黄瓜(色素较深)样品:移取上清液5 mL至50 mL 小烧杯中,在50 ℃水浴温度下氮吹至约 1 mL。上样前,先用5 mL乙腈-甲苯(3∶1,体积比)预淋PC/NH2串联柱,弃去;当液面到达填料顶部时,迅速将样品浓缩液转移至净化柱上,再用5 mL乙腈-甲苯(3∶1)洗涤样液烧杯,并将洗涤液转移至净化柱中,再重复4次洗涤转移,收集上述25 mL洗脱液于100 mL烧杯中,50 ℃水浴温度下氮吹至干。加入2.5 mL 乙腈混匀定容,经0.22 μm微孔有机滤膜过滤后,供超高效液相色谱-质谱测定。
番茄、卷心菜、大白菜、丝瓜(色素较浅)样品:用NH2柱替代PC/NH2串联柱,其他相同。
1.4色谱-质谱条件
1.4.1色谱条件Poroshell 120 EC-C18反相液相色谱柱(3.0 mm×100 mm,2.7 μm);流动相:A为5 mmol/L乙酸铵水溶液,B为乙腈;流速0.40 mL/min;柱温40 ℃;进样量2 μL 。梯度洗脱程序:0~0.5 min,95% A;0.5~4.0 min,95%~20% A;4.0~7.0 min,20%~5% A。停止时间7.0 min 。
1.4.2质谱条件离子源:大气压电喷雾电离,正离子模式(ESI+);毛细管电压:3.5 kV;离子源干燥气温度:300 ℃;鞘气温度:350 ℃;鞘气流量:12 L/min;扫描方式:多反应监测(MRM);5.5 min后加电子倍增管电压(EMV) 300 V。4种农药的质谱分析参数见表1。

表1 4种农药的多反应监测质谱分析参数
*quantitative ion
2结果与讨论
2.1样品前处理条件的优化
2.1.1净化条件的优化蔬菜样品基质中含有较多的有机酸、维生素以及脂肪等,这些物质带来的基质效应将会严重影响检测结果的准确性[12]。为降低或消除基质效应,选择合适的样品前处理方法至关重要[13]。本研究对固相萃取(SPE) 与基质固相分散萃取法两种净化技术进行了比较。
采用SPE柱进行净化时,选择了NH2,Florisil,C18,PC/NH24种固相萃取柱,并选择不同的淋洗液进行洗脱。NH2-SPE:二氯甲烷+甲醇(95+5) 4 mL预淋,10 mL洗脱;Florisil-SPE:丙酮+正己烷(10+90) 4 mL预淋,10 mL洗脱;C18-SPE:乙腈+甲苯(3+1) 5 mL预淋,10 mL洗脱;PC/NH2-SPE:乙腈+甲苯(3+1) 5 mL预淋,10 mL洗脱,收集第1瓶(石墨化碳易吸附农药,所以洗脱液又增加15 mL,收集第2瓶);分别收集洗脱液,吹干,定容,待测。
采用基质固相分散萃取(类似QuEChERS)净化法时,选择3种不同的净化填料进行筛选:QuE1(0.1 g PSA-0.3 g MgSO4);QuE2(0.1 g PSA-0.3 g MgSO4-0.05 g Carb);QuE3(0.3 g MgSO4-0.1 g C18-0.1 g PSA)。其他步骤参照文献[14]。
以基质较复杂、色素较深的空心菜为例,添加100 μg/kg的混标至空心菜空白样品中,重复测定3次,以纯标计算得到的回收率结果如表2所示。
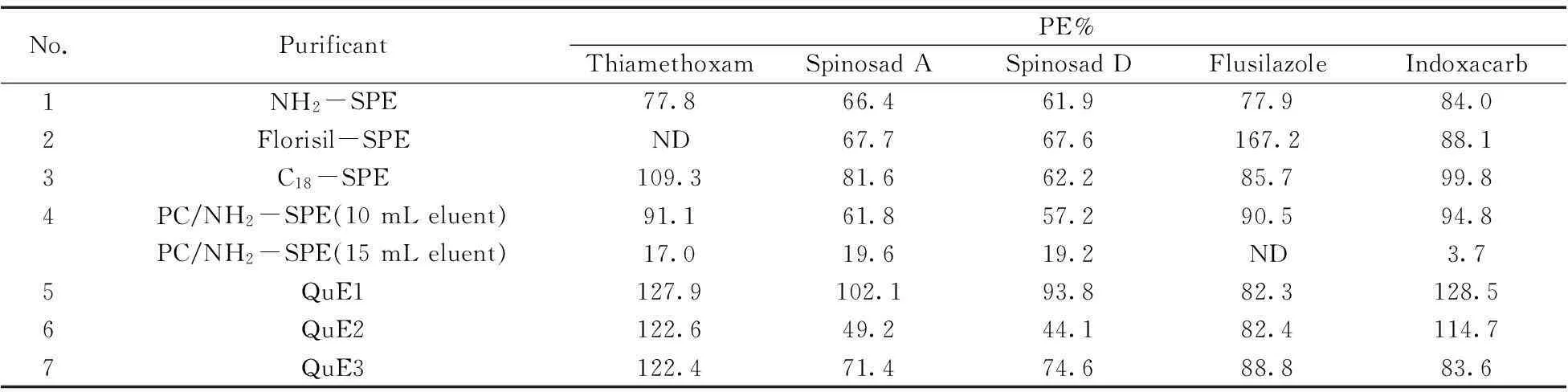
表2 不同净化条件下空心菜样品加标回收率的比较
ND:no detected
通过以上7种方法的比较,并综合去除色素效果和回收率结果,发现方法4(淋洗液10+15 mL)既能保证方法回收率,又能除去色素等杂质,有利于保护色谱柱、离子源等,延长色谱柱、仪器的寿命。
根据上述试验,发现淋洗液用乙腈-甲苯混合溶剂,空心菜样品中5种化合物的回收率和杂质的去除效果最佳。
实验继续考察了色素较浅的番茄空白样添加100 μg/kg标样后的回收率,重复3次,并筛选了PC/NH2,NH2,C18,QuE3 4种净化方法,SPE的洗脱液统一用乙腈-甲苯(3∶1,体积比)25 mL,QuE3(0.3 g MgSO4-0.1 g C18-0.1 g PSA),实验结果见表3 。

表3 不同净化方法在番茄空白样品中加标回收率的比较
从表3结果可知,QuE3法的回收率偏高,去除杂质效果有限,基质效应较明显;C18-SPE柱中噻虫嗪的回收率偏高,NH2柱和PC/NH2串联柱的回收率基本能满足要求,PC/NH2串联柱的回收率比NH2柱的回收率低,可能是由于PC/NH2串联柱中的PC较容易吸附农药。NH2柱的价格低,故从成本和回收率结果考虑,对于色素较低的样品采用NH2柱净化。
2.1.2SPE方法中淋洗液体积的优化选择PC/NH2-SPE,乙腈-甲苯(3∶1)混合溶剂,考察了不同淋洗液体积(10,15,20,25,30 mL)对空心菜中噻虫嗪、多杀霉素A、多杀霉素D、氟硅唑、茚虫威回收率(加标100 μg/kg)的影响。结果表明,随着乙腈-甲苯淋洗剂体积的增大,噻虫嗪、多杀霉素A、多杀霉素D的回收率增加,氟硅唑、茚虫威的回收率增加不明显。当淋洗液体积达到25 mL时回收率基本能满足分析要求;当洗脱液在30 mL时回收率较高,但噻虫嗪的回收率偏高是由于杂质干扰增强。所以确定淋洗剂体积为25 mL。
选择NH2柱,乙腈-甲苯(3∶1)混合溶剂,考察了不同淋洗体积(10,15,20,25,30 mL)对番茄中噻虫嗪、多杀霉素A、多杀霉素D、氟硅唑、茚虫威回收率(100 μg/kg)的影响。结果表明,氟硅唑、茚虫威的回收率在10 mL洗脱液时已能满足要求;噻虫嗪、多杀霉素A、多杀霉素D的回收率随着淋洗液的增加而增加,当淋洗液体积达到25 mL时洗脱液较为澄清,且回收率基本能满足分析要求;当洗脱液在30 mL时回收率较高,但洗脱液的颜色加深且浑浊,噻虫嗪的回收率明显偏高,杂质干扰增强。因此,确定最佳淋洗剂体积为25mL。
2.2色谱条件的选择
2.2.1流动相的筛选比较了甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.1%甲酸水流动相体系的分离效果,由于4种农药均为正离子电离模式,在流动相中加入甲酸后4种农药更易于电离,且灵敏度更高,所以选择水相中加一定的甲酸。有机溶剂相使用甲醇时,多杀霉素D和氟硅唑很难分开;而用乙腈则可以得到较好地分离,所以最终选择乙腈-0.1%甲酸水为流动相。
2.2.2色谱柱比较了常用的3种超高效液相色谱柱:poroshell 120 EC-C18(3.0 mm×100 mm,2.7 μm),poroshell 120 EC-C18(3.0 mm×50 mm,2.7 μm),ZORBAX Eclipse Plus C18(2.1 mm×50 mm,1.8 μm)。发现100 mm长柱比50 mm短柱能更好地分离以上4种农药,所以选择poroshell 120 EC-C18(3.0 mm×100 mm,2.7 μm)进行分离。
2.2.3柱温考察了柱温(20,30,40 ℃)对分离效果的影响,发现4种农药的灵敏度和稳定性均变化不明显。但柱温高时,泵压力较小,样品溶液中的颗粒不易凝固在柱中,所以选择温度40 ℃,以保证样品溶液顺利通过色谱柱,较好的延长色谱柱寿命。
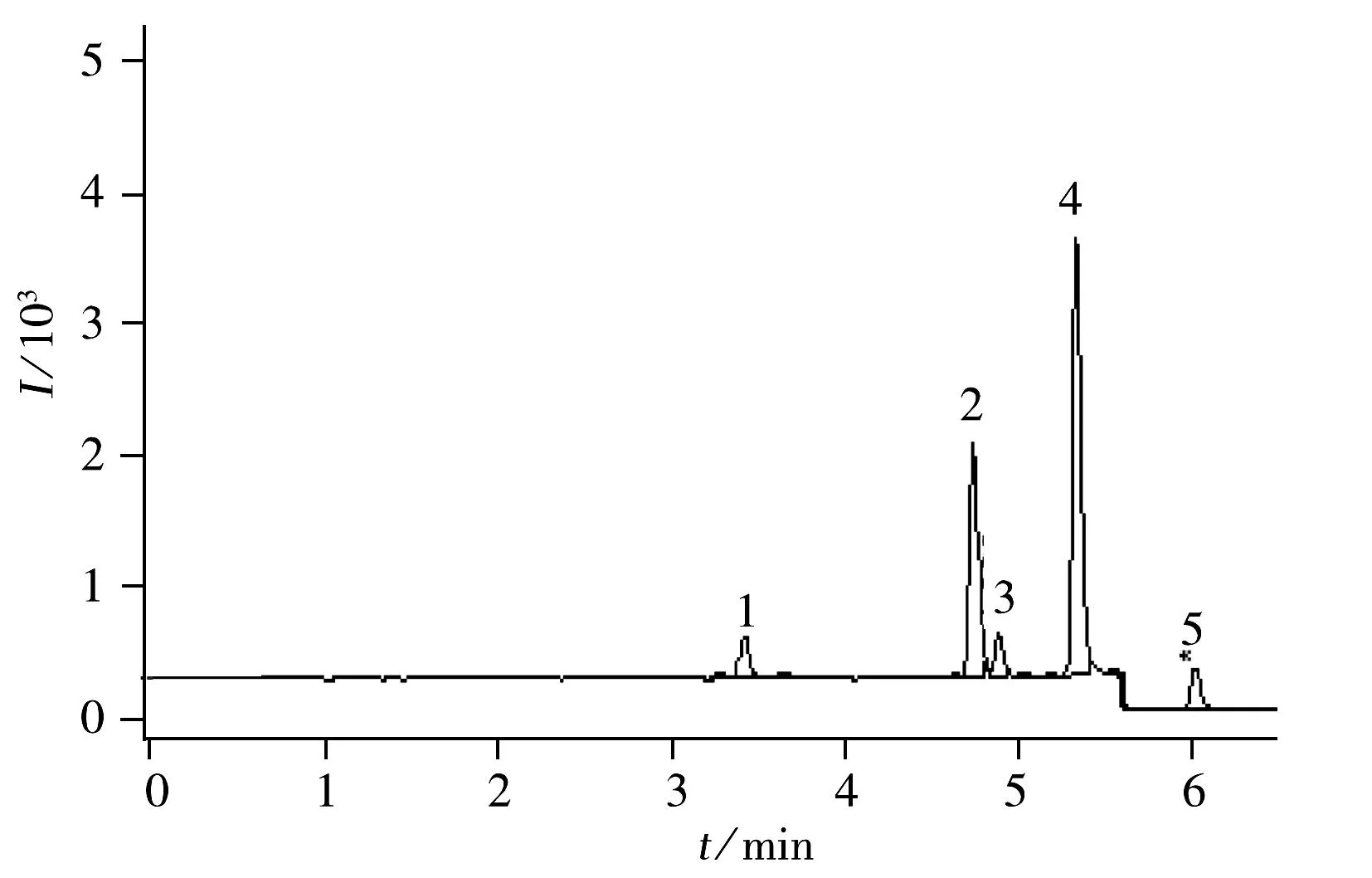
图1 4种农药标准溶液(5 μg/L)在MRM模式下的UPLC-MS/MS色谱图Fig.1 UPLC-MS/MS chromatogram of 4 pesticides(5 μg/L)1.thiamethoxam,2.spinosad A,3.spinosad D,4.flusilazole,5.indoxacarb
2.3质谱条件的选择
将4种农药标准储备溶液稀释至500 μg/L,分别进行一级质谱扫描以确定各农药的准分子离子峰;再分别以其准分子离子进行选择离子监测(MS2SIM),并优化碎裂电压(Fragment);再通过子离子扫描(Product ion scan)确定定量离子和定性离子,最后采用多反应监测(MRM)采集模式进行碰撞能量的进一步优化。因为茚虫威的灵敏度较低,所以在茚虫威出峰(5.5 min)时开始加电压(Delta EMV)300 V,可以更好地提高其响应值。
2.4检出限与线性范围
配制4种农药的混合标准溶液,质量浓度分别为5,10,50,100,250,500 μg/L,进样2 μL,以MRM定量离子的色谱峰面积(Y)对分析物的质量浓度(X,μg/L)绘制标准曲线,以3倍信噪比(S/N)确定检出限(LOD),10倍信噪比(S/N)确定定量下限(LOQ),结果见表4 。4种农药在5~500 μg/L范围内线性关系良好,LOD为0.033~0.167 μg/kg,LOQ为0.10~0.50 μg/kg。图1为5 μg/L标准品的MRM色谱图。
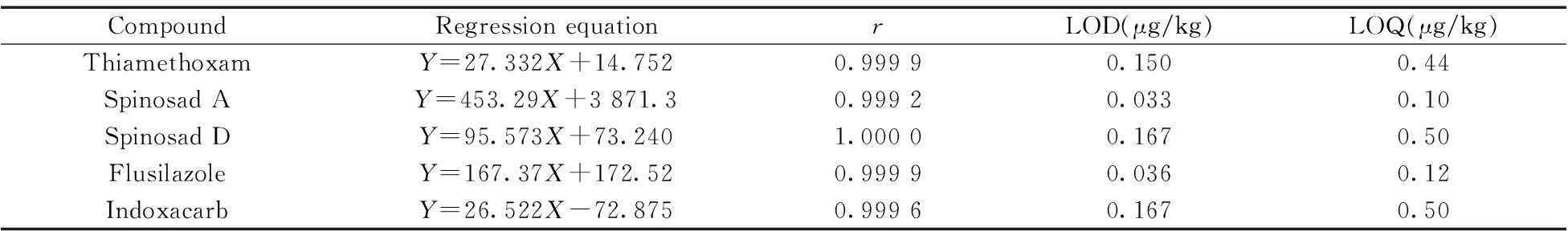
表4 4种农药的线性方程、相关系数(r)、 检出限(LOD)和定量下限(LOQ)
2.5回收率与精密度
分别采用空心菜、芹菜、豇豆、黄瓜、番茄、卷心菜、大白菜、丝瓜8种蔬菜进行添加回收实验和精密度实验,分别以10,50,250 μg/kg 作为3个添加水平,每个添加水平做5次平行实验,结果如表5所示。

表5 3个加标水平下农药的回收率及精密度(n=5)
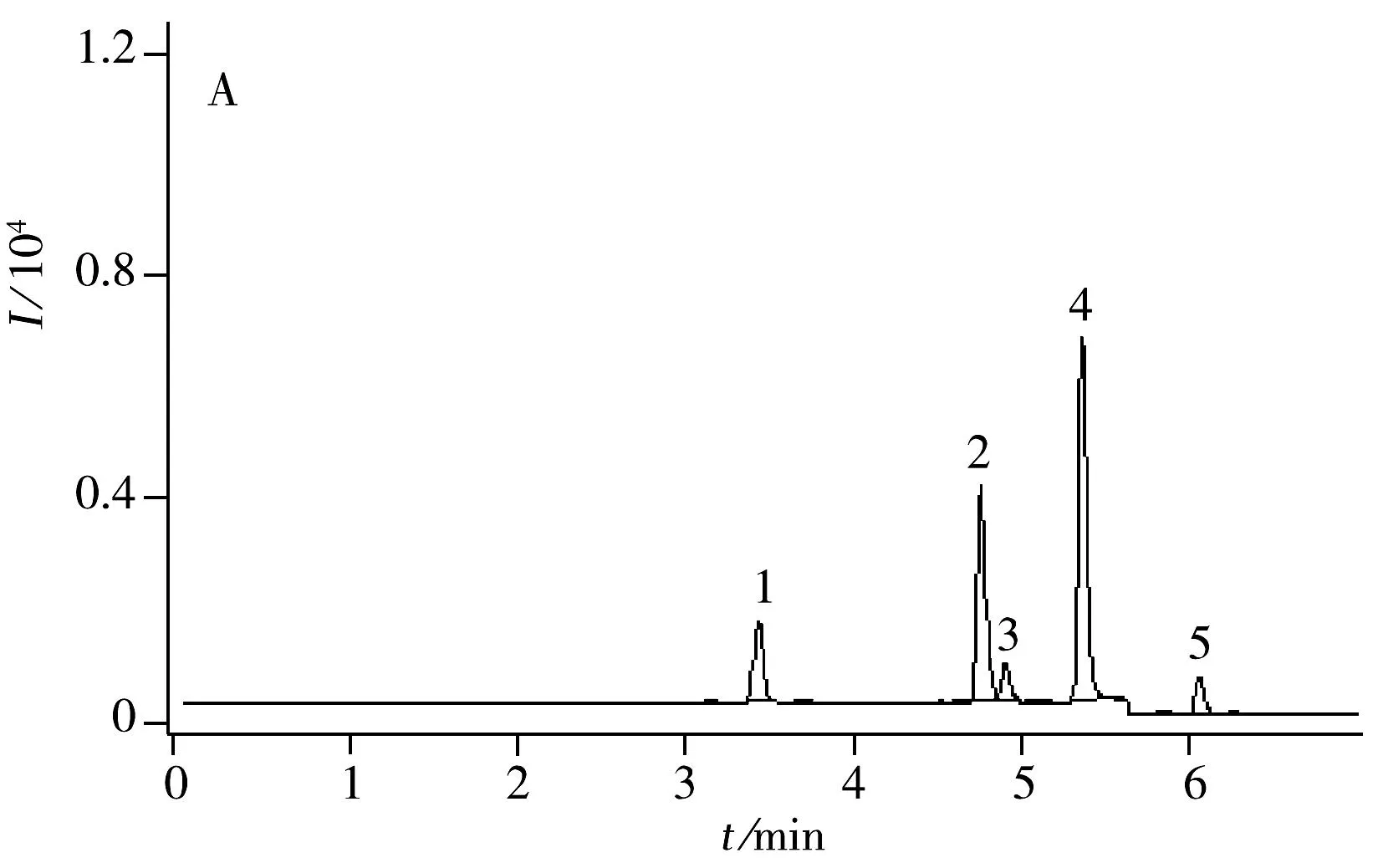
4种农药(5种化合物)的平均回收率为70.9%~123.4%,相对标准偏差(RSD)为0.7%~14.2 %,表明该方法有良好的精密度和准确度,能达到残留分析的要求。图2为空心菜和番茄添加10 μg/kg样品的UPLC-MS/MS色谱图。
2.6蔬菜样品的检测
应用本方法对市售多种蔬菜共100个样品进行随机抽检。在杭白菜、空心菜、米苋、芹菜、青菜、生菜等12个样品中检出茚虫威(残留量0.01~0.25 mg/kg),茼蒿、苋菜、芹菜3个样品中检出噻虫嗪(残留量0.01~0.16 mg/kg),苋菜等2个蔬菜样品检出氟硅唑(残留量0.03~0.04 mg/kg)。查询国标、CODEX/FAO、欧盟、日本等对噻虫嗪等4种农药在相应蔬菜上最大残留限量值(MRL),发现参照欧盟标准:氟硅唑在所有蔬菜中的MRL为0.01 mg/kg(国标暂未规定氟硅唑在苋菜中的MRL,规定其在玉米笋中为0.01 mg/kg,刀豆、番茄0.1 mg/kg,黄瓜1 mg/kg)。本次抽检的100个蔬菜样品中,有2个苋菜样品超标(氟硅唑参照欧盟蔬菜上的残留限量值),需谨慎使用。
参考文献:
[1]Zhu L P,Dong J,Sun J,Pan S Q.Chin.J.Anal.Lab.(朱丽萍,董静,孙军,潘守奇.分析试验室) ,2008,27(8):79-82.
[2]Lu S M,Wang X C,Zhang J T,Ma Y E.Mod.Agrochem.(陆松茂,汪学才,张俊涛,马又娥.现代农药),2007,6(5):35-38.
[3]Jian Q,Zhu G Y,Zheng Z T.Agrochemicals(简秋,朱光艳,郑尊涛.农药),2015,54(1):51-52.
[4]Chen L,Chen J M,Xia F L,Dai L C,Yu P Z.Chin.J.Pestic.(陈莉,陈家梅,夏福利,戴荣彩,余苹中.农药学学报),2004,6(2):87-89.
[5]Liu B,Guo D L,Mao J S,Zhao S C,Wang Y T.Agrochemcals(刘宾,郭栋梁,毛江胜,赵善仓,王玉涛.农药),2009,48(9):667-668,674.
[6]Wang L Z,Wang D F,Zheng J C,Wang R L,Liu Y N.Phys.Test.Chem.Anal.:Chem.Anal.(王连珠,王登飞,郑俊超,王瑞龙,刘溢娜.理化检验:化学分册) ,2006,42(12):1025-1029.
[7]Zhang F,Zhang X Z,Luo F J,Chen Z M,Sun W J,Liu G M,Lou Z Y.J.Instrum.Anal.(张芬,张新忠,罗逢健,陈宗懋,孙威江,刘光明,楼正云.分析测试学报),2013,32(4):393-400.
[8]GB/T 20769-2008.Determination of 450 Pesticides and Relates Chemicals Residues in Fruits and Vegetables—LC-MS-MS Method(水果和蔬菜中450种农药及相关化学品残留量的测定 液相色谱-串联质谱法.中华人民共和国标准).
[9]Sun M,Cao Z Y,Liu H,Ma Y N,Chen M X.Chin.J.Anal.Lab.(孙敏,曹赵云,刘慧,马有宁,陈铭学.分析试验室) ,2010,29(8):70-74.
[10]Wu Y,Jiang B,Xu Y G,Zhao W,Meng X R,Zhou Y,Yu J H,Zu Y G.Chin.J.Chromatogr.(吴岩,姜冰,徐义刚,赵伟,孟祥瑞,周原,于佳会,祖元刚.色谱) ,2015,33(3):228-234.
[11]Jiang B W.FoodSci.(江滨炜.食品科学),2009,30(10):176-178.
[12]Zhou L,Wang X Q,Xu H,Wang X Y,Liu X C,Liu Z W,Liu Q J,Zhang H.Phys.Test.Chem.Anal.:Chem.Anal.(周莉,王新全,徐浩,王祥云,刘芯成,刘之伟,刘秋菊,章虎.理化检验:化学分册),2009,28(6):753-756.[13]Xiang P,Shen M,Zhuo X Y.J.Instrum.Anal.(向平,沈敏,卓先义.分析测试学报),2009,28(6):753-756.[14]Yi X B,Liang Y S,Huang X Q,Sun H Z,Jiang C,Liu S Q.J.Instrum.Anal.(易锡斌,梁玉树,黄晓琴,孙慧珍,江楚,刘世琦.分析测试学报),2015,34(7):829-835.
Simultaneous Determination of Four Pesticides Residues in Vegetables by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
ZHAN Xiu-ping1,CHEN Jian-bo1*,MA Lin1,HUANG Lan-qi1,ZHAO Li1,YU Shu-hong2
(1.Shanghai Agriculture Technical Extension Service Center,Shanghai201103,China;2.Shangrao Agricultural Product Quality and Safety Testing Center in Jiangxi Province,Shangrao333400,China)
Abstract:A method was developed for the determination of four pesticides residues in a variety of vegetables using solid-phase extraction(SPE) and ultra performance liquid chromatography-triple quadrupole-mass spectrometry(UPLC-MS/MS).The purification methods(solid phase extraction column,QuEChERS method,elution solvent,elution volume),chromatographic conditions(mobile phase type,flow rate and column temperature) and mass spectrometric parameters(fragment,delta EMV) were optimized.The pesticides samples were extracted with acetonitrile,and then cleaned up on a Carbon/NH2(or NH2) SPE column.The eluting solution was evaporated and made up to a definite volumn with methanol,finally analyzed by reversed-phase ultra performance liquid chromatography under multiple reaction monitoring(MRM) of positive ion mode with the external standard method.The calibration curves of four pesticides showed good linearities in the range of 5-500 μg/L with correlation coefficients not less than 0.999 2.The limits of detection(LOD) were in the range of 0.033-0.167 μg/kg and the limits of quantitation(LOQ) were in the range of 0.10-0.50 μg/kg for 4 pesticides spiked in vegetable.The recoveries of 4 pesticides in vegetable sample spiked with three concentration levels of 10,50,250 μg/kg ranged from 70.9% to 123.4% with RSDs less than 15%.The established method was accurate,sensitive and simple,and was suitable for the simultaneous analysis of various pesticides residues.
Key words:ultra performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS);solid-phase extraction(SPE);pesticide residue;vegetable
收稿日期:2015-09-30;修回日期:2015-11-07
基金项目:上海市农业委员会青年科技基金(沪农青字(2014)第4-11号)
*通讯作者:陈建波,硕士,农艺师,研究方向:农药质量与残留分析,Tel:021-64059431,E-mail:cjb0123@126.com
doi:10.3969/j.issn.1004-4957.2016.04.018
中图分类号:O657.63;F767.2
文献标识码:A
文章编号:1004-4957(2016)04-0476-06

