RP- HPLC法测定牛黄上清丸中栀子苷、芍药苷、黄芩苷、小檗碱的含量
杨小军,丁永辉西北民族大学化工学院,甘肃兰州7304;甘肃食品药品监督管理局
RP- HPLC法测定牛黄上清丸中栀子苷、芍药苷、黄芩苷、小檗碱的含量
杨小军1,丁永辉2
1西北民族大学化工学院,甘肃兰州730124;2甘肃食品药品监督管理局
[摘要]目的:建立牛黄上清丸中栀子苷、芍药苷、黄芩苷和小檗碱的含量测定方法。方法:采用高效液相色谱(RP-HPLC)梯度洗脱,在不同波长下测定含量。色谱条件:Zorbax Ecl i pse XDB-C(18)键合硅胶(4.6 mm× 150 mm,5 μm),流动相乙腈为0.2%磷酸水梯度洗脱,流速1.0 mL/mi n,柱温为20℃,检测波长分别为240 nm(栀子苷、芍药苷),275 nm(黄芩苷),350 nm(盐酸小檗碱)。结果:栀子苷、芍药苷、黄芩苷和盐酸小檗碱分别在0.112~0.84μg(r=0.9998),0.20~1.50μg(r=0.9992),0.208~3.64μg(r=0.9990),0.232~2.32μg(r=0.999 7)范围内线性关系良好,平均加样回收率分别为98.62%,100.30%,99.80%,98.92%,RSD分别为1.66%、1.93%、0.94%、0.95%。结论:该方法操作简便,结果准确,精密度高,重现性良好,可用于同时测定牛黄上清丸(大蜜丸)中栀子苷、芍药苷、黄芩苷和盐酸小檗碱的含量,可为提升、完善牛黄上清丸的质量标准及含量测定的方法提供科学依据。
[关键词]RP-HPLC;牛黄上清丸;栀子苷;芍药苷;黄芩苷;盐酸小檗碱
Determination of Jasminoidin,Peoniflorin,Baicalin and Berberine Hydrochloride in NiuHuang ShangQing Pills by RP-HPLC
YANG Xiaojun1,DING Yonghui2
1 Chemical Engineering Institute of Northwest University for Nationalities,Lanzhou 730124,China;2 Gansu Food and Drug Administration
Abstract Objective:To establish the method for content determination of jasminoidin,peoniflorin,baicalin and berberine hydrochloride in NiuHuang ShangQing pills.Methods:RP-HPLC was adopted for gradient elution,and the contents were detected under different wavelength.Chromatographic conditions:Zorbax Eclipse XDB-C18bonded silica gel chromatographic column(4.6 mm×150 nm,5μm),mobile phase:acetonitrile:0.2% phosphoric acid solution,gradient elution,flow rate was 1.0 mL/min,column temperature was 20℃,detection wavelengths were 240 nm (jasminoidin,peoniflorin),275 nm (baicalin) and 350 nm (berberine hydrochloride).Results:Jasminoidin,peoniflorin,baicalin and berberine hydrochloride presented better linear relationship in the ranges between 0.112 and 0.84 μg(r=0.999 8),0.20 and 1.50μg(r=0.999 2),0.208 and 3.64μg (r=0.999 0),0.232 and 2.32 μg(r=0.999 7),average recovery rates were 98.53%,100.30%,99.80% and 98.62% respectively.RSD were 1.66%,1.93%,0.94% and 0.95%.Conclusion:The method,easy to operate,accurate and reproducible,couldbe usedto determine the contents of jasminoidin,peoniflorin,baicalinand berberine hydr ochloridein NiuHuang ShangQing pills simultaneously,and it could provide scientific evidence for improving quality control and content determination methods of NiuHuang ShangQing pills.
Keywords RP-HPLC;NiuHuang ShangQing pills;jasminoidin;peoniflorin;baicalin;berberine hydrochloride
牛黄上清丸(大蜜丸)是中医治疗实热证的经典方剂之一,首载于明代著名医家李梴的《医学入门》,是《中国药典》历年收载的品种[1],药方由人工牛黄、栀子、黄连、黄柏、黄芩、大黄、连翘、赤芍等十九味中药调制而成。牛黄上清丸具有清热泻火、解毒消肿、除烦、疏风等功效。牛黄上清丸(大蜜丸)的主要组成药物为栀子、黄连、黄柏、赤芍、黄芩,栀子苷、盐酸小檗碱、芍药苷及黄芩苷。有报道采用高效液相色谱法对牛黄上清丸中黄芩苷和小檗碱的含量进行测定[2-4],但同时测定其中栀子苷、芍药苷、黄芩苷和盐酸小檗碱含量的方法未见文献报道,因此有必要对其进行含量测定,以控制其质量。笔者运用高效液相色谱法建立同时测定栀子苷、芍药苷、黄芩苷及盐酸小檗碱的含量的方法,具有快速、方便、灵敏度高、选择性好、可同时分析多种化合物等优点,可为提升牛黄上清丸的质量标准及含量测定的方法提供科学依据。
1 仪器与试药
Agilent 1200高效液相色谱仪(美国Agilent公司提供),G1322A型配置真空脱气机、G1329A型自动进样器、DAD,G1315B型真空二极管阵列检测器、G1311A型四元泵,Zorbox Eclipse XDB-C18键合硅胶色谱柱(4.6 mm×150 mm,5 μm);Agilent 1200色谱工作站(美国Agilent公司提供);AB204-S型电子分析天平(瑞士Mettler Toledo公司提供);AP001-0671型抽滤机;AS3120型双频数控超声波清洗仪(天津奥特赛斯恩斯仪器有限公司提供);DFT-200型万能粉碎机(温岭市林大机械有限公司提供)。甲醇(分析纯,天津市北方天医化学试剂厂生产),甲醇(色谱纯,天津市光复精细化工研究所生产),乙腈(色谱纯,天津市凯信化学工业有限公司生产);磷酸(分析纯,烟台市双双化工有限公司生产);水为超纯水。栀子苷对照品(中国药品生物制品检定所,批号:749-8801含量测定用);芍药苷对照品(中国药品生物制品检定所提供,批号:110736-201333);黄芩苷对照品(中国药品生物制品检定所提供,批号:110715-201316供含量测定用);盐酸小檗碱对照品(中国药品生物制品检定所提供,批号:110713-201209供含量测定用);牛黄上清丸(北京同仁堂股份有限公司同仁堂制药厂提供,批号:0015447,0015483,1015268,规格6 g×10丸)。
2 溶液的制备
2.1对照品溶液的制备分别取栀子苷对照品、芍药苷对照品、黄芩苷对照品和盐酸小檗碱对照品适量,精密称定后,分别置于10 mL容量瓶中,加一定量甲醇(分析纯),摇匀,置超声仪中超声至全部溶解,放冷至室温,加甲醇至刻度,摇匀,即得含栀子苷、芍药苷、黄芩苷及盐酸小檗碱浓度分别为0.2、0.32、0.32、0.252 mg/mL。然后分别精确量取上述各对照品贮备液,按体积1∶1混合,充分摇匀,即得含栀子苷0.05mg/mL、芍药苷0.08 mg/mL、黄芩苷0.08 mg/mL和盐酸小檗碱0.063 mg/mL的混合对照品溶液。取适量混合对照品溶液,用微孔滤膜(孔径:0.45 μm)滤过,弃去初滤液,取续滤液,备用。
2.2样品溶液的制备取牛黄上清丸约3 g,剪成小块,精密称定,置研钵中,以40 mL甲醇分次研磨,定量转移至50 mL具塞容量瓶中,超声提取1小时,取出放冷至室温后加甲醇定容至刻度,摇匀,静置,取上清液,用微孔滤膜(孔径:0.45 μm)滤过,弃去初滤液,取续滤液,备用。
2.3阴性对照品溶液的制备牛黄上清丸中栀子苷、芍药苷、黄芩苷及盐酸小檗碱分别来自中药材栀子、赤芍、黄芩、及黄连和黄柏,按牛黄上清丸(大蜜丸)处方组成比例与制备方法,按样品溶液的制备方法分别配制缺栀子、缺赤芍、缺黄芩、缺黄连和黄柏的阴性对照品溶液。
3 色谱条件
色谱柱:Zorbox Eclipse XDB-C18键合硅胶色谱柱(4.6 mm×150 mm,5 μm);柱温:20℃;检测波长:240 nm(栀子苷,芍药苷),275 nm(黄芩苷),350 nm(盐酸小檗碱);流动相:乙腈(A)-0.2%磷酸水溶液(B);流速:1.0 mL/min,梯度洗脱程序见表1。
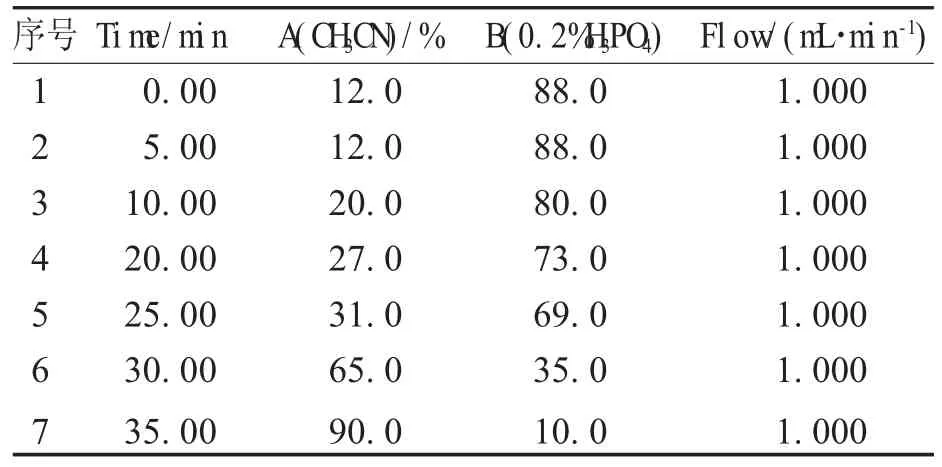
表1 梯度梯度洗脱程序
3.1分离度考察分离度是用来判断物质在色谱柱中的分离情况,常用分离度作为色谱柱分离能力的指标,用R表示。其中R=2(tR1-tR2)/(W1+W2)。精密吸取上述牛黄上清丸样品溶液,按上述色谱条件进样,进样量10 μL,结果见表2。

表2 分离度考察结果
从表2可以看出,栀子苷、芍药苷、黄芩苷、盐酸小檗碱与相邻杂质峰之间的分离度均大于1.5,表明4种待测组分均能与杂质完全分离,分离效果良好。
3.2专属性实验分别取混合对照品溶液、样品溶液及各阴性对照品溶液,按3项下的色谱条件分别进行进样分析,进样量为10 μm,记录色谱图,结果如下图1—3。结果显示,在样品溶液色谱图中,有与混合对照品溶液栀子苷、芍药苷、黄芩苷及盐酸小檗碱保留时间相一致的特征峰,而阴性对照品无此特征峰,表明其他组分对所测组分无干扰。分析结果表明,本法的专属性良好。

图1 240 nm处的色谱图
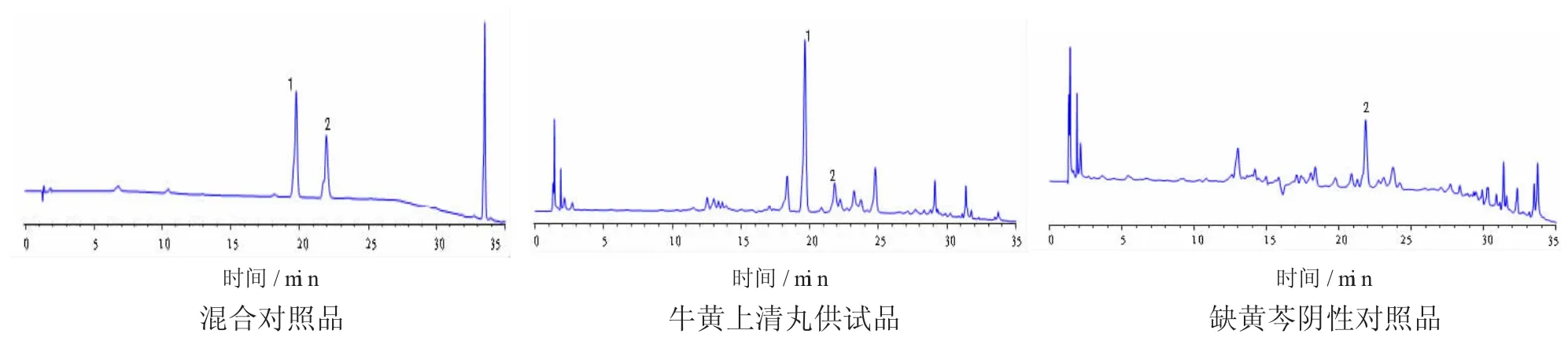
图2 在275nm处的色谱图
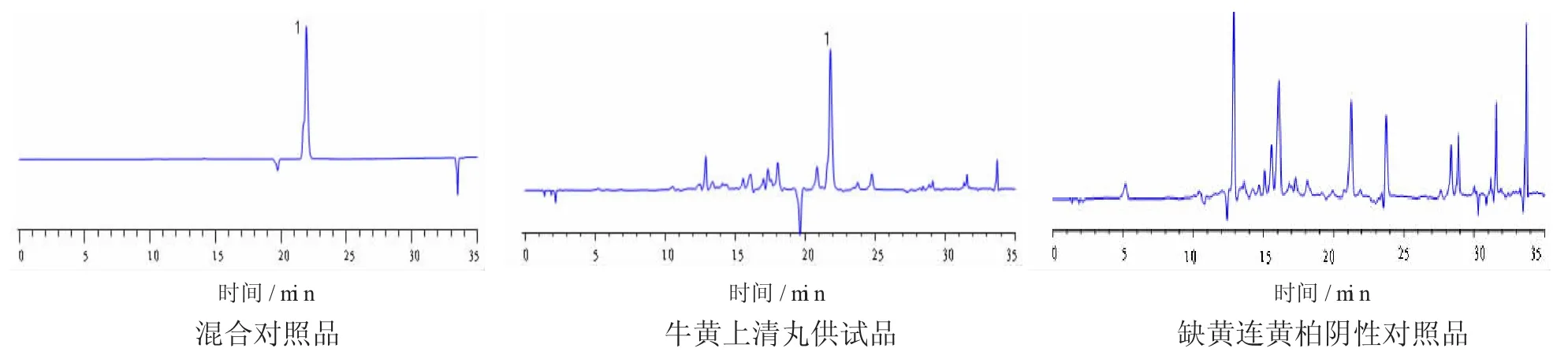
图3 在350nm处的色谱图
3.3拖尾因子实验检查待测峰的拖尾因子是为了保证色谱柱的分离效果和测定精度。拖尾因子是通过计算5%峰高处峰宽与峰顶点至前沿的距离来评价峰形的参数,用T表示。其计算公式为:T=W0.05h/2d1。式中W0.05h为5%峰高处的峰宽;d1为峰顶点至峰前沿之间的距离。精密吸取样品溶液,按3项下色谱条件进样,进样量10 μL,结果见表3。
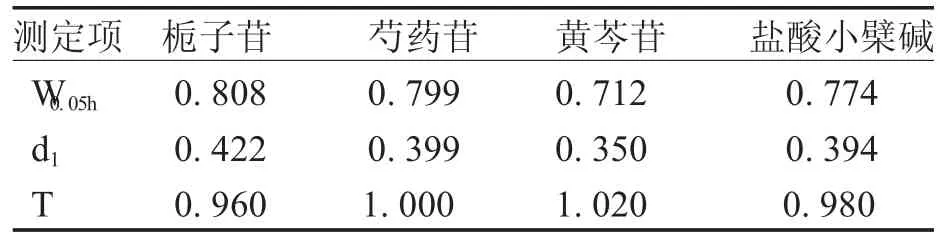
表3 拖尾因子实验
从表3可以看出,栀子苷、芍药苷、黄芩苷和盐酸小檗碱的拖尾因子介于0.95~1.05之间,符合《中国药典》规定,峰形良好。
3.4理论板数计算理论板数N用于评价色谱柱的效能,是色谱的柱效能参数之一。N取决于固定相的性质(粒度、粒径分布等)、填充状况、色谱柱柱长、流动相的种类好流速及测定柱效所用物质的性质。若峰形对称,则N可用下式表示:
N=5.54(tR/Wh/2)2式中tR表示保留时间,Wh/2表示半高峰宽。精密吸取上述混合对照品溶液,按上述色谱条件进样,进样量为10 μL,结果见表4。
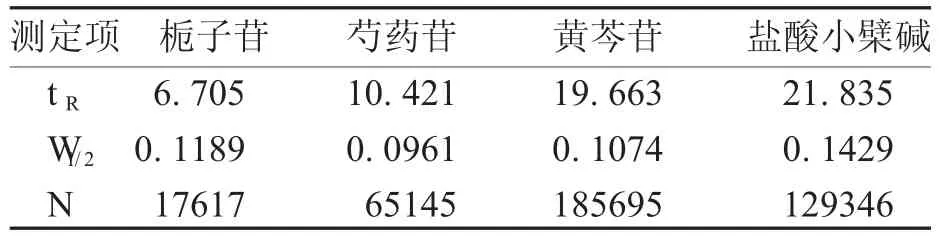
表4 理论板数
栀子苷的理论板数为17 617,芍药苷的理论板数为65 145,黄芩苷的理论板数为185 695,盐酸小檗碱的理论板数为129 346。
4 方法学考察
4.1标准曲线与线性关系考察按3项下的色谱条件,取混合对照品溶液按2、4、6、8、10、15、20、25、30、35 μL分别自动进样分析,记录色谱图,其中栀子苷及芍药苷的检测波长为240 nm,黄芩苷与盐酸小檗碱的检测波长分别为275 nm、350 nm。分别以峰面积Y为纵坐标,进样量X为横坐标绘制标准曲线,得回归方程分别为:
栀子苷:Y=2888X-8.3926,r=0.9998,线性范围为0.112~0.84 μg;
芍药苷:Y=831.43X-22.698,r=0.9992,线性范围为0.20~1.50 μg;
黄芩苷:Y=1885.1X-265.87,r=0.9990,线性范围为0.208~3.64 μg;
盐酸小檗碱:Y=4312.1X-415.83,r=0.9997,线性范围为0.232~2.32 μg。
表明栀子苷,芍药苷、黄芩苷及盐酸小檗碱的线性关系良好,见表5及图4—7。

表5 栀子苷、芍药苷、黄芩苷及盐酸小檗碱的标准曲线结果
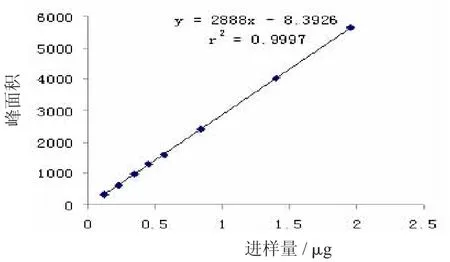
图4 栀子苷标准曲线
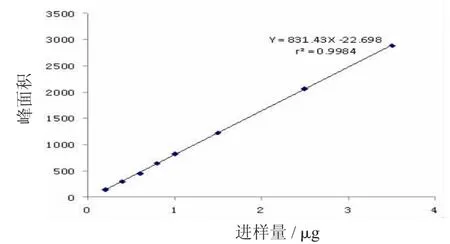
图5 芍药苷标准曲线

图6 黄芩苷标准曲线
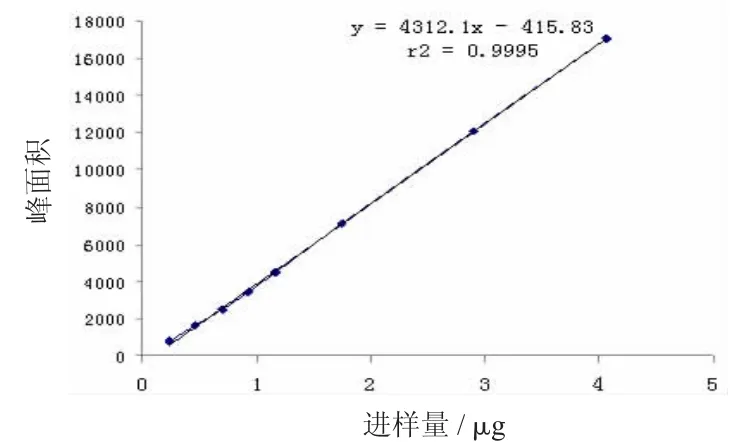
图7 盐酸小檗碱标准曲线
4.2精密度实验分别取同一混合对照品溶液,按3项下的色谱条件,连续自动进样5次,进样量为10 μL,记录色谱峰面积,结果见表6。计算得栀子苷、芍药苷、黄芩苷及盐酸小檗碱峰面积的RSD分别为1.23%、1.37%、1.19%和1.04%。表明仪器精密度良好。栀子苷、芍药苷、黄芩苷及盐酸小檗碱峰面积的RSD分别为1.23%、0.93%、1.02%和0.90%。表明仪器精密度良好。
4.3重复性实验取同一批号的牛黄上清丸(批号:0015447)6份,每份约3 g,分别精密称定,按3项下的制备方法平行制备供试品溶液6份,按3项下的色谱条件分别进样,进样量为10 μL,记录色谱峰面积,计算各成分含量,测定结果见表7。栀子苷、芍药苷、黄芩苷及盐酸小檗碱的平均含量分别为0.584 2、0.755 2、5.672 0、0.628 9 mg/g,RSD分别为1.76%,2.21%,0.58%及0.91%。表明方法的重现性良好。
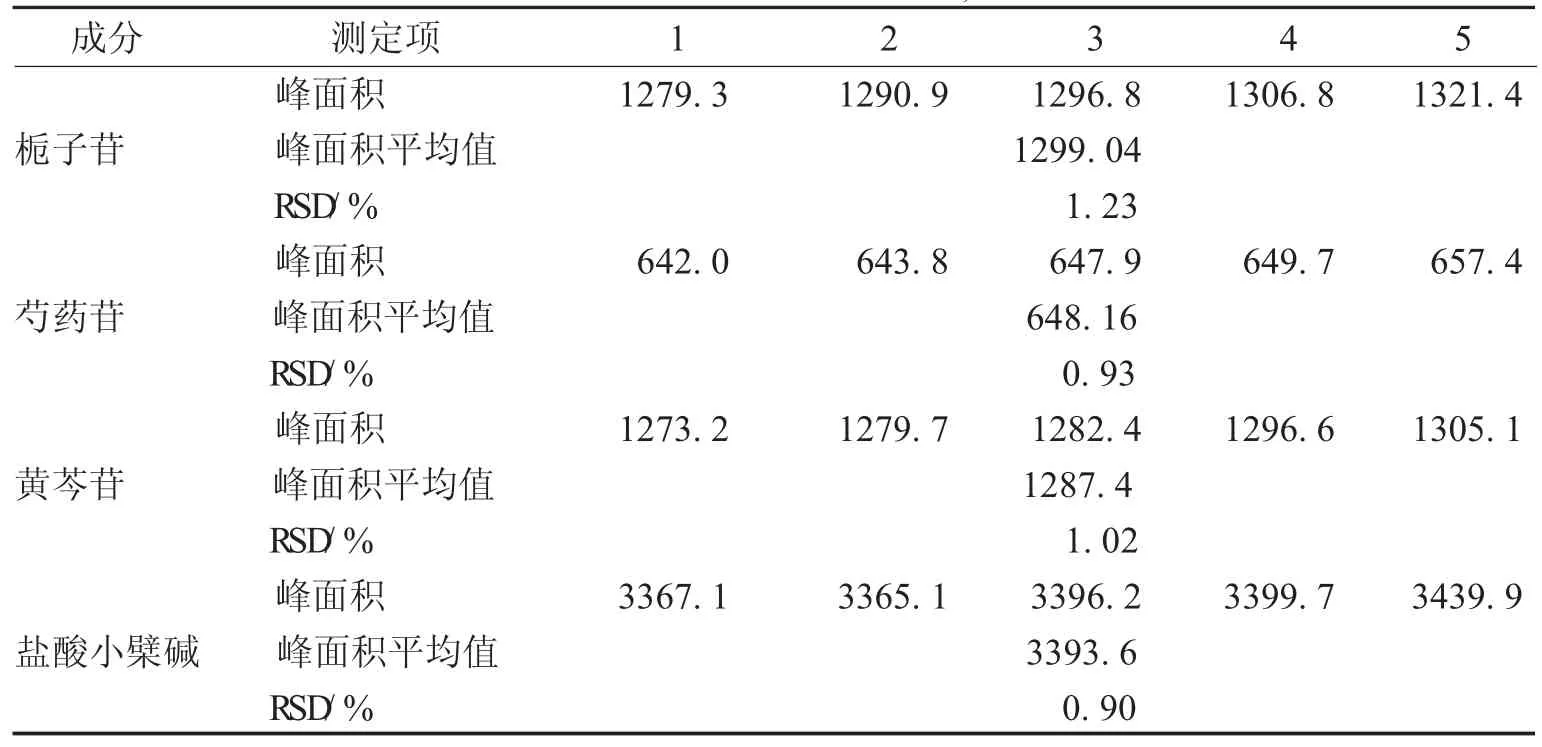
表6 精密度考察结果(n=5)
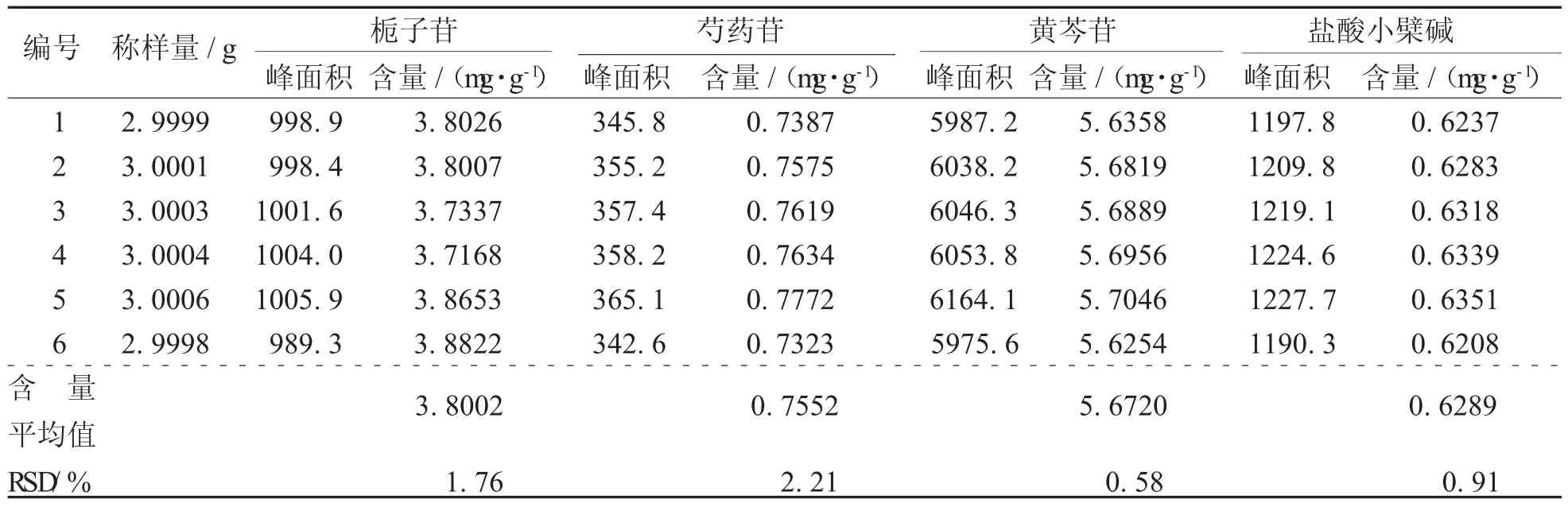
表7 重复性考察结果(n=6)
4.4稳定性实验取配制好的同一供试品溶液(批号:1015268),室温下放置,每个2小时进一次样,进样量为10 μL,按3项下的色谱条件进行进样分析,并记录各测定时间下栀子苷、芍药苷、黄芩苷及盐酸小檗碱的色谱峰面积,测定结果见表8。计算得峰面积RSD依次为1.81%、1.68%、0.58%、1.43%。表明本供试品在24小时内基本稳定。
4.5加样回收率实验精密称取已知含量的同一批号(批号:0015483)牛黄上清丸(大蜜丸)6份,每份约3.0 g,按3项下的制备方法制备供试品溶液,分别精密量取上述溶液1.0 mL,置于5 mL容量瓶中,分别加入含0.2 mg/mL栀子苷的对照品溶液0.19 mL,含0.32 mg/mL芍药苷的对照品溶液0.14 mL,含0.32 mg/mL黄芩苷的对照品溶液1.0 mL,含0.252 mg/mL盐酸小檗碱的对照品溶液0.15 mL,混合均匀,按上述含量测定项下的方法进行测定,进样量为10 μL,记录各色谱峰面积。按下式进行回收率计算,结果见表9。
回收率(%)=(测得值-样品中含量)/加入量×100%
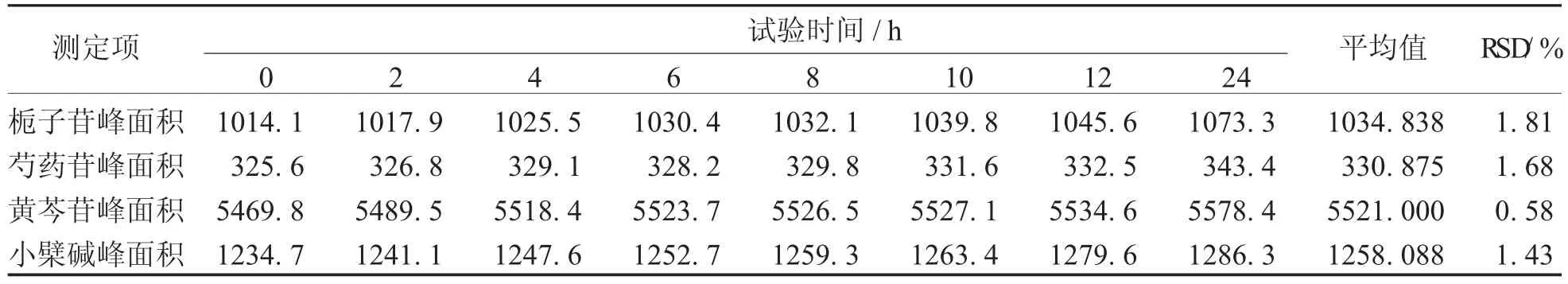
表8 稳定性考察结果
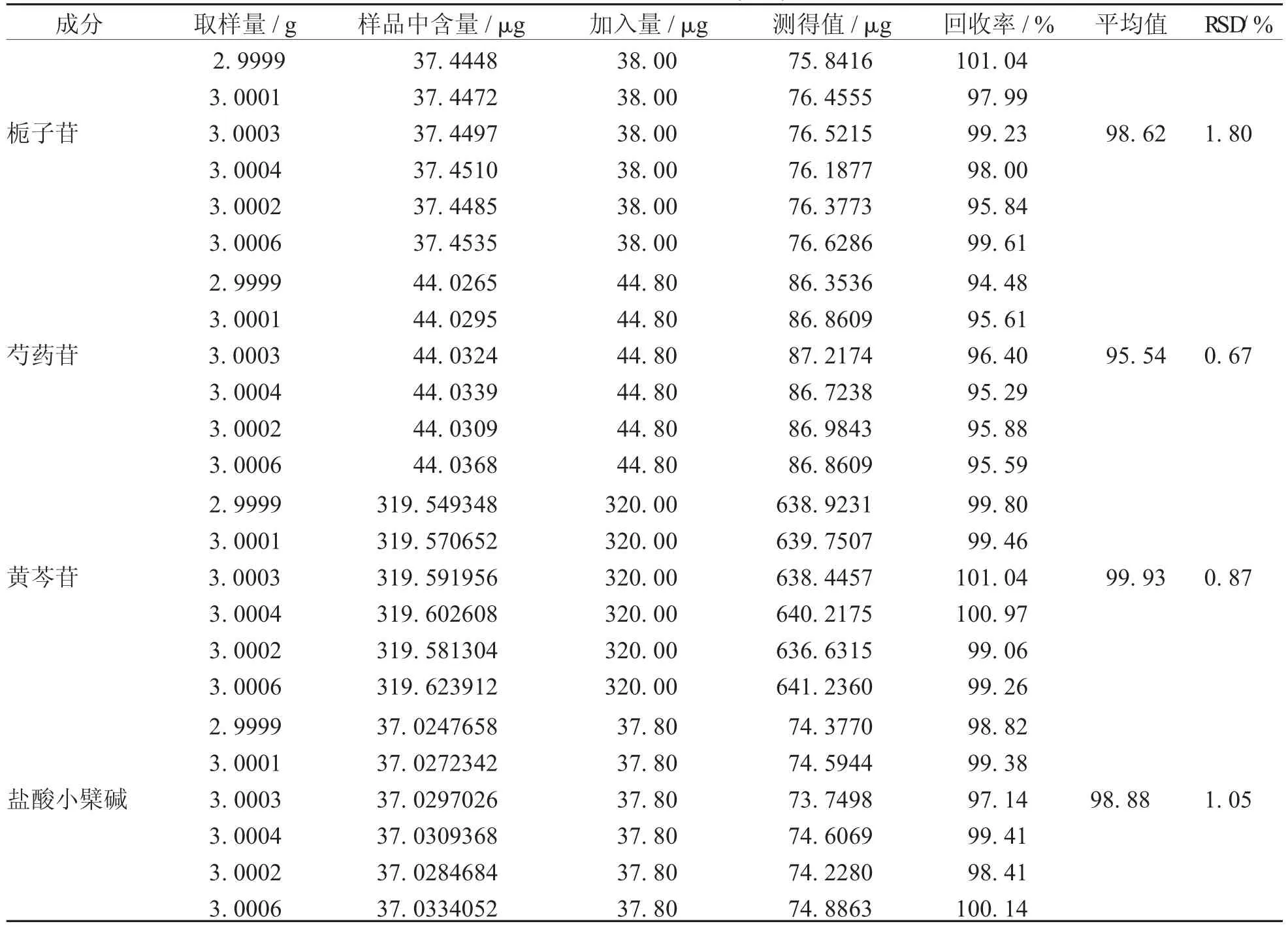
表9 回收率实验结果(n=6)
计算结果得,栀子苷的平均回收率(n=6)为98.53%,RSD=1.66%;芍药苷的平均回收率为99.38%,RSD=2.43%;黄芩苷的平均回收率为99.80%,RSD=0.94%;盐酸小檗碱的平均回收率为98.92%,RSD=0.95%。表明该方法准确度良好。
4.6样品含量测定分别取3个不同批号的牛黄上清丸(大蜜丸)各3份,每份约3 g,精密称定,按3项下样品的制备方法平行制备各样品溶液,在上述色谱条件下进样测定,进样量10 μL,在240 nm、275 nm、350 nm波长处分别记录栀子苷、芍药苷、黄芩苷及盐酸小檗碱的色谱峰面积,根据线性回归方程积计算牛黄上清丸中栀子苷、芍药苷、黄芩苷及盐酸小檗碱的含量,结果见下面以批号为1015268、取样量为3.000 3 g样品的相关数据为例,分别计算牛黄上清丸中栀子苷、芍药苷、黄芩苷及盐酸小檗碱的含量,见表10。
由于样品中各待测成分浓度均在线性范围内,根据样品制备过程和各待测成分的相应线性方程计算。
5 讨论
5.1流动相的选择4个待测成分中,栀子苷、芍药苷、黄芩苷属于苷类化合物,盐酸小檗碱为季铵生物碱,利用各待测成分的极性不同,因而在色谱柱中的保留时间不同而将各成分分开。但由于该制剂药味众多,干扰大,采用测定其中某一化合物的流动相体系均无法满足对四种待测成分进行有效的分离测定。本实验过程中考察了一定比例的甲醇-水、乙腈-水、乙腈-甲醇-水、乙腈-0.2%磷酸水溶液等流动相体系,但分离效果均不理想,各目标成分之间或目标成分与杂质成分之间无法达到良好分离甚至无法分离,或是目标成分的保留时间过长。实验发现,随着流动相中乙腈比例的增大,洗脱能力越强,但当乙腈达到某一比例后,会导致保留时间缩短,各成分过早出峰,各个色谱峰不能完全分开。而当流动相中的有机相采用甲醇时,基线飘移大。通过反复实验,以乙腈-0.2%磷酸水溶液作为流动相,采用梯度洗脱的方法,栀子苷、芍药苷、黄芩苷及盐酸小檗碱的分离效果最理想。
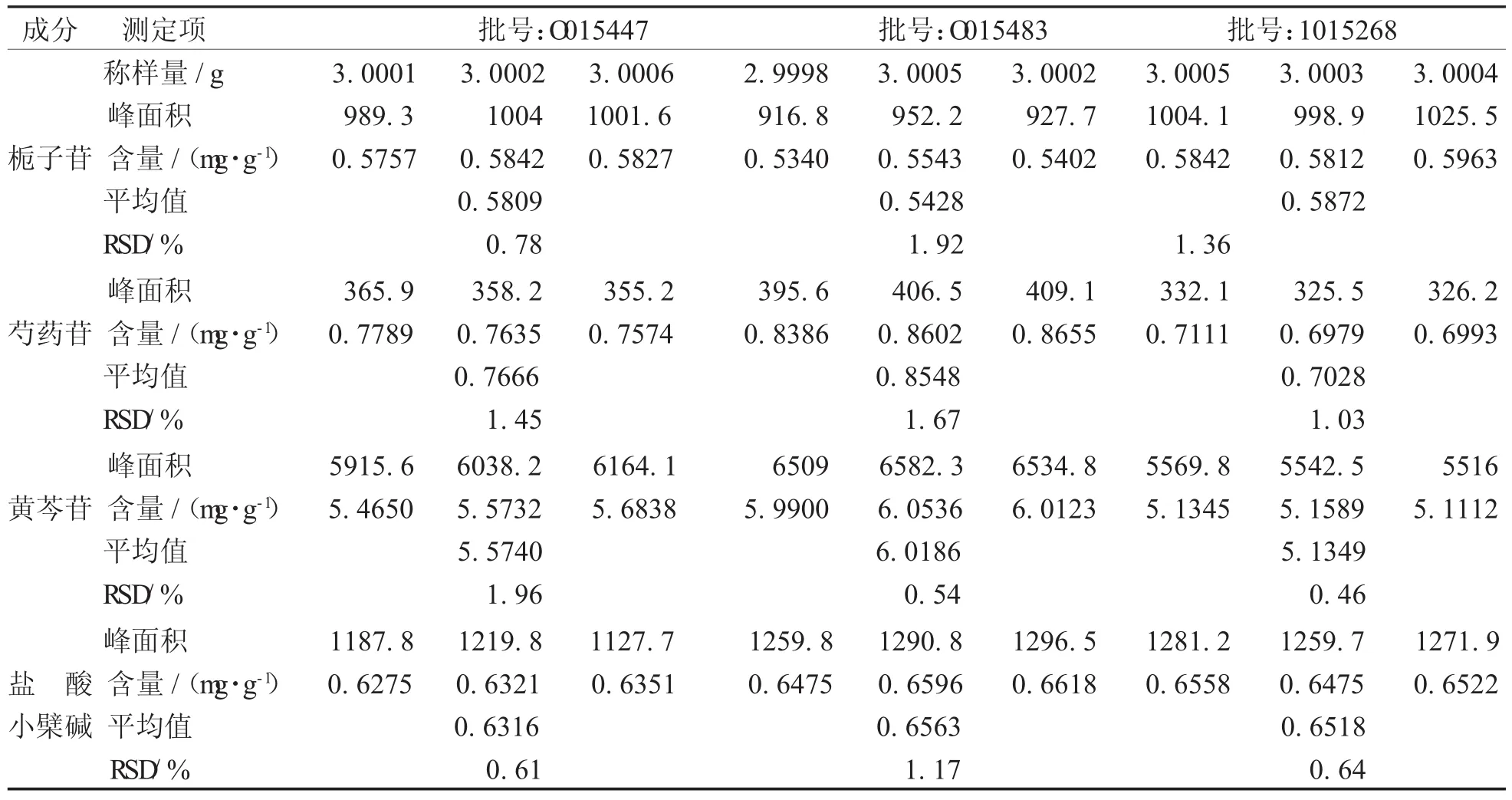
表10 牛黄上清丸(大蜜丸)含量测定结果
5.2检测波长的选择实验中通过DAD上得到的栀子苷、芍药苷、黄芩苷和盐酸小檗碱的紫外吸收光谱图如图8—11所示,可知栀子苷在197 nm 和240 nm处有吸收,芍药苷在195 nm和237 nm处有吸收,黄芩苷在196、215、278 nm及318 nm处有吸收,盐酸小檗碱在194、231、265 nm及351 nm有吸收。由于该味药剂中成分多,干扰大,4个待测成分无法在同一波波长下测定,需采用多波长的检测方法。栀子苷与芍药苷在240 nm波长下检测,黄芩苷在275 nm波长下检测,而盐酸小檗碱在350 nm波长下检测。在此波长条件下,各成分分离度良好,色谱峰不拖尾,并可消除杂质峰的干扰。
5.3提取溶剂、提取方法及提取时间的选择提取溶剂与处理方法对牛黄上清丸中的栀子苷、芍药苷、黄芩苷和盐酸小檗碱的含量测定有较大影响。在选择溶剂时,用过甲醇,甲醇-水(90∶10),甲醇-水(70∶30),甲醇-水(50∶50),乙醇,氯仿,结果发现甲醇的提取效果最好,与其他溶剂相比可提取到较多的有效成分,且操作简便。实验还发现,以甲醇为溶剂,并通过超声处理,可提取到较大量的有效成分。所以本实验在制备样品溶液时均用甲醇为溶剂并加以超声处理进行提取。另外还对不同超声处理时间进行了对比,实验结果表明超声处理1小时提取效果最佳,因此选择超声处理1小时用于供试品溶液的提取。
参考文献
[1]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010:616.
[2]黄山君,杨琪伟,石燕红,等.一测多评法测定白芍中芍药苷与芍药内酯苷的含量[J].中国药学杂志,2011,36(6):780-783.
[3]李姝梅,阳敬,熊磊,等.高效液相色谱法测定柴藿颗粒中黄芩苷的含量[J].儿科药学杂志,2012,18(3):43-45.
[4]孟克巴牙儿,常岚,张高娃,等.HPLC法测定颈椎通络丸桂皮醛、芍药苷含量[J].中国民族医药杂志,2012,18(1):61-62.
作者简介:杨小军(1982—),男,硕士学位,讲师。研究方向:药物分析。
收稿日期:2015-09-20
[中图分类号]R284.2
[文献标识码]A
[文章编号]1004-6852(2016)02-0027-07

