子宫内膜异位组织中VEGF、c-fos表达及意义
潘虹,刁静,汤蕴琦,潘颖琳,李佳蕊,张萍(上海交通大学医学院附属新华医院,上海200092)
子宫内膜异位组织中VEGF、c-fos表达及意义
潘虹,刁静,汤蕴琦,潘颖琳,李佳蕊,张萍(上海交通大学医学院附属新华医院,上海200092)
摘要:目的探讨子宫内膜异位组织中血管内皮生长因子(VEGF)、c-fos表达及意义。方法选择23例子宫内膜异位症(EMs)患者异位内膜组织23例份(异位内膜组)及在位内膜组织20例份(在位内膜组),正常子宫内膜组织21例份(对照组)。采用免疫组化SP法检测各组VEGF表达,蛋白免疫印迹法检测各组c-fos表达,并分析内膜组织VEGF与c-fos蛋白表达的关系。结果异位内膜组和在位内膜组VEGF、c-fos表达均高于对照组,P均<0.05;异位内膜组和在位内膜组VEGF、c-fos表达比较,P均>0.05。子宫内膜组织中VEGF与c-fos表达呈正相关(r=0.425,P<0.05)。结论EMs患者在位及异位内膜组织中VEGF与c-fos表达均升高;c-fos可能通过上调VEGF表达,促进子宫内膜组织血管生成,继而引起EMs的发生。
关键词:子宫内膜异位症;血管内皮生长因子;c-fos
子宫内膜异位症(EMs)是指具有生长功能的子宫内膜组织,如腺体和间质,出现在子宫腔被覆内膜及宫体肌层以外的其他部位。育龄期妇女EMs的发病率为10%~15%[1],不孕症患者发病率高达40%[2]。EMs是一种良性疾病,但具有转移、侵袭等恶性生物学行为。研究发现,血管形成与EMs的发生密切相关[3,4]。c-fos、血管内皮生长因子(VEGF)是调节血管形成的重要因子,但其与EMs发病的关系鲜见报道。为此,我们进行了如下研究。
1资料与方法
1.1临床资料选取2010年6月~2012年6月在我院行腹腔镜和开腹手术的EMs患者23例,年龄24~47岁、平均35.6岁,均为卵巢子宫内膜异位囊肿,无其他合并症;既往月经规律,术前6个月未服用任何激素类药物,术后病理检查确诊为EMs;参照1985年美国生育学会修订的EMs分期标准(r-AFS),均为Ⅱ、Ⅲ期。术后取其异位内膜组织23例份(异位内膜组),其中增生期12例份、分泌期11例份,HE染色后均可见子宫内膜腺体;取其在位内膜组织20例份(在位内膜组),其中增生期11例份、分泌期9例份。选取正常子宫内膜组织21例份(对照组),均由其他良性疾病行子宫切除或宫腔镜检查刮宫所得,病理检查证实均无子宫内膜病变,其中增生期11例份、分泌期10例份。患者年龄26~48岁,平均36.3岁。
1.2VEGF表达检测各组标本分为两份,一份立即浸泡在10%甲醛中固定,常规石蜡包埋,4 μm厚连续切片。采用免疫组化SP法检测VEGF表达,操作步骤严格按试剂盒说明书进行。采用Image-Pro Plus6.0软件分析显微镜下放大400倍的VEGF免疫组化图像。分析前先对阳性目标彩色分割、编辑,获得满意图形、图像,选取相应区域,测量其积分光密度(IOD)及面积,以IOD值除以测量面积得到平均光密度。每张切片在高倍镜下选取10个视野,计算10次平均光密度,取平均值。
1.3c-fos表达检测将另一份标本立即放入液氮中,置于-80 ℃超低温冰箱保存,采用蛋白免疫印迹法检测c-fos表达。加入组织裂解液后提取蛋白,测定蛋白浓度,裂解组织以每孔30 μg上样,行聚丙烯酰胺凝胶电泳。电转移至硝酸纤维素膜,封闭后依次加入兔抗人c-fos多克隆抗体、兔抗人actin多克隆抗体和辣根过氧化物酶标记的羊抗兔IgG,最后经化学荧光发光法显影试剂盒显影,操作过程按说明书进行。采用数字凝胶成像系统对结果进行灰度扫描分析,相对表达量以c-fos灰度面积积分与内参照肌动蛋白actin的比值表示。
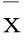
2结果
异位内膜组和在位内膜组VEGF、c-fos表达均高于对照组,P均<0.05;异位内膜组和在位内膜组VEGF、c-fos表达比较,P均>0.05。见表1。直线相关分析显示,子宫内膜组织VEGF与c-fos表达呈正相关(r=0.425,P<0.05)。
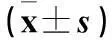
表1 各组VEGF、c-fos表达比较
注:与对照组比较,*P<0.05。
3讨论
EMs是雌激素依赖性良性病变,但具有一些类似恶性肿瘤的生物学行为,特别是组织侵袭和血管形成能力。目前EMs发病机制尚未明确,以Sampson的经血逆流种植学说为主。但经血逆流至盆腔是普遍的生理现象,其中发生EMs者只占10%~15%[5],提示经血逆流可能只是诱因。因此,探讨子宫内膜在腹腔内种植生长的机制才是阐明EMs发病的关键。目前认为,黏附、侵袭、血管形成是内膜异位种植的病理生理过程[6],其中黏附和侵袭的过程很短暂,而异位种植病灶的发生和发展依赖于充足的血液供应,故认为血管异常增生是EMs发病的重要原因[7]。
VEGF具有多种生物学效应,被认为是调节血管生长作用最强的因子[8,9]。原癌基因c-fos是受雌激素作用的靶基因之一,人类和小鼠c-fos基因启动子区域存在功能性雌激素反应元件,雌激素作用后c-fos表达显著上升,并与Jun蛋白形成转录因子AP-1,调节细胞侵袭、生长及血管形成等相关靶基因的表达。因此,c-fos被认为是雌激素早期应答基因,可作为雌激素作用的早期感受分子[10,11]。“在位内膜决定论”认为, EMs患者在位内膜组织VEGF表达明显高于非EMs[6]。本研究异位内膜组和在位内膜组VEGF、c-fos表达均显著高于对照组,而异位内膜组与在位内膜组VEGF、c-fos表达比较无统计学差异,与史淑红等[12]研究结论一致,均支持“在位内膜决定论”,提示EMs患者在位内膜组织血管生成能力较正常子宫内膜组织增强,一旦逆流进入腹腔,很容易产生新生血管,并进一步侵袭、发展,促使异位内膜的成功种植和发展。Rein等[13]研究显示,异位内膜组织VEGF表达高于在位内膜组织,本研究结果与其不同。可能与本研究采集异位内膜标本不同有关,新形成的异位内膜组织VEGF表达可能偏高,而陈旧性异位内膜组织VEGF表达可能下降。
研究显示,雌二醇通过c-fos上调乳腺癌组织VEGF表达,从而促进乳腺癌组织的血管形成[14]。Catar等[15]研究发现,TGF-β1可诱导腹膜间皮细胞表达VEGF,电泳迁移率试验显示TNF-α或IL-1β与TGF-β1共同作用后,通过c-fos激活VEGF基因启动子区域,而小干扰RNA抑制c-fos表达或c-fos抑制剂则降低VEGF基因启动子活性,并下调VEGF表达水平;提示c-fos是介导TNF-α、IL-1β与TGF-β1促进腹膜间皮细胞表达VEGF的重要分子。本研究结果显示,子宫内膜组织中VEGF与c-fos表达呈正相关,说明c-fos可能通过上调VEGF表达而促进异位子宫内膜组织血管生成,继而导致EMs的发生。本研究为探讨EMs的发病机制提供了新思路,有望为EMs临床治疗提供新靶点。
参考文献:
[1] Missmer AS, Hankinson SE, Spiegelman D, et al. Reproductive history and endometriosis among premenopausal women[J]. Obstet Gynecol, 2004,104(5):965-974.
[2] Bruner-Tran KL, Zhang Z, Eisenberg E, et al. Down-regulation of endometrial matrix metalloproteinase-3 and -7 expression in vitro and therapeutic regression of experimental endometriosis in vivo by a novel nonsteroidal progesterone receptor agonist, tanaproget[J]. J Clin Endocrinol Metab, 2006,91(4):1554-1560.
[3] May K, Becker CM. Endometriosis and angiogenesis[J]. Minerva Ginecol, 2008,60(3):245-254.
[4] Lockwood CJ. Mechanisms of normal and abnormal endometrial bleeding[J]. Menopause, 2011,18(4):408-411.
[5] 徐丛剑,程明军,黄宇婷,等.子宫内膜异位症病因学研究进展[J].中国实用妇科与产科杂志,2009,25(9):712-714.
[6] 仝佳丽,郎景和.子宫内膜异位症的在位内膜病变研究进展[J].现代妇产科进展,2010,19(6):465-467.
[7] Xu H, Zhang T, Man GC, et al. Vascular endothelial growth factor C is increased in endometrium and promotes endothelial functions, vascular permeability and angiogenesis and growth of endometriosis[J]. Angiogenesis, 2013,16(3):541-551.
[8] 汪俊元,王安才,曹蘅,等.血管内皮生长因子与血管重构的关系及阿托伐他汀干预作用[J].中国现代医学杂志,2009,19(9):1379.
[9] Wu Ming, Yih Ho, Hong Nerng. The role of cytokines in endometriosis[J]. Am J Reprod Immunol, 2003,49(5):285-296.
[10] Gilabert-Estellés J, Ramón LA, Espana F, et al. Expression of angiogenic factors in endometriosis: relationship to fibrinolytic and metalloproteinase systems[J]. Hum Reprod, 2007,22(8):2120-2127.
[11] John S, Nayvelt I, Hsu HC, et al. Regulation of estrogenic effects by beclin 1 in breast cancer cells[J]. Cancer Res, 2008,68(19):7855-7863.
[12] 史淑红,高秀娟,李艳芳,等.sflt-1、VEGF在子宫内膜异位组织中的表达及意义[J].山东医药,2014,54(36):30-32.
[13] Rein DT, Schmidt T, Bauerschmitz G, et al. Treatment of endometriosis with a VEGF-targeted conditionally replicative adenovirus[J]. Fertil Steril, 2010,93(8):2687-2694.
[14] De Francesco EM, Pellegrino M, Santolla MF, et al. GPER mediates activation of HIF1α/VEGF signaling by estrogens[J]. Cancer Res, 2014,74(15):4053-4064.
[15] Catar R, Witowski J, Wagner P, et al. The proto-oncogene c-Fos transcriptionally regulates VEGF production during peritoneal inflammation[J]. Kidney Int, 2013,84(6):1119-1128.
中图分类号:R711.71
文献标志码:B
文章编号:1002-266X(2016)08-0063-03
doi:10.3969/j.issn.1002-266X.2016.08.025
通信作者:张萍(E-mail: shxinhuazp@163.com)
基金项目:国家自然科学基金青年科学基金资助项目(81100410);上海市自然科学基金资助项目(10ZR1420200)。

