腹腔镜与开腹宫颈癌根治术对机体细胞免疫影响的对比研究*
魏向群,吴春秀,冯昊,李文亮,陈艳欢
(1.昆明医科大学第三附属医院妇科,云南昆明650118;2.河北省秦皇岛市第一医院妇科,河北秦皇岛066000;3.河北省秦皇岛市第三医院外科,河北秦皇岛066000)
腹腔镜与开腹宫颈癌根治术对机体细胞免疫影响的对比研究*
魏向群1,吴春秀2,冯昊3,李文亮1,陈艳欢1
(1.昆明医科大学第三附属医院妇科,云南昆明650118;2.河北省秦皇岛市第一医院妇科,河北秦皇岛066000;3.河北省秦皇岛市第三医院外科,河北秦皇岛066000)
摘要:目的对比研究腹腔镜及传统开腹宫颈癌根治术对早期宫颈癌患者细胞免疫的影响。方法收集昆明医科大学第三附属医院妇科早期(Ⅰa2~Ⅱa1期)宫颈癌患者60例,开腹组、腹腔镜组各30例。采用流式细胞术检测患者手术前1天、术后1天、术后5天及术后28天外周血中T淋巴细胞亚群、自然杀伤细胞(NK)、多种细胞因子诱导的杀伤细胞(CIK)和T淋巴细胞活化功能,比较两组手术前后免疫指标的变化。结果①术后1天两组患者T淋巴细胞亚群数量较术前1天下降(P<0.05),术后5天各指标较术后1天有所升高,腹腔镜组下降程度小于开腹组(P<0.05),且恢复快;②术后1天两组患者外周血人白细胞抗原(HLA)-DR+CD3+数量较术前下降,HLA-DR+CD8+较术前升高,腹腔镜组变化程度小,在术后5天恢复快。结论腹腔镜组术后免疫功能变化幅度小,恢复快,对患者免疫功能抑制程度轻,可能更好地保护了患者的免疫功能。
关键词:细胞免疫;子宫颈癌;腹腔镜宫颈癌根治术;人白细胞抗原DR;T细胞亚群
子宫颈癌(cervical carcinoma)是原发于子宫颈的上皮恶性肿瘤。早期宫颈癌的主要治疗手段是手术,其5年生存率可达70%~90%。肿瘤的术后复发和转移是最主要的致命原因[1],而肿瘤术后的复发、转移、种植、扩散在一定程度上取决于机体的免疫功能状态[2]。研究表明,恶性肿瘤患者术前已存在免疫抑制现象和自身免疫监视能力下降,手术创伤会导致其免疫功能进一步下降[3],其抑制程度与手术创伤严重程度有关[4-6]。本文通过比较腹腔镜及开腹宫颈癌根治术手术前、后外周血中T淋巴细胞亚群、自然杀伤细胞(natural killer,NK)、多种细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)以及T淋巴细胞活化功能的变化,旨在探讨两种术式对患者机体免疫的影响,为早期宫颈癌患者手术方式的选择及术后预后判断提供理论依据。
1 资料与方法
1.1一般资料
选取昆明医科大学第三附属医院妇科2012年10月-2013年10月收治的早期(Ⅰa2~Ⅱa1期)宫颈癌患者60例,行开腹宫颈癌根治术(abdominal radical hysterectomy,ARH)及腹腔镜宫颈癌根治术(laparoscopic radical hysterectomy,LRH),ARH组30例,LRH组30例,两组病例手术均由同一组医师完成,手术时均采用全麻。入组病例,ARH组平均年龄为(42.67±7.93)岁,体重(57.7±7.62)kg;LRH组平均年龄为(41.37±6.37)岁,体重(56.5±6.30)kg。ARH组鳞癌26例,腺癌4例;LRH组鳞癌25例,腺癌5例。采用国际妇产科联盟(International Federation of Gynecologyand Obstetrics,FIGO)2009年更新的临床分期标准,ARH组宫颈癌患者Ⅰa2期1例,Ⅰb1期26例,Ⅰb2期1例,Ⅱa1期2例;LRH组Ⅰa2期0例,Ⅰb1期28例,Ⅰb2期1例,Ⅱa1期1例。两组间年龄、体重、病理类型及FIGO分期差异无统计学意义(P>0.05)。两组患者均为原发性肿瘤,术前、术后采血期间均未接受放化疗、免疫抑制剂及免疫增强剂治疗;术前排除第2种肿瘤、罹患自身免疫性疾病、免疫缺陷病、超敏反应性疾病的患者、术中及术后输血患者及其他内外科合并症患者;后续补充治疗和术后随访均在本院进行。
术式:ARH术(广泛子宫切除±双附件切除+盆腔淋巴结清扫)均按刘新民主编《妇产科手术学》[7]第3版手术方法进行;LRH术(腹腔镜下广泛子宫切除±双附件切除+盆腔淋巴结清扫)手术方法参照文献[8]进行。
1.2主要试剂及主要仪器
1.2.1试验主要试剂①荧光素标识单克隆抗体(BDMutiTESTINK.kit)含有A和B 2种4色抗体。A:CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5,鉴别T淋巴细胞亚群的免疫表型。B:CD3-FITC/CD16+ 56-PE+CD45-PC5,鉴别T淋巴细胞NK细胞、CIK细胞的免疫表型;②抗体:CD3-FITC/HLA-DR-PE+ CD45-PC5鉴别活化3的免疫表型;CD8-FITC/HLADR-PE+CD45PC5鉴别活化8的免疫表型。
1.2.2主要仪器流式细胞仪Beckman Coulter(美国Beckman Coulter公司)。
1.3外周血的收集
采集患者术前1天及术后1天、术后5天和术后28天的空腹外周血2 ml,加入含肝素抗凝管,送检。
1.4统计学方法
统计分析采用SPSS 17.0软件包进行统计处理,计量资料用均数±标准差(±s)表示,各免疫指标组内比较采用方差分析,两组间比较采用独立样本t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 LRH组手术前1天、术后1天、术后5天及术后28天T淋巴细胞亚群、NK细胞及CIK细胞数量的变化
研究LRH组手术前后外周血T细胞亚群、NK细胞及CIK细胞数量变化,结果显示:LRH组术后1天外周血CD3+数量、CD4+数量及CD4+/CD8+比值均较术前明显下降(P<0.05),CD8+数量术后1天较术前亦有下降,但差异无统计学意义(P>0.05);在术后5天CD3+、CD4+、CD8+数量以及CD4+/CD8+比值较术后1天升高,且已恢复至术前水平。手术前、术后1天、术后5天NK细胞、CIK细胞数量差异均无统计学意义(P>0.05),术后28天各项免疫指标与术前比较差异无统计学意义(P>0.05)。见表1。
2.2 ARH组手术前1天、术后1天、术后5天及术后28天T淋巴细胞亚群、NK细胞及CIK细胞数量的变化
研究ARH组手术前后外周血T细胞亚群、NK细胞及CIK细胞数量变化,结果显示:ARH组术后1天外周血CD3+、CD4+、CD8+数量及CD4+/CD8+比值均较术前明显下降(P<0.01);在术后5天较术后1天明显升高,但CD4+、CD8+数量尚未恢复至术前水平(P<0.05)。手术前、术后1天、术后5天NK细胞、CIK细胞数量差异均无统计学意义(P>0.05),术后28天各项免疫指标与术前比较差异无统计学意义(P>0.05)。见表2。
表1 LRH组手术前1天、术后1天、术后5天及术后28天T淋巴细胞亚群、NK细胞及CIK细胞数量的变化(±s)
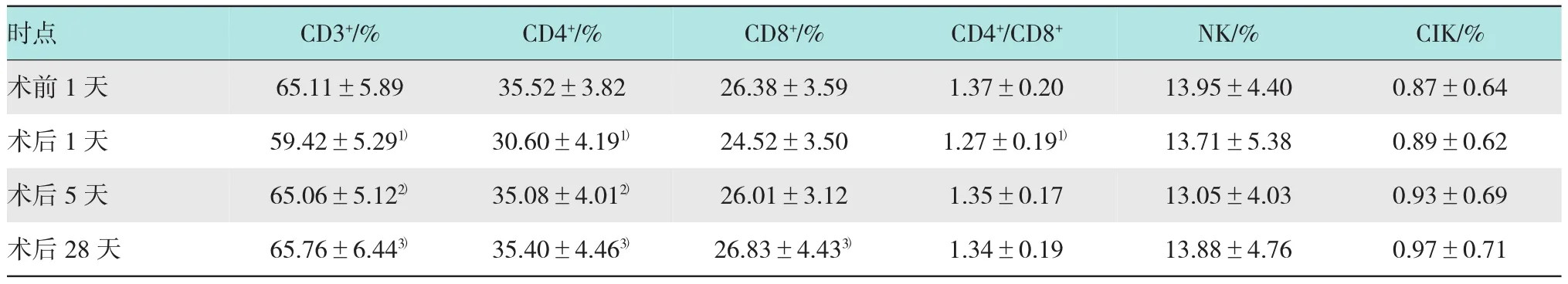
表1 LRH组手术前1天、术后1天、术后5天及术后28天T淋巴细胞亚群、NK细胞及CIK细胞数量的变化(±s)
注:1)术前1天与术后1天比较,P<0.05;2)术后1天与术后5天比较,P<0.05;3)术后1天与术后28天比较,P<0.05
时点 CD3+/% CD4+/%术前1天 65.11±5.89 35.52±3.82术后1天 59.42±5.291) 30.60±4.191)术后5天 65.06±5.122) 35.08±4.012)术后28天 65.76±6.443) 35.40±4.463)CD8+/% CD4+/CD8+ NK/% CIK/% 26.38±3.59 1.37±0.20 13.95±4.40 0.87±0.64 24.52±3.50 1.27±0.191) 13.71±5.38 0.89±0.62 26.01±3.12 1.35±0.17 13.05±4.03 0.93±0.69 26.83±4.433) 1.34±0.19 13.88±4.76 0.97±0.71
表2 ARH组手术前1天、术后1天、术后5天及术后28天T淋巴细胞亚群、NK细胞及CIK细胞数量的变化(±s)
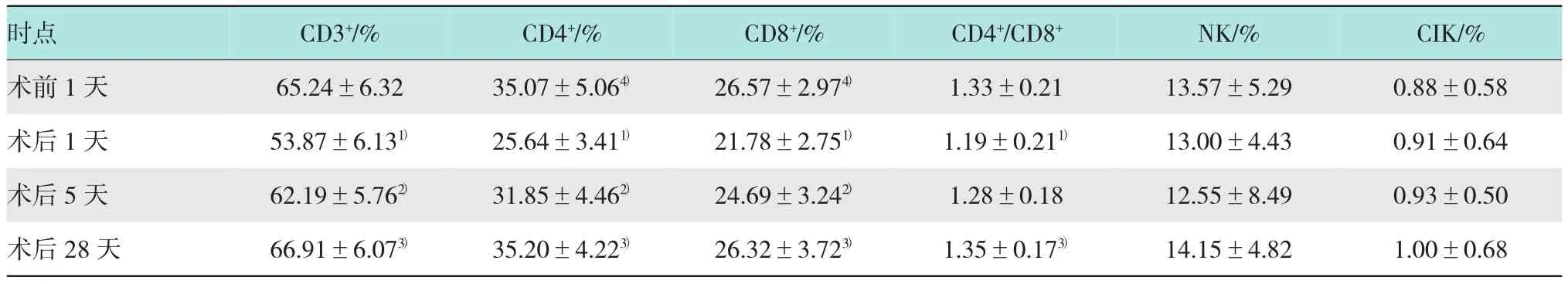
表2 ARH组手术前1天、术后1天、术后5天及术后28天T淋巴细胞亚群、NK细胞及CIK细胞数量的变化(±s)
注:1)术前1天与术后1天比较,P<0.05;2)术后1天与术后5天比较,P<0.05;3)术后1天与术后28天比较,P<0.05;4)术后5天与术前1天比较,P<0.05
时点 CD3+/% CD4+/%术前1天 65.24±6.32 35.07±5.064)术后1天 53.87±6.131) 25.64±3.411)术后5天 62.19±5.762) 31.85±4.462)术后28天 66.91±6.073) 35.20±4.223)CD8+/% CD4+/CD8+ NK/% CIK/% 26.57±2.974) 1.33±0.21 13.57±5.29 0.88±0.58 21.78±2.751) 1.19±0.211) 13.00±4.43 0.91±0.64 24.69±3.242) 1.28±0.18 12.55±8.49 0.93±0.50 26.32±3.723) 1.35±0.173) 14.15±4.82 1.00±0.68
2.3 LRH组及ARH组手术前、术后1天和术后5 天T细胞亚群数量变化比较
2.3.1 LRH组及ARH组手术前、后CD3+数量变化比较LRH组术后1天CD3+的数量(59.42± 5.29)下降幅度明显小于ARH组(53.87±6.13)(P<0.01);术后5天LRH组(65.06±5.12)较ARH组(62.19±5.76)恢复快(P<0.05),LRH组在术后5天已恢复至术前水平,但ARH组指标仍低于术前。见表3。
2.3.2 LRH组及ARH组手术前、后CD4+数量变化比较LRH组术后1天CD4+的数量(30.60± 4.19)下降幅度明显小于ARH组(25.64±3.41)(P<0.01);术后5天LRH组(35.08±4.01)较ARH组(31.85±4.46)恢复快(P<0.05),LRH组在术后5天已恢复至术前水平,但ARH组指标仍低于术前。见表4。
2.3.3 LRH组及ARH组手术前和后CD8+数量变化比较LRH组术后1天CD8+的数量(24.52± 3.50)下降幅度明显小于ARH组(21.78±2.75)(P<0.01);术后5天LRH组(26.01±3.12)较ARH组(24.69±3.24)恢复快,但差异无统计学意义(P>0.05),LRH组在术后5天已恢复至术前水平,但
ARH组指标仍稍低于术前。见表5。
2.3.4 LRH组及ARH组手术前、后CD4+/CD8+数量变化比较LRH组术后1天CD4+/CD8+比值(1.27±0.19)下降幅度小于ARH组(1.19±0.21),但差异无统计学意义(P>0.05);术后5天LRH组(1.35±0.17)较ARH组(1.28±0.18)恢复快,但差异无统计学意义(P>0.05),LRH组在术后5天已恢复至术前水平,但ARH组指标仍稍低于术前。见表6。
表3 RH组及ARH组手术前、后CD3+数量变化比较(±s)
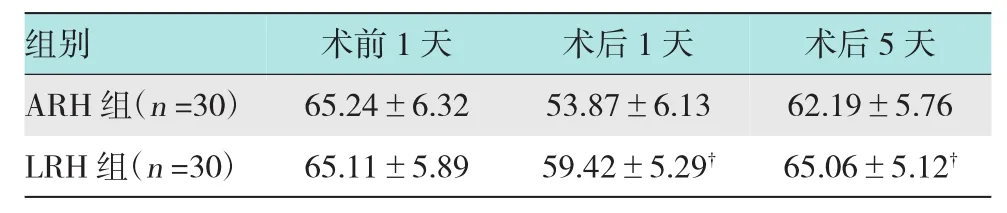
表3 RH组及ARH组手术前、后CD3+数量变化比较(±s)
注:†LRH组与ARH组比较,P<0.05
组别 术前1天 术后1天 术后5天ARH组(n=30) 65.24±6.32 53.87±6.13 62.19±5.76 LRH组(n=30) 65.11±5.89 59.42±5.29† 65.06±5.12†
表4 LRH组及ARH组手术前1天、术后1天和术后5天外周血中CD4+数量变化比较(±s)
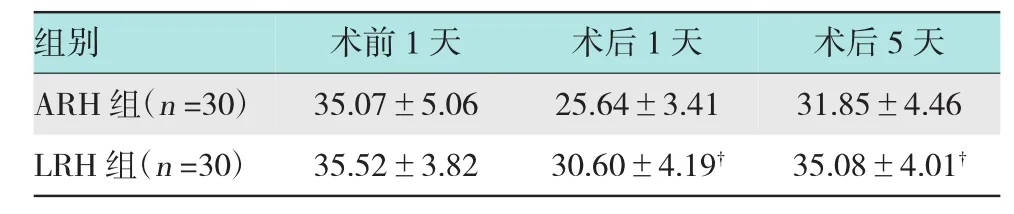
表4 LRH组及ARH组手术前1天、术后1天和术后5天外周血中CD4+数量变化比较(±s)
注:†LRH组与ARH组比较,P<0.05
组别 术前1天 术后1天 术后5天ARH组(n=30) 35.07±5.06 25.64±3.41 31.85±4.46 LRH组(n=30) 35.52±3.82 30.60±4.19† 35.08±4.01†
2.4 LRH组及ARH组患者外周血中T淋巴细胞活化功能的变化
2.4.1 LRH组及ARH组患者外周血中活化T细胞人白细胞抗原(human leukocyte antigen,HLA)-DR+CD3+的变化LRH组和ARH组术后1天外周血HLA-DR+CD3+数量(4.31±1.36;2.97± 1.15)均较术前(5.82±2.15;5.78±2.57)下降,且LRH组下降程度小于ARH组(P>0.05);两组患者术后5天HLA-DR+CD3+(5.48±1.47;4.38±1.39)较术后1天均有升高趋势,且LRH组较ARH组恢复快,LRH组已恢复至术前水平,而ARH组仍低于术前,且至术后28天ARH组(4.76±1.21)仍未恢复至术前水平(P>0.05)。两组间手术前后HLA-DR+CD3+的数量均差异无统计学意义(P>0.05)。见表7。
2.4.2 LRH组及ARH组患者外周血中活化Ts细胞HLA-DR+CD8+的变化LRH组及ARH组患者术后1天外周血HLA-DR+CD8+的数量(2.02± 1.12;2.69±1.12)均较术前(1.63±0.92;1.67±0.82)升高,且LRH组升高程度小于ARH组(P>0.05);两组术后5天HLA-DR+CD8+(1.66±0.75;2.01± 1.08)均较术后1天有所下降,且LRH组较ARH组恢复快(P>0.05),LRH组已降至术前水平,而ARH组仍高于术前;两组之间手术前后HLA-DR+CD8+的数量均差异无统计学意义(P>0.05)。见表8。
表5 LRH组及ARH组手术前1天、术后1天、术后5天外周血中CD8+数量变化比较(±s)
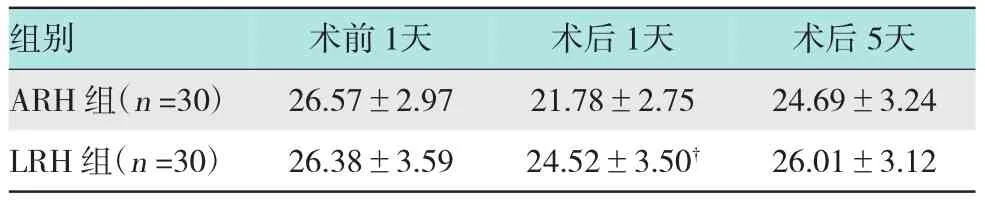
表5 LRH组及ARH组手术前1天、术后1天、术后5天外周血中CD8+数量变化比较(±s)
注:†LRH组与ARH组比较,P<0.05
组别 术前1天 术后1天 术后5天ARH组(n=30) 26.57±2.97 21.78±2.75 24.69±3.24 LRH组(n=30) 26.38±3.59 24.52±3.50† 26.01±3.12
表6 LRH组及ARH组手术前1天、术后1天、术后5天外周血中CD4+/CD8+比值变化比较(±s)
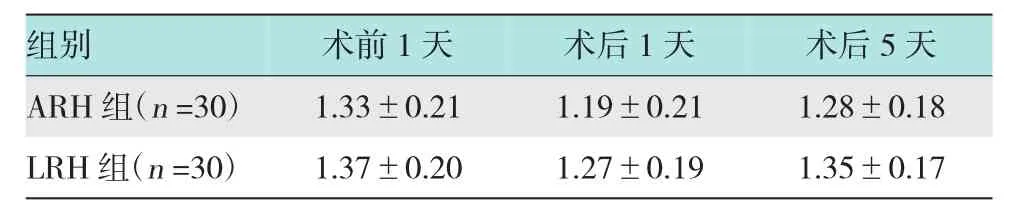
表6 LRH组及ARH组手术前1天、术后1天、术后5天外周血中CD4+/CD8+比值变化比较(±s)
组别 术前1天 术后1天 术后5天ARH组(n=30) 1.33±0.21 1.19±0.21 1.28±0.18 LRH组(n=30) 1.37±0.20 1.27±0.19 1.35±0.17
表7两组术前1天、术后1天、术后5天及术后28天活化T细胞HLA-DR+CD3+数量变化(±s)
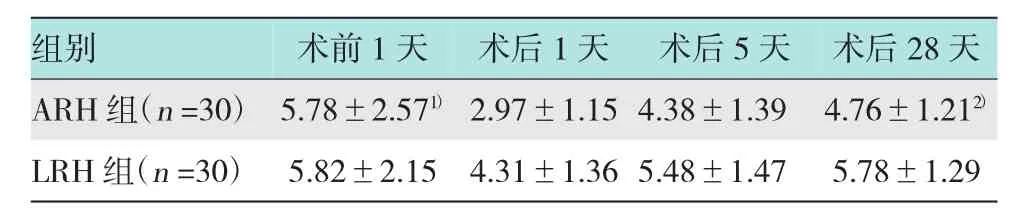
表7两组术前1天、术后1天、术后5天及术后28天活化T细胞HLA-DR+CD3+数量变化(±s)
注:1)术后1天与术前1天比较,P<0.05;2)术后1天与术后28天比较,P<0.05
组别 术前1天 术后1天ARH组(n=30)5.78±2.571)2.97±1.15 LRH组(n=30) 5.82±2.15 4.31±1.36术后5天 术后28天4.38±1.39 4.76±1.212)5.48±1.47 5.78±1.29
表8两组术前1天、术后1天、术后5天及术后28天活化Ts细胞HLA-DR+CD8+数量变化比较(±s)
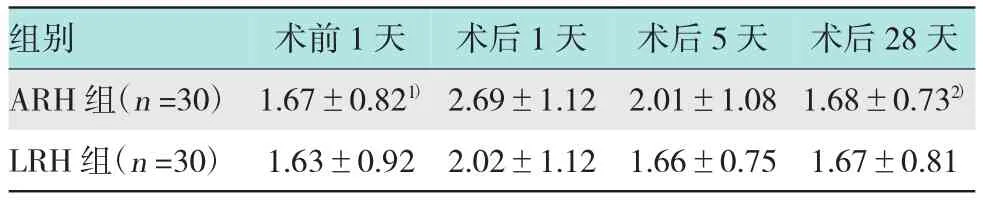
表8两组术前1天、术后1天、术后5天及术后28天活化Ts细胞HLA-DR+CD8+数量变化比较(±s)
注:1)术后1天与术前1天比较,P<0.05;2)术后1天与术后28天比较,P<0.05
组别 术前1天 术后1天ARH组(n=30)1.67±0.821)2.69±1.12 LRH组(n=30) 1.63±0.92 2.02±1.12术后5天 术后28天2.01±1.08 1.68±0.732)1.66±0.75 1.67±0.81
3 讨论
近几年来,宫颈癌的诊断及治疗均取得一定的进展,宫颈癌根治术是早期宫颈癌患者的主要治疗手段,早期宫颈癌患者5年生存率达到85%~90%,但仍有约10%早期宫颈癌患者最终死于肿瘤的复发和转移,而肿瘤术后的复发、转移、种植、扩散在一定程度上取决于机体的免疫功能状态。外科手术是对人体一种特殊形式的创伤,虽然受多种因素的影响,但其基本过程与一般创伤相同,外科手术所致的应激反应可使机体免疫功能受抑制,且免疫抑制的程度及持续时间与手术或创伤的大小有关,免疫抑制时间越长,术后并发感染率及肿瘤转移发生率就越高[8]。目前腹腔镜手术治疗早期宫颈癌对患者免疫功能影响的报道少见。本研究从早期宫颈癌患者外周血中T淋巴细胞亚群以及T淋巴细胞活化功能的角度出发,采用流式细胞术检测患者免疫功能,从而研究腹腔镜及开腹两种不同手术方式的宫颈癌根治术对患者免疫功能的影响,为早期宫颈癌患者手术方式的选择及术后预后的判断提供依据。
3.1机体的抗肿瘤免疫机制
机体的抗肿瘤免疫的效应机制包括细胞免疫和体液免疫两个方面,其中细胞免疫是抗肿瘤免疫的主力[9],是免疫活性T淋巴细胞介导的一系列免疫应答和免疫调节功能。免疫活性T淋巴细胞可分为CD4(辅助性T细胞)和CD8(抑制性T细胞)两个亚群。CD4+T淋巴细胞是人体免疫系统中一种重要的免疫细胞,而CD4+/CD8+是监视人体细胞免疫功能、反映免疫状态的重要指标,比值越低,细胞对肿瘤免疫应答能力就越低[10]。
3.2两种术式对T淋巴细胞亚群的影响
T淋巴细胞是一种具有多功能的细胞群体,分为若干亚群,其中CD4(辅助/诱导T细胞)、CD8(抑制/细胞毒T细胞)是两类重要的细胞亚群,CD4+/CD8+比值更能反映机体的免疫状态。CD3+T细胞的减少是免疫功能受抑制的总体反映。CD4+T细胞主要分化为辅助性T淋巴细胞,CD4+T细胞在严重的创伤后发生两个方面的变化,一是总数的减少,辅助其他细胞参与免疫应答的能力减弱;另一方面是Th1/Th2失衡,最终临床上表现为“免疫麻痹”。CD8+T细胞包括细胞毒性T细胞和抑制性T细胞两个亚群,有实验研究表明开腹宫颈癌术后CD8+下降。对宫颈癌肿瘤浸润淋巴细胞研究发现,CD8+的数量随宫颈癌临床病理分期的进展、淋巴结转移的出现而减少,也是宫颈癌独立的预后影响因素。正常情况下,T淋巴细胞及亚群的数目在周围组织中相对稳定,若T淋巴细胞总数及其亚群或CD4+/CD8+异常时,可导致机体免疫功能的紊乱和一系列的病理变化,易发生肿瘤或自身免疫性疾病[11]。
本研究利用流式细胞术检测外周血T淋巴细胞,结果表明,LRH术及ARH术后1天外周血CD3+、CD4+、CD8+和CD4+/CD8+的表达均较术前明显下降,并且LRH组下降幅度明显小于开腹组;术后第5天LRH组各指标基本恢复至术前水平,但ARH术后第5天CD3+、CD4+和CD8+的表达仍低于术前。手术后CD3+数量、CD4+数量和CD4+/CD8+比值较术前明显下降,而CD8+T细胞包括抑制性T细胞和细胞毒性T细胞,手术后一部分CD8+T细胞可能因炎性或病原等因素会出现数量升高,但其总数是下降的,机体免疫受抑制。这一结果与国内外报道一致。本研究结果也表明,LRH组和ARH组虽都可引起一定程度的免疫功能抑制,但LRH组对机体免疫功能的抑制较ARH组为轻。
3.3两种术式对T淋巴细胞活化功能的影响
HLA-DR主要作用是参与抗原提呈。当机体受到各种外源性或内源性致病因子刺激时,这些抗原经单核细胞处理后呈递给T淋巴细胞,从而诱发免疫应答反应。研究显示[12-14]手术或创伤后,HLA-DR表达下降,其下降的程度与损伤的程度相关。Bolla 等[15]研究发现单核细胞表面HLA-DR的表达在开腹手术后长时间持续降低,而腹腔镜术后无明显改变。Wu等[16]随机对照研究了12例腹腔镜和14例开腹结直肠癌切除术,发现两组术后2 h外周血HLA-DR均降低,术后第4天腹腔镜组恢复至术前水平,而开腹组仍低于术前水平,认为手术损伤的程度决定了HLA-DR恢复的快慢。另有学者在对26例肾细胞癌患者的研究中,发现外周血HLA-DR在腹腔镜和开腹术后无明显差别[17]。
本研究结果显示,LRH组和ARH组术后1天外周血HLA-DR+CD3+均较术前下降,LRH组下降程度小于ARH组;两组患者术后5天HLA-DR+ CD3+均有升高趋势,且LRH组已恢复至术前水平,而ARH组仍低于术前,且至术后28天ARH组仍未恢复至术前水平。两组患者术后1天外周血HLA-DR+CD8+较术前升高,在术后5天HLA-DR+ CD8+较术后1天有下降趋势,且LRH组已降至术前水平,而ARH组仍高于术前。本研究样本量较少,虽然目前结果显示两组间的差异无统计学意义,但本研究的结果与国内外研究总体趋势是一致的。手术后HLA-DR+CD3+T细胞,即能有效抗肿瘤的活化T细胞的比例发生下降,且下降程度与损伤程度相关,而HLA-DR+CD8+T细胞,即活化部分CD8+T细胞受炎性、病原等因素出现升高,免疫功能受抑制,且腹腔镜手术对外周血T淋巴细胞HLA-DR表达的影响较开腹手术小。
综上所述,手术后免疫指标的复杂变化能影响机体免疫功能的状态。相对开腹手术来说,腹腔镜手术引起机体免疫反应轻,对免疫功能的抑制作用也较小,术后恢复快[18]。本研究再次证实了这一点。
参考文献:
[1]赵映华,李孟达,彭小萍,等.具有盆腔淋巴结转移的宫颈癌预后影响因素研究[J].中国现代医学杂志, 2007, 17(5): 623-625.
[2] Pagès F, Galon J, Dieu-Nosjean MC, et al. Immune infiltration in human tumors: a prognostic factor that should not be ignored[J]. Oncogene, 2010, 29(8): 1093-1102.
[3] Mlecnik B, Bindea G, Pagès F, et al. Tumor immunosurveillance in human cancers[J]. Cancer Metastasis Rev, 2011, 30(1): 5-12.
[4] Burke JG, Watson RW, McCormack D, et al. Intervertebral discs which cause low hack pain secrete higl1 levels of proinflammatory mediators[J]. Bone Joint Surg Br, 2002, 84(2): 196-201.
[5] Perez-Cruet MJ, Foley KT, Isaacs RE, et al. Micreendeseopic lurebar discectomy: technique note[J]. Neure Surgery, 2002, 51(5 Supp1): s129-sl36.
[6] Fridman WH, Pages F, Sautes-Fridman C, et al. The immune contexture in human tumours: impact on clinical outcome[J]. Nat Rev Cancer, 2012, 12(4): 298-306.
[7]刘新民.妇产科手术学[M].第3版.北京:人民卫生出版社, 2003: 296-309.
[8]马原,魏向群,杨琳琳,等.腹腔镜下宫颈癌根治术治疗宫颈癌的临床分析[J].昆明医科大学学报, 2013, 34(10): 107-110.
[9]施晓,章波儿,李海洋,等.腹腔镜手术对良性妇科疾病患者免疫功能的影响[J].中国妇幼保健, 2011, 26(1): 125-127.
[10]朱小丽.外周血T淋巴细胞亚群检测在恶性肿瘤中的价值[J].医药论坛杂志, 2011, 32(1): 83-84.
[11]史继静,刘潮奇.白介素6与肿瘤相关性的研究进展[J].生命的化学, 2008, 28(1): 12-14.
[12]李洁华,许丹.腹腔镜与开腹手术剥除卵巢良性畸胎瘤对机体免疫功能影响的比较研究[J].实用妇产科杂志, 2010, 26(5): 358-360.
[13] Schietroma M, Carlei F, Lezoche E, et al. Evaluation of immune response in patients after open or laparoscopic cholecystectomy[J]. Hepatogastroenterology, 2004, 48(39): 642-645.
[14]赵倩,边爱平.腹腔镜子宫切除术对IL-2、HLA-DR表达的影响[J].医药论坛杂志, 2006, 27(12): 13-15.
[15] Bolla G, Tuzzato G. Immunologic postoperative competence after laparoscopy versus laparotomy[J]. Surg Endosc, 2003, 17(8): 1247-1250.
[16] Wu FP, Sietses C, Blomberg BM, et al. Systemic and peritoneal inflammatory response after laparoscopic or conventional colon resection in cancer patients: a prospective, randomized trial[J]. Dis Colon Rectum, 2003, 46(2): 147-155.
[17] Landman J, Olweny E, Sundaram CP, et al. Prospective comparison of the immunological and stress response following laparoscopic and open surgery for localized renal cell carcinoma[J]. J Urol, 2004, 17l(4): 1456-1460.
[18] Kloosterman T, Von Blomberg BM, Borgstein P, et al. Unimpaired immune function after laparoscopic cholecystectomy[J]. Surg, 2011, 115(4): 424-426.
(吴静编辑)
论著
Comparative study of laparoscopic and transabdominal radical hysterectomy's impact on the cellular immunity*
Xiang-qun Wei1, Chun-xiu Wu2, Hao Feng3, Wen-liang Li1, Yan-huan Chen1
(1.Department of Gynecological Oncology, the 3rd Hospital affiliated to Kunming Medical University, Kunming, Yunnan 650118, China; 2.Department of Gynecology, the 1st Hospital of Qinhuangdao, Qinhuangdao, Hebei 066000, China; 3.Department of Surgery, the 3rd Hospital of Qinhuangdao, Qinhuangdao, Hebei 066000, China)
Abstract:Objective To compare the difference of impact on the cellular immunity between laparoscopic and transabdominal radical hysterectomy. Methods 60 patients with early cervical cancer (Ⅰa2~Ⅱa1), half of them were assigned to do abdominal radical hysterectomy (ARH) and the other half for laparoscopic radical hysterectomy (LRH). Adopt flow cytometry (FCM) detect peripheral blood T lymphocyte subsets, NK cells, CIK cells and T lymphocyte activation function on one day before surgery, one day, five days, and 28 days after the surgery separately. Compare the changes of immune status. Results After one day, the number of T lymphocyte subsets declined compared with preoperative one day(P<0.05). After five days, each index in LRH group was increased compared with postoperative one day, and the degree of decline is less than the ARH group (P<0.05), and recovered faster. After one day, the number of HLA-DR+CD3+in LRH group compared with the preoperative one day declined and HLA-DR+CD8+increased, and the degree of change is less than the ARH group, and recovered faster. Conclusions Immune function in patients after laparoscopic group was less changed, and recovered quickly, while the immune function were less inhibited, it may protect patients' immune function better.
Keywords:cellular immunity; cervical cancer; laparoscopic cervical cancer radical prostatectomy; human leukocyte antigen-DR (HLA-DR); T-cell subsets
*基金项目:云南省科技厅资助项目(No:2014FZ036)
收稿日期:2015-08-19
文章编号:1007-1989(2016)03-0001-06
DOI:10.3969/j.issn.1007-1989.2016.03.001
中图分类号:R737.3
文献标识码:A

