荜茇酰胺对人胃癌细胞株MKN45增殖、凋亡的影响及其机制研究
·论著·
荜茇酰胺对人胃癌细胞株MKN45增殖、凋亡的影响及其机制研究
段超勤*邓超邹晓平#
南京大学医学院附属鼓楼医院消化科(210008)
背景:近年研究显示,荜茇酰胺(PL)在诸多恶性肿瘤中可通过升高活性氧(ROS)水平选择性杀伤肿瘤细胞,然而其对胃癌细胞的作用仍有待进一步研究。目的:探讨PL对人胃癌细胞株MKN45增殖、凋亡的影响及其可能机制。方法:以不同浓度PL以及caspase抑制剂、抗氧化剂单独或联合处理MKN45细胞,CCK-8法检测细胞活性,流式细胞术检测细胞周期、细胞凋亡和细胞内ROS水平,蛋白质印迹法检测凋亡相关蛋白XIAP、cleaved-caspase3、7、9、cleaved-PARP、p53及其下游靶基因p21、GADD45α、PUMA表达。结果:PL可剂量和时间依赖性地抑制MKN45细胞增殖,经PL处理的MKN45细胞G1期细胞比率、细胞凋亡率和细胞内ROS水平显著升高,抗凋亡蛋白XIAP表达下调,caspase依赖性凋亡途径、p53及其下游靶基因激活。抗氧化剂NAC或广谱caspase抑制剂Z-VAD-FMK预处理可逆转PL的促ROS生成以及增殖抑制和促凋亡作用。结论:PL能抑制MKN45细胞增殖,使细胞发生G1期阻滞,诱导细胞凋亡,其抗肿瘤效应的作用机制可能为升高肿瘤细胞内ROS水平,进而激活p53和caspase依赖性凋亡途径。
关键词荜茇酰胺;活性氧;肿瘤抑制蛋白p53;半胱氨酸天冬氨酸蛋白酶;细胞凋亡;胃肿瘤
Effect and Underlying Mechanism of Piperlongumine on Proliferation and Apoptosis of Human Gastric Cancer Cell Line MKN45
DUANChaoqin,DENGChao,ZOUXiaoping.DepartmentofGastroenterology,theAffiliatedDrumTowerHospitalofNanjingUniversityMedicalSchool,Nanjing(210008)
Correspondence to: ZOU Xiaoping, Email: zouxiaoping795@hotmail.com
Background: Recently, studies have shown that piperlongumine (PL) selectively killed cancer cells by elevating reactive oxygen species (ROS) in various cancers. However, the effect of PL on gastric cancer cells remained to be further studied. Aims: To investigate the effect of PL on proliferation and apoptosis of human gastric cancer cell line MKN45 and its underlying mechanism. Methods: MKN45 cells were treated with different doses of PL, caspase inhibitor, antioxidant, and their combinations, respectively. Cell viability was assessed by CCK-8 assay; cell cycle, apoptosis and intracellular ROS level were measured by flow cytometry; and Western blotting was employed to determine the expression of apoptosis-related proteins (XIAP, cleaved-caspase3, 7, 9 and cleaved-PARP), p53 and its downstream target genes (p21, GADD45α and PUMA). Results: PL inhibited the proliferation of MKN45 cells in a dose- and time-dependent manner. In MKN45 cells treated with PL, the proportion of cells in G1 phase, apoptotic rate and intracellular ROS level were significantly increased, the expression of inhibitor of apoptosis protein XIAP was down-regulated, and the caspase-dependent apoptosis pathway, p53 and its downstream target genes were activated. Pretreatment with antioxidant NAC or Z-VAD-FMK, a general caspase inhibitor could partially abolish the effect of PL on ROS production and its antitumor effect. Conclusions: PL can inhibit cell proliferation and induce cell cycle G1 phase arrest and apoptosis in MKN45 cells. Its antitumor effect may be associated with a ROS-mediated p53 activation and subsequent triggering of caspases cascade of cell apoptosis.
Key wordsPiperlongumine;Reactive Oxygen Species;Tumor Suppressor Protein p53;Caspases;
Apoptosis;Stomach Neoplasms
尽管胃癌发病率已从1975年位居世界第一位下降至2012年的世界第五位,但胃癌致死率仍居癌症相关死亡率的第三位[1]。大部分胃癌患者确诊时已属晚期,且半数以上的局部进展期胃癌患者术后可能复发,3年生存率低于40%[2]。近年来,随着免疫治疗、新辅助治疗、分子靶向药物等治疗方法的不断进步,胃癌患者的长期生存率有所提高。化疗仍是进展期胃癌患者最主要的治疗方法[3],然而其所面临的药物毒性大、患者反应率低、并发症多等问题导致患者的生存质量和生存率均不容乐观[4-5],因此寻找新的有效治疗胃癌的方法是一个亟待解决的问题。荜茇酰胺(piperlongumine, PL)是提取自中药荜茇的一种生物碱,既往研究表明其具有抗血小板[6]、抗焦虑和抑郁[7]、抗炎和血管屏障保护[8]等活性,并能对多种肿瘤细胞株和小鼠移植瘤模型发挥抑制生长、诱导凋亡和抗癌效应[9-12],然而PL对胃癌细胞的作用及其机制仍有待进一步研究。本研究探讨了PL对人胃癌细胞株MKN45增殖、凋亡的影响及其可能机制。
材料与方法
一、肿瘤细胞株和主要试剂
人胃癌细胞株MKN45购自中科院上海细胞库,由南京鼓楼医院消化科实验室冻存保管;PL、N-乙酰半 胱氨酸(NAC)、2’,7’-二氯荧光素二乙酸盐(DCFH-DA)(Sigma-Aldrich Co. LLC.),Z-VAD-FMK(Selleck Chemicals),CCK-8细胞增殖/细胞毒性检测试剂盒[东仁化学科技(上海)有限公司],细胞周期、细胞凋亡检测试剂盒(BD Biosciences),p21抗体、聚腺苷二磷酸核糖聚合酶(PARP)抗体、p53 抗体、生长停滞DNA损伤可诱导蛋白α(GADD45α)抗体、p53上调凋亡调节因子(PUMA)抗体(Santa Cruz Biotechnology, Inc.),X连锁凋亡抑制蛋白(XIAP)抗体(R&D Systems),caspase3、caspase7、caspase9抗体、羊抗鼠、羊抗兔二抗(Cell Signaling Technology, Inc.)。
二、方法
1. 细胞培养:MKN45细胞以含10%胎牛血清和1%双抗(100 U/mL青霉素+100 μg/mL链霉素) 的RPMI 1640培养基培养于5% CO2、37 ℃恒温细胞培养箱内,常规消化传代。
2. 细胞处理:取对数生长期MKN45细胞,按后续实验要求以5×103/孔接种于96孔板(细胞活性检测)或以2×105/孔接种于6孔板(除细胞活性检测外的其余检测),孵育24 h后进行相应处理。具体分组处理方式包括:①加入终浓度为0、1、2、4、6、8、10 μmol/L的PL,孵育24 h、48 h;②加入终浓度为0、5、7.5、10 μmol/L的PL,孵育3 h、12 h、24 h、36 h、48 h;③加入7.5 μmol/L PL孵育24 h、20 μmol/L Z-VAD-FMK孵育1 h或Z-VAD-FMK预处理1 h+PL 24 h,并设置不予任何处理的对照组;④加入7.5 μmol/L PL孵育3 h/24 h、3 mmol/L NAC孵育1 h或NAC预处理1 h+PL 3 h/24 h,并设置不予任何处理的对照组。
3. 细胞活性检测(CCK-8法):MKN45细胞经相应处理后,弃培养基,加入含10% CCK-8 的培养基避光孵育1.5 h,以酶标仪测定450 nm波长处吸光度(A)值。细胞相对存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
4. 细胞周期检测:MKN45细胞经相应处理后,胰酶消化、收集细胞,预冷PBS洗涤3次,1 000 r/min离心5 min,弃上清,加入A液固定10 min,加入B液处理10 min,加入C液(PI)染色30 min,上流式细胞仪检测。
5. 细胞凋亡检测:MKN45细胞经相应处理后,胰酶消化、收集细胞,预冷 PBS洗涤2次,以100 μL 1×结合缓冲液重悬细胞,加入5 μL Annexin V/FITC和5 μL PI,混匀后室温避光放置15 min,加入400 μL 1×结合缓冲液,上流式细胞仪检测。
6. 活性氧(ROS)检测:MKN45细胞经相应处理后,胰酶消化、收集细胞,10 μmol/L DCFH-DA 37 ℃孵育30 min,预冷PBS洗涤2次,1 h内上流式细胞仪检测。
7. 蛋白质印迹法:MKN45细胞经相应处理后,胰酶消化、收集细胞,预冷 PBS洗涤2次,加入适当裂解液4 ℃或冰上裂解15 min,12 000 r/min离心15 min,BCA法蛋白定量,将各组蛋白调整为同一浓度,沸水煮5 min。取20~40 μg总蛋白上样,8%~12% SDS-PAGE电泳分离1~2 h,蛋白转移至PVDF膜,5%脱脂牛奶封闭2 h,加入1∶1 000~1∶2 000稀释的相应一抗,4 ℃孵育过夜,TBST洗涤3次,加入相应二抗孵育2 h,TBST洗涤3次,ECL显影,化学发光成像系统捕获并保存图像。
三、统计学分析
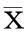
结果
一、PL抑制MKN45细胞增殖
以0、1、2、4、6、8、10 μmol/L PL处理MKN45细胞24 h或48 h后,CCK-8法检测显示,PL可抑制MKN45细胞增殖,作用呈剂量依赖性(图1A)。以0、7.5、10 μmol/L PL处理MKN45细胞12 h、24 h、36 h、48 h后,CCK-8法检测显示,PL对MKN45细胞的增殖抑制作用呈时间依赖性(图1B)。
二、PL诱导MKN45细胞G1期阻滞
以0、5、7.5、10 μmol/L PL处理MKN45细胞24 h 后,流式细胞分析显示,PL可诱导MKN45细胞发生G1期阻滞(图2A、2B);蛋白质印迹法检测显示,PL可上调细胞周期负调控因子p21蛋白表达(图2C),与流式细胞分析结果相符。
三、PL诱导MKN45细胞凋亡
以0、5、7.5、10 μmol/L PL处理MKN45细胞24 h 后,流式细胞分析显示,PL可诱导MKN45细胞凋亡(图3A、3B);蛋白质印迹法检测显示,PL可下调抗凋亡蛋白XIAP表达,上调cleaved-caspase3、7、9、cleaved-PARP表达(图3C),即激活caspase依赖性凋亡途径,与流式细胞分析结果相符。
四、caspase抑制剂可部分逆转PL的促凋亡作用
以广谱caspase抑制剂Z-VAD-FMK(20 μmol/L)预处理MKN45细胞1 h后,再加入7.5 μmol/L PL处理24 h,流式细胞分析显示,与仅予PL处理相比,Z-VAD-FMK预处理可部分逆转PL的促凋亡作用(图4A、4B);蛋白质印迹法检测显示,Z-VAD-FMK预处理可下调cleaved-caspase3、9、cleaved-PARP表达(图4C)。

图1 PL对MKN45细胞的增殖抑制作用呈剂量(A)和时间(B)依赖性
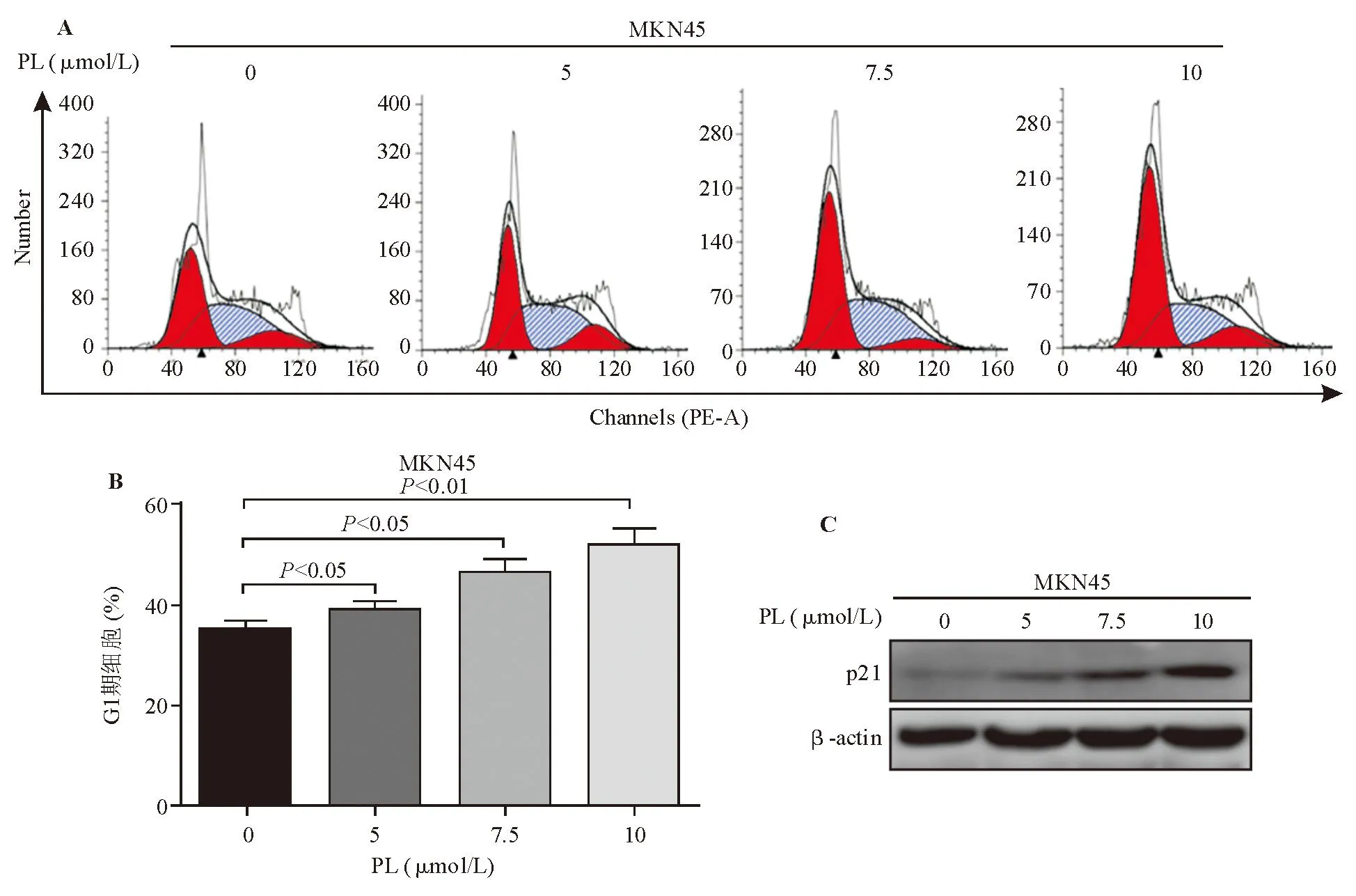
图2 PL上调p21蛋白表达(C),诱导MKN45细胞G1期阻滞(A、B)

图3 PL下调XIAP表达,激活caspase依赖性凋亡途径(C),诱导MKN45细胞凋亡(A、B)
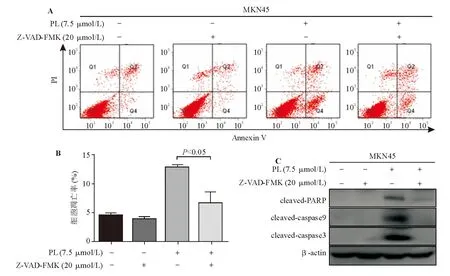
图4 caspase抑制剂可抑制caspase依赖性凋亡途径(C),部分逆转PL对MKN45细胞的促凋亡作用(A、B)
五、PL通过ROS-p53途径诱导细胞凋亡
以0、5、7.5、10 μmol/L PL处理MKN45细胞3 h 后,流式细胞分析显示,细胞内ROS水平升高,而抗氧化剂NAC(3 mmol/L, 1 h)预处理可逆转PL(7.5 μmol/L, 3 h)的促ROS生成作用(图5A、5B);以0、5、7.5、10 μmol/L PL处理MKN45细胞24 h后,蛋白质印迹法检测显示,p53及其下游靶基因p21、GADD45α、PUMA蛋白表达上调(图5C)。上述发现提示PL可能通过升高MKN45细胞内ROS水平激活p53,进而诱导细胞凋亡。
六、抗氧化剂可逆转PL的增殖抑制作用
以抗氧化剂NAC(3 mmol/L)预处理MKN45细胞1 h后,再加入7.5 μmol/L PL处理24 h,CCK-8法和蛋白质印迹法检测显示,与仅予PL处理相比,NAC预处理可逆转PL的增殖抑制作用(图6A),同时下调p53、cleaved-PARP表达(图6B),进一步证实PL系通过ROS-p53途径诱导MKN45细胞凋亡。
讨论
近年研究显示,PL在诸多恶性肿瘤中可通过升高ROS水平选择性杀伤肿瘤细胞,在体内、外实验中均显现出明显的抗肿瘤效应。本研究结果证实PL对人胃癌细胞株MKN45具有显著抑制增殖和诱导凋亡作用。与既往研究[9,13-14]结果相符,本研究发现PL能升高MKN45细胞内的ROS水平,继而上调p53及其下游靶基因表达,下调抗凋亡蛋白XIAP表达,激活caspases级联反应,使细胞发生G1期阻滞,细胞凋亡增多,增殖受抑。
p53作为抑癌基因可直接调节细胞周期和细胞凋亡,氧化应激和DNA损伤可激活p53,导致p53蛋白表达上调[15]。作为p53靶基因之一的p21是细胞周期负调控因子,p53激活可上调其表达,进而诱导细胞发生G1期阻滞[16-17]。本研究结果表明,PL可通过升高MKN45细胞内ROS水平激活p53及其下游靶基因p21、GADD45α、PUMA, 从而使MKN45细胞阻滞于G1期,诱导细胞凋亡。为明确ROS在PL诱导MKN45细胞凋亡中的作用,进一步以抗氧化剂NAC预处理MKN45细胞,发现NAC预处理可逆转PL的促ROS生成和增殖抑制作用,下调p53、cleaved-PARP表达,证实PL系通过ROS-p53途径发挥其抗肿瘤效应。

图5 PL升高MKN45细胞内活性氧水平(A、B),上调p53及其下游靶基因表达(C)
图6 抗氧化剂可下调p53、cleaved-PARP表达(B),逆转PL对MKN45细胞的增殖抑制作用(A)
凋亡抑制蛋白(IAPs)是细胞凋亡过程中的关键调控因子,而XIAP为IAPs家族的重要成员之一,可通过抑制caspase3、7、9激活而阻断caspase依赖性凋亡途径[18]。本研究发现,以PL处理MKN45细胞可下调XIAP表达,激活caspase3、7、9及其下游PARP,从而诱导细胞凋亡,而广谱caspase抑制剂Z-VAD-FMK预处理可部分逆转PL的促凋亡作用,表明PL至少是部分通过caspase依赖性途径诱导细胞凋亡。
综上所述,本研究结果表明PL能抑制人胃癌细胞株MKN45增殖,使细胞发生G1期阻滞,诱导细胞凋亡,其抗肿瘤效应的作用机制可能为升高肿瘤细胞内ROS水平,进而激活p53和caspase依赖性凋亡途径,PL有望成为胃癌的潜在治疗药物。
参考文献
1 Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136 (5): E359-E386.
2 Mullen JT, Ryan DP. Neoadjuvant chemotherapy for gastric cancer: what are we trying to accomplish?[J]. Ann Surg Oncol, 2014, 21 (1): 13-15.
3 Wagner AD, Unverzagt S, Grothe W, et al. Chemotherapy for advanced gastric cancer[J]. Cochrane Database Syst Rev, 2010, 17 (3): CD004064.
4 Van Cutsem E, Moiseyenko VM, Tjulandin S, et al; V325 Study Group. Phase Ⅲ study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group[J]. J Clin Oncol, 2006, 24 (31): 4991-4997.
5 Bamias A, Pavlidis N. Systemic Chemotherapy in Gastric Cancer: Where Do We Stand Today?[J]. Oncologist, 1998, 3 (3): 171-177.
6 Park BS, Son DJ, Park YH, et al. Antiplatelet effects of acidamides isolated from the fruits of Piper longum L[J]. Phytomedicine, 2007, 14 (12): 853-855.
7 Cícero Bezerra Felipe F, Trajano Sousa Filho J, de Oliveira Souza LE, et al. Piplartine, an amide alkaloid from Piper tuberculatum, presents anxiolytic and antidepressant effects in mice[J]. Phytomedicine, 2007, 14 (9): 605-612.
8 Lee W, Yoo H, Kim JA, et al. Barrier protective effects of piperlonguminine in LPS-induced inflammationinvitroandinvivo[J]. Food Chem Toxicol, 2013, 58: 149-157.
9 Raj L, Ide T, Gurkar AU, et al. Selective killing of cancer cells by a small molecule targeting the stress response to ROS[J]. Nature, 2011, 475 (7355): 231-234.
10Makhov P, Golovine K, Teper E, et al. Piperlongumine promotes autophagy via inhibition of Akt/mTOR signalling and mediates cancer cell death[J]. Br J Cancer, 2014, 110 (4): 899-907.
11Bharadwaj U, Eckols TK, Kolosov M, et al. Drug-repositioning screening identified piperlongumine as a direct STAT3 inhibitor with potent activity against breast cancer[J]. Oncogene, 2015, 34 (11): 1341-1353.
12Golovine K, Makhov P, Naito S, et al. Piperlongumine and its analogs down-regulate expression of c-Met in renal cell carcinoma[J]. Cancer Biol Ther, 2015, 16 (5): 743-749.
13Chen Y, Liu JM, Xiong XX, et al. Piperlongumine selectively kills hepatocellular carcinoma cells and preferentially inhibits their invasion via ROS-ER-MAPKs-CHOP[J]. Oncotarget, 2015, 6 (8): 6406-6421.
14Jin HO, Lee YH, Park JA, et al. Piperlongumine induces cell death through ROS-mediated CHOP activation and potentiates TRAIL-induced cell death in breast cancer cells[J]. J Cancer Res Clin Oncol, 2014, 140 (12): 2039-2046.
15Meek DW. Regulation of the p53 response and its relationship to cancer[J]. Biochem J, 2015, 469 (3): 325-346.
16Brugarolas J, Chandrasekaran C, Gordon JI, et al. Radiation-induced cell cycle arrest compromised by p21 deficiency[J]. Nature, 1995, 377 (6549): 552-557.
17Boulaire J, Fotedar A, Fotedar R. The functions of the cdk-cyclin kinase inhibitor p21WAF1[J]. Pathol Biol (Paris), 2000, 48 (3): 190-202.
18Silke J, Meier P. Inhibitor of apoptosis (IAP) proteins-modulators of cell death and inflammation[J]. Cold Spring Harb Perspect Biol, 2013, 5 (2). pii: a008730.
(2015-10-23收稿;2015-11-25修回)
DOI:10.3969/j.issn.1008-7125.2016.02.002
*Email: duanchaoqin@126.com
#本文通信作者,Email: zouxiaoping795@hotmail.com

