硅掺杂碳量子点荧光猝灭法测定水样中铜(Ⅱ)
占霞飞,唐建设,吴 军,曹梓楷
(安徽建筑大学 环境与能源工程学院,安徽 合肥 230601)
硅掺杂碳量子点荧光猝灭法测定水样中铜(Ⅱ)
占霞飞,唐建设*,吴 军,曹梓楷
(安徽建筑大学 环境与能源工程学院,安徽 合肥 230601)
3-氨丙基三甲氧基硅烷(APTMS)与戊二醛(GA)混合前驱物合成的硅掺杂碳量子点(SDCQDs),其最大吸收、激发和发射波长分别为259,245,395 nm,量子产率为13.60%,XPS谱图表明碳量子点掺杂Si,且富含甲亚胺基团和硅氧键。Cu2+对碳量子点荧光产生猝灭作用,依据Cu2+浓度与碳量子点荧光强度猝灭率的相关性,建立碳量子点荧光探针测定水样中Cu2+的分析方法,其它金属离子对Cu2+干扰程度较小,回收率为91.4%~100.8%,检出限为0.13 μmol/L,相对标准偏差为0.20%~0.92%。
硅掺杂碳量子点;荧光猝灭;S曲线方程拟合;铜(Ⅱ)
铜广泛存在于环境与生物体中。它是生物生命活动所必需的微量元素之一,能以酶的辅助因子形式参与生物体代谢过程[1],但铜过量会严重危害生态环境及人类健康[2-3],因此,发展Cu2+的高灵敏、快速检测方法具有重要意义。目前对Cu2+的测定主要有原子吸收光谱法[4-5]、电化学分析法[6]、分光光度法[7]等,但这些方法存在分析成本高、过程繁琐、时间长等缺陷[8]。荧光探针测定重金属的方法具有简便、快速、灵敏等优点[9-10],深受国内外研究者的青睐。目前测定水样中Cu2+的荧光探针有草甘膦修饰CdSe/CdS量子点、溶胶-凝胶法制备ZnO量子点、巯基乙酸为稳定剂合成DDTC-CdSe/CdS量子点等[11-13],而以硅掺杂碳量子点为荧光探针测定Cu2+的方法尚未见报道。本研究以3-氨丙基三甲氧基硅烷(APTMS)和戊二醛(GA)合成的硅掺杂碳量子点作为荧光探针,基于Cu2+对该碳量子点产生荧光猝灭作用,建立了一种水样中Cu2+测定的新方法。该方法简便、快速、选择性较好、灵敏度高、检出限低。
1 实验部分
1.1 仪器与试剂
UV759紫外可见分光光度计(上海菁华科技仪器有限公司);F-7000荧光光谱仪(日本日立公司)和pHS-3D型酸度计(上海雷磁仪器公司);TGL-20M型台式高速冷冻离心机(上海卢湘仪离心机有限公司)。
3-氨丙基三甲氧基硅烷(APTMS)、戊二醛溶液(GA)、硫酸奎宁(Φ=0.55)、磷酸氢二钾、硫酸、硫酸铜(国药集团化学试剂有限公司);乙二胺四乙酸(上海东懿化学试剂公司);采用K2HPO4和KH2PO4溶液配制磷酸盐缓冲液(0.20 mol/L,pH 6.0),在酸度计上校准。所有化学试剂均为分析纯,实验用水为自制蒸馏水。
1.2 硅掺杂碳量子点的制备
取211 μL 0.10 mol/L GA溶液于20 mL烧杯中,缓慢滴加175 μL 0.05 mol/L APTMS,用0.10 mol/L H2SO4调至pH 5.5,补水至20 mL。转入聚四氟乙烯内衬反应釜,180 ℃持续加热8 h,自然冷却至室温,离心,过0.45 μm滤膜,取上清液,得到硅掺杂碳量子点,于4 ℃冰箱中保存备用。
1.3 Cu2+的测定
在1 mL磷酸盐缓冲液(0.20 mol/L,pH 6.0)中,滴加2 mL 1.25 mmol/L(以GA浓度计算)硅掺杂碳量子点标准溶液,再依次加入1 mL不同浓度的Cu2+标准溶液,用水定容至5 mL,摇匀。以5 mL硅掺杂碳量子点溶液为空白液制作标准曲线,样品测定时将水样替换为Cu2+标准溶液。
1.4 数据处理
以测定未加Cu2+样品的荧光强度为F0,含不同浓度Cu2+样品的硅掺杂碳量子点荧光强度为F,设定荧光发射光谱的激发波长为245 nm,最大发射波长为395 nm,激发和发射狭缝均为5 nm。计算荧光强度ΔF=F0-F,荧光猝灭率为Q=(F0-F)/F0×100%。
2 结果与讨论
2.1 硅掺杂碳量子点的光学性能
图1为硅掺杂碳量子点的紫外可见吸收光谱(A)、荧光激发光谱及发射光谱(B)。所制备的硅掺杂碳量子点的最大吸收波长为259 nm,其最大激发波长位于245,345 nm,荧光发射峰位于395 nm处,荧光发射峰呈高斯对称,半峰宽较窄(31 nm),表明硅掺杂碳量子点的粒径分布均匀。与单独硅掺杂碳量子点的吸收峰相比,加入Cu2+后硅掺杂碳量子点的吸收峰发生红移,说明Cu2+的加入导致一种新化合物的形成[14];最大荧光发射峰的荧光信号强度降低,表明Cu2+对该碳量子点的荧光产生猝灭作用。以硫酸奎宁作荧光标准物,采用相对测量法[15]测得硅掺杂碳量子点的量子产率为13.60%。
2.2 硅掺杂碳量子点的表征

2.3 硅掺杂碳量子点对Cu2+检测
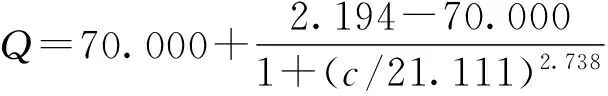
依据文献[23]中Stern-Volmer方程,计算出荧光猝灭常数Ksv为2.37×107L/mol,大于100 L/mol,相关系数r2=0.961 5,结合图1A中吸收光谱的变化情况,说明Cu2+对硅掺杂碳量子点的猝灭过程为静态猝灭。有研究表明,粒径为3.27 nm CA-CdTe量子点的荧光猝灭常数为5.699×104L/mol(>100 L/mol),且加入Cu2+的CA-CdTe量子点吸收光谱明显不同于单独CA-CdTe量子点的吸收光谱,说明Cu2+对CA-CdTe量子点的荧光猝灭过程为静态猝灭[24]。硅掺杂碳量子点表面的甲亚胺基团上氮原子与Cu2+之间发生很强的配位作用,Cu2+与硅掺杂碳量子点发生电荷转移,导致体系荧光猝灭[25-26]。表1为不同量子点检测Cu2+的检出限比较,结果表明,硅掺杂碳量子点测定Cu2+的检出限较低(0.13 μmol/L或8.32 μg/L)。

表1 量子点检测Cu2+的检出限比较Table 1 Comparison of the reported methods for Cu2+using quantum dots
*:no data
2.4 共存物的影响
考察了常见离子(Fe3+,Cr3+,Cd2+,Ca2+,Co2+,Pb2+,Mg2+,Zn2+,Ag+和Na+)对25 μmol/L Cu2+测定的影响。结果显示,加入同倍量的金属离子,Cu2+产生显著的猝灭作用,荧光猝灭率达27%;除Fe3+对其有一定的干扰外(选用掩蔽剂柠檬酸溶液[30]将Fe3+掩蔽消除),其它离子的干扰程度小,硅掺杂碳量子点的荧光强度猝灭率在±5%之间。表明该方法对Cu2+检测具有较高的选择性。
为确定硅掺杂碳量子点的猝灭作用是由Cu2+造成,选用金属离子专属螯合剂EDTA来评价硅掺杂碳量子点的荧光性能恢复情况[31]。分别测定25 μmol/L EDTA,25 μmol/L Cu2+和等摩尔EDTA与Cu2+混合3种情形下体系的荧光强度。结果显示,单独Cu2+存在时,会导致硅掺杂碳量子点的荧光强度猝灭,而单独EDTA对硅掺杂碳量子点的荧光强度影响较小,当等摩尔EDTA-Cu2+存在时,可促使硅掺杂碳量子点的荧光强度恢复,恢复率达65%。表明加入绝对过量的EDTA可以恢复硅掺杂碳量子点的荧光性能,与文献报道一致[32]。
2.5 水样中Cu2+的检测
取自来水和湖水样品,过0.45 μm滤膜后,各分成9份。分别添加1 mL不同浓度的Cu2+标准溶液,定容后Cu2+浓度分别为5,15,25 μmol/L,测定体系荧光强度值,计算Cu2+浓度,各样品均测定3次取平均值,并进行加标回收试验,结果见表2。本方法的回收率为91.4%~100.8%,相对标准偏差(RSD)为0.20%~0.92%,表明选用APTMS和GA合成硅掺杂碳量子点荧光猝灭法测定环境水样中Cu2+有良好的准确度和精密度。

表2 水样中 Cu2+的检测结果与加标回收率Table 2 Determination results and recovery of copper ions in water samples
3 结 论
本文采用APTMS与GA混合前驱物合成的硅掺杂碳量子点,具有优良的荧光性能和较高的量子产率。基于Cu2+对硅掺杂碳量子点具有选择性荧光猝灭作用,建立了自来水、湖水中Cu2+的检测方法。该方法操作简单、选择性较好、灵敏度高。
[1] Anna W,Anita K,Monika S P,Maksymilian K,Wojciech G,Bartosz S,Magorzata H,Agata C,Anna K F,Paulina C,Witold S,Stanisaw W,Wojciech G,Krzysztof S,Zbigniew K,Wojciech P,Andrzej P,Ewa F.PrzegladLekarski,2013,69(10):785-797.
[2] Bibi M,Hashmi M Z,Malik R N.Hum.Exp.Toxicol.,2016,35(1):78-90.
[3] Ullah S,Hasan Z,Zuberi A.Toxicol.Environ.Chem.,2016,98(1):64-76.
[4] Karimi M A,Mohammadi1 S Z,Mehrjardi A H,Mohadesi A,Yarahmadi J.J.Anal.Sci.Technol.,2015,6(1):1-11.
[6] Nourifard F,Payehghadr M,Kalhor M,Nejadali A.Electroanalysis,2015,27(10):2479-2485.
[7] Sunil A,Rao S J.J.Anal.Chem.,2015,70(2):154-158.
[8] Qi L,Wu F Y.J.NanchangUniv.:Nat.Sci.(戚丽,吴芳英.南昌大学学报:理科版),2012,36(1):50-53.
[9] Xu J G,Zhang J J,Chen Z B,Chen Y,Zhang L.Chin.J.Anal.Lab.(徐基贵,张俊俊,陈志兵,陈玉,张莉.分析试验室),2011,30(1):26-28.
[10] Tao H L,Li S H,Xu M Z,Zhou S L,He Z H.J.Anal.Sci.(陶慧林,黎舒怀,徐铭泽,周素莲,何宗辉.分析科学学报),2013,29(5):639-642.
[11] Liu Z Q,Liu S P,Yin P F,He Y Q.Anal.Chim.Acta,2012,745(1):78-84.
[12] Ng S M,Wong D S N,Phung J H C,Chua H S.Talanta,2013,116:514-519.
[13] Wang J Z,Zhou X P,Ma H B,Tao G H.Spectrochim.ActaA,2011,81(1):178-183.
[14] Wang J J,Lian M,Xiong J,Li Z J.Chin.J.Anal.Chem.(王佳佳,连曼,熊杰,李在均.分析化学),2016,44(3):367-376.
[15] Dong Y Q,Wang R X,Li H,Shao J W,Chi Y W,Lin X M,Chen G N.Carbon,2012,50:2810-2815.
[16] Zhang R Z,Chen W.Biosens.Bioelectron.,2014,55:83-90.
[17] Wu Y P,Zhou Y,Li J L,Zhou H D,Zhao H C,Chen J M.J.Appl.Polym.Sci.,2016,133(26):43589-43600.
[18] Zhang Y C,Zhang J,Sheng C D,Chen J,Liu Y X,Zhao L,Xie F.Energ.Fuel.,2011,25(1):240-245.
[19] Cayuela A,Soriano M L,Kennedy S R,Steed J W,Valcárcel M.Talanta,2016,151:100-105.
[20] Qian Z S,Ma J J,Shan X Y,Feng H,Shao L X,Chen J R.Chemistry,2014,20(8):2254-2263.
[21] Hou J Y,Dong J,Zhu H S,Teng X,Ai S Y,Mang M L.Biosens.Bioelectron.,2015,68:20-26.
[22] Xiang L,Zhao F,Pan F K,Zhan X F,Wang S Y,Tang J S.Chin.J.Anal.Lab.(项丽,赵峰,潘法康,占霞飞,汪师园,唐建设.分析试验室),2014,33(11):1271-1275.
[23] Huang S,Ma J Q,Zhang L X,Dong M Y,Li X H,Luo Q L.J.HubeiUniv.:Nat.Sci.Ed.(黄珊,马建强,张丽霞,董明月,李雪华,罗秋玲.湖北大学学报:自然科学版),2013,35(3):344-349.
[24] Gan T T,Zhang Y J,Zhao N J,Xiao X,Yin G F,Shi Z Y.ActaOpt.Sin.(甘婷婷,张玉钧,赵南京,肖雪,殷高方,石朝毅.光学学报),2013,33(12):1-7.
[25] Wang H J,Zhang W Z,Cheng H E,Zhou P.Chin.J.Lumin.,2012,33(9):1030-1036.
[26] Koneswaran M,Narayanaswamy R.Sens.ActuatorB,2009,139(1):91-96.
[27] Nurerk P,Kanatharana P,Bunkoed O.Luminescence,2016,31(2):515-522.
[28] Gao L J,Zhao Y,Sun X H,Chai H M,Chen L.Chin.J.Anal.Lab.(高楼军,赵艳,孙雪花,柴红梅,陈露.分析试验室),2012,31(3):59-61.
[29] Zhan X S,Zhang B H,Wu F Y.J.NanchangUniv.:Eng.Technol.(占寻寿,张宝华,吴芳英.南昌大学学报:工科版),2010,32(3):228-232.
[30] Zhao Q,Chang Q,Yang J L,Liu J,Hu S L.Chin.J.Lumin.(赵清,常青,杨金龙,刘俊,胡胜亮.发光学报),2014,35(3):387-392.
[31] Jeevika H A,Shankaran D R.ColloidSurf.A,2014,461:240-247.
[32] Li L B,Yu B,You T Y.Biosens.Bioelectron.,2015,74:263-269.
Determination of Copper Ions in Water Samples by Silicon Doped Carbon Quantum Dots
ZHAN Xia-fei,TANG Jian-she*,WU Jun,CAO Zi-kai
(Environmental Engineering School,Anhui Jianzhu University,Hefei 230601,China)
The silicon doped carbon quantum dots(SDCQDs) were synthesized using 3-aminopropyl-trimethoxysilane(APTMS) and glutaraldehyde(GA) as mixed precursors.The maximum absorption wavelength,fluorescence excitation and fluorescence emission wavelengths of the SDCQDs were 259 nm,245 nm and 395 nm,respectively.The quantum yield of SDCQDs was 13.60%.The XPS spectra showed that the quantum dots were rich in azomethine group and silicon oxygen bond.The fluorescent intensity of SDCQDs could be quenched by copper ions.Hence,on the basis of the relationship between fluorescence quenching ratio and concentrations of copper ions,a method was developed for the determination of copper ions in water samples by using silicon doped carbon quantum dot as fluorescent probe.Other metal ions had no function of quenching.The spiked recoveries were in the range of 91.4%-100.8%,the detection limit was 0.13 μmol/L and the relative standard deviations(RSDs) were in the range of 0.20%-0.92%.
silicon doped carbon quantum dots;fluorescence quenching;fitting of S curve equation;copper ions
2016-03-29;
2016-05-14
国家科技支撑计划项目(2012BAJ08B03);国家自然科学基金(21205001);安徽省自然科学基金(1208085MB16)
10.3969/j.issn.1004-4957.2016.11.016
O657.3;O614.121
A
1004-4957(2016)11-1461-05
*通讯作者:唐建设,博士,副教授,研究方向:环境分析检测,Tel:0551-63812122,E-mail:tjs28@ahjzu.edu.cn
——以离子色谱法测定冬瓜中亚硝酸盐含量为例

