p-JNK/p-c-Jun通路参与大鼠杏仁核点燃癫痫模型
李巷,潘建青,康慧聪,杨志刚,韩金玲,聂荔,肖小华,张玲玲,朱遂强
p-JNK/p-c-Jun通路参与大鼠杏仁核点燃癫痫模型
李巷1,潘建青1,康慧聪2,杨志刚1,韩金玲1,聂荔1,肖小华3,张玲玲1,朱遂强2
目的:研究杏仁核点燃癫痫模型中c-Jun氨基末端激酶(JNK)通路的活化。方法:雄性Wistar大鼠20只,随机分为对照组10只和模型组10只。将电极植入大鼠右侧杏仁核,对照组不给予电刺激,模型组每天给予500 μA的电流刺激,大鼠连续10 d在刺激后达到5级发作视为点燃成功。成功点燃的大鼠,在最后1次5级发作后2 h处死。Western blot检测2组海马JNK、p-JNK、c-Jun、p-c-Jun的表达。结果:模型组刺激侧海马p-JNK、p-c-Jun表达明显高于对照组(P<0.05)。结论:p-JNK/p-c-Jun通路可能参与杏仁核癫痫模型点燃。
杏仁核点燃;磷酸化JNK;磷酸化c-Jun
颞叶癫痫及其动物模型主要的病理变化是海马硬化,包括神经元缺失及胶质细胞增生[1]。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)又被称为应激活化蛋白激酶(stress-activated protein kinase,SAPK),是丝裂原活化蛋白激酶系统成员之一,参与细胞生长、分化等的调控。JNK激活参与多种癫痫动物模型,与神经元凋亡相关。JNK可通过一系列磷酸化级联反应激活。活化的JNK可调控细胞核底物如c-jun等,促进细胞凋亡[2]。杏仁核点燃模型是目前国际公认的一种更为接近人类、应用广泛的复杂部分性发作模型。本课题组前期研究已发现,杏仁核点燃模型中刺激侧海马免疫组化染色有p-JNK表达,并与神经元损害部位一致。本研究定量检测刺激侧海马JNK/p-JNK及其下游信号c-jun/p-c-jun的表达,进一步阐述点燃模型海马损伤的分子机制。
1 材料与方法
1.1 主要试剂与材料
1.1.1 实验动物 SPF级雄性Wistar大鼠20只,体质量250~300 g。标准实验条件饲养。1.1.2主要试剂 兔抗JNK多克隆抗体及兔抗p-JNK多克隆抗体购自美国Cell Signal公司,小鼠抗p-c-Jun多克隆抗体购自美国Santa Cruz公司,HRP标记羊抗兔IgG及羊抗小鼠IgG购自北京中杉金桥生物技术公司,小鼠抗β-actin单克隆抗体购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 模型制作及分组6%水合氯醛腹腔注射麻醉大鼠后,固定于立体定位仪上,将自制五芯电极中的刺激电极植入右侧杏仁核基底外侧核(前囟后2.2 mm,旁开右侧4.8 mm,颅骨表面下8.5 mm)[4]。其他3个电极分别接上微型螺丝,置于前囟点左右及人字缝后方作为记录电极和参考电极。牙托粉固定。将所有大鼠随机分为对照组和模型组,各10只。2组均手术植入电极,术后1周,对照组每天抓取,但不予电刺激;模型组每天同一时间予电刺激:细电流,连续串刺激,延时100 ms,波宽1 ms,波间隔19 ms,频率50 Hz,串长100,方波,刺激强度500 μA,1次/d。刺激后记录大鼠行为学变化。发作强度参照国际通用的Racine分级,并参考以往研究[3]。连续10天达到5级发作视为模型点燃。最后1次5级发作2 h取标本。
1.2.2 Western blot检测 提取海马组织蛋白,测定蛋白浓度后,行SDS-PAGE凝胶电泳,转膜,封闭,加一抗、二抗孵育,DAB显色,扫描胶片,使用美国Gene Genius公司凝胶成像分析系统分析JNK、p-JNK、c-Jun、p-c-Jun及β-actin光密度值。
1.2.3 组织学变化 制备脑组织冰冻切片,尼氏染色后中性树胶封片,镜下观察电极位置是否正确,有无异常出血及组织损害。有以上情况出现的大鼠实验数据予以剔除。
1.3 统计学处理
采用SPSS 16.0软件处理数据,计量资料以(χ±s)表示,组间比较采用独立样本均数t检验,计数资料以率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
Westernblot结果显示,2组p-JNK46/54均有表达,模型组蛋白表达量明显增多;相对光密度值分析示:对照组、模型组中p-JNK46/actin分别为(0.24±0.02)、(0.48±0.01),p-JNK54/actin分别为(0.26±0.02)、(0.50± 0.03),差异有统计学意义(P<0.05),见图1B;JNK在2组中均有大量表达,但差异无统计学意义。p-c-Jun在2组均有表达,相对光密度值分析示:对照组、模型组中p-c-Jun分别为(0.38±0.03)、(0.88±0.02),差异有统计学意义(P<0.05),见图2B;c-Jun在2组中均有大量表达,但差异无统计学意义。
模型组1只大鼠点燃不成功,电极脱落,其他大鼠点燃后均表现出稳定的5级发作。对照组大鼠无电极脱落。
3 讨论
研究发现,在成功点燃的模型中,刺激侧海马p-JNK表达明显增多,与前期研究海马神经元损伤部位基本一致;刺激侧海马p-c-Jun表达明显增多;提示杏仁核点燃模型可能是通过p-JNK激活c-Jun致p-c-Jun表达增多,参与海马神经元损伤。
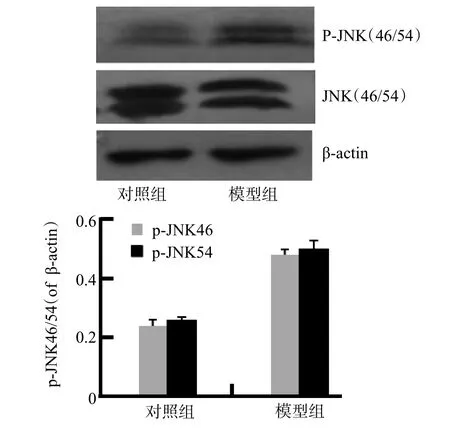
图1 对照组与模型组JNK与p-JNK变化

图2 对照组与模型组c-jun与p-c-jun变化
JNK的编码基因有3个,JNK1/2广泛存在于体内各种组织,JNK3主要分布在脑组织[4],通过磷酸化丝氨酸/苏氨酸残基来活化。各种促炎反应因子如肿瘤坏死因子(tumor necrosis factor,TNF)α、白细胞介素(interleukin,IL)-1β,细胞应激如热休克、紫外线照射、氧化应激都可以激活JNK[5]。JNK激活参与了多种癫痫动物模型,在毛果芸香碱导致的癫痫持续状态早期即有JNK的激活,且广泛分布于边缘系统,与神经元损伤区域分布一致[6];海人酸癫痫大鼠模型中,注射海人酸30 min即开始出现JNK激活,持续2 h恢复正常,同时JNK的底物c-jun磷酸化增强,参与神经元损伤[7]。JNK1及c-jun活化参与电休克惊厥[8];戊四氮小鼠癫痫模型中磷酸化JNK、磷酸化c-jun及上游信号MKK4均表达增多[9]。海马快速电点燃模型中,胶质细胞介导了JNK的活化并参与神经元的损伤过程[10]。上述实验均证实了JNK信号转导系统参与了急性癫痫发作及神经元损伤,但对于长期癫痫发作JNK通路是否参与研究较少。本实验中,杏仁核低强度电流刺激点燃模型是一个长期慢性的过程,大鼠完全点燃持续15~20 d,与对照组相比,模型组刺激侧海马p-JNK及p-c-Jun表达明显增多,与其他癫痫模型报道一致。
JNK活化后主要通过2个途径参与细胞损伤:一方面,转移至细胞核内,激活转录因子c-jun,进而增加AP-1转录及细胞凋亡;另一方面,一部分激活的JNK留在胞质中,参与Bcl-2家族成员的活化,最终导致细胞凋亡。本实验中刺激侧海马p-JNK及p-c-Jun表达明显增多,说明活化的JNK可进一步激活c-jun参与模型点燃。实验还需进一步研究其他可能的途径(如Bcl-2家族成员),进一步阐明杏仁核点燃的分子机制。
[1]Löscher W.Animal models of intractable epilepsy[J].Prog Neurobiol, 1997,53:239-258.
[2]Takeda K,Matsuzawa A,Nishitoh H,et al.Roles of MAPKKK ASK1 in stress-induced cell death[J].Cell Struct Funct,2003,28:23-29.
[3]李建英,李巷,康慧聪,等.左乙拉西坦对海人酸大鼠点燃癫痫模型的保护作用[J].神经损伤与功能重建,2013,8:247-249.
[4]Gupta S,Barrett T,Whitmarsh AJ,et al.Selective interaction of JNK protein kinase isoforms with transcription factors[J].EMBO J,1996,15: 2760-2770.
[5]Bruckner SR,Tammariello SP,Kuan CY,et al.JNK3 contributes to c-Jun activation and apoptosis but not oxidative stress in nerve growth factor-deprived sympathetic neurons[J].J Neurochem,2001,78:298-303.
[6]Garrido YC,Sanabria ER,Funke MG,et al.Mitogen-activated protein kinase is increased in the limbic structures of the rat brain during the early stages of status epilepticus[J].Brain Res Bull,1998,47:223-229.
[7]Jeon SH,Kim YS,Bae CD,et al.Activation of JNK and p38 in rat hippocampus after kainic acid induced seizure[J].Exp Mol Med,2000,32: 227-230.
[8]Brecht S,Simler S,Vergnes M,et al.Repetitive electroconvulsive seizures induce activity of c-Jun N-terminal kinase and compartment-specific desensitization of c-Jun phosphorylation in the rat brain[J].Brain Res Mol Brain Res,1999,68:101-108.
[9]Morgan L,Neame SJ,Child H,et al.Development of a pentylenetetrazole-induced seizure model to evaluate kinase inhibitor efficacy in the central nervous system[J].Neurosci Lett,2006,395:143-148.
[10]Cole-Edwards KK,Musto AE,Bazan NG.c-Jun N-terminal kinase activation responses induced by hippocampal kindling are mediated by reactive astrocytes[J].J Neurosci,2006,26:8295-8304.
(本文编辑:唐颖馨)
Involvement of p-JNK/p-c-Jun signalingin Amygdala-kindled Seizures
LIXiang1,PANJi-an-qing1,KANGHui-cong2,YANGZhi-gang1,HANJin-ling1,NIELi1,XIAOXiao-hua3,ZHANGLing-ling1, ZHUSui-qiang2
1.Departmentofneurology,NanshanHospital,Shenzhen,Guangdong,518052,China;2.Department ofNeurology,Tongji Hospital,Tongji Medical College,HuazhongUniversityofScienceandTechnology,Wuhan,430030,China;3.DepartmentofNeurology,SecondPeople’sHospital,Shenzhen,Guangdong, 518052,China
Objective:To evaluate the involement of JNK mitogen-activated protein kinase signaling pathway in amygdala-kindled models.Methods:Twenty Wistar rats were randomly divided into control group(n=10) and kindling group(n=10).Electrodes were implanted into the right amygdala of all the rats.Kindling was accomplished using stimulus strength of 500 μA applied daily to the amygdala until stage 5 were induced in rats for consecutive 10 days.All kindled rats were decapitated 2 h after the tenth stage 5 seizures.Rats in the control group did not receive stimulus.Western blot were performed to test the expression of JNK,p-JNK,c-Jun,p-c-Jun in hippocampus.Results:Kindling increased the expression of p-JNK and p-c-Jun in amygdala-kindled models. The difference is statistical significant between control group and kildling group.Conclusion:p-JNK/p-c-Jun signaling may be involved in amygdala-kindled seizures.
amygdala-kindled;p-JNK;p-c-Jun
R741;R742.1
A DOI 10.16780/j.cnki.sjssgncj.2016.06.002
1.深圳市南山区人民医院神经内科广东 深圳518052
2.华中科技大学统计医学院附属同济医院神经内科武汉 430030
3.深圳市第二人民医院广东 深圳518052
国家自然科学基金青年基金(No.81201006)湖北省自然科学基金(No.2011CDB201)深圳市南山区技术研发和创意设计项目分项基金(No.南 科 研 卫2012002)深圳市南山区技术研发和创意设计项目分项基金(No.南 科 研 卫2014015)深圳市科技计划项目(No.JCYJ20140414 170821276)
2016-01-26
朱遂强zhusuiqiang@163. com

