低分子质量褐藻寡糖的高效酶法制备及其抗氧化活性评价
张明杰, 李 恒, 蒋 敏, 郝 瑶, 许正宏, 史劲松
(江南大学 药学院, 江苏 无锡 214122)
低分子质量褐藻寡糖的高效酶法制备及其抗氧化活性评价
张明杰, 李 恒, 蒋 敏, 郝 瑶, 许正宏, 史劲松
(江南大学 药学院, 江苏 无锡 214122)
褐藻寡糖具有多种生理活性, 本研究通过酶解与分级条件的优化, 获得了低分子质量褐藻寡糖的酶法制备工艺, 并在体外模型上评价了不同分子质量组分的抗氧化活性。结果表明, 优化后的褐藻寡糖制备条件为: 底物浓度1.20%, 酶底比4.35 U/mg, 酶解时间4 h。进一步采用乙醇沉淀和超滤分离后, 获得了重均分子质量分别为0.84、1.40、2.25和34.56 kDa的4种组分, 其得率分别为50.82%、5.15%、11.48%和12.00%。各组分均具有一定的还原能力, 可有效清除DPPH和羟自由基, 其中低分子质量组分A的抗氧化活性最为显著, 其清除羟自由基的能力与维生素C相近。
褐藻寡糖; 制备工艺; 乙醇沉淀; 超滤; 抗氧化
褐藻寡糖主要由褐藻类植物细胞壁中的褐藻胶降解获得, 与多糖形式相比, 褐藻寡糖具有更高的溶解度和生物利用度, 有着抗氧化、免疫调节、抗肿瘤等多种生物活性[1-8]。其中, 抗氧化活性是其他生物活性产生的基础[9], 能够减缓生物体内活性氧自由基所造成的细胞和组织损伤。相关研究也显示, 自由基的过量产生和累积与癌症、帕金森病等一系列疾病的发生、发展密切相关[10-11], 而褐藻寡糖对上述疾病均有一定程度的改善作用。因此, 对褐藻寡糖的抗氧化性进行评价, 可以指导其生产工艺, 也可为产品开发提供依据。
研究表明, 褐藻寡糖的抗氧化活性不仅与其制备方式、M/G比例等相关, 还与组分的分子质量大小相关[12-16]。Zhao等[17]通过酶解制备得到三种褐藻寡糖, 其中分子质量低于1.0 kDa的组分具有较强的羟自由基清除能力, 且分子质量大小对抗氧化性能的影响程度要大于M/G比值。目前, 褐藻寡糖作为功能因子已受到较多关注, 需要建立一种高效、安全、简便的低分子质量褐藻寡糖的制备工艺来推动其产业进程。本研究以海藻酸钠为原料, 通过褐藻胶裂解酶水解方法制备褐藻寡糖, 在水解条件优化的基础上, 利用乙醇沉淀和超滤方法对产物进行分级分离,对所获得的4种组分进行抗氧化活性分析。
1 实验材料与仪器
1.1 实验材料
褐藻胶裂解酶: 由嗜盐白蚁菌WX (Isoptericola halotolerans WX)发酵产酶[18-19], 纯化得到酶液, 酶活为870 U/mL; 海藻酸钠、磷酸二氢钠、磷酸氢二钠、无水乙醇、酒石酸钾钠、3, 5-二硝基水杨酸、氢氧化钠、苯酚、亚硫酸氢钠等购自国药化学试剂有限公司; 抗坏血酸(Vitamin C, VC)、1, 1-二苯基-2-三硝基苯肼(2, 2-diphenyl-1-picrylhydrazyl, DPPH)、铁氰化钾、邻苯三酚、盐酸、水杨酸均为分析纯。二到七糖标准品, 购自青岛博智汇力生物科技公司。
DNS试剂: 准确称取酒石酸钾钠 244.40 g加入煮沸的500 mL蒸馏水中溶解, 然后依次加入6 g 3, 5-二硝基水杨酸, 21 g氢氧化钠, 5 g苯酚和5 g亚硫酸氢钠, 搅拌溶解后定容至1 L, 在棕色瓶中贮存7~10 d后使用。
TLC展开剂: 由正丁醇、甲酸、水按4︰6︰1配制; 显色剂: HCl 1 mL, 苯胺 2 mL, 二苯胺2 g, 85%磷酸10 mL, 溶于100 mL丙酮中, 棕色瓶储存。
1.2 实验仪器
恒温水浴锅: 金坛市富华电器有限公司; Milli-Q超滤装置: Milford公司; 旋转蒸发仪: 德国Heidolph公司; 真空冷冻干燥机: 美国Labconco公司; 恒温磁力搅拌器: 巩义市予华仪器有限责任公司。
2 实验方法
2.1 褐藻寡糖的酶法制备工艺研究
2.1.1 酶解时间的影响
以50 mmol/L pH 7.0的磷酸缓冲液配制10 mL 1%(W/V)海藻酸钠溶液, 加入2 mL酶液。40℃下分别水解1~9 h, 反应结束后测定还原糖含量。
2.1.2 酶底比的影响
以50 mmol/L pH 7.0的磷酸缓冲液配制10 mL 1%(W/V)海藻酸钠溶液, 分别加入不同体积的酶液,在40℃下水解4.0 h, 通过测定反应结束后的还原糖含量, 考察不同酶底比水解效果的影响。
2.1.3 底物浓度对酶解效果的影响
以50 mmol/L pH 7.0的磷酸缓冲液分别配制0、0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%、1.6%、1.8%、2.0%(W/V)海藻酸钠溶液, 按最适加酶量和水解时间考察底物浓度的影响。
2.2 DNS法测定还原糖含量
2.2.1 标准曲线制作
准确称取10 mg无水葡萄糖醛酸溶解定容至100 mL。分别吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL标准葡萄糖醛酸溶液, 用去离子水补至1 mL, 各加入1 mL DNS, 沸水浴3 min, 立即冷却定容至10 mL, 520 nm处测定吸光值。以1 mL去离子水按同样显色操作为空白, 以横坐标为葡萄糖醛酸含量(mg), 纵坐标为吸光值, 绘制标准曲线。
2.2.2 酶解样品还原糖含量测定方法
分别取1 mL降解产物, 用同样的方法测定吸光度值, 带入标准曲线计算其还原糖含量。
2.3 咔唑-硫酸法测定总糖含量
2.3.1 标准曲线制作
准确称取20 mg葡萄糖醛酸溶解定容至50 mL,分别吸取0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4 mL标准葡萄糖醛酸溶液, 用去离子水补至1 mL,冰浴条件下加入5mL 0.025 mol/L H2SO4-四硼酸钠溶液, 混匀后在沸水浴中加热25 min, 冷却至室温后加入0.2 mL 0.1%咔唑-无水乙醇溶液, 震荡摇匀, 沸水浴加热15 min, 冷却至室温, 520 nm处测定吸光度值, 以横坐标为葡萄糖醛酸含量(mg), 纵坐标为吸光度值, 绘制标准曲线。
2.3.2 酶解样品总糖含量测定方法
分别取1 mL降解产物, 用同样的方法测定吸光度值, 带入标准曲线计算其总糖。
2.4 低聚糖样品的平均聚合度
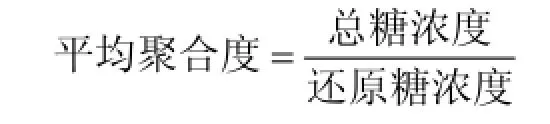
2.5 低分子质量褐藻寡糖的分级制备
褐藻寡糖水解液经10 000 r/min离心5 min去除沉淀, 加入无水乙醇至60%(V/V), 4℃静置过夜, 离心收集上清, 经浓缩、冻干后得到组分A。离心所得沉淀经去离子水复溶后, 依次通过截留分子质量10 kDa和3 kDa的中空纤维膜进行超滤处理, 再分别经浓缩、冻干得到10 kDa膜截留组分(D)、3 kDa膜截留组分(C)和3 kDa透过组分(B)。
2.6 重均分子质量分析
采用高效凝胶渗透色谱(HPGPC)法检测并分析褐藻寡糖平均分子质量, 以不同分子质量葡聚糖标准品制作标准曲线。色谱柱为Shodex Ohpak SB-803HQ (8.0 mm×300 mm), 流动相为0.1 mol/L Na2SO4, 流速为0.5 mL/min, 检测器为示差折光检测器, 采用Chemstation色谱工作站和GPC软件计算分子质量。
2.7 褐藻寡糖抗氧化性活性测定
2.7.1 DPPH自由基清除能力的测定
用无水乙醇配制成0.04 g/L DPPH溶液。分别取2 mL不同浓度的褐藻寡糖和多糖(2、4、6和8 g/L)溶液, 加入等体积的DPPH溶液, 混合均匀后室温放置30 min, 5000 r/min离心10 min后取上清液于517 nm处测定吸光值。以维生素C(VC)作为阳性对照。样品对DPPH自由基的清除率用以下公式计算:
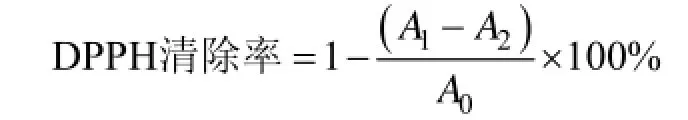
A0—无水乙醇与DPPH溶液混合液的吸光值;
A1—样品溶液与DPPH溶液混合液的吸光值;
A2—样品溶液与无水乙醇混合液的吸光值。
2.7.2 羟自由基(·OH)清除率的测定
分别吸取1 mL的9 mmol/L FeSO4和9 mmol/L水杨酸-乙醇溶液, 依次加入1 mL不同浓度褐藻寡糖和多糖(2、4、6和8 g/L)的溶液和1 mL 8.8 mmol/L H2O2, 37℃反应30 min, 以蒸馏水为对照, 于510 nm处测定吸光值。以VC作为阳性对照。样品吸光值为测定吸光值减去不加H2O2时的溶液本底吸光值。按下式计算羟自由基清除率:
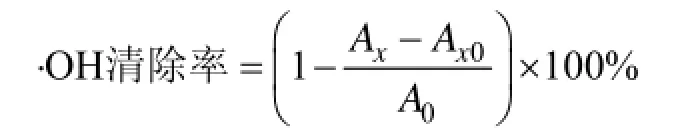
A0—空白对照液的吸光值; Ax—加入样品溶液后扣除本底的吸光值;
Ax0—不加显色剂H2O2样品溶液本底的吸光值。
2.7.3 总还原能力的测定
分别吸取2.5 mL 0.2 mol/L的磷酸缓冲液(pH 6.6)和1 mL不同浓度褐藻寡糖和多糖(2、4、6和8 g/L)的溶液, 加入2.5 mL 1%铁氰化钾, 混合均匀后于50℃反应20 min, 加入2.5 mL 10%三氯乙酸终止反应。反应液经5000 r/min离心10 min后取2.5 mL上清液,依次加入2.5 mL蒸馏水和0.5 mL FeCl3, 混匀后静置10 min, 于700 nm处测定吸光值。以VC作为阳性对照。
3 结果与分析
3.1 褐藻寡糖酶法制备工艺优化
3.1.1 酶解时间对降解效果的影响
酶解过程中, 随时间的推移, 酶解所得褐藻低聚糖的平均聚合度也随之快速下降(图1)。酶解4 h后, 低聚糖的平均聚合度趋于平稳, 其平均聚合度为24.42左右。进一步延长反应时间, 底物的转化率有所增加, 但从生产效率角度考虑, 适宜的酶解时间4 h。
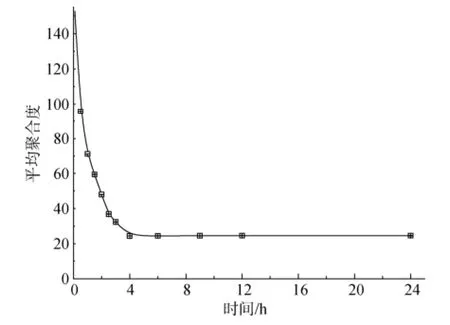
图1 时间对海藻酸钠水解效果的影响Fig. 1 Effect of hydrolysis time on sodium alginate hydrolysis
3.1.2 酶底比对降解效果的影响
从图2可以看出, 在海藻酸钠降解过程中, 褐藻低聚糖平均聚合度随着加酶量的提高而逐渐降低。在酶用量4.35 U/mg时, 酶解所得低聚糖的平均聚合度值近似达到稳定, 为16.95。继续增加酶量时平均聚合度变化并不显著, 所以选择最适加酶量为4.35 U/mg。
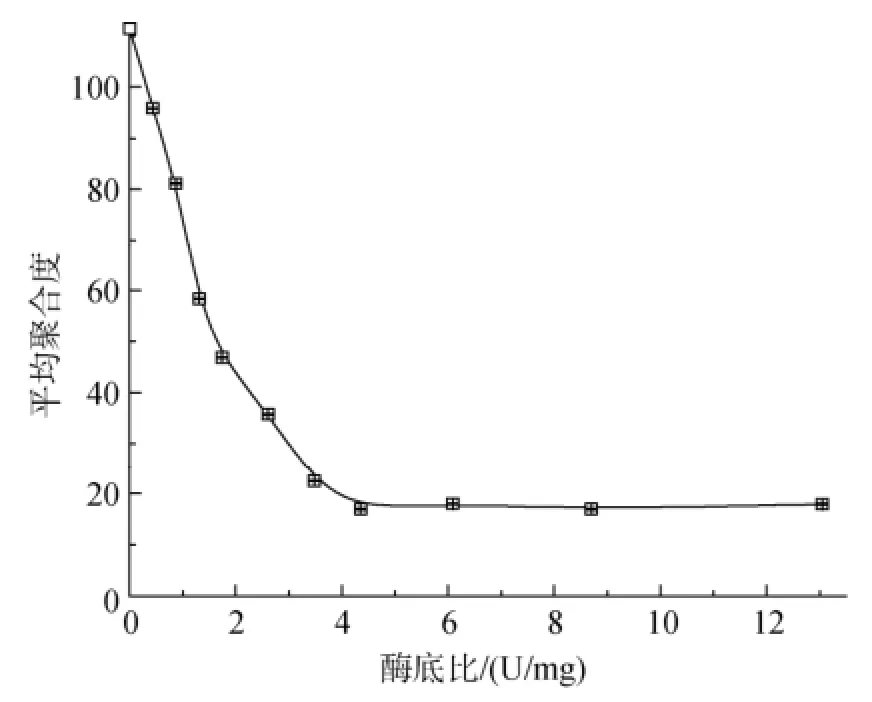
图2 酶底比对海藻酸钠水解效果的影响Fig. 2 Effect of the ratio of enzyme and substrate addition on sodium alginate hydrolysis
3.1.3 底物浓度对降解效果的影响
海藻酸钠的水溶液具有高粘度特性, 且随底物浓度增加, 溶液黏度呈几何级数上升[20]。因此在能够保证均匀搅拌的前提下, 底物浓度一般低于2%, 否则呈现凝胶状态。实验考查了不同底物浓度下的水解效果(图3), 发现海藻酸钠浓度为1.2%时, 所得低聚糖的平均聚合度最低, 平均聚合度为9.84, 水解率最高; 之后平均聚合度不再显著变化。
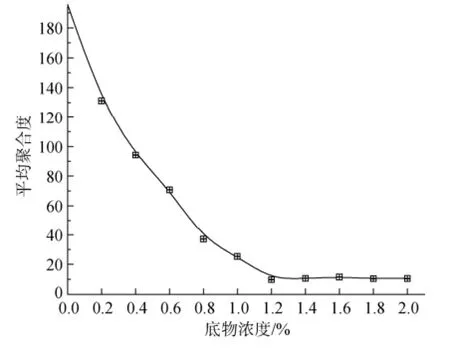
图3 底物浓度对海藻酸钠水解效果的影响Fig. 3 Effect of substrate concentration on sodium alginate hydrolysis
3.2 低分子质量褐藻寡糖的制备工艺
实验采用乙醇沉淀与超滤法对酶解后的褐藻寡糖进行分级分离。如图4所示, 采用TLC对4种组分进行分析, 组分A主要由聚合度2-7的褐藻寡糖组成, 推测其平均分子质量小于1.50 kDa; 组分B、C、D分子质量较大, 仅有少量的2-7的褐藻寡糖。

图4 4种组分TLC图谱Fig. 4 TLC profile of alginate oligosaccharides
进一步采用HPGPC法检测各组分分子质量, HPGPC图谱如图5所示。4种样品中均含有多个分子质量分布的寡糖片段。组分A中主要含重均分子质量为0.48 kDa的组分; 组分B中主要含重均分子质量为5.03 kDa的组分; 组分C中主要含重均分子质量为3.68 kDa的组分; 组分D中主要含重均分子质量为51.15kDa和68.23 kDa的两个组分。
依据Chemstation色谱工作站和GPC软件计算得到4种组分的重均分子质量(Mw), 如表1所示。褐藻寡糖(平均聚合度<13)的总得率达到67.45%, 其中,组分A得率最高, 达到50.82%。结合制备工艺分析可知, 利用60%的乙醇沉淀, 可以一步得到重均分子质量0.84 kDa的较低分子质量褐藻寡糖组分, 得率达到50%以上; 进一步结合膜分离的方法, 虽无法对不同分子质量低聚糖进行精确分离, 但可高效率的得到较低分子质量的寡糖部分, 并实现不同分子质量分布低聚糖的有效分级。
由以上酶解与分级分离过程得到低分子质量褐藻寡糖的制备工艺, 如图6所示:
3.3 褐藻寡糖体外抗氧化能力
3.3.1 褐藻寡糖对DPPH的清除能力
DPPH是一种稳定的自由基, 可用来衡量物质的抗氧化能力[21]。表2显示了原料和经过分级处理的4种组分的DPPH清除活性, 结果表明, 酶解得到的4种组分均具有一定的DPPH清除活性, 且清除作用均随浓度的升高而增强。其中, 组分A对DPPH清除能力显著高于其他三种组分。当组分A浓度为6 g/L时, 清除率达到最高, 为78.65%。组分A对DPPH自由基的半抑制浓度IC50为0.79 g/L。Liu等[22]研究了氧化法降解得到的褐藻寡糖体外抗氧化活性,其在2.50 g/L时对DPPH的清除率为40.40%。相比于化学降解法, 酶解的褐藻寡糖具有更好的DPPH清除能力, 可能与其酶解过程中形成双键有关[3]。
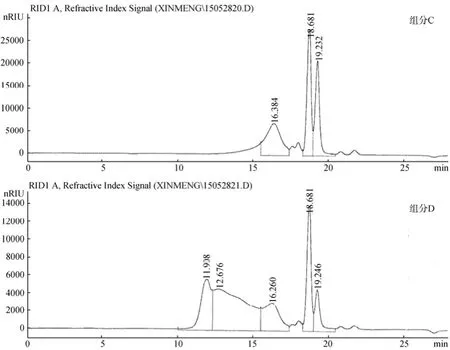
图5 褐藻寡糖的HPGPC色谱图Fig. 5 High-performance gel chromatogram profiles of alginate oligosaccharides
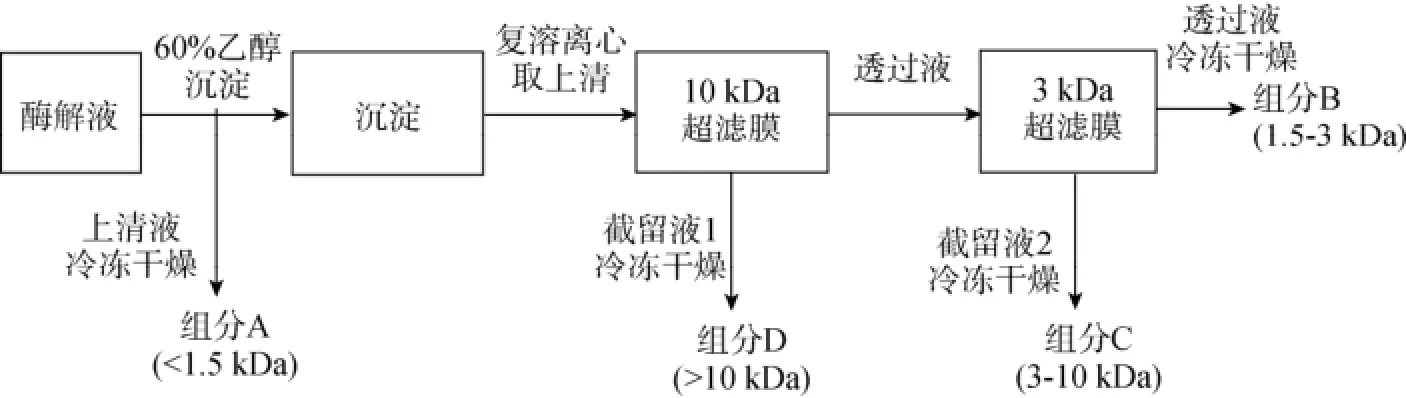
图6 低分子质量褐藻寡糖的制备工艺流程图Fig. 6 Process chart of alginate oligosaccharides
3.3.2 褐藻寡糖对羟自由基的清除能力
羟自由基是造成组织脂质过氧化、蛋白质解聚等的主要活性氧种类, 羟自由基清除率是反映抗氧化剂的抗氧化作用的重要指标[23]。由表3可以看出,海藻酸钠和4种组分对羟自由基均具有良好的清除能力。与 DPPH 清除活性相似, 4种组分对羟自由基的清除能力随着各自浓度的升高而增强。在同一浓度下, 4种组分对羟自由基的清除能力均大于海藻酸钠, 且具有随分子质量降低, 清除能力增大的趋势。当组分A的浓度为2 g/L时, 可达到与VC相近的抗氧化结果, 其IC50为0.50 g/L。周绪霞等[13]研究发现, 分子质量小于8 kDa的褐藻寡糖在浓度为1.20 g/L时, 对羟自由基的清除率达到75%。与之相比, 组分A达到75%羟自由基清除率时的浓度仅为0.59 g/L。由此可见, 经自行筛选的褐藻胶裂解酶降解制备的低分子量褐藻寡糖具有较强的羟自由基清除能力。
研究表明, 寡糖可能通过氢电转移机制引起内在单糖基团中异头氢的移动而发挥羟自由基清除活性[24]。一些研究者也认为, 醇类物质的化学结构能有效地清除羟基自由基[25], 由此推测, 褐藻寡糖的羟基基团为其羟自由基清除功能的发挥提供了结构基础。
3.3.3 褐藻寡糖的还原能力
表4可以看出, 海藻酸钠和4种组分均表现出一定的还原力。在同等浓度下, 组分A的还原力大于其他各低聚糖组分。这也可以为以上不同分子质量低聚糖组分在DPPH和羟自由基清除能力的差异结果提供依据。
综上所述, 酶解得到的4种褐藻低聚糖组分对DPPH、羟自由基均具有良好的清除作用, 其自身有一定的还原力, 其中, 平均分子质量较小的组分A具有最高的抗氧化活性。文献报道, 寡糖的分子质量是影响其抗氧化活性的一个重要因素。在硫酸软骨素、透明质酸等的抗氧化活性评价中, 低分子质量产物均表现出比大分子更高的自由基清除活性, 且不同聚合度低聚糖的活性程度不同。褐藻寡糖抗氧化活性与分子质量的关系与上述结论一致[26-28]。
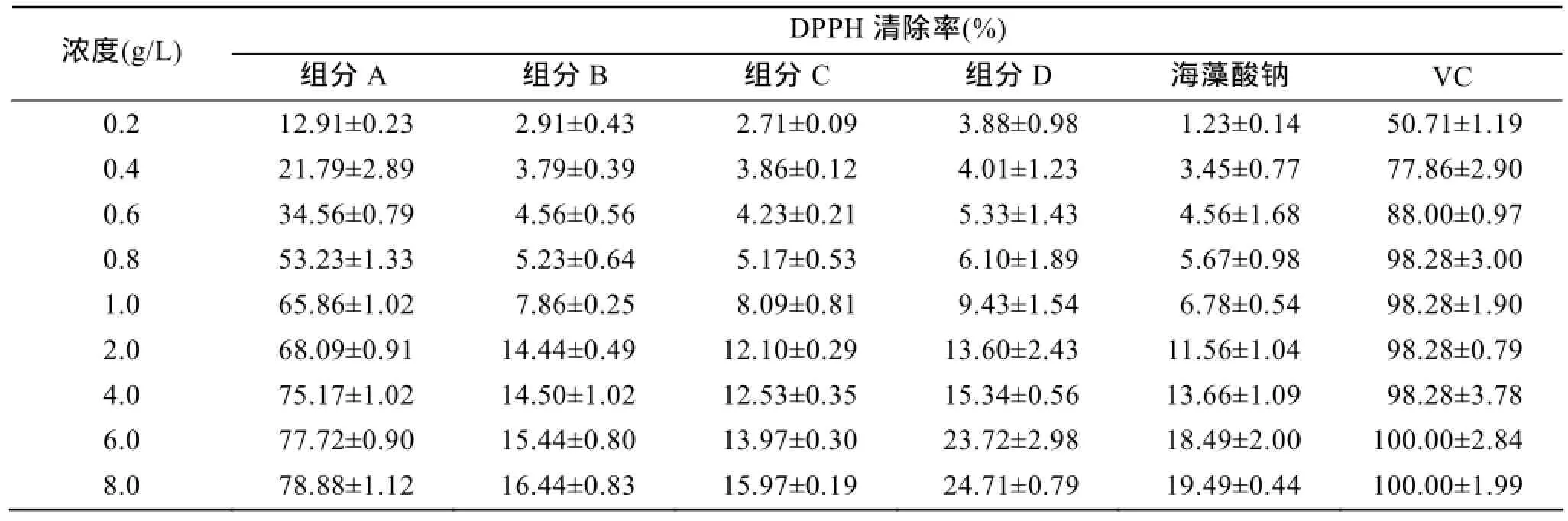
表2 各组分的DPPH清除活性Tab. 2 Scavenging effects of alginate oligosaccharides on DPPH

表3 褐藻寡糖对羟自由基的清除活性Tab. 3 Scavenging effects of alginate oligosaccharides on ·OH
4 结语
采用自制的褐藻胶裂解酶对海藻酸钠溶液进行酶解制备褐藻低聚糖, 得到的产物通过60%乙醇沉淀和超滤法进行分级得到4种分子质量不同的组分。通过HPGPC对4个组分的分子量进行检测, 其平均分子质量分别为0.84、1.40、2.25和34.56 kDa, 其中, 分子质量低于2.25 kDa的褐藻寡糖成分得率达67.45%, 与文献结果相比, 本实验在酶解效率及低分子量褐藻寡糖的得率方面具有更明显的优势[29]。
对这4种组分的抗氧化活性进行评价, 4个组分对DPPH均有一定的清除作用, 并具有剂量依赖关系。其中, 平均分子质量最小的组分A清除DPPH的能力远大于其余各组分, 其IC50为0.79 g/L。此外,组分A具有较强的羟自由基清除活性和还原力, 2 g/L组分A即表现出与0.8 g/L的VC相近的羟自由基清除效果。综合抗氧化评价结果来看, 组分A表现出较好的体外抗氧化活性, 也进一步说明分子质量较小的低聚糖具有更强的抗氧化活性, 详细的抗氧化机制以及构效关系还有待深入研究。
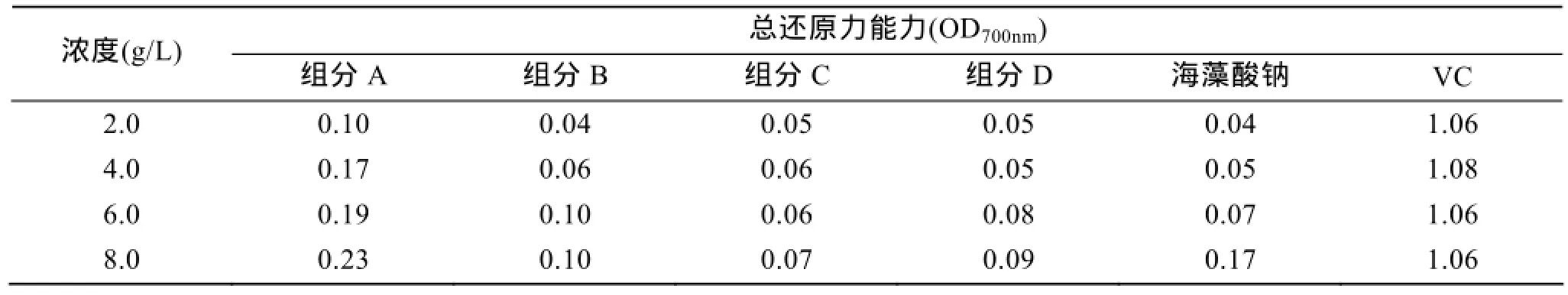
表4 褐藻寡糖的还原力Tab. 4 Reducing power of alginate oligosaccharides
[1] Iwamoto M, Kurachi M, Nakashima T, et al. Structure-activity relationship of alginate oligosaccharides in the induction of cytokine production from RAW264.7 cells[J]. Febs Letters, 2005, 579(20): 4423-4429.
[2] Thiang Y W, Lori A P, Neal L S. Alginate lyase: Review of major sources and enzyme characteristic, structure-function analysis, biological roles, and applications[J]. Annual Review of Microbiology, 2000, 54(2): 289-340.
[3] Xu X, Wu X T, Wang Q Q, et al. Immunomodulatory effects of alginate oligosaccharides on murine macrophage RAW264.7 cells and their structure−activity relationships[J]. Journal of Agricultural and Food Chemistry. 2014, 62, 3168-3176.
[4] Hu X, Jiang X. Antitumour activities of alginate-derived oligosaccharides and their sulphated substitution derivatives[J]. European Journal of Phycology, 2004, 39(1) : 67-71.
[5] Le Q L, Naotsugu N, Vo T T H, et al. Enhancement of plant growth stimulation activity of irradiated alginate by fractionation[J]. Radiation Physics and Chemistry, 2009, 78: 796-799.
[6] 吴燕燕, 张婉, 李来好, 等. 海藻中抗氧化、保湿功能活性物质的研究进展[J]. 海洋科学, 2015, 39(9): 138-142. Wu Yanyan, Zhang Wan, Li Laihao, et al. The research progress of antioxidant and moisturizing active substance in seaweed[J]. Marine Sciences, 2015, 39(9): 138-142.
[7] 刘旭, 曲桂燕, 周裔彬, 等. 泡叶藻及海带藻渣中岩藻聚糖硫酸酯的提取及其抗氧化活性[J]. 海洋科学, 2013, 37(12): 34-39. Liu Xu, Qu Guiyan, Zhou Yibin, et al. Ultrasound assisted extraction and in vitro antioxidant activity analysis of fucoidans from Ascophyllum mackaii and Laminaria japonica residue[J]. Marine Sciences, 2013, 37(12): 34-39.
[8] 王雪妹, 王晶, 张全斌. 褐藻多糖硫酸酯对脂多糖诱导大鼠肾小球系膜细胞NO产生量的影响[J]. 海洋科学, 2014, 38(10): 1-5. Wang Xuemei, Wang Jing, Zhang Quanbin. Effect of fucoidan on NO production induced by LPS in rat glomerular mesangial cells[J]. Marine Sciences, 2014, 38(10): 1-5.
[9] 甘瑾. 玛咖(Lepidium meyenii Walp.)抗氧化活性及活性物质基础的研究[D]. 北京: 中国林业科学研究院, 2013: 1-112. Gan Jin. Study on antioxidant activities and antioxidative substance basis of Maca (Lepidium mevenii Waip.) [D]. Beijing: Chinese Academy of Forestry. 2013: 1-112.
[10] 董晓莉, 耿美玉, 管华诗, 等. 褐藻酸性寡糖对帕金森病大鼠纹状体、杏仁核多巴胺释放的影响[J]. 中国海洋药物, 2003, 5(95): 9-11. Dong Xiaoli, Geng Meiyu, Guan Huashi. et al. Effects of marine acidic oligose on dopamine release from striatum and amygdala in the rat models of Parkinson’s disease[J]. Chinese Journal of Marine Drugs, 2003, 5(95): 9-11.
[11] 王媛媛, 郭文斌, 王淑芳, 等. 褐藻寡糖的生物活性与应用研究进展[J]. 食品与发酵工业, 2010, 36(10): 122-126. Wang Yuanyuan, Guo Wenbin, Wang Shufang, et al. Research progress on biological activities and applications of alginate oligosaccharide[J]. Food and Fermentation Industries, 2010, 36(10): 122-126.
[12] 孙丽萍, 薛长湖, 许家超, 等. 褐藻胶寡糖体外清除自由基活性的研究[J]. 中国海洋大学学报, 2005, 35(5): 811-814. Sun Liping, Xue Changhu , Xu Jiachao, et al. A Study of the antioxidant abilities of alginate oligosaccharides[J]. Periodical of Ocean University of China, 2005, 35(5): 811-814.
[13] 周绪霞, 徐鋆, 丁玉庭. 酶解制备褐藻胶寡糖及其产物的抗氧化活性分析[J]. 食品与发酵工业, 2014, 40(2): 116-120. Zhou Xuxia, Xu Jun, Ding Yuting. Alginate-derived oligosaccharides product by alginate lyase and detection of the antioxidant activity[J]. Food and Fermentation Industries, 2014, 40(2): 116-120.
[14] Falkeborg M, Cheong L Z, Gianfico C, et al. Alginate oligosaccharides: Enzymatic preparation and antioxidant property evaluation[J]. Food Chemistry, 2014, 164: 185-194.
[15] 杨钊, 张真庆, 管华诗, 等. 一种新的褐藻胶寡糖制备方法—氧化降解法[J]. 海洋科学, 2004, 28(7): 19-22. Yang Zhao, Zhang Zhenqing, Guan Huashi, et al. Oxidation depolymerization-a new method for preparation of alginate oligosaccharides. Marine sciences, 2004, 28(7): 19-22.
[16] 杨小青, 卢虹玉, 李延平, 等. 羊栖菜不同分子质量褐藻多酚抗氧化活性研究[J]. 海洋科学, 2013, 37(4): 47-51. Yang Xiaoqing, Lu Hongyu, Li Yanping, et al. Antioxidative Activities of phlorotannins with different molecular weight extracted from Sargassum fusiforme[J]. Marine Sciences, 2013, 37(4): 47-51.
[17] Zhao X, Li B F, Xue C H, et al. Effect of molecular weight on the antioxidant property of low molecular weight alginate from Laminaria japonica[J]. Journal of Applied Phycology, 2012, 24: 295-300.
[18] 魏丹. 高效降解褐藻胶菌种的选育及其酶学性质的研究[D]. 无锡: 江南大学, 2013: 1-50. Weidan. Isolation of a high efficient alginate-degrading strain and characterization of alginase[D]. Wuxi: Jiangnan University, 2013: 1-50.
[19] Dou W F, Wei D, Li H, et al. Purification and characterisation of a bifunctional alginate lyase from novel Isoptericola halotolerans CGMCC 5336[J]. Carbohydrate Polymers, 2013, 98: 1476-1482.
[20] 于子森, 孙庆山, 纪全, 等. 海藻酸钠溶液粘度特性的研究[J]. 科技信息, 2007, 11, 277-278. Yu Zisen, Sun Qingshan, Ji Quan, et al. Study on the viscosity property of sodium alginate[J]. Science Information, 2007, 11, 277-278.
[21] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J]. 食品科学, 2014, 35(9): 317-322. Wei Xianya, Yin Liqin, Zhong Cheng, et al. Advances in the DPPH radical scavenging assay for antioxidant activity evaluation Food Science, 2014, 35(9): 317-322.
[22] Liu S Y, Liu G Y, Yi Y T. Novel vanadyl complexes of alginate saccharides: Synthesis, characterization, and biological activities[J]. Carbohydrate Polymers, 2015, 121: 86-91.
[23] 金黎明, 郑奕, 杨艳, 等. 壳聚糖及其衍生物的抗氧化作用[J]. 食品与发酵工业, 2008, 34(11): 66-68. Jin Liming, Zheng Yi, Yang Yan, et al. Study on antioxidant activity of chitosan and its derivatives[J]. Food and Fermentation Industries, 2008, 34(11): 66-68.
[24] Chen H X, Wang Z S, Qu Z H, et al. Physicochemical characterization and antioxidant activity of a polysaccharide isolated from oolong tea[J]. European Food Research and Technology, 2009, 229, 629-635.
[25] Li X. Solvent effects and improvements in the deoxyribose degradation assay for hydroxyl radical scavenging [J]. Food Chemistry, 2013, 141(3): 2083-2088.
[26] 张莲. 硫酸软骨素寡糖的制备及其体外抗氧化活性研究[D]. 无锡: 江南大学, 2012, 1-41. Zhang Lian. Preparation and antioxidant activity in vitro of chondroitin sulfate oligosaccharides[D]. Wuxi: Jiangnan University, 2012, 1-41.
[27] Kim J K, Srinivasan P, Kim J H, et al. Structural and antioxidant properties of gamma irradiated hyaluronic acid[J]. Food Chemistry, 2008, 109(4): 763-770.
[28] Stern R. Devising a pathway for hyaluronan catabolism: are we there yet?[J]. Glycobiology, 2003, 13(12): 105R-115R.
[29] 黄菊, 丁晨, 谢超, 等. 海藻胶低聚寡糖的酶法制备纯化技术及保水理化性质分析[J]. 海洋与湖沼, 2015, 46(3): 595-602. Huang Ju, Ding Chen, Xie Chao, et al. Alginate oligosaccharides: Enzymatic preparation, purification, and the physical and chemical properties[J]. Oceanologia et Limnologia Sinica, 2015, 46(3): 595-602.
Received:Mar. 15, 2016
Efficient preparation of alginate oligosaccharides by enzymatic hydrolysis and evaluation of antioxidant activities in vitro
ZHANG Ming-jie, LI Heng, JIANG Min, HAO Yao, XU Zheng-hong, SHI Jin-song
(School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, China)
alginate oligosaccharides; preparation procedure; ethanol precipitation; ultrafiltration; antioxidant activity
Alginate oligosaccharides are characterized by various biological activities. In this study, we developed a technique for the efficient preparation of alginate oligosaccharides by optimizing the process conditions for enzymatic hydrolysis and separation. We evaluated the antioxidant activities of the obtained alginate hydrolysates in vitro. We found the optimized conditions for alginate oligosaccharides preparation to be as follows: a substrate concentration of 1.2%, a ratio of enzyme to substrate dosage of 4.35 U·mg–1, and a hydrolysis time of 4 h. Through successive processes of ethanol precipitation and ultrafiltration, we obtained four constituents with average molecular weights of 0.84, 1.40, 2.25, and 34.56 kDa, respectively. The yields of these four constituents were 50.82%, 5.15%, 11.48%, and 12.00%, respectively. Our in vitro antioxidation study results show that the constituent A (Mw 0.84 kDa) demonstrated the most significant antioxidant activity and the hydroxyl radical scavenging ability was similar to that of vitamin C.
Q539
A
1000-3096(2016)12-0062-09
10.11759/hykx20160315001
(本文编辑: 康亦兼)
2016-03-15;
2016-04-05
国家海洋公益性行业科研专项(201305007); “十二五”国家科技支撑项目(2012BAD33B06)
[Foundation: Public Science and Technology Research Funds Projects of the Ocean (No. 201305007) ; “twelfth five-year” National Science and Technology Support Program (No. 2012BAD33B06)]
张明杰(1989-), 女, 江苏宿迁人, 硕士研究生, 研究方向为制药工程, 电话: 0510-85328177, E-mail: zhangmingjie2013@126.com;史劲松, 通信作者, 主要从事糖工程技术及功能糖产品开发研究, 电话: 0510-85328177, E-mail: shijs@163.com

