南麂列岛火焜岙潮间带底栖纤毛虫物种多样性和群落时空分布
陈旭淼, 陈万东, 蔡厚才, 徐奎栋
(1. 中国科学院 海洋研究所 海洋生物分类与系统演化实验室, 山东 青岛 266071; 2. 南麂列岛国家海洋自然保护区管理局, 浙江 平阳 325401)
南麂列岛火焜岙潮间带底栖纤毛虫物种多样性和群落时空分布
陈旭淼1, 陈万东2, 蔡厚才2, 徐奎栋1
(1. 中国科学院 海洋研究所 海洋生物分类与系统演化实验室, 山东 青岛 266071; 2. 南麂列岛国家海洋自然保护区管理局, 浙江 平阳 325401)
纤毛虫是潮间带沉积物中多样性高且丰度占优势的类群, 其群落结构可反映环境状态。于2013年11月(秋季)、2014年2月(冬季)、5月(春季)和8月(夏季)开展了南麂列岛火焜岙砂质潮间带沉积物中纤毛虫物种多样性和群落结构的时空分布研究。结果表明, 该生境中底栖纤毛虫物种丰富, 共检获148种纤毛虫, 涉及19目70余属; 纤毛虫的丰度和物种组成呈现显著的季节差异和垂直分层差异。其中, 丰度占优势的纤毛虫按食性依次为菌食类群、肉食类群和藻食类群; 已非典型的砂隙纤毛虫区系,而是呈现出某些有机质丰富的泥沙质沉积物中的纤毛虫群落的特点, 这可能是该生境受人类活动影响的后续效应。但纤毛虫物种多样性较高, 这表明尽管存在人类干扰的长期效应, 潮间带周边环境良好,对周边居民及设施的动迁等多样性保护措施可能已经产生了向好的结果。
南麂列岛; 潮间带沉积物; 纤毛虫; 物种多样性; 群落结构
南麂列岛处于江浙沿岸流和台湾暖流的交汇处,北上的南海暖流和南下的黄海冷水团在不同季节交替作用, 众多岛礁和复杂地形导致的局部涡流和上升流, 为南麂列岛海域造就了复杂的流系。因此, 这里的生态环境独特, 具有多样化的生物种类和复杂的生物区系结构。自20世纪60年代起, 针对南麂列岛的海洋生物本底资源调查已查明各门类共1876种海洋生物在此生存; 其中贝、藻资源尤其丰富, 分别占全国贝、藻总种数的15%和25%[1-5]。南麂列岛国家级海洋自然保护区的潮间带沙滩生态学的研究工作, 目前已针对大型底栖动物、大型底栖海藻和微小型藻类开展了大量研究[6-17], 纤毛虫原生动物的生态学研究尚未开展。
纤毛虫作为原生动物的重要组成类群之一, 在潮间带微型底栖生物生态系统中占据十分重要的生态地位, 在向更高营养级的能量传递及全球碳循环中起到不可替代的枢纽作用; 纤毛虫群落结构的时空演替, 也在一定程度上影响着潮间带沉积物中微型生物生态系统的结构[18-19]。作为国家海洋局《南麂列岛国家级海洋自然保护区海洋生物资源与栖息环境调查及保护效果评估》(2010)研究项目的一部分,本工作选取的研究场所——南麂列岛火焜岙潮间带,在过去曾有较密集的人类活动, 后来由于乡政府搬迁,居民大幅减少[20]; 因此, 针对该潮间带表层20 cm沉积物中的底栖纤毛虫的物种多样性和群落结构及其时空演替的研究, 将为南麂列岛国家级海洋自然保护区的生物资源开发、环境保护和修复提供必要的基础资料。
1 材料与方法
1.1 采样环境与研究站点
选取南麂列岛国家级海洋自然保护区的火焜岙沙滩为样品采集地点(图1A, B), 其沿岸为居民生活区, 有生活、农业等污水渗入沙滩(图1C), 外接自然海域(图1D), 是南麂列岛潮间带的典型代表。在火焜岙沙滩高潮带(27°27.851′N, 121°04.806′E)、中潮带(27°27.810′N, 121°04.840′E)和低潮带(27°27.772′N, 121°04.881′E)分别选取一个采样点, 于2013年11月2日(秋季)、2014年2月14日(冬季)、2014年5月14日(春季)和2014年8月8日(夏季)进行了四个季度的样品采集。
1.2 采样方法
将长约30 cm、内径3.4 cm的有机玻璃管插入沉积物中, 采集从表层至20 cm深度的沉积物样品,每个样点设3个重复。用于生物分析的样品, 将各沉积物分5层(0~4 cm、4~8 cm、8~12 cm、12~16 cm和16~20 cm)分别加入120 mL广口样品瓶中, 使用等体积(约36 mL)的4%冷戊二醛溶液(0.45 μm孔径滤膜过滤的海水配置)固定保存。用于环境因子测定的样品仅取最上面两层, 于–20℃冷冻保存, 带回实验室进行分析。

图1 样品采集地点Fig. 1 Location of sampling site
1. 3 样品处理、分析与环境因子测定
样品处理参照海洋微型底栖生物调查方法与操作规程[21]。
根据永久制片中纤毛虫的纤毛图式和个体大小、形状等形态学特征进行物种鉴定, 参依Lynn纤毛虫分类系统[22], 获得潮间带沉积物样品中纤毛虫的多样性信息。计算单位体积沉积物中纤毛虫的个体数目, 获取丰度信息。依据有关纤毛虫食性的文献和镜检中对纤毛虫食物泡的观察大致判定纤毛虫的摄食功能群。
沉积物叶绿素a和脱镁叶绿素a含量利用Turner II荧光光度计测定。有机碳含量利用总有机碳分析仪Vario TOC Cube (Elementar, Germany) 测定, 有机质含量为有机碳含量乘以系数1.724。含水量根据沉积物烘干 (80℃, 48 h) 前后质量的减少来计算。现场测定沉积物间隙水温度和盐度数据。
1.4 数据处理及统计分析
数据分析采用大型多元统计软件PRIMER v5.2.8 (Plymouth Poutines in Multivariate Ecological Research)。物种多样性的单变量分析包括群落的物种数(N, number of species)、Margalef多样性指数(d, Margalef diversity index)、香农-威纳指数(H′, Shannon-Wiener diversity index)和均匀度指数(J′, Pielou’s evenness index), 使用PRIMER v5.2.8计算, 并进行对数转换, 单因子方差分析(One-Way ANOVA)采用类分析(CLUSTER)和多维定标分析(MDS)模块。生物因子相似性矩阵的建立采用Bray-Curtis相似性, 数据转换采用对数转换。采用单因子相似性检验(One-Way ANOSIM)分析不同季节、不同潮带和不同分层之间物种多样性和群落结构的差异显著性[23-25]。
2 结果
2.1 环境因子
高、中、低潮带表层0~4 cm和4~8 cm的沉积物间隙水的温度的四季变化范围为12~30℃, 春、秋两季的间隙水温度差异不大; 高、中、低潮带间隙水的温度没有明显差异。间隙水的盐度变动范围较大(5~30); 在冬季, 呈现由高潮带到低潮带递增的趋势;秋季、春季和夏季呈现由高潮带到低潮带递减的趋势; 不同分层间, 盐度没有差异。
火焜岙的沉积物类型为砂质, 粒度值超过300 μm。沉积物中有机质含量的周年变动(0.064%~1.666%),未呈现出明显的季节、垂直或水平分布差异; 仅表现出在春季的整体水平最高。
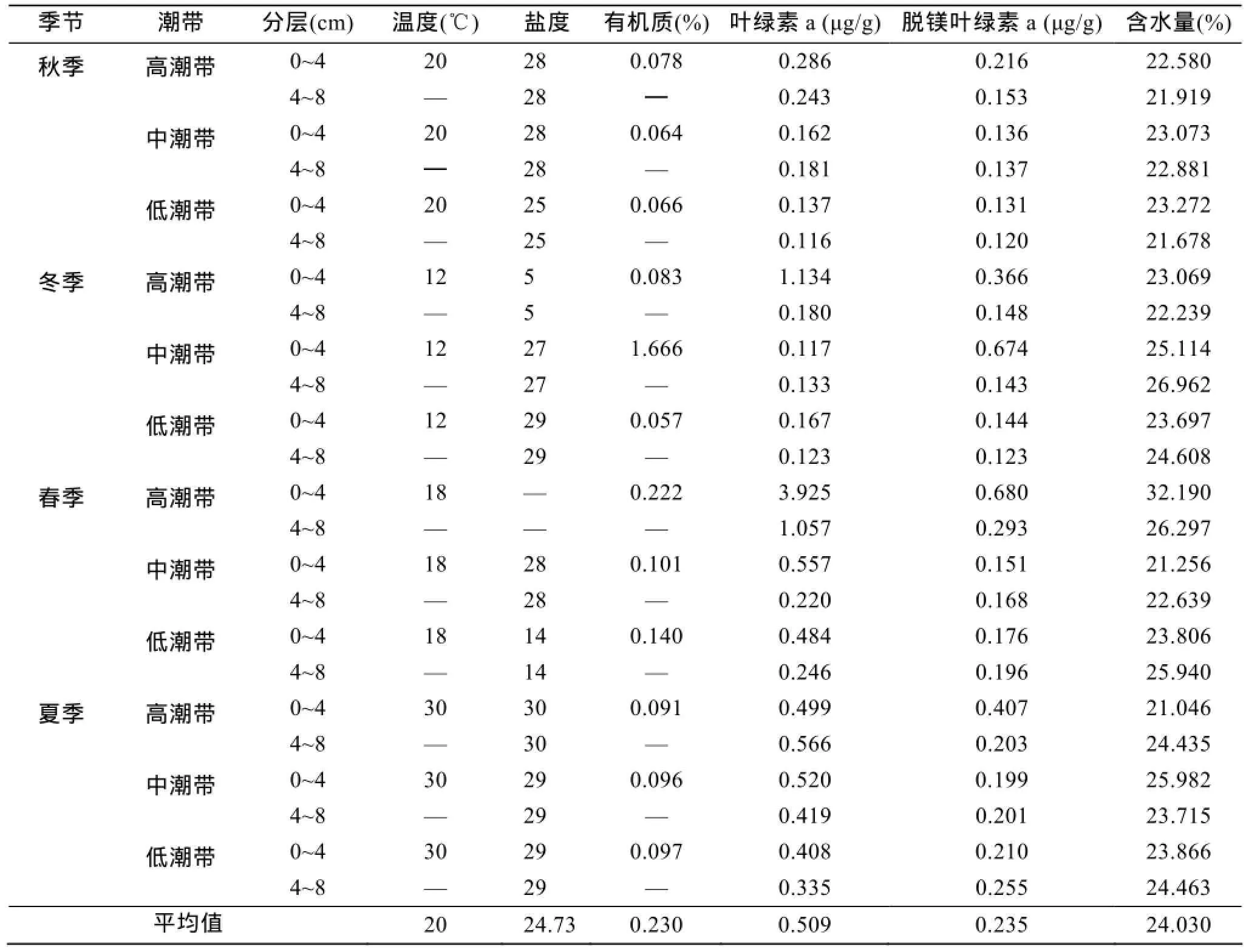
表1 采样期间的环境因子Tab. 1 Environmental factors during sampling period
沉积物中叶绿素a和脱镁叶绿素a含量的周年变动范围分别为0.116~3.925 μg/g和0.120~0.680 μg/g,没有呈现出明显的季节、垂直或水平分布差异; 与有机质含量一致, 叶绿素a含量在春季的整体水平最高。
沉积物中含水量的周年变动范围为21.046%~ 32.190%, 季节、垂直或水平分布均无明显差异; 仅在秋季呈现较低的整体水平。
2.2 纤毛虫物种多样性与时空分布
在火焜岙潮间带一年四季高、中、低潮带表层20 cm沉积物样品中, 共检获纤毛虫148种, 涉及19个目级阶元、70余属。侧口目(24种, 16.2%)、前管目(20种, 13.5%)、核残目(16种, 10.8%)、游仆目(16种, 10.8%)、钩刺目(13种, 8.8%)、前口目(8种, 5.4%)和嗜污目(8种, 5.4%)的物种数较多, 为该潮间带沉积物中纤毛虫的主要类群, 占据总物种数的70.9% (图2)。
这些纤毛虫涉及了4个主要的功能群: 菌食类群(如游仆目、嗜污目、前管目、咽膜目)、藻食类群(如齿管目、偏体目、篮管目)、肉食类群(如侧口目、核残目和钩刺目)和无选择的杂食类群。
火焜岙潮间带沉积物中纤毛虫在秋季的物种多样性最高, 共检获112种纤毛虫; 冬季最低, 仅有73种; 春季和夏季居中, 各检获94种纤毛虫。以肉食性为主的核残目和侧口目, 菌食性的前管目、嗜污目和游仆目纤毛虫在一年四季均具有较高的多样性,其中夏季以侧口目纤毛虫的比例最高, 达21.3%。此外, 肉食性为主的钩刺目纤毛虫在秋季、春季和夏季均具有较高的多样性; 前口目纤毛虫(菌食性为主)在秋季和冬季具有较高的多样性(表2)。
火焜岙潮间带纤毛虫的物种数(图3A)、Margalef多样性指数(图3B)和香农-威纳指数(图3C)呈现出从高潮带向低潮带、从表层向深层逐步递减的大致趋势, 而均匀度指数则未见明显的变化趋势(图3D)。
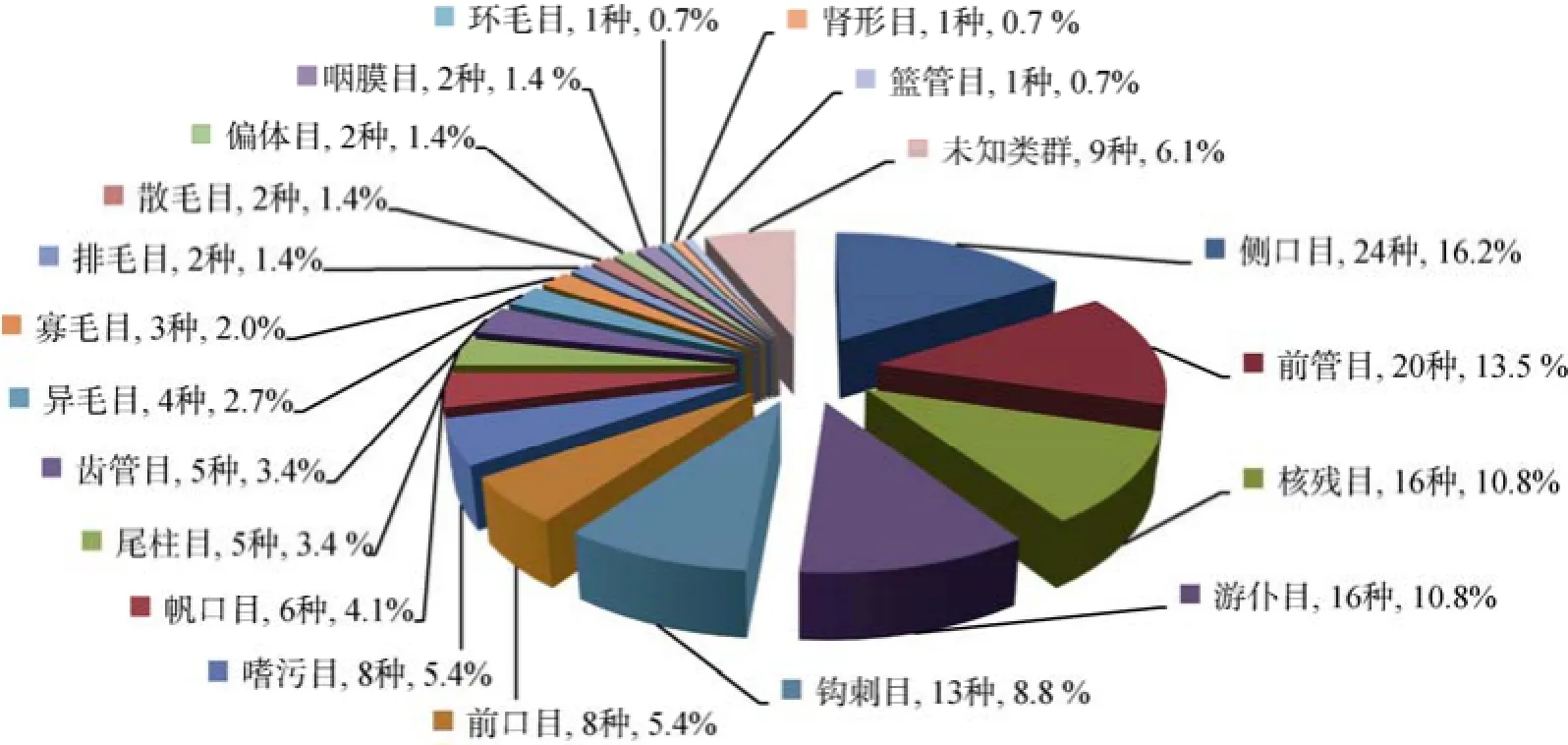
图2 底栖纤毛虫的物种多样性分布Fig. 2 Species diversity distribution of benthic ciliates

表2 底栖纤毛虫物种多样性组成的周年变化Tab. 2 Annual variations in species diversity composition of benthic ciliates
单因子方差分析(One-Way ANOVA)表明, 不同季节样品的纤毛虫物种数(N, number of species)、Margalef多样性指数(d, Margalef diversity index)、香农-威纳指数(H′, Shannon-Wiener diversity index)和均匀度指数(J′, Pielou’s evenness index)均呈现极显著的差异(P<0.01)。不同采样深度样品中的纤毛虫在物种数(P=0.007)、Margalef多样性指数(P=0.028)和香农-威纳指数(P=0.031)上存在极显著或显著差异。而高、中、低潮带样品中的纤毛虫仅在物种数上存在显著差异(P=0.013)。
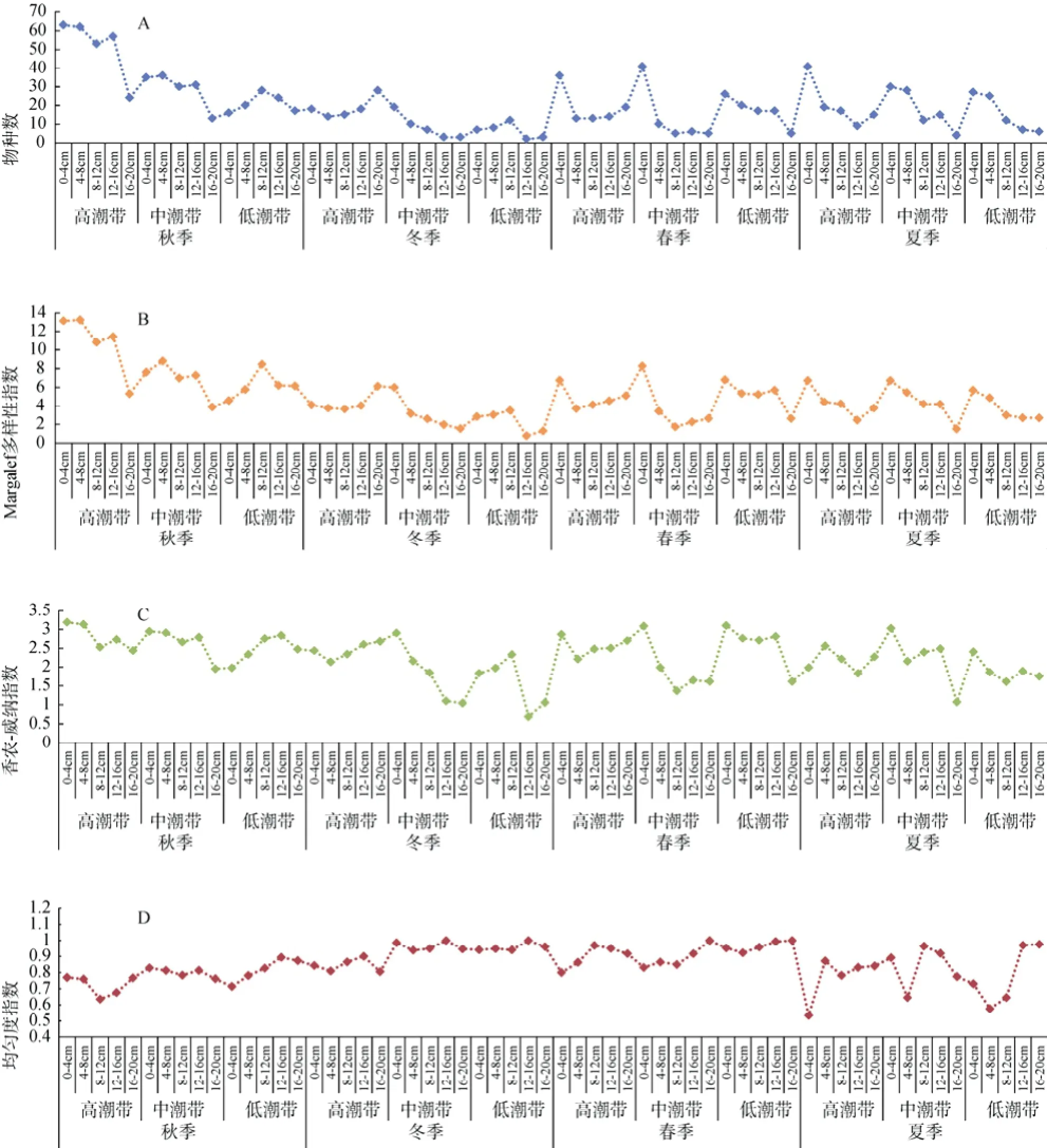
图3 一年四季纤毛虫物种多样性的水平和垂直分布的变化Fig. 3 Annual variation in horizontal and vertical distributions of ciliates species diversity
2.3 纤毛虫各类群的丰度与时空分布
2.3.1 季节变化
火焜岙潮间带沉积物中的纤毛虫丰度夏季最高,达到74.2个/cm3, 秋季次之, 为64.2个/cm3; 冬季最低, 为26.4个/cm3; 春季为36.9个/cm3楯。菌食性的纤虫、双眉虫和游仆虫等游仆目纤毛虫在一年四季均为最优势类群, 在秋、冬、春、夏四个季节中分别占总丰度的41.0%、34.8%、18.2%和22.0%(表3)。
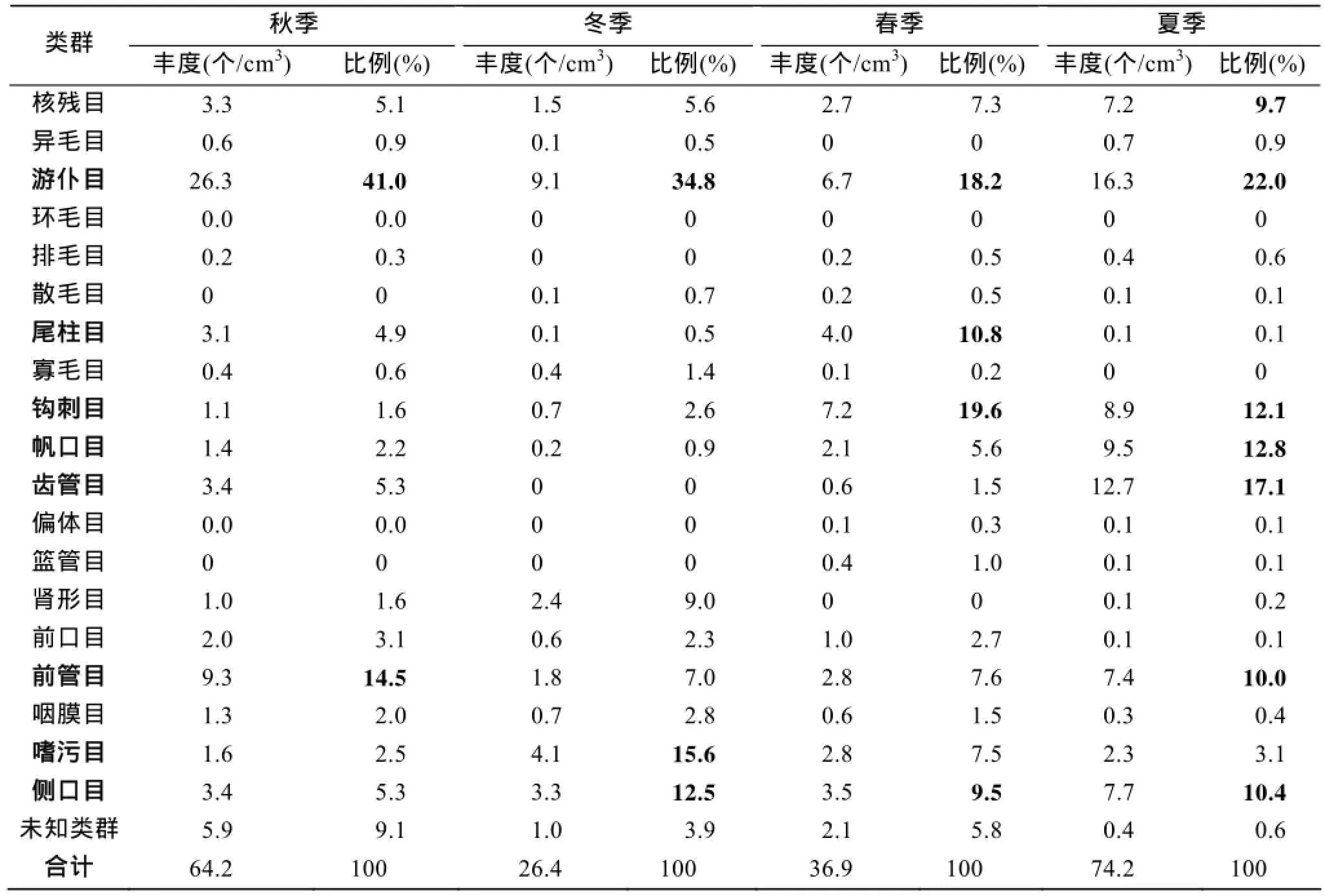
表3 一年四季纤毛虫主要类群的丰度及所占比例Tab. 3 Annual abundance and relative ratio of main groups of ciliates
在秋季, 菌食性的前管目纤毛虫亦为优势类群,占总丰度的14.5%; 导致菌食类群成为秋季沉积物中的最优类群, 占据总丰度的55.5%以上, 次优的肉食类群不足13%。在冬季, 菌食性的嗜污目和肉食性的侧口目纤毛虫也是优势类群, 分别占据总丰度的15.6%和12.5%; 冬季的最优类群为菌食类群(占总丰度57.4%以上), 肉食类群为次优类群(约占总丰度的20.7%)。在春季, 杂食性的尾柱目和肉食性的钩刺目纤毛虫为另外两个优势类群, 分别占据总丰度的10.8%和19.6%; 春季的最优类群为菌食类群(约占总丰度43%), 次优的肉食类群约占总丰度的36.4%, 二者差距明显缩小。在夏季的沉积物样品中,最优势类群仍为菌食类群(约占总丰度47.9%), 次优类群为肉食类群(约占总丰度32.2%), 藻食类群也较为优势(约占总丰度17.3%; 表3)。
因此, 火焜岙潮间带沉积物中, 菌食类纤毛虫为全年的最优类群, 在秋季和冬季均可占据总丰度的一半以上; 次优类群为肉食性纤毛虫, 在春季和夏季会占据总丰度的30%以上, 大大缩小了和菌食类群的差距; 藻食性纤毛虫仅在夏季丰度大增, 达到总丰度的17%以上, 成为第三优势类群。
2.3.2 水平和垂直变化
秋季: 由高潮带到低潮带, 纤毛虫的总丰度明显递减(图4), 这与环境因子中有机质含量、叶绿素a和脱镁叶绿素a含量的递减趋势基本吻合(表1)。菌食性的游仆目和前管目在高、中、低潮带均为最优势类群, 游仆目在3个潮带分别占总丰度的48.6%、28.0%和37.7%, 前管目分别为12.3%、18.2%和15.5%(图5)。纤毛虫丰度的垂直变化没有呈现明显的变化趋势, 16~20 cm层在高、中、低潮带均显著低于其他层(表4)。
冬季: 由高潮带到低潮带, 纤毛虫的总丰度仍旧呈现递减的趋势(图4), 但中、低潮带的差距不大。冬季样品中, 高、中、低潮带均出现的优势类群包括菌食性的游仆目(在高、中、低潮带分别占据总丰度的34.6%、25.4%和46.3%)和嗜污目(在高、中、低潮带分别占据总丰度的16.0%、10.2%和18.5%)及肉食性的侧口目(在高、中、低潮带分别占据总丰度的11.3%、20.3%和11.1%; 图5)。除此之外, 在高潮带,肾形目也是优势类群, 占据总丰度的11.6%; 在中潮带和低潮带, 优势类群前管目(菌食性), 分别占据总丰度的13.6%和13.0%; 在中潮带, 优势类群还包括以肉食性为主的核残目, 占据总丰度的10.2%(图5)。纤毛虫的丰度, 在高潮带为0~4 cm较高, 4~8 cm最低, 8~20 cm随深度增加逐步增高; 在中潮带由表层到底层, 基本呈现逐步递减的趋势; 在低潮带, 8~12 cm层纤毛虫丰度最高(表4)。
春季: 由高潮带到低潮带, 纤毛虫的总丰度呈现较明显的逐步递减趋势(图4)。藻食性的偏体目在高、中、低潮带均为优势类群, 分别占据总丰度的12.8%、31.0%和14.8%。菌食性的游仆目和杂食性的排毛目在高潮带和中潮带均为优势类群: 游仆目在高、中潮带分别占据总丰度的29.2%和10.9%; 排毛目在高、中潮带分别占据总丰度的12.8%和12.6%。在低潮带, 优势类群还包括杂食性的尾柱目、菌食性的帆口目、咽膜目和嗜污目, 分别占据总丰度的11.5%、18.9%、11.5%和10.7%(图5)。在高潮带和中潮带, 0~4 cm层的纤毛虫丰度分别为178.1个/cm3和125.7个/cm3, 明显高于其他各层(<50个/cm3);在低潮带, 随着深度增加, 纤毛虫的丰度逐步递减(表4)。
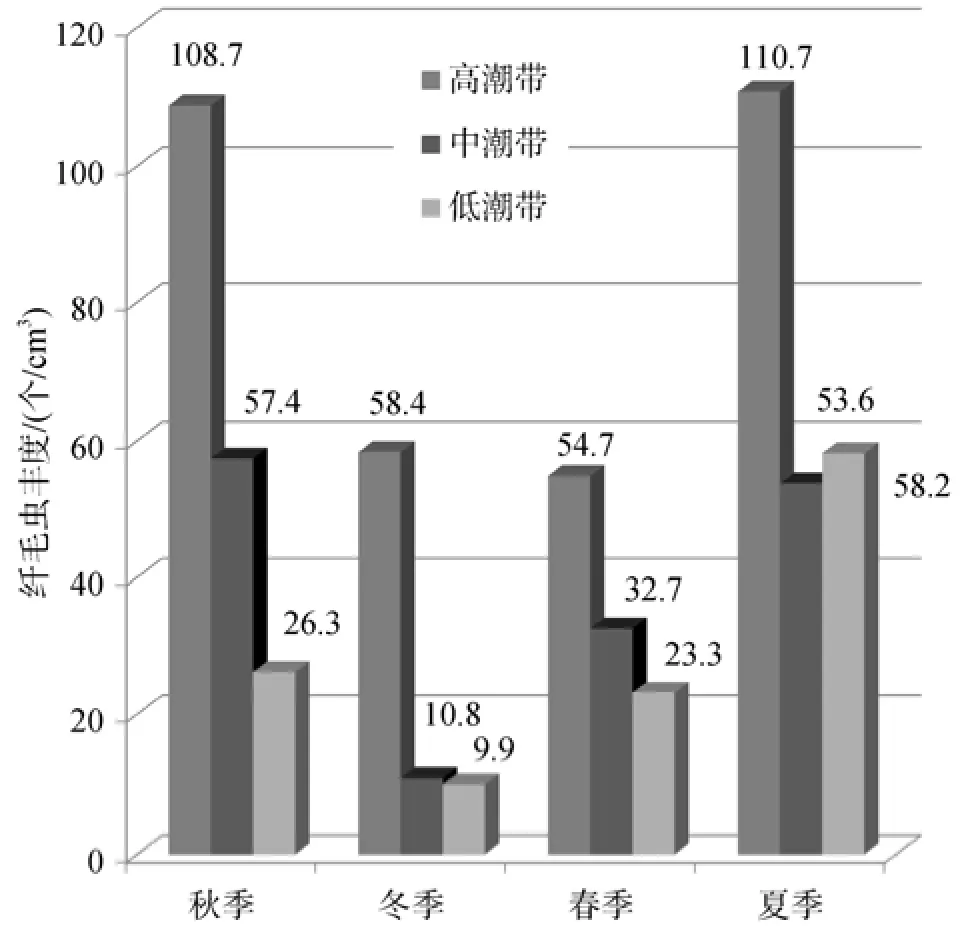
图4 一年四季纤毛虫丰度(个/cm3)的水平变化Fig. 4 Annual horizontal variation of ciliates abundance (cells/cm3)

表4 一年四季纤毛虫丰度的垂直变化Tab. 4 Annual vertical variation of ciliates abundance
夏季: 纤毛虫的总丰度在高潮带达到峰值110.7个/cm3, 中潮带最低(53.6个/cm3), 低潮带为58.2个/cm3(图4)。高潮带的最优势类群为藻食性的齿管目、菌食性的帆口目和肉食性的核残目, 分别占据总丰度的32.2%、20.7%和13.6%。中、低潮带的优势类群为菌食性的游仆目(分别占51.0%、18.3%)和前管目(10.6%、10.4%)及肉食性的侧口目(17.1%、11.0%)。肉食性的钩刺目, 是低潮带的最优势类群, 占据总丰度的40.1%(图5)。在高潮带, 0~4 cm层纤毛虫丰度极高, 达383.7个/cm3, 其他四层均低于60个/cm3;在中潮带, 0~4 cm和4~8 cm层纤毛虫丰度分别为74.3个/cm3和144.1个/cm3, 其他3层均低于30个/cm3; 在低潮带, 0~4 cm和4~8 cm层纤毛虫丰度分别为97.3个/cm3和138.6个/cm3, 其他3层均低于40个/cm3(表4)。
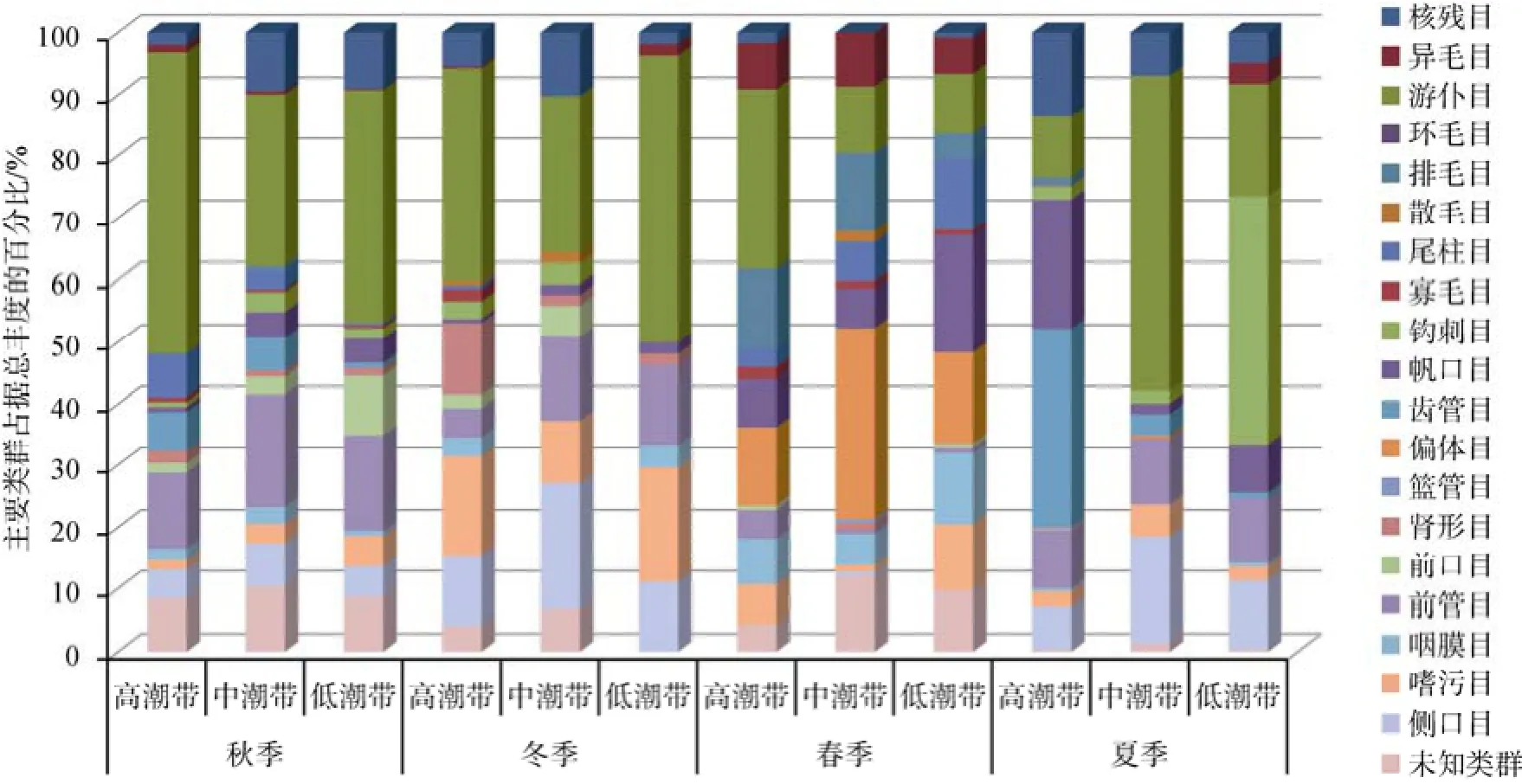
图5 一年四季纤毛虫主要类群占据总丰度的百分比Fig. 5 Annual variation of percentage of main groups in ciliates
2.3.3 数据分析
聚类分析和多维定标分析显示, 在60%~80%的相似性水平上, 火焜岙潮间带沉积物中纤毛虫群落按秋季(Ⅰ)、春季(Ⅱ)和夏季(Ⅲ)样品各自聚为一组, 而冬季不同潮带的样品则散布于其他季节样品间(图6)。
单因子相似性检验(One-Way ANOSIM)分析表明, 火焜岙潮间带0~20 cm沉积物样品中纤毛虫群落结构在不同季节中的差异极显著(P=0.001), 在不同分层中差异显著(P=0.014), 而在不同潮带的差异不显著。

图6 纤毛虫群落结构的聚类分析(A)和多维定标分析(B)Fig. 6 Cluster analysis (A) and MDS ordination (B) of ciliate communities
3 讨论
海洋近岸海域底栖生态环境异质多样, 能够提供丰富的食物来源, 潮间带砂隙生纤毛虫通常是砂质沉积物中最重要的捕食者, 具有较高的形态和功能多样性, 丰度可达1000个/cm3甚至更高[26]。迄今,对沿海底栖纤毛虫的研究主要集中于潮间带砂隙纤毛虫的分类学和区系研究[19,21,27-30], 对其时空和季节变化所知甚少。
南麂列岛地处台湾暖流与江浙沿岸流交汇和交替消长的海区, 属亚热带海洋季风气候, 研究所涉火焜岙潮间带属砂质沉积物。迄今有关亚热带海区潮间带纤毛虫的物种多样性和分布特点所知不多,对其季节变化则仍然未知。本研究在火焜岙潮间带表层20 cm沉积物中获得了19目70余属的148种纤毛虫, 远远高于来自红海[31]、地中海[32-33]沿岸砂质潮间带的纤毛虫物种多样性; 与来自白海[34-36]沿岸砂质潮间带的数据相近。需要指出的是, 来自红海、地中海和白海沿岸砂质潮间带的纤毛虫物种多样性数据均来自多站位的多年观察[31-36], 而本研究结果仅是基于火焜岙单一站位一年里四次采集的样品。因此, 南麂列岛的高生物多样性特点不仅体现在大型底栖动物、大型海藻和微小型藻类[6-17]等类群上,在底栖纤毛虫为代表的原生动物中亦有体现。
地中海砂质潮间带的纤毛虫物种多样性和群落结构组成, 具有明显的季节性差异: 以Corliss纤毛虫系统[37]中的动基片纲(为多源类群, 内含Lynn 2008纤毛虫系统[22]中的核残目、钩刺目、齿管目、偏体目、篮管目、肾形目、前口目、前管目、侧口目)为全年的最优势类群, 寡膜纲[37](含帆口目、咽膜目、嗜污目)[22]偶尔多于动基片纲, 而多膜纲[37](含异毛目、游仆目、环毛目、排毛目、散毛目、尾柱目、寡毛目)[22]丰度最低; 优势种来自肉食类为主的核残目和侧口目及菌食类群前管目, 即以肉食性纤毛虫为主、菌食性纤毛虫次之[32]。而火焜岙潮间带的纤毛虫在物种数和丰度全年以动基片纲为最优势类群(平均占总丰度的46.1%), 多膜纲在物种数和丰度上占第二位(平均占总丰度的34.8%), 在秋季甚至超过动基片纲而成为最优类群(47.6% vs. 36.5%)。从食性上看, 火焜岙砂质潮间带丰度占优势的纤毛虫依次为: 菌食类群、肉食类群和藻食类群, 最优势的类群为菌食性的游仆目纤毛虫。纤毛虫摄食功能群的变化显示南麂列岛火焜岙潮间带虽为砂质底质, 但其中的纤毛虫已非典型的砂隙纤毛虫区系, 而是具有某些有机质丰富的泥沙质沉积物中的纤毛虫群落特点。据报导[20], 火焜岙曾是南麂乡政府所在地, 居民集中, 还办过渔粉厂、冷冻厂等水产企业。纤毛虫摄食功能群的上述变化很可能是这段时间沿岸居民生活和企业生产污水排放等所致, 尽管附近居民已动迁, 企业也已停产, 但造成的影响目前依然存在。
白海砂质潮间带的纤毛虫物种多样性和群落组成具有十分明显的垂直分布差异, 物种数目和丰度随着深度增大而递减, 且七成以上的丰度由表层0.5 cm沉积物贡献[35]。而在火焜岙潮间带砂质沉积物中, 纤毛虫物种多样性和群落结构组成, 尽管不同分层间有显著差异, 但无论是多样性还是丰度并未见随深度递减的趋势。造成这种差异的原因, 一方面可能由于样品采集方式不同(白海采集表层3 cm: 前两层每层0.5 cm, 后两层每层1 cm; 而火焜岙采集表层20 cm:每层4 cm); 另一方面, 白海的自然海滩沉积物中的纤毛虫以食藻类群占优势, 且绝大多数样品的采集在白天进行, 因此纤毛虫的垂直分布受藻类垂直分布的直接影响, 呈现从表层至底层明显递减的特点。而火焜岙潮间带由于受人类活动影响, 沉积物中菌食性纤毛虫成为优势类群, 导致其从表层至底层物种多样性和丰度的递减趋势并不明显。
我国针对砂质潮间带沉积物中纤毛虫物种多样性和群落结构的研究尚较为缺乏。青岛湾是青岛近岸潮间带的代表, 其低潮带和火焜岙同为砂质沉积物, 沿岸有生活污水排放口和旅游景点, 受人类活动的影响较大。从纤毛虫的摄食功能群构成看, 火焜岙和青岛湾全年的优势类群均为菌食性的游仆目纤毛虫。相较于火焜岙, 青岛湾低潮带表层0~8 cm沉积物中的纤毛虫周年平均丰度(99个/cm3)高于火焜岙(75.5个/cm3), 纤毛虫丰度的季节波动幅度较小,但随深度递减的趋势相较于火焜岙更为显著[38]。究其原因, 可能是受中潮带泥沙质沉积物的影响, 青岛湾低潮带砂质沉积物沙粒更细, 沉积物中叶绿素a含量和有机质含量明显较火焜岙砂质潮间带高, 从而造成纤毛虫丰度和分布上的差异。通常, 纤毛虫的物种数与丰度呈显著的正相关关系, 即高丰度通常与高物种数相关联。但这一点并未在青岛湾和火焜岙的纤毛虫丰度-物种数关系上体现出来, 在青岛湾砂质潮间带按月采样的周年调查获得的纤毛虫平均丰度高于火焜岙约30%, 但所获纤毛虫物种数仅为火焜岙的一半。南麂列岛火焜岙所展现的纤毛虫高物种多样性表明, 尽管存在人类干扰的长期效应,南麂列岛火焜岙潮间带周边环境较佳, 周边居民及设施的动迁以及建立自然保护区起到了有效的多样性保护作用。
致谢: 本研究室孟昭翠在实验设计过程中提供大力支持,周百灵在数据处理和分析中提供帮助; 环境因子数据的测定, 由周百灵、史本泽、李菊、李洁和李宇航共同完成, 在此谨致谢忱。
参考文献:
[1] 刘瑞玉. 中国海洋生物名录[M]. 北京: 科学出版社, 2008: 1-1267. Liu Ruiyu. Checklist of marine biota of China Seas[M]. Beijing: Ocean Press, 2008: 1-1267.
[2] 黄宗国. 中国海洋生物种类与分布[M]. 北京: 海洋出版社, 2008: 1-1191. Huang Zongguo. Marine species and their distribution in China [M]. Beijing: Ocean Press, 2008: 1-1191.
[3] 黄宗国, 林茂. 中国海洋物种和图集[M]. 北京: 海洋出版社, 2012: 1-1380. Huang Zongguo, Lin Mao. The living species and their illustrations in China’ seas [M]. Beijing: Ocean Press, 2012: 1-1380.
[4] 蔡厚才, 彭欣. 走进贝藻王国[M]. 上海: 上海人民美术出版社, 2011: 1-118. Cai Houcai, Peng Xin. Welcome to the Kingdom of shellfish and algae [M]. Shanghai: Shanghai People’s Fine Arts Publishing House, 2011: 1-118.
[5] 俞永跃. 基于海岛管理的南麂列岛生物多样性保护实践与经验[M]. 北京: 海洋出版社, 2011: 1-205. Yu Yongyue. Practices and lessons from island-based conservation of biodiversity in Nanji Islands [M]. Beijing: Ocean Press, 2011: 1-205.
[6] 汤雁滨, 高爱根, 廖一波, 等. 南麂列岛岩相潮间带多毛类生态初步研究[J]. 海洋科学, 2014, 38(2): 53-62. Tang Yanbin, Gao Aigen, Liao Yibo, et al. Preliminary study on ecology of polychaetes at intertidal rocky zone on Nanji Islands [J]. Marine Sciences, 2014, 38(2): 53-62.
[7] 何贤保, 章飞军, 林利, 等. 南麂列岛岛礁区域鱼类种类组成和数量分布[J]. 海洋与湖沼, 2013, 44(2): 454-460. He Xianbao, Zhang Feijun, Lin Li, et al. Species composition and quantitative distribution of fishes in island-reef water of Nanji Islands [J]. Oceanologia et Limnologia Sinica, 2013, 44(2): 454-460.
[8] 李扬, 李欢, 吕颂辉, 等. 南麂列岛海洋自然保护区浮游植物的种类多样性及其生态分布[J]. 水生生物学报, 2010, 34(3): 618-628. Li Yang, Li Huan, Lü Songhui, et al. Species diversity and distribution of phytoplankton in Nanji Islands National Nature Reserve [J]. Acta Hydrobiologica Sinica, 2010, 34(3): 618-628.
[9] 彭欣, 谢起浪, 陈少波, 等. 南麂列岛潮间带底栖生物时空分布及其对人类活动的响应[J]. 海洋与湖沼, 2009, 40(5): 584-589. Peng Xin, Xie Qilang, Chen Shaobo, et al. Distribution of intertidal benthos and the human impact in Nanji Islands, China [J]. Oceanologia et Limnologia Sinica, 2009, 40(5): 584-589.
[10] 高爱根, 曾江宁, 徐晓群, 等. 南麂列岛大沙岙沙滩贝类的时空分布[J]. 海洋学研究, 2008, 26(2): 13-19. Gao Aigen, Zeng Jiangning, Xu Xiaoqun, et al. Temporal-spatial distribution of the shellfish in the sandbeach of Dasha-ao, Nanji Archipelago [J]. Journal of Marine Sciences, 2008, 26(2): 13-19.
[11] 高爱根, 曾江宁, 陈全震, 等. 南麂列岛海洋自然保护区潮间带贝类资源时空分布[J]. 海洋学报, 2007, 29(2): 105-111. Gao Aigen, Zeng Jiangning, Chen Quanzhen, et al. Time and space distribution of Molluscas of intertidal zone in Nanji Archipelago Marine Nature Reserve [J]. Acta Oceanologica Sinica, 2007, 29(2): 105-111.
[12] 纪焕红, 叶属峰, 刘星, 等. 南麂列岛海洋自然保护区浮游动物的物种组成及其多样性[J]. 生物多样性, 2006, 14(3): 206-215. Ji Huanhong, Ye Shufeng, Liu Xing, et al. The species composition and diversity of zooplankton in Nanji Islands National Nature Reserve [J]. Biodiversity Science, 2006, 14(3): 206-215.
[13] 林岿璇, 张志南, 韩洁. 南麂列岛海洋自然保护区潮间带小型生物初步研究[J]. 青岛海洋大学学报, 2003, 33(2): 219-225. Lin Kuixuan, Zhang Zhinan, Han Jie. A preliminary study on the meiofaunal in the intertidal zone in Nanji Islands Marine Reserve [J]. Periodical of Ocean University of Qingdao, 2003, 33(2): 219-225.
[14] 朱根海, 王旭, 王春生, 等. 南麂列岛国家海洋自然保护区微、小型藻类生态研究 I. 种类组成与生态特点[J]. 东海海洋, 1998, 16(2): 1-21. Zhu Genhai, Wang Xu, Wang Chunsheng, et al. Ecological studies on nanoalgae and microalgae in Nanji Island National Marine Nature Conservation Area I. Species composition and ecological characteristics. Journal of Marine Sciences, 1998, 16(2): 1-21.
[15] 朱根海, 王旭, 王春生, 等. 南麂列岛国家海洋自然保护区微、小型藻类生态研究 II. 数量分布[J]. 东海海洋, 1998, 16(2): 22-28. Zhu Genhai, Wang Xu, Wang Chunsheng, et al. Ecological studies on nanoalgae and microalgae in Nanji Islands National Marine Natural Conservation Area II. Quantitative distribution. Journal of Marine Sciences, 1998, 16(2): 22-28.
[16] 朱根海, 陈国通, 杨俊毅, 等. 南麂列岛海域微小型底栖藻类生态研究[J]. 东海海洋, 1996, 14(2): 26-34. Zhu Genhai, Chen Guotong, Yang Junyi, et al. Ecological study on benthic nano- and microalgae in the water area of Nanji Archipelago [J]. Journal of Marine Sciences, 1996, 14(2): 26-34.
[17] 朱根海, 陈国通, 杨俊毅. 南麂列岛潮间带的微小型底栖藻类[J]. 东海海洋, 1994, 12(2): 16-28. Zhu Genhai, Chen Guotong, Yang Junyi. Benthic nanoand microalgae on intertidal zone of Nanji Archipelago [J]. Journal of Marine Sciences, 1994, 12(2): 16-28.
[18] 沈韫芬. 原生动物学[M]. 北京: 科学出版社, 1999: 1-656. Shen Yunfen. Protozoology [M]. Beijing: Science Press, 1999: 1-656.
[19] 类彦立, 徐奎栋. 底栖纤毛虫原生动物的生态学研究进展[J]. 水生生物学报, 2008, 32 (suppl.): 155-160. Lei Yanli, Xu Kuidong. Research progress in the ecology of benthic ciliated protozoa[J]. Acta Hydrobiologica Sinica, 2008, 32 (suppl.): 155-160.
[20] 杨晓兰, 张健, 叶新荣, 等. 南麂列岛自然保护区潮间带环境质量现状评价[J]. 东海海洋, 1994, 12(2): 70-76. Yang Xiaolan, Zhang Jian, Ye Xinrong, et al. The present environment quality assessment of intertidal zone in natural protect area of Nanji Archipelago[J]. Journal of Marine Sciences, 1994, 12(2): 70-76.
[21] 类彦立, 徐奎栋. 海洋微型底栖生物调查方法与操作规程[J]. 海洋与湖沼, 2011, 42(1): 157-164. Lei Yanli, Xu Kuidong. Techniques and operating procedures for the investigation of marine microbenthos [J]. Oceanologia et Limnologia Sinica, 2011, 42(1): 157-174.
[22] Lynn D. H. The Ciliated Protozoa. Characterization, Classification, and Guide to the Literature, 3rdedn [M]. Springer, Dordrecht, 2008: 1-605.
[23] 周红, 张志南. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用[J]. 青岛海洋大学学报, 2003, 33(1): 58-64. Zhou Hong, Zhang Zhinan. Rationale of the multivariate statistical software PRIMER and its application in benthic community ecology [J]. Periodical of Ocean University of Qingdao, 2003, 33(1): 58-64.
[24] Clarke K R. Non-parametric multivariate analyses of changes in community structure [J]. Australian Journal of Ecology, 1993, 18: 117-143.
[25] Clarke K R, Warwick R M. Change in marine communities: an approach to statistical analysis and interpretation [J]. Plymouth: Plymouth Marine Laboratory, 1994: 1-144.
[26] 徐奎栋. 海洋微型底栖生物的多样性与地理分布[J].生物多样性, 2011, 19(6): 661-675. Xu Kuidong. Biodiversity and biogeography of marine microbenthos: progress and prospect [J]. Biodiversity Science, 2011, 19(6): 661-675.
[27] Fauré-Fremiet E. Ecologie des Ciliés psammophiles littoraux [J]. Bulletin biologique de la France et de la Belgique, 1950, 81: 35-75.
[28] Dragesco J. Ciliés mésopsammiques littoraux, systématique, morphologie, écologie [J]. Des Travaux de la Station Biologique de Roscoff (Nouvelle Série), 1960, 12: 1-356.
[29] Carey P G. Marine Interstitial Ciliates: An Illustrated Key [M]. Chapman and Hall, London, 1992: 1-351 .
[30] Borror A C. Ecology of interstitial ciliates [J]. Transactions of the American Microscopical Society, 1968, 87: 233-243.
[31] Al-Rasheid K A S. New records of interstitial ciliates (Protozoa Ciliophora) from the Saudi coasts of the Red Sea [J]. Tropical Zoology, 2001, 14: 133-156.
[32] Santangelo G, Lucchesi P. The interstitial ciliated protozoa of a Mediterranean microcommunity [J]. Hydrobiologia, 1992, 230: 79-92.
[33] Lucchesi P, Santangelo G. The interstitial ciliate microcommunity of a Mediterranean sandy shore under differing hydrodynamic disturbances [J]. Italian Journal of Zoology, 1997, 64, 253-259.
[34] Mazei Y A, Burkovsky I V. Vertical structure of the interstitial ciliate community in the Chernaya River Estuary (the White Sea) [J]. Protistology, 2003, 3: 107-120.
[35] Mazei Y A, Burkovsky I V. Species composition of benthic ciliate community in the Chernaya River Estuary (Kandalaksha Gulf, White Sea) with a checklist of total White Sea benthic ciliate fauna [J]. Protistology, 2005, 4, 107-120.
[36] Burkovsky I V, Mazei Y A. Long-term dynamics of marine interstitial ciliate community [J]. Protistology, 2010, 6: 147-172.
[37] Corliss J O. The Ciliated Protozoa. Characterization, Classification and Guide to the Literature [M]. Oxford, New York, Toronto, Sydney, Paris, Frankfurt, 1979: 1-455.
[38] 代仁海. 潮间带底栖纤毛虫分类学及生态学初步研究[D]. 中国海洋大学硕士学位论文, 2009: 1-68. Dai Renhai. Preliminary investigation on the taxonomy and ecology of benthic ciliates in intertidal area [D]. Master degree thesis of Ocean University of China, 2009: 1-68.
Received:Feb. 28, 2016
Spatiotemporal distribution of species diversity and community structure of ciliates in intertidal sandy sediments of Huokun’ao beach, Nanji Islands
CHEN Xu-miao1, CHEN Wan-dong2, CAI Hou-cai2, XU Kui-dong1
(1. Department of Marine Organism Taxonomy and Phylogeny, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Nanji Islands National Marine Nature Reserve Administration, Pingyang 325401, China)
Nanji Islands; intertidal sediment; ciliate; species diversity; community structure
In intertidal sediments, ciliates are a highly diverse and quantitatively dominant group. Their community structure may in some sense reflect the condition of environmental quality. This study investigates the spatiotemporal distribution of species diversity and community structure of ciliates in the intertidal sandy sediments of Huokun’ao beach, Nanji Islands National Marine Natural Reserve, based on sample collections in November 2013 (autumn), February (winter), May (spring) and August (summer) 2014. Results show highly diverse and abundant ciliates in the intertidal sediments of the beach, where a total of 148 species representing 19 orders and over 70 genera were identified. The abundance and species composition of benthic ciliates shows significant correlation with seasons and sediment depth. Bacterivorous ciliates constitute the most abundant group, followed by carnivores, and algivores. The predominance of bacterivores indicates that the ciliate community in the intertidal sediment of Huokun’ao is not typical interstitial ciliates fauna, but that it follows a pattern similar to that in muddy sand sediments with a high level of organic matter. This is likely to be an effect of long-term human activities. In spite of the impact, the high diversity of ciliates indicates that the benthic environment in the Huokun’ao beach and its surrounding area is in a fair condition, which is attributed to the biodiversity conservation measures adopted, e.g. relocation of surrounding residents and facilities.
Q958.12
A
1000-3096(2016)12-0082-12
10.11759/hykx20150515001
(本文编辑: 梁德海)
2016-02-28;
2016-05-16
国家自然科学基金项目(41476144, 41306153); 国家海洋局《南麂列岛国家级海洋自然保护区海洋生物资源与栖息环境调查及保护效果评估》(2010)
[Foundation: National Natural Science Foundation of China, No. 41476144, No. 41306153; Nanji Islands Marine Natural Reserve Project]
陈旭淼(1984-), 女, 山东青岛人, 博士, 从事纤毛虫原生动物分类和系统发育研究, 电话: 0532-82898785, E-mail: xchen@qdio.ac.cn;徐奎栋, 通信作者, 电话: 0532-82898776, E-mail: kxu@qdio.ac.cn

