渤海湾浮游纤毛虫丰度和生物量的周年变化
于 莹,王 宇,张博伦,王 硕,徐晓甫,张武昌
1 泰山学院,泰安 271000 2 天津市水产研究所,天津 300457 3 中国科学院海洋生态与环境科学重点实验室,中国科学院海洋研究所,青岛 266071 4 青岛海洋科学与技术(试点)国家实验室,海洋生态与环境科学功能实验室,青岛 266237 5 中国科学院海洋大科学研究中心,青岛 266071
作为海洋微食物网的重要组成类群[1—2],浮游纤毛虫粒径较小(5—200 μm),主要包括营浮游生活的无壳寡毛类纤毛虫和砂壳纤毛虫两大类,分别隶属于纤毛门(Ciliophora Doflein),旋毛纲(Spirotrichea Bütschli)下的寡毛亚纲(Oligotrichia Bütschli)及环毛亚纲(Choreotrichia Small &Lynn)[3]。
温带近岸海区的浮游纤毛虫丰度和生物量呈现明显的季节波动,一年之中往往呈现双峰值,一般在春季和夏季[4]或春季和秋季[5]达到高峰。无壳纤毛虫通常在浮游纤毛虫中占绝对优势,砂壳纤毛虫占浮游纤毛虫丰度的比例一般<10%[6—7],砂壳纤毛虫偶尔在温度较高的夏季或秋季超过无壳纤毛虫丰度占优势[8—10]。
渤海湾位于渤海西部,面积约为1.47×104km2,平均水深12.5 m,海水交换能力弱,是一个典型的半封闭性浅水海湾。于莹等[11—12]对渤海湾浮游纤毛虫丰度和种类的季节变化有过调查,但没有完整的周年变化资料。本研究于2019年7月—2020年6月在渤海湾天津近岸海域进行浮游纤毛虫丰度和生物量的周年调查,为渤海湾浮游生态系统研究提供基础数据和参考资料。
1 材料和方法
2019年7月—2020年6月在渤海湾固定站位(117°59′E,39°02′N,水深9—12 m,图1)进行每月1次(2019年7月22日、8月23日、9月23日、10月21日、11月25日、12月23日、2020年1月16日、2月24日、3月20日、4月19日、5月25日及6月22日)共12个航次纤毛虫样品的采集。

图1 采样站位图Fig.1 Location of the sampling station
用YSI Professional Plus便携式水质分析仪测定表层海水的温度和盐度。采集表层水样500 mL,用GF/F滤膜过滤,滤膜置于-20℃冰箱保存。滤膜带回实验室用90%丙酮低温(0 ℃)萃取24 h后,用分光光度计测量叶绿素a(Chl a)浓度。
采集表层水样1 L,用Lugol′s液固定(终浓度1%)。样品分析按照Utermöhl方法[13]进行,自然沉淀至少48 h,虹吸后剩余约150 mL,于阴凉处保存。取16 mL放于沉降杯内,在Olympus IX71倒置显微镜下100倍或400倍镜检,记录无壳纤毛虫和砂壳纤毛虫(不计空壳)的个数。测量纤毛虫虫体的体长、体宽等,按最接近的几何形状(如柱体、球体和锥体)计算体积。生物量由体积乘转换系数(0.19 pg C/μm3)[14]得来,砂壳纤毛虫体积直接按照肉体体积计算。
按照纤毛虫细胞体积的大小将无壳纤毛虫分成3种粒级:小型无壳纤毛虫(ACI,103—104μm3)、中型无壳纤毛虫(ACII,104—105μm3)及大型无壳纤毛虫(ACIII,>105μm3)[15]。砂壳纤毛虫根据文献[16]鉴定到种,按照砂壳纤毛虫种类出现的季节规律,将砂壳纤毛虫分为周年出现种、冬季种、春季种、夏季种及秋季种五大类[17]。
根据徐兆礼等[18]的公式计算优势度(Y),Y>0.02时,该种为优势种。砂壳纤毛虫群落的多样性采用Shannon指数(H′)[19],均匀度采用Pielou指数(J)[20]。
采用R语言的vegan程序包进行砂壳纤毛虫群落结构和环境因子的Mantel检验,经过9999次排列得到统计结果,置信度设为95%;采用SPSS 20.0进行纤毛虫丰度和生物量与环境因子的相关性分析,运用Pearson相关分析方法,置信度设为95%。
2 结果
2.1 环境因子
表层海水温度、盐度和Chl a浓度呈现明显的周年变化。年平均温度为(14.15±9.79)℃(平均值±标准差,下同),1月最低(2.35 ℃),7月最高(29.60 ℃);年平均盐度为31.53±0.44,夏秋季较低,其中7月最低(30.76);年平均Chl a浓度为(3.67±4.19)μg/L,一年之中出现两个峰值,分别在3月(5.53 μg/L)和7月(15.29 μg/L,图2)。
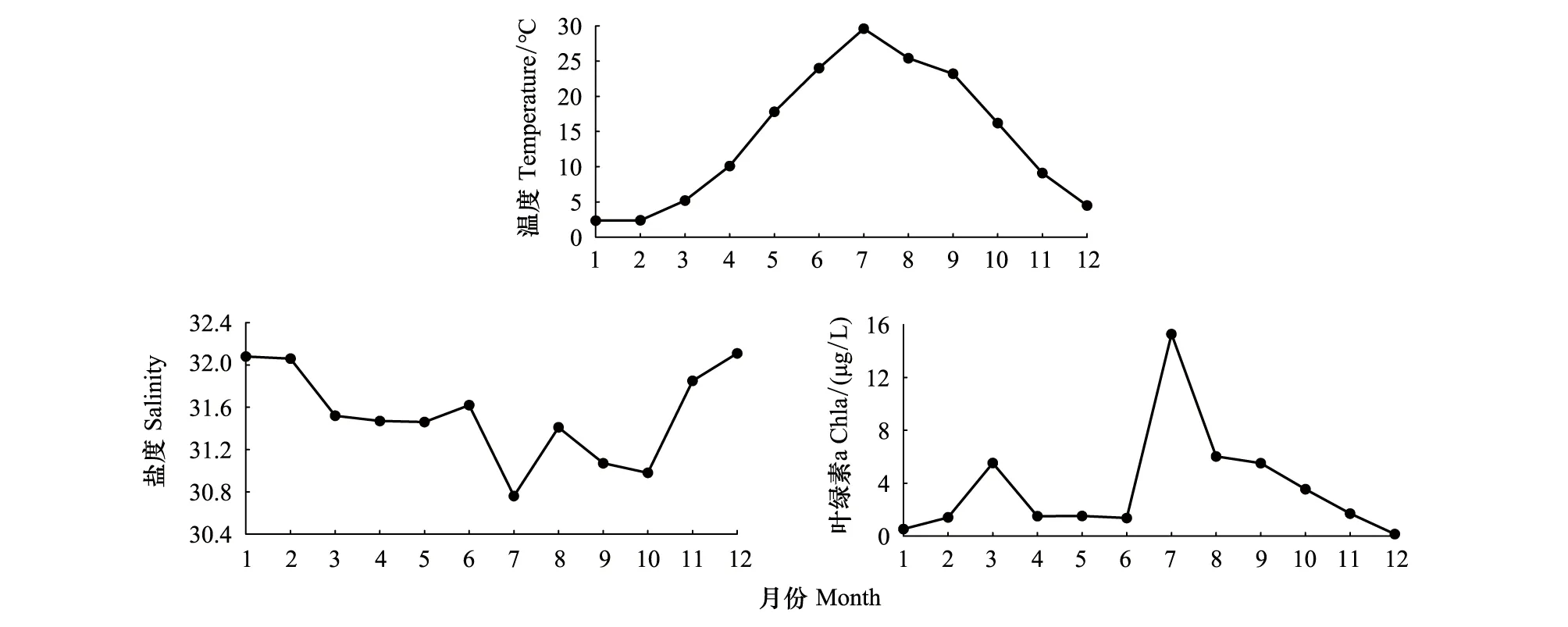
图2 温度、盐度及Chl a浓度的周年变化Fig.2 Annual variation of water temperature,salinity and Chl a concentration
2.2 纤毛虫丰度和生物量
无壳纤毛虫年平均丰度为(1382±1929)个/L(137—6748 个/L),年平均生物量为(2.29±3.05)μg C/L(0.09—10.83 μg C/L),丰度和生物量均在4月和8月呈现双峰值;砂壳纤毛虫年平均丰度为(946±2384)个/L(0—8440 个/L),年平均生物量为(3.86±11.57)μg C/L(0.00—40.57 μg C/L),丰度和生物量均在7月出现最高值;总纤毛虫年平均丰度为(2328±2735)个/L(143—8577 个/L),年平均生物量为(6.15±11.35)μg C/L(0.09—41.02 μg C/L),丰度和生物量均在4月和7月呈现双峰值(图3)。

图3 无壳纤毛虫、砂壳纤毛虫及总纤毛虫丰度和生物量的周年变化Fig.3 Annual variation of abundance and biomass of aloricate ciliates,tintinnids and total ciliates
砂壳纤毛虫占纤毛虫总丰度的比例平均为(28.6±32.6)%,5—7月较高,占比均超过50%,其中7月最高(98.4%)。
2.3 无壳纤毛虫粒级结构
无壳纤毛虫粒级结构没有呈现明显的季节规律。ACI在无壳纤毛虫丰度中占绝对优势,占无壳纤毛虫丰度的比例平均为(76.7±25.1)%;ACII占无壳纤毛虫丰度的比例平均为(20.6±25.2)%;ACIII占无壳纤毛虫丰度的比例最小,平均值为(2.7±4.9)%(图4)。
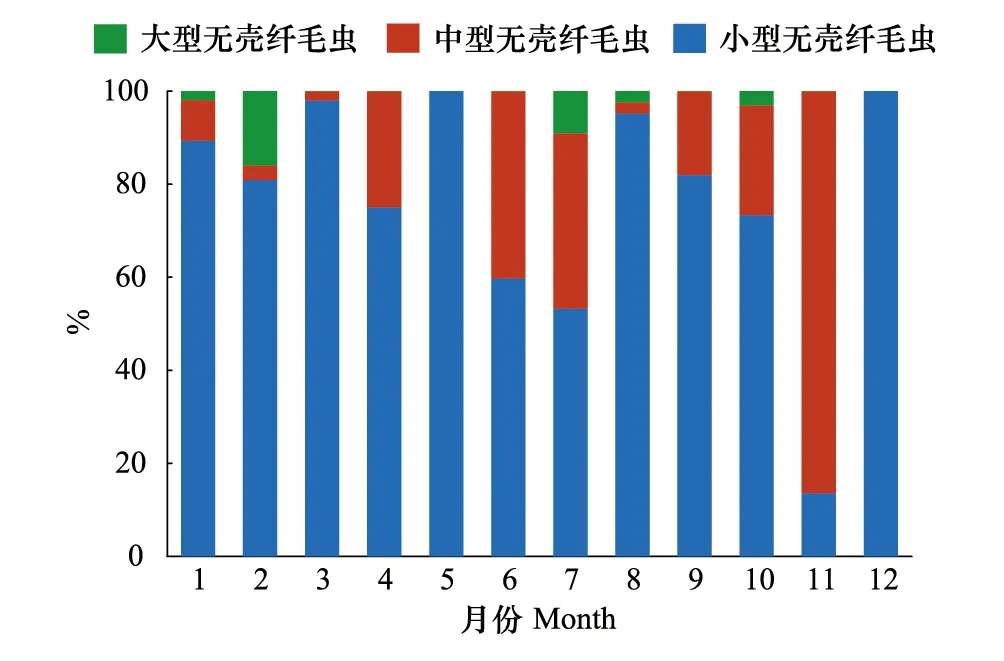
图4 无壳纤毛虫粒级组成的周年变化Fig.4 Annual variation of size classes of aloricate ciliates
2.4 砂壳纤毛虫群落
2.4.1种类组成
共鉴定砂壳纤毛虫6属21种(表1),其中拟铃虫属(Tintinnopsis)种类最多(13种)。优势种为简单薄铃虫(Leprotintinnussimplex,Y=0.08)、诺氏薄铃虫(Leprotintinnusnordqvisti,Y=0.04)和原始筒壳虫(Tintinnidiumprimitivum,Y=0.03)。砂壳纤毛虫种类数在6—8月较高,7月最高(10种)。

表1 渤海湾砂壳纤毛虫种类Table 1 Species list of tintinnids in the Bohai Bay
丰度较高(丰度占砂壳纤毛虫总丰度的比例>2%)的种类有10种,为简单薄铃虫(36.9%)、诺氏薄铃虫(19.5%)、原始筒壳虫(11.0%)、直颈拟铃虫(Tintinnopsisdirecta,8.2%)、寇氏拟铃虫(Tintinnopsiskofoidi,7.0%)、波罗的拟铃虫(Tintinnopsisbaltica,3.2%)、罗氏拟铃虫(Tintinnopsislohmanni,2.8%)、根状拟铃虫(Tintinnopsisradix,2.8%)、布氏拟铃虫(Tintinnopsisbutschlii,2.6%)及三亚类杯虫(Metacylissanyahensis,2.0%)。其中,寇氏拟铃虫只在温度较低(2.4—5.2℃)的冬季出现,是冬季种。波罗的拟铃虫只在温度为17.8℃的春季出现,是春季种。原始筒壳虫在春季和夏季均有发现,在夏季(>23.2℃)丰度较高;三亚类杯虫、布氏拟铃虫、罗氏拟铃虫、根状拟铃虫、诺氏薄铃虫、简单薄铃虫及直颈拟铃虫只在温度较高(>23.2℃)的夏季出现,是夏季种(图5)。
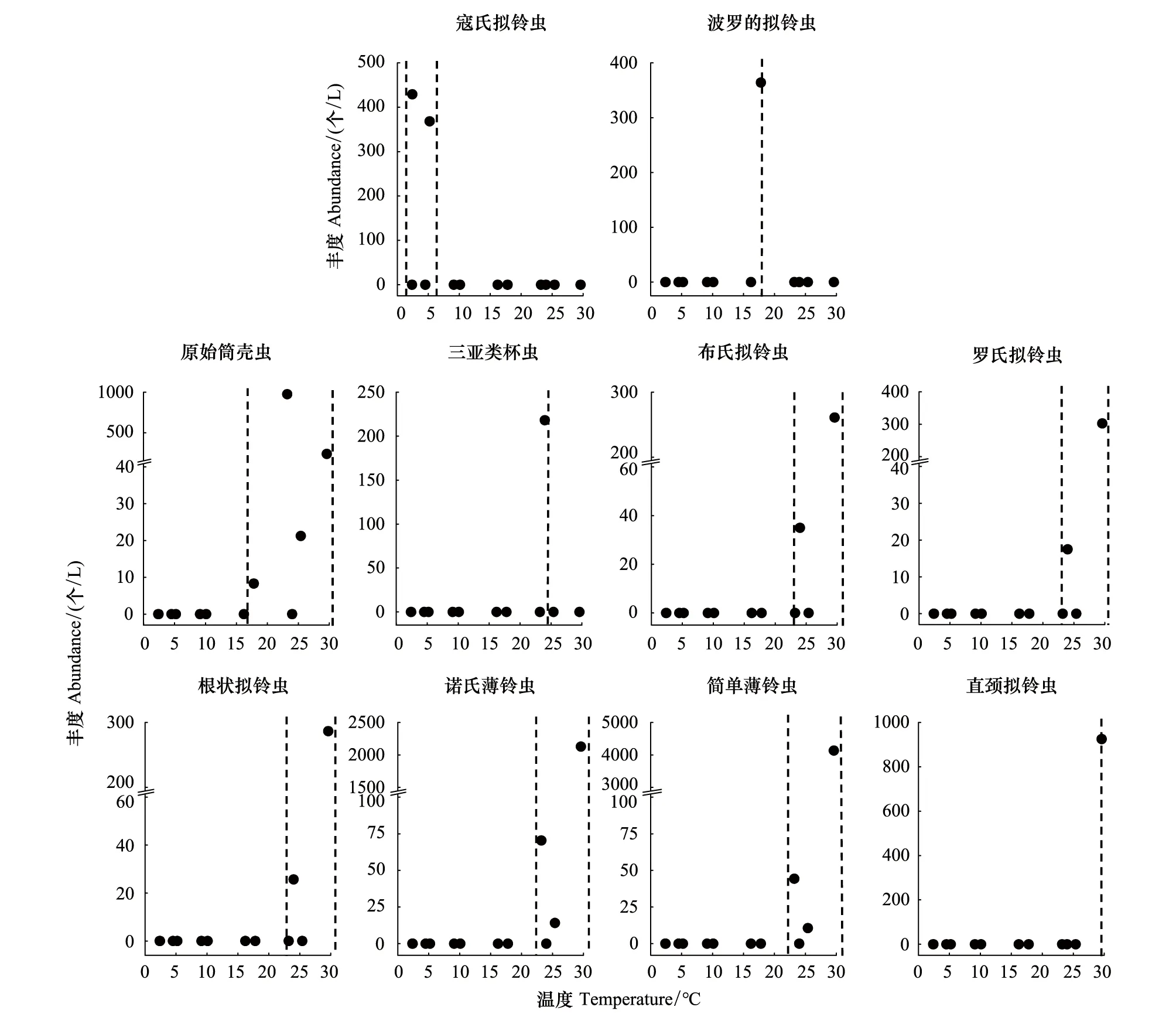
图5 丰度较高砂壳纤毛虫种类出现的温度范围Fig.5 Temperature range in which abundant tintinnids occurred
2.4.2群落结构
砂壳纤毛虫种类组成周年变化明显,不同种群出现季节更替。2、3月寇氏拟铃虫占优,5月波罗的拟铃虫占优,6月三亚类杯虫占优,7月简单薄铃虫、诺氏薄铃虫及直颈拟铃虫丰度较高,8月长形旋口虫(Helicostomellalonga)及原始筒壳虫丰度较高,9月原始筒壳虫占优,10月卡拉直克拟铃虫(Tintinnopsiskarajacensis)占比100%,11月筒状拟铃虫(Tintinnopsistubulosoides)及爱氏网纹虫(Favellaehrenbergii)占优(图6)。Mantel 检验表明,驱动砂壳纤毛虫群落周年变化的主要环境因子是温度,次要因子是盐度(表2)。

表2 砂壳纤毛虫群落结构(用Bray-Curtis相异度测量)和环境因子的Mantel检验Table 2 Mantel test between tintinnid community (measured as Bray-Curtis dissimilarity) and environmental factors

图6 砂壳纤毛虫种类组成的周年变化Fig.6 Annual variation of species composition of tintinnids
砂壳纤毛虫群落Shannon指数的平均值为0.95±0.78,在6—8月较高,7月最高(2.11);Pielou指数的平均值为0.52±0.34,在6—8月及12月较高,12月最高(1.00)。
2.5 纤毛虫与环境因子相关性分析
无壳纤毛虫丰度与温度、盐度和Chl a浓度均没有明显相关性。砂壳纤毛虫丰度、纤毛虫总丰度及砂壳纤毛虫占纤毛虫总丰度的比例均与温度呈极显著的正相关;砂壳纤毛虫丰度和纤毛虫总丰度均与盐度呈极显著的负相关,砂壳纤毛虫占纤毛虫总丰度的比例与盐度呈显著的负相关;砂壳纤毛虫丰度、纤毛虫总丰度及砂壳纤毛虫占纤毛虫总丰度的比例均与Chl a浓度呈极显著的正相关(表3)。

表3 纤毛虫丰度及砂壳纤毛虫占纤毛虫总丰度的比例与温度、盐度及Chl a浓度的相关性分析Table 3 Correlation between ciliate abundance,and percentage of tintinnids to total ciliate abundance and water temperature,salinity and Chl a concentration
3 讨论
近年来,多数研究主要关注纤毛虫丰度、种类组成与环境因子的关系[21—23]及物理过程如水团等对纤毛虫丰度分布的影响[24—27],只有少数研究关注纤毛虫群落组成长时间序列的变化[28—29]。本文在渤海湾近岸海区开展纤毛虫丰度和种类组成的周年调查,补充渤海湾纤毛虫长时间序列的数据。
与其它海区相比,本次调查中纤毛虫丰度和生物量均处在已有文献的范围之内(0—145000 个/L,0—400 μg C/L)[30];与之前渤海湾的研究[11—12]相比,本次调查中无壳纤毛虫丰度相差不大,砂壳纤毛虫丰度明显较高;与獐子岛海区[31]、胶州湾[9]周年资料对比(表4),渤海湾纤毛虫丰度较低,砂壳纤毛虫丰度占纤毛虫总丰度的比例稍高。
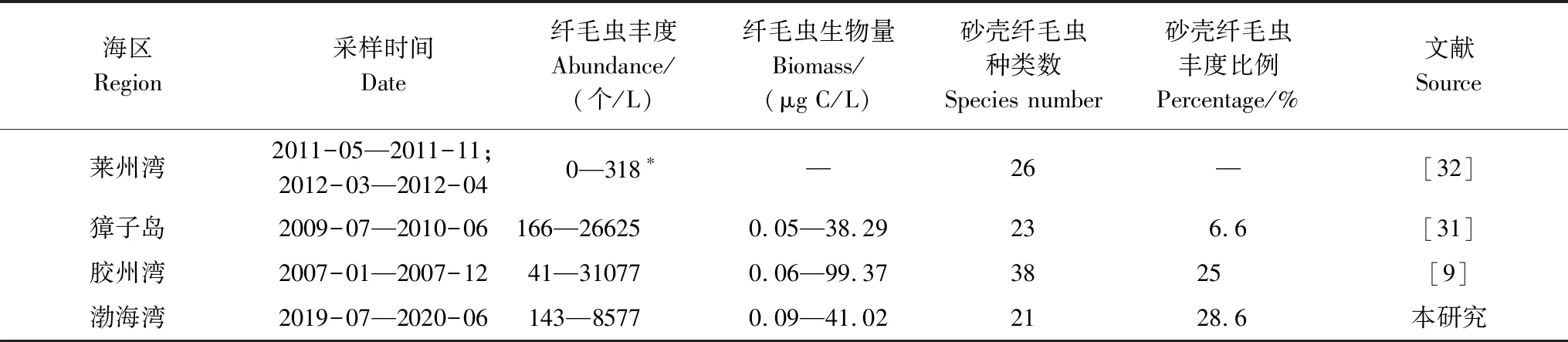
表4 我国海区浮游纤毛虫群落的周年变化数据Table 4 Annual studies of planktonic ciliate communities in China seas
3.1 纤毛虫丰度和生物量的周年变化
本研究中纤毛虫丰度和生物量分别在春季和夏季出现峰值,表现出典型的温带近岸海区的周年变化规律。温带近岸海区如Gdansk Basin[33]、Kaštela Bay[34]、胶州湾[9]等,纤毛虫丰度和生物量通常在春、夏季或者春、秋季呈现双峰型,这可能与饵料水平(Chl a浓度)的周年变化密切相关。与多数研究类似[35—37],渤海湾纤毛虫丰度和生物量与Chl a浓度呈极显著的正相关,其两个峰值与Chl a浓度的峰值基本吻合,稍有滞后,这说明上行控制在渤海湾纤毛虫丰度和生物量周年变化中扮演重要的角色。
渤海湾无壳纤毛虫和砂壳纤毛虫出现峰值的时间存在较大差异,这可能是由于无壳纤毛虫和砂壳纤毛虫在不同营养条件下的竞争力不同导致的。砂壳纤毛虫摄食的饵料粒级较大(多为nano级浮游植物),且由于肉体外具壳需要的饵料更多,因此在寡营养条件下(pico级浮游植物占优)生长能力较低[38];在较高饵料条件下(nano级浮游植物占优),砂壳纤毛虫具有更高的竞争力,丰度往往较高,有时会超过无壳纤毛虫在丰度上占优势[39]。本研究中7月砂壳纤毛虫丰度高达8440 个/L,远超无壳纤毛虫占绝对优势,这可能与7月较高水平的饵料条件(用Chl a浓度指示)有关。
3.2 砂壳纤毛虫种类
渤海湾砂壳纤毛虫各种类只在某些月份出现,不同种群更替有序,砂壳纤毛虫群落组成呈现明显的周年变化。与莱州湾的研究结果[32]不同,本次渤海湾调查中只记录了冬季种、春季种及夏季种,没有发现周年出现种。
本研究中大部分砂壳纤毛虫丰度都偏向在温度较高的夏季较高,值得注意的两种砂壳纤毛虫——波罗的拟铃虫和寇氏拟铃虫,其偏好的水温较低(低于18℃)。波罗的拟铃虫只在水温为17.8 ℃的5月出现,其他月没有记录,这说明波罗的拟铃虫偏好温度适中的环境,在温度较高或较低时不适合生长[40]。寇氏拟铃虫只在温度低于5.2 ℃的2、3月出现,是一种喜低温的砂壳纤毛虫,这与胶州湾的研究结果[41]不同,胶州湾寇氏拟铃虫一般在温度为5—15 ℃时丰度较高。这种差异可能是由于本研究采样站位单一的局限性导致,需要在今后积累更大范围的样品来得出更准确的结论。喜低温砂壳纤毛虫种类的出现可以作为冷水团的指示种,在浮游纤毛虫与物理过程的耦合关系研究中发挥重要的指示作用。
3.3 渤海的新纪录种——三亚类杯虫
本研究在渤海首次纪录到三亚类杯虫(图7),该种类为南方种[42],一般在我国近岸36°N以南海区有发现,如胶州湾[42]、东海[43—44]及南海近岸[45—46],本研究第一次在我国36°N以北海区纪录到三亚类杯虫,且与其它海区相比,渤海湾三亚类杯虫个体稍大(表5)。

图7 三亚类杯虫显微照片Fig.7 Micrograph of Metacylis sanyahensis
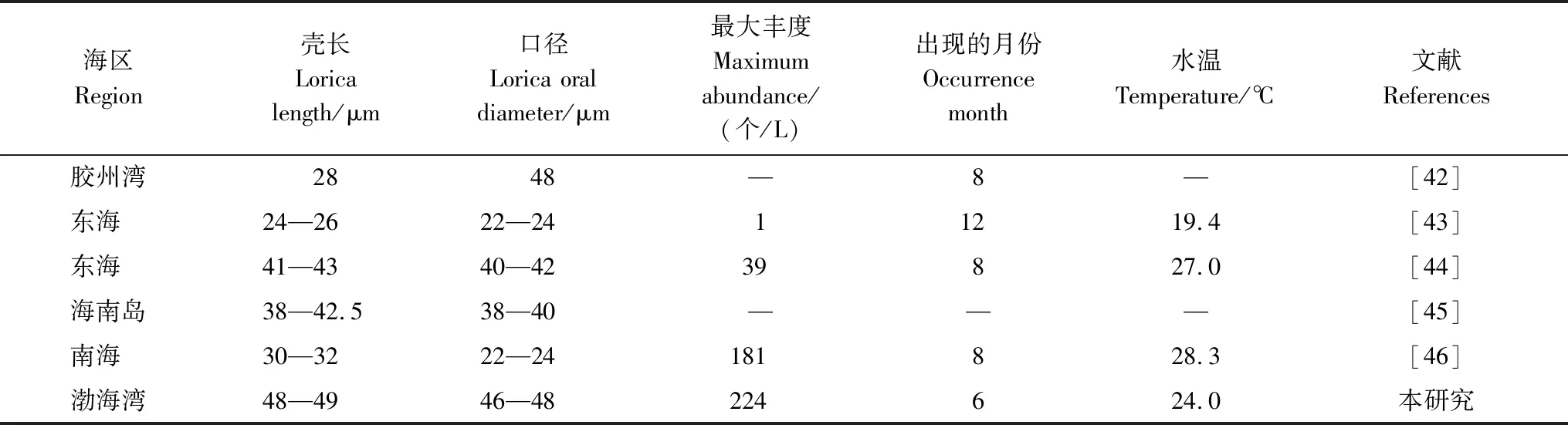
表5 我国海区的三亚类杯虫Table 5 Metacylis sanyahensis in China seas
现有资料表明,三亚类杯虫在我国海区丰度不高,出现频率也较低,一般趋向分布在温度较高的夏季,在其它季节很少观测到。作为喜高温的南方种,三亚类杯虫北移,在渤海湾出现,可能与全球变暖有关,可以作为暖水团的指示种在微型浮游动物与水团的耦合关系研究中发挥重要的指示作用。

