固本防哮饮对幼龄小鼠哮喘缓解期模型IKK/IκB/NF-κB信号途径的调节作用
袁雪晶, 曹建梅, 许慧洁
(南京中医药大学附属医院儿科,江苏南京210029)
固本防哮饮对幼龄小鼠哮喘缓解期模型IKK/IκB/NF-κB信号途径的调节作用
袁雪晶, 曹建梅, 许慧洁
(南京中医药大学附属医院儿科,江苏南京210029)
摘要:目的 观察固本防哮饮对幼龄哮喘缓解期小鼠IKK/IκB/NF-κB信号途径的影响。方法 采用幼龄BALB/c小鼠,鸡卵蛋白腹腔注射和雾化吸入致敏,并多次雾化吸入激发的方法建立幼龄哮喘缓解期小鼠模型。造模成功后给药4周,测小鼠气道阻力、HE染色观察小鼠肺组织病理变化、肺泡灌洗液细胞计数和细胞分类、Western b1ot法检测肺组织和外周血单个核细胞中IκB激酶β(IKKβ)、NF-κB抑制蛋白α(IκBα)、核因子-κB(NF-κB)P65蛋白表达。结果 固本防哮饮可以降低幼龄哮喘缓解期小鼠的气道阻力、降低肺泡灌洗液(BALF)中细胞总数,降低BALF中中性粒细胞和单核细胞比例(P<0.05,P<0.01),改善支气管周围炎性细胞浸润,减轻气道重塑,并能增加肺组织和
关键词:固本防哮饮;哮喘缓解期;气道高反应性;炎性细胞侵润;IKK/IκB/NF-κB通路
dol:10.3969/j.issn.1001-1528.2016.02.038
支气管哮喘是一种炎症细胞、炎症介质以及细胞因子共同参与的慢性气道非特异性炎症性疾患,是儿童时期的多发病、常见病,此病的发病率正逐年上升[1-2]。目前尚无能够根治哮喘的药物,中医药治疗哮喘具有良好疗效[3-4]。固本防哮饮处方是著名儿科专家江育仁教授针对哮喘缓解期治疗的经验方,前期多中心随机对照研究已证实其临床应用能够延长哮喘缓解天数,减少哮喘发作次数,改善患儿生存质量,实验研究也证实其能通过调节机体Th1/Th2细胞的平衡,减轻气道炎症和气道重塑[5-6]。
近来许多研究表明,核因子-κB(nuc1ear factor kaPPaB,NF-κB)通路可介导多种免疫细胞的增殖、分化和炎症因子的产生[7]。这条通路的活化与炎症性的自身免疫性疾病相关,包括支气管哮喘[8]。NF-κB抑制蛋白(inhibitor of nuc1ear factor kaPPa-B,IκB)可以抑制NF-κB的活性[9-10]。IκB激酶家族(the IkaPPaB kinases,IKKs)作为NF-κB信号途径的关键成员,能解除IκB对NF-κB的抑制,激活参与应激反应和免疫细胞活化、增殖、分化、凋亡等多种相关基因转录的调控。
本次研究中我们使用幼龄BALB/c小鼠,采用卵蛋白致敏引起的慢性过敏性气道炎症哮喘模型,观察固本防哮饮对哮喘模型小鼠气道反应性、BALF炎症细胞计数、肺脏组织病理学以及对IKK/IκB/NF-κB信号途径的影响。
1材料与方法
1.1 实验材料
1.1.1 动物 清洁级BALB/c雌性小鼠,3~4周龄,体质量13~20 g,由上海斯莱克实验动物有限公司提供,生产许可证: SCXK(沪)2009-0001。适应饲养3 d。
1.1.2 药物 固本防哮饮由炙黄芪、党参、白术、茯苓、煅牡蛎、蝉蜕、陈皮、防风、辛夷、五味子和生甘草11味药组成,将上述11味药按比例5∶3.3∶3.3∶3.3∶5∶2∶2∶1∶2∶2∶1配伍,然后取8倍量冷水浸药30 min,煎30 min(沸后),滤过;第2煎加6倍量水煎30 min,将2次煎液滤过,合并浓缩调至含生药2 g/mL的溶液,密封于无菌量瓶,4℃储存备用。药物由江苏省中医院药剂科加工制备和质控。
1.2 试剂和仪器
1.2.1 试剂 卵蛋白(OVA)(批号0009006591)、氯化乙酰胆碱(批号137751)、硫酸钾铝(批号1416173)均购自美国Sigma公司;Trizo1(批号15596-026)购自美国Invitrogen公司;PMSF(苯甲基磺酰氟)、AProtinin购自南京生兴生物技术公司;蛋白定量试剂盒(Bio-Rad DC Protein Assay Kit)为Bio-Rad公司产品;GAPDH抗体(批号KC-5G5)购自美国Stanta cruz公司;过氧化物酶标记的山羊抗兔IgG二抗购自美国KPL公司;ECL购自瑞典Amersham公司;IKKβ Antibody(批号2684)、IκBαAntibody(批号9242)、NF-κB P65(C22B4)RabbitmAb(批号4764)购自美国CST公司;三羟甲基氨基甲烷(Tris)(批号2J162J16)、甘氨酸(批号2L262L26)、丙烯酰胺(批号2E252E25)、双丙烯酰胺(批号9F039F03)、十二烷基硫酸钠(SDS)(批号9L212C09)、过硫酸铵(批号0J110J11),以上试剂均购自南京生兴生物技术有限公司;琼脂糖(批号0000190547)购自美国Invitrogen公司;脱脂奶粉(批号2048823)购自美国BD公司。
1.2.2 仪器 动物肺功能体描箱、呼吸机及AniRes 2005软件分析系统均由北京鑫奥成科技有限公司提供;S-888E型超声雾化器由南京道芬电子有限公司生产,配套装置是一个体积约22 cm×22 cm×50 cm的有机玻璃盒;C1iniBio 128D型酶标仪为奥地利ASYS Hitech公司产品;SORVALL低温离心机为德国Biofuge stratos公司产品。JY92-Ⅱ超声波细胞粉碎机为宁波新芝生物科技有限公司产品;Western电泳仪为美国Bio-Rad公司产品;病理石蜡切片机为德国(SLEE)MNT公司产品;医用X光片购自美国Kodak公司;电转仪为美国Bio-Rad公司产品;Power Pac Basic凝胶成像及分析系统为美国Bio-Rad公司产品;垂直平板微电泳槽、直流稳压电泳仪为北京市六一仪器厂产品;
1.3 动物造模方法 幼龄小鼠哮喘缓解期模型建立:参考文献及前期实验方法,略加改进[6,11-12]。采用BALB/c乳鼠,适应性饲养2~3 d后,除正常组外,小鼠予腹腔注射卵蛋白致敏,卵蛋白用硫酸钾铝混合,在第1天和第11天致敏(OVA 100 μg/只),同时第11天雾化吸入卵蛋白(5 mg/m L)30 min致敏,从第19日开始,小鼠放入雾化器的有机玻璃盒中,以卵蛋白(1 mg/mL)雾化吸入30 min激发,每2周为一个激发周期,每个激发周期激发2次,2次激发为连续2日,共完成6个激发周期,第90日为末次激发。对照组小鼠以生理盐水致敏和激发。
1.4 分组和给药 末次激发后第2天,将模型小鼠随机分为4组,即模型组和固本防哮饮6.5、13、26 g(生药)/kg组。受试药物从第90日开始给药,每日灌胃1次,共给药28日。正常组和模型组均以等体积的0.9%的氯化钠溶液灌胃。
1.5 检测指标
1.5.1 气道反应性测定 使用小动物肺功能分析系统测定乙酰胆碱激发的气道高反应性[12-13]。小鼠末次给药24 h后,腹腔注射戊巴比妥钠(40 mg/kg)麻醉,分离气管,剪开一小口,插入一2 mm塑料管,固定插管,连接于动物肺功能仪;用4号头皮针做尾静脉穿刺,并连接含乙酰胆碱的注射器备用;将小鼠置于密闭的体描箱中,按呼吸频率90次/min、潮气量5~6 mL/kg调整呼吸机参数;等小鼠气道压力稳定后,从低剂量逐渐递增尾静脉给予乙酰胆碱(11、33、100、300 μg/mL)0.1 mL;记录每次给予相应剂量的乙酰胆碱后5 s到1 min的数据,利用AniRes 2005分析软件计算最大肺阻力(RL)。
1.5.2 肺泡灌洗液(BALF)中细胞计数 在环状软骨上用血管钳固定气管,其下做横行切口,26G针头置入,固定,用0.4 mL PBS进行肺泡灌洗,每次灌洗后立即回收BALF置于离心管中,计回收率,于4℃储存,2 h内作细胞分离。BALF于1 000×g离心10 min,上清液置-70℃保存。沉淀细胞重悬,吹打均匀后取0.1 mL于血细胞计数台测定细胞总数,取0.2 mL涂片、甲醇固定、Wright's染色的方法计数,至少数200个细胞作细胞分类计数。
1.5.3 肺组织病理学观察 行支气管肺泡灌洗后,打开胸腔,取右侧肺组织4%多聚甲醛固定,酒精脱水,石蜡切片后进行HE染色,光学显微镜下观察气道壁厚度和肺组织的炎性改变等病理变化。取左侧肺组织进行蛋白检测。
1.5.4 小鼠肺组织IKKβ、IκBα、NF-κB P65蛋白检测
采用Western b1ot法检测小鼠肺组织IKKβ、IκBα、NF-κB P65蛋白表达。用10倍体积于组织体积的RIPA裂解液对组织进行匀浆,收集上清液,用BCA法测定蛋白水平,将蛋白统一稀释成3 mg/mL,再加入3×1oading buffer及1/20体积的巯基乙醇,制成蛋白上样液,沸水浴5 min后,-20℃冰箱冻存。用该样品进行Western b1ot检测,点样前均要再沸水浴5 min。取30 μL样品,进行10%聚丙烯酰胺凝胶电泳。待分离胶凝集后,配制5%浓缩胶。倒入5%浓缩胶后,插入预先准备好的梳子。待胶凝集好后,上样,进行电泳分离蛋白,上层胶用85 V电压电泳,当样品至分离胶时,改用130 V电压电泳。一般电泳时间在1.5 h左右。然后将蛋白质从凝胶转至PVDF膜上,半干法转膜。PVDF膜在5%的Mi1k(TBST溶解)封闭液中室温摇动2 h。按相应比例稀释好相应抗体,将稀释好的抗体和膜一起孵育,4℃冰箱过夜。用TBST(Tris盐缓冲液含0.05% Tween-20)洗一抗,洗涤3次,每次5 min。孵育相应二抗(按1∶5 000,用TBST溶解)3 h(摇床)。用TBST洗二抗,洗涤3次,每次5 min。将ECL的A和B两种试剂吸出,在EP管内等体积混合,然后均匀滴在PVDF膜的蛋白面,反应1~2 min后,将PVDF膜上多余的ECL工作液吸干,之后转移到在X片夹中预先铺好的保鲜膜上一侧,把另一侧翻过来盖在其上。根据信号的强弱适当调整曝光时间,然后显影、定影,扫描胶片,分析结果。
1.5.5 小鼠外周血单个核细胞中IKKβ、IκBα、NF-κB P65蛋白检测 小鼠眼眶取血,肝素抗凝,离心分离血浆后,将全血用Hank's液倍比稀释,采用Fico11密度梯度离心法分离外周血单个核细胞。将稀释后的全血缓慢叠加于分离液上,保持液体界面清晰,水平离心(2 000 r/min)20 min,吸取中间白色单个核细胞层,Hank's液洗涤2次,用Hank's液重悬,台酚蓝染色计数,使细胞计数为1× 106/mL。超声破碎细胞,提取总蛋白,用Western b1ot法测定外周血单个核细胞IKKβ、IκBα、NF-κB P65蛋白水平(方法同“1.5.4”项)。
2 统计学方法
实验数据运用SPSS 17.0软件进行统计分析,统计描述采用均数±标准差表示,统计推断进行单因素方差分析,并运用LSD法进行两两比较,P<0.05认为具有显著性差异。
3 结果
3.1 对幼龄哮喘缓解期小鼠气道反应性的影响 肺功能检测结果显示各组小鼠的肺阻力(RL)基础值无明显差异。氯化乙酰胆碱激发后模型组气道阻力显著高于正常对照组,固本防哮饮可以剂量依赖性降低氯化乙酰胆碱激发后小鼠肺阻力(RL)(P<0.05,P<0.01),降低气道反应性。结果见表1。
表1 固本防哮饮对幼龄哮喘缓解期小鼠气道反应性(RL)的影响[±s,n=5,cmH20/(mL·s),1 cmH20=0.1 k Pa]

表1 固本防哮饮对幼龄哮喘缓解期小鼠气道反应性(RL)的影响[±s,n=5,cmH20/(mL·s),1 cmH20=0.1 k Pa]
注:与模型组比较,*P<0.05,**P<0.01
11 33 100 300正常对照组 — 1.48±0.46 1.80±0.42* 2.31±1.10** 3.05±2.61** 3.78±2.92**模型组 — 1.42±0.72 6.69±4.29 13.43±6.47 16.85±5.49 19.80±4.21固本防哮饮低剂量组 6.5 1.48±0.39 3.29±1.36 5.59±1.83* 9.87±2.68* 13.56±2.85*固本防哮饮中剂量组 13 1.33±0.37 2.57±1.63 2.98±1.40** 6.33±4.00** 10.61±3.52**固本防哮饮高剂量组 26 1.34±0.31 2.07±0.62* 2.53±0.37** 3.33±1.11** 5.84±2.19组别 剂量/ (g·kg-1)乙酰胆碱/(μg·mL-1)0 **
3.2 对幼龄哮喘缓解期小鼠BALF细胞计数和细胞分类的影响 模型组小鼠细胞计数显著高于正常对照组,且细胞分类计数中,嗜酸性粒细胞、中性粒细胞和单核细胞也显著高于正常对照组(P<0.05)。固本防哮饮可以降低BALF中细胞总数和中性粒细胞、单核细胞百分率(P<0.05,P<0.01),提示给予固本防哮饮后,可以减轻模型小鼠的炎性细胞浸润。结果见表2。
3.3 对幼龄哮喘缓解期小鼠肺组织病理改变的影响 对照组小鼠肺脏未见炎细胞浸润,支气管壁完整,黏膜未见充血水肿,管壁和平滑肌厚度正常;而模型组小鼠肺脏可见气道上皮不完整,气道黏膜水肿明显及平滑肌增生、增厚,周围见有大量炎性细胞浸润,以中性粒细胞和嗜酸性粒细胞为主。给予固本防哮饮后,小鼠肺脏病理改变显著改善,气道黏膜水肿明显减轻,平滑肌厚度显著减小,炎性细胞浸润也显著减轻,表明固本防哮饮可以改善哮喘小鼠的气道病理进展。结果见图1。
表2 固本防哮饮对幼龄哮喘缓解期小鼠BA L F细胞计数以及细胞分类的影响(±s,n=5)
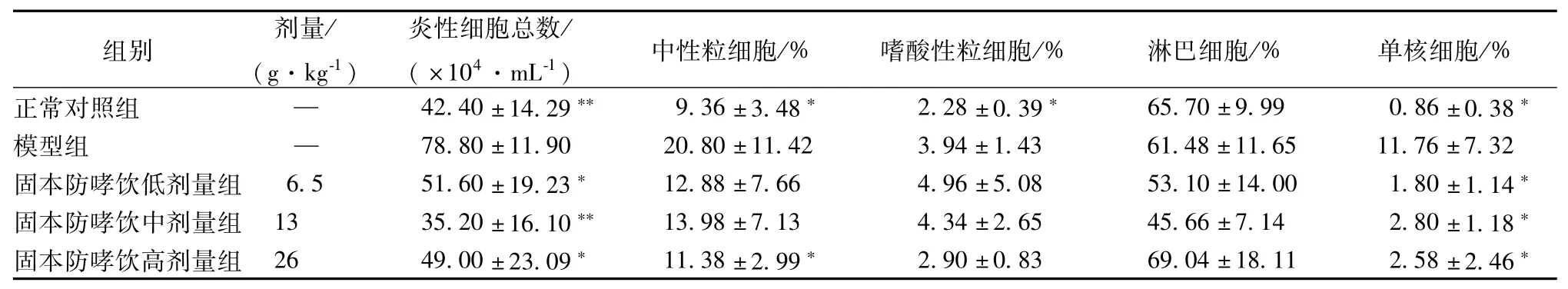
表2 固本防哮饮对幼龄哮喘缓解期小鼠BA L F细胞计数以及细胞分类的影响(±s,n=5)
注:与模型组比较,*P<0.05,**P<0.01
组别 剂量/ (g·kg-1)炎性细胞总数/ (×104·mL-1) 中性粒细胞/% 嗜酸性粒细胞/% 淋巴细胞/% 单核细胞/%正常对照组 — 42.40±14.29** 9.36±3.48* 2.28±0.39* 65.70±9.99 0.86±0.38*模型组 — 78.80±11.90 20.80±11.42 3.94±1.43 61.48±11.65 11.76±7.32固本防哮饮低剂量组 6.5 51.60±19.23* 12.88±7.66 4.96±5.08 53.10±14.00 1.80±1.14*固本防哮饮中剂量组 13 35.20±16.10** 13.98±7.13 4.34±2.65 45.66±7.14 2.80±1.18*固本防哮饮高剂量组 26 49.00±23.09* 11.38±2.99* 2.90±0.83 69.04±18.11 2.58±2.46*

图1 各组小鼠肺组织HE染色病理图片(×2 0 0)
3.4 对幼龄哮喘缓解期小鼠肺IKKβ、IκBα、NF-κB P65蛋白表达的影响 采用Western b1ot法对各组IKKβ、IκBα、NF-κB P65(C22B4)蛋白表达检测,结果发现,在相对分子质量为87、39、65、36 kDa区域分布出现目的条带,分别是IKKβ、IκBα、NF-κB P65(C22B4)和内参GAPDH(见图2)。

1.正常对照组 2.模型组 3固本防哮饮低剂量组4.固本防哮饮中剂量组 5.固本防哮饮高剂量组图2 各组肺组织IKKβ、IκBα、NF-κBp 6 5 (C22B4)蛋白表达
通过对目的条带的定量分析,模型组和正常对照组比较IKKβ、NF-κB P65(C22B4)表达均明显增高(P<0.05),IκBα表达显著降低(P<0.01)。给药后与模型组比较,固本防哮饮中、高剂量组IKKβ表达显著降低(P<0.05);固本防哮饮各剂量组NF-κB P65(C22B4)表达均显著降低,其中固本防哮饮中、高剂量组降低更为明显(P<0.01);而固本防哮饮中、高剂量组IκBα表达量增加(P<0.05)。结果见表3。
3.5对幼龄哮喘缓解期小鼠外周血单个核细胞中IKKβ、IκBα、NF-κB P65 (C22B4)蛋白表达的影响 采用Western b1ot法对各组IKKβ、IκBα、NF-κB P65(C22B4)蛋白表达检测,结果发现,在相对分子质量为87、39、65、36 kDa区域分布出现目的条带,分别是IKKβ、IκBα、NF-κB P65
(C22B4)和内参GAPDH(见图3)。
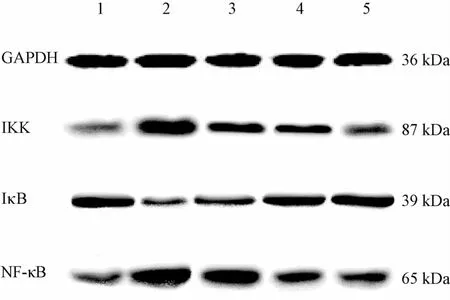
1.正常对照组 2.模型组 3.固本防哮饮低剂量组4.固本防哮饮中剂量组 5.固本防哮饮高剂量组图3 各组外周血单个核细胞中I KKβ、IκBα、NF-κB p65(C22B4)蛋白表达
通过对目的条带的定量分析,模型组和正常对照组比较IKKβ、NF-κB P65(C22B4)表达均明显增高(P<0.01),IκBα表达显著降低(P<0.05)。给药后与模型组比较,固本防哮饮低、中、高3个剂量组IKKβ表达显著降低(P<0.01);固本防哮饮中、高剂量组NF-κB P65 (C22B4)表达显著降低(P<0.05);而固本防哮饮高剂量组IκBα表达量显著增加(P<0.05)。结果见表4。
4 讨论
为了制备一种更符合儿童哮喘特点的哮喘模型来开展研究,此次试验选用幼龄小鼠造模,建立幼龄小鼠哮喘缓解期模型。目前哮喘发病机制尚未完全明了,气道慢性炎症以及炎症导致的气道高反应性和气道重塑是哮喘的基本病理特征[13-14]。本次实验肺功能分析结果显示,模型小鼠气道阻力显著高于正常对照组,而固本防哮饮可以降低小鼠气道RL值,降低模型小鼠的气道高反应性。模型小鼠的BALF中炎性细胞总数明显升高,细胞分类计数中以嗜酸性粒细胞、中性粒细胞和单核细胞比例升高为主,表明哮喘缓解期小鼠气道炎症仍然存在,固本防哮饮可以降低模型小鼠BALF中炎性细胞总数,降低中性粒细胞和单核细胞百分率,来减轻气道慢性炎症。肺脏病理学观察表明模型组小鼠气道壁炎性浸润并存在明显增生,而固本防哮饮可以显著减轻肺脏支气管壁周围炎性浸润和气道壁增生、增厚,改善气道重塑。
表3 固本防哮饮对幼龄哮喘缓解期小鼠肺组织中IKKβ、IκBα、NF-κBp 6 5(C 2 2 B 4)相对光密度值的影响(±s,n=5)
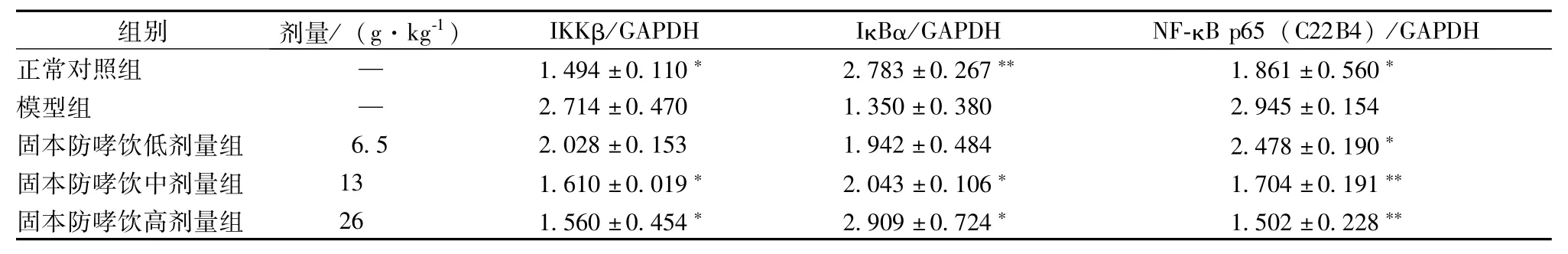
表3 固本防哮饮对幼龄哮喘缓解期小鼠肺组织中IKKβ、IκBα、NF-κBp 6 5(C 2 2 B 4)相对光密度值的影响(±s,n=5)
注:与模型组比较,*P<0.05,**P<0.01
组别 剂量/(g·kg-1) IKKβ/GAPDH IκBα/GAPDH NF-κB P65(C22B4)/GAPDH正常对照组模型组固本防哮饮低剂量组固本防哮饮中剂量组固本防哮饮高剂量组—1.494±0.110* 2.783±0.267** 1.861±0.560*2.714±0.470 1.350±0.380 2.945±0.154 6.5 2.028±0.153 1.942±0.484 2.478±0.190*13 1.610±0.019* 2.043±0.106* 1.704±0.191**26 1.560±0.454* 2.909±0.724* 1.502±0.228 —**
表4 固本防哮饮对幼龄哮喘缓解期小鼠外周血单个核细胞中I KKβ、IκBα、NF-κB p 6 5(C 2 2 B 4)相对光密度值的影响(±s,n=5)

表4 固本防哮饮对幼龄哮喘缓解期小鼠外周血单个核细胞中I KKβ、IκBα、NF-κB p 6 5(C 2 2 B 4)相对光密度值的影响(±s,n=5)
注:与模型组比较,*P<0.05,**P<0.01
组别 剂量/(g·kg-1) IKKβ/GAPDH IκBα/GAPDH NF-κB P65/GAPDH正常对照组模型组固本防哮饮低剂量组固本防哮饮中剂量组固本防哮饮高剂量组0.509±0.035** 1.070±0.107* 0.423±0.114**—1.123±0.067 0.603±0.186 1.242±0.270 6.5 0.807±0.073** 0.706±0.103 1.001±0.248 13 0.733±0.084** 0.890±0.271 0.758±0.125*26 0.626±0.036** 1.113±0.163* 0.533±0.154 —*
NF-κB通路在控制宿主免疫、炎症反应和调控细胞增殖、生存的基因表达中发挥重要作用,是已知最重要、最万能的信号网代表之一。在哺乳动物中,NF-κB家族包含五个相应成员: Re1(也称为c-Re1)、Re1A(也称为P65)、Re1B、P50(编码的NF-κB1基因)和P52(编码的NF-κB2基因)。这些蛋白相互作用形成具有转录活性的二聚体或异质二聚体家族。这五个蛋白都有Re1同源域(RHD),在二聚作用和DNA捆绑中发挥作用。RHD羧基端有一个核定位序列(NLS),转录激活功能就是由NF-κB蛋白羧基端露出RHD介导的[15]。
IκB能够控制NF-κB信号途径。目前发现IκBs家族有9个成员: IκBα、IκBβ、IκBε、IκBζ、bc1-3、IκBNS、P100、P105和新近发现的IκBη。不同IκB蛋白与不同的NF-κB亚基结合,发挥不同的生理功能[15-17]。IκBα主要介导NF-κB的基础抑制,是IκB家族中降解速度最快,抑制NF-κB活性的最重要成分[18-19]。静息细胞的细胞质中NF-κB(通常是P65与P50异质二聚体)与IκBα组成复合体。NF-κB与IκB在细胞中的平衡状态会被细胞外的快速特异性的信号打破。IκBs有一个锚蛋白重复序列域(ARD),是由6到7个锚蛋白重复序列组成的,能够捆绑到P65的RHD,掩盖NLS。NF-κB激活有两方面:通过蛋白媒体的信号依赖的磷酸化和泛素依赖的IκBα降解及降解后的以细胞核为靶目标的NF-κB P65 NLS释放。除了IκBα介导的NF-κB同源DNA位点的剥夺,这个过程的许多方面依赖于所有涉及蛋白的折叠状态的改变来改变转录。经典IκB家族,像IκBα典型蛋白,通过掩盖NF-κBNLS,使他们的转录因子在细胞质中被隔绝,从而抑制NF-κB与DNA的结合。NLS可接近性受IκBα降解控制,一旦NLS可接近,NF-κB转录因子进入细胞核与DNA结合,发挥调控他们各自靶基因的转录的作用[15,19]。
IKK复合体是NF-κB活化作用的信号整合中心,由两个丝氨酸-苏氨酸激酶(IKKαand IKKβ)和调节亚单位NEMO(又称为IKKγ)组成。IKK复合体整合来自所有NF-κB活化刺激信号,并催化各种各样的IκB和NF-κB蛋白的磷酸化[20]。尽管IKKα和IKKβ在结构和生化方面有相似之处,但是他们有不同的亚细胞位点和磷酸化靶点,因而表现不同的生理病理学作用。IKKβ主要存在于细胞质,IKKα在细胞质和细胞核之间穿梭[21]。IKKβ的作用靶点是IκB两个邻近丝氨酸残基,导致IκB的泛素化和蛋白降解,随后释放和激活NF-κB。炎症因子IL-1、TNFα、内毒素(脂多糖)、病毒感染、双链RNA以及物理信号如紫外线辐射等刺激会导致IKKβ活化和随后的NF-κB信号途径的激活[22-23]。
实验中我们采用肺组织和外周血两方面来研究哮喘和药物对IKK/IκB/NF-κB信号通路所产生的影响,分别反映哮喘及固本防哮饮对机体局部和整体免疫功能的作用。在幼龄哮喘缓解期小鼠肺组织中IκBα表达显著降低(P<0.01),IKKβ、NF-κB P65(C22B4)表达均明显增高(P<0.05),固本防哮饮能够增加IκBα表达量,降低IKKβ、NF-κB P65 (C22B4)的表达,尤其是中高剂量组作用显著(P<0.05,P<0.01)。在外周血单个核细胞中,IκBα表达也显著降低(P<0.05),IKKβ、NF-κB P65(C22B4)表达均明显增高(P<0.01),固本防哮饮高剂量组能显著增加IκBα表达量(P<0.05),而固本防哮饮各剂量组均能显著降低IKKβ的表达(P<0.01);中高剂量组能显著降低NF-κB P65 (C22B4)的表达(P<0.05)。提示幼龄哮喘缓解期小鼠模型中存在IKK/IκB/NF-κB信号通路功能异常,中药效方固本防哮饮治疗哮喘可能的机制是通过调控IKK/IκB/NF-κB信号通路来实现的,即增加IκBα的表达,并抑制IKK、NF-κB的表达和转录来发挥其抗炎和调节免疫的作用。
参考文献:
[1] 张晓非,夏英鹏.支气管哮喘发病机制研究进展[J].中国煤炭工业医学杂志,2010,13(8): 1251-1254.
[2] Gui1bert TW,Morgan W J,Zeiger R S,etal.Long-term inha1ed corticosteroids in Preschoo1chi1dren athigh risk for asthma [J].N Engl JMed,2006,354(19): 1985-1997.
[3] 梁亚浩,张黎雯,汪 毅,等.GINA方案加中药贴敷治疗哮喘患儿328例的临床观察[J].中国中西医结合杂志,2013,33(10): 1424-1426.
[4] 林 英,王 波,罗先琼.黄芪预防儿童哮喘复发的临床研究[J].中国中西医结合杂志,2011,(8):1090-1092.
[5] 袁雪晶,孙轶秋,王素梅,等.固本防哮饮联合穴位敷贴治疗儿童哮喘缓解期100例临床研究[J].中华中医药杂志,2010,25(12): 2306-2308.
[6] 袁雪晶,夏 晨,汪受传.固本防哮饮对哮喘缓解期小鼠的治疗作用[J].中药新药与临床药理,2010,21(3): 257-260.
[7] Hayden M S,Ghosh S.NF-κB in immunobio1ogy[J].Cell Res,2011,21(2): 223-244.
[8] Yamamoto Y,Gaynor R B.IkaPPaB kinases: key regu1ators of the NF-kaPPaB Pathway[J].Trends Biochem Sci,2004,29 (2): 72-79.
[9] Yadav V R,Prasad S,Sung B,etal.The Ro1e of cha1cones insuPPression of NF-κB-mediated inf1ammation and cancer[J]. Int ImmunoPharmacol,2011,11(3): 295-309.
[10] Ghosh S,Hayden M S.Ce1ebrating 25 years of NF-κB research [J].Immunol Rev,2012,246(1): 5-13.
[11] Forsythe P,Inman M D,Bienenstock J.Ora1 treatment with 1ive Lactobaci11us reuteri inhibits the a11ergic airway resPonse in mice[J].Am JResPir Crit CareMed,2007,175(6): 561-569.
[12] 袁雪晶.固本防哮饮治疗儿童哮喘缓解期肺脾气虚证的临床和实验研究[D].南京:南京中医药大学,2010.
[13] 戴 建,殷凯生,孙培莉.咪喹莫特对哮喘小鼠气道反应性及气道重塑的影响[J].南京医科大学学报:自然科学版,2009,29(1): 50-54.
[14] 王雅娟,朱慧志,孔献春,等.川芎嗪改善哮喘大鼠气道高反应性的作用观察[J].中成药,2014,36(4): 834-837.
[15] Dyson H J,Komives E A.Ro1e of disorder in IκB-NFκB interaction[J].IUBMB life,2012,64(6): 499-505.
[16] Zheng C,Yin Q,Wu H.Structura1studies of NF-κB signa1ing [J].Cell Res,2011,21(1): 183-195.
[17] Hinz M,Ars1an S Ç,Scheidereit C.It takes two to tango: IκBs,the mu1tifunctiona1 Partners of NF-κB[J].Immunol Rev,2012,246(1): 59-76.
[18] Kanarek N,Ben-Neriah Y.Regu1ation of NF-κB by ubiquitination and degradation of the IκBs[J].Immunol Rev,2012,246(1): 77-94.
[19] Schuster M,Annemann M,P1aza-Sirvent C,et al.AtyPica1 IκB Proteins-nuc1earmodu1ators of NF-κB signa1ing[J].Cell Commun Signal,2013,11(1): 23.
[20] Hinz M,Scheidereit C.The IkaPPaB kinase comP1ex in NF-kaPPaB regu1ation and beyond[J].EMBO RePorts,2014,15 (1): 46-61.
[21] Huang W C,Hung M C.Beyond NF-κB activation: nuc1ear functions of IκB kinaseα[J].J Biomed Sci,2013,20 (1): 3.
[22] Schmid JA,Birbach A.IkaPPaB kinase beta(IKKbeta/IKK2/ IKBKB)—a keymo1ecu1e in signa1ing to the transcriPtion factor NF-kaPPaB[J].Cytokine Growth Factor Rev,2008,19 (2): 157-165.
[23] Lee H J,Seo H S,Kim G J.Houttuynia cordata Thunb inhibits the Production of inf1ammatory cytokines through inhibition of the NFκB signa1ing Pathway in HMC1 human mast ce11s[J]. Mol Med ReP,2013,8(3): 731-736.
中图分类号:R285.5
文献标志码:B
文章编号:1001-1528(2016)02-0409-06
作者简介:袁雪晶(1976—),女,副教授,副主任医师,博士,主要从事儿童呼吸系统和免疫相关性疾病的研究。Te1: 13913893416,E-mai1: yuanxuejing2007@126.combook=410,ebook=188外周血单个核细胞中IκBα表达量(P<0.01,P<0.05),降低肺组织和外周血单个核细胞中IKKβ(P<0.05,P<0.01)、NF-κB P65(P<0.01,P<0.05)的高表达。结论 固本防哮饮降低气道高反应性,减轻支气管炎性细胞浸润以及调节机体IKK/IκB/NF-κB信号通路的功能失调可能是其防止哮喘复发的作用机制。
基金项目:国家自然科学基金-青年基金(81102615);江苏省科技厅-自然基金项目(BK2011868);康缘中医药科技创新基金项目(HZ1008KY)
收稿日期:2014-09-25

