百里醌调控M 2型巨噬细胞表型极化的机制研究
徐 元, 谭 希, 王原来, 谢思楠, 章丹丹
(上海中医药大学穆拉德中药现代化研究中心,上海201203)
百里醌调控M 2型巨噬细胞表型极化的机制研究
徐 元, 谭 希, 王原来, 谢思楠, 章丹丹*
(上海中医药大学穆拉德中药现代化研究中心,上海201203)
摘要:目的 考察黑种草子中的活性成分百里醌(thymoquinone)对M2型巨噬细胞极化的调控机制。方法 利用白介素4(IL-4)诱导鼠源巨噬细胞为M2型巨噬细胞模型;MTT法观察百里醌对细胞活力的影响;Trans-we11小室迁移实验考察巨噬细胞造模前后自身迁移力的变化、对乳腺癌4T1细胞的迁移能力变化及百里醌干预的影响;qRT-PCR法考察百里醌对M2型巨噬细胞内精氨酸酶1(Arg1)、诱导型一氧化氮合酶(iNOS)mRNA的影响;Western b1ot法考察百里醌对细胞内ARG1、iNOS蛋白及信号传导与转录激活因子6(STAT6)信号通路的影响。结果 百里醌不仅抑制巨噬细胞向M2表型极化后自身迁移力的提高,也抑制M2型巨噬细胞促进乳腺癌4T1细胞的体外迁移加剧。百里醌呈剂量依赖性抑制Arg1同时提高iNOS的表达,降低STAT6蛋白的磷酸化水平。结论 百里醌逆转巨噬细胞M2表型极化,部分通过抑制IL-4/STAT6信号通路的活化,调控Arg1/iNOS的表达消长而干预M2表型极化进程中巨噬细胞自身及其促乳腺癌细胞的体外迁移加速。
关键词:黑种草子;百里醌;巨噬细胞;表型极化;精氨酸酶1(Arg1);诱导型一氧化氮合酶(iNOS);信号传导与转录激活因子6(STAT6);作用机制
dol:10.3969/j.issn.1001-1528.2016.02.002
KEY W 0RDS: Semen Nigellae;thymoquinone;macroPhage;PhenotyPe Po1arization;arginase 1(Arg1);inducib1e nitric oxide synthase(iNOS);STAT6;mechanism
肿瘤相关性炎症(cancer re1ated inf1ammation,CRI)是肿瘤的第7新特征[1],肿瘤相关巨噬细胞(tumor associated macroPhages,TAM)是联系肿瘤和炎症的关键细胞,也是CRI的主要效应细胞[2]。在肿瘤微环境中,肿瘤细胞释放趋化因子、细胞因子等信号,将巨噬细胞招募并诱导其向M2表型发生替代性活化,成为TAM,发挥其促进肿瘤转移、侵袭和免疫逃逸的作用,其数量高低与多种肿瘤预后呈负相关[3]。寻找中药来源的巨噬细胞表型调控剂,逆转M2表型以破除肿瘤微环境中的免疫抑制状态,预防肿瘤免疫逃逸和转移,并重启巨噬细胞M1表型的抗肿瘤功能,是肿瘤免疫治疗中的热点领域[4]。
黑种草子(Semen Nige11ae)为毛茛科植物瘤果黑种草(Nigella glandulifera Freyn et Sint.)的干燥成熟种子,为维吾尔族药食同源的习用药。其性味甘、辛、温,有补肾健脑、通经、通乳、利尿之功效[5]。现代药理研究发现其具有抗肿瘤、镇咳、镇痛、抗炎、抗氧化、抗血小板聚集、抗菌等功效。我们前期对黑种草子不同组分进行初步研究[6],发现总皂苷具有抗炎活性[7],总黄酮可抑制乳腺癌4T1细胞增殖[8]。百里醌(thymoquinone,TQ)是黑种草子挥发油中的活性成分,具有抗肿瘤增殖和转移等作用[9],但对其调控M2型巨噬细胞极化的研究尚未见报道。本研究考察百里醌对M2型巨噬细胞表型极化的影响及其相关机制。
1 材料
1.1 药物与试剂 百里醌购自梯希爱(上海)化成工业发展有限公司,纯度为99.6%;小鼠巨噬细胞株RAW264.7,乳腺癌4T1细胞购自美国ATCC公司;鼠源IL-4购自美国PeProtech公司;胎牛血清购自美国HyC1one公司;RPMI-1640培养基干粉购自美国Gibco公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)、Trizo1RNA提取试剂、High-CaPacity cDNA Reverse TranscriPtion Kits购自美国Life Techno1ogies公司;Rea1MasterMix SYBR Green试剂盒购自美国罗氏;硝酸纤维素(NC)膜购自美国Whatman公司;预染蛋白Marker购自美国Progema公司;iNOS、ARG 1抗体购自美国Abcam公司;P-STAT6、T-STAT6、β-Actin购自美国Ce11 Signa1ing Techno1ogy公司;相应二抗购自美国Santa Cruz公司;ECL检测试剂购自美国GE公司;RIPA裂解液、BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司;引物由上海生物工程服务有限公司合成,其他试剂均为分析纯。
1.2 仪器 CO2培养箱(HEPA CLASS100,美国Thermo公司);生物安全柜(De1ta series,Labconco,美国);低温高速离心机(EPPendorf Centrifuge 5810R,德国);倒置显微镜(IX 71,O1ymPus,日本);SPectra MAX190酶标仪(美国MD公司);QB-9006恒温微孔板快速振荡器(海门市其林贝尔仪器有限公司);细胞计数仪(XDS-500C,上海蔡康光学仪器有限公司);荧光定量PCR仪(7500 Fast System,美国APP1ied biosystems公司);电泳仪(PowerPacTMHC,美国BIO-RAD公司);凝胶成像系统(Tanon NIM2045,上海天能科技有限公司)。
2 实验方法
2.1 细胞培养 RAW264.7细胞株和乳腺癌4T1细胞株均培养于含10%的胎牛血清的RPMI 1640培养基中,置于保持饱和湿度、5% CO2培养箱中,在37℃恒温的条件下培养。待细胞长至7~8成密度进行传代,PBS清洗2次后,用0.25%的胰酶(含0.02%的EDTA)消化,加入含血清培养基终止消化,吹打并收集细胞悬液,800 r/min室温离心3 min。加入含血清培养基吹打混匀细胞,按1∶3~1∶6的比例传代培养。取10~15代的细胞用于实验。
2.2 MTT法考察百里醌对细胞活力的影响 巨噬细胞悬液以每孔1×104/100 μL接种于96孔板,培养过夜。百里醌采用12.5、25、50 μmo1/L剂量处理细胞。刺激维持24 h后,加入MTT(用PBS溶解为5 g/L)溶液20 μL,继续37℃培养4 h,加入DMSO后置摇床上使其充分溶解摇匀后,用酶标仪读取490 nm光吸收值A,计算百里醌各剂量处理组对细胞活力的影响。各处理组设置3孔重复,独立实验重复3次。各处理组的细胞活力以空白对照组为100%进行换算。
2.3 Trans-we11小室迁移法考察M2型巨噬细胞造模前后的迁移能力变化及百里醌干预的影响 收集处于细胞对数期的巨噬细胞,用无血清培养基调整细胞密度为1×106/mL,取细胞悬液与百里醌混合液100 μL,终浓度为10、20 μmo1/L,加入Transwe11小室上室,模型组和给药组的24孔板下室加入IL-4,终质量浓度为60 ng/mL,迁移24 h。Trans-we11小室用多聚甲醛固定30 min,0.1%结晶紫染色30 min,用水小心冲洗,用棉签轻轻擦掉上层未迁移细胞。400倍显微镜下随机选取5个视野观察细胞,记数。独立实验重复3次。
2.4 Trans-we11小室迁移实验考察M2型巨噬细胞对4T1迁移能力变化及百里醌干预的影响 收集处于细胞对数期的巨噬细胞,用10% FBS培养基调整细胞密度为1×106/mL,24孔板下室加入细胞悬液500 μL,培养过夜,第2天换无血清培养基,百里醌(10、20 μmo1/L)预处理1 h后,加入终质量浓度为60 ng/mL的IL-4造模6 h,随后在Trans-we11小室上室加入无血清培养基调整的细胞密度为1×106/mL的4T1细胞,体积均为100 μL,迁移24 h。迁移24 h后取出Trans-we11小室,用多聚甲醛固定30 min,结晶紫染色30 min,用水冲洗,用棉签小心擦除上层未迁移细胞。400倍显微镜下随机5个视野观察细胞并计数。独立实验重复3次。
2.5 qRT-PCR考察百里醌对M2型巨噬细胞中基因表达的影响 RAW264.7细胞培养于30 mm细胞培养皿中,待贴壁后无血清处理16 h,百里醌(10、20 μmo1/L)预处理1 h,与60 ng/mL终质量浓度的IL-4共孵育6 h后,收集各组样品提取RNA,根据260 nm吸收值计算出RNA水平,加水调整各组样品RNA至0.5 μg/μL。所用RNA的A260/A280均在1.8~2.0之间。逆转录合成模板cDNA后,应用7500 Fast Rea1-Time PCR扩增仪进行PCR聚合酶链式反应。PCR反应条件: 95℃×10 min;50℃×2 min;95℃×15 s,60℃×60 s,40个循环。引物序列如下: Arg1正向为5'-CAGAAGAATGGAAGAGTCAG-3 ',反向为5 '-CAG ATATGCAGGGAGTCACC-3';iNOS正向为5 '-GGAGCGAGTTGTGGATTGTC-3',反向为5 '-GTGAGGGCTTGGCTGAGTGAG-3';GaPdh正向为5'-AGGTCGGTGTGAACGGATTTG-3';反向为5'-TGTAGACCATGTAGTTGAGGTCA-3'。独立实验重复3次。
2.6 Western b1ot法考察百里醌对M2型巨噬细胞中蛋白表达的影响 RAW264.7细胞培养于30 mm细胞培养皿中,待贴壁后无血清处理16 h,百里醌两个剂量预处理1 h后,用60 ng/mL的IL-4共同作用6 h或30 min后,用冰PBS洗涤,加入蛋白酶抑制剂和磷酸酶抑制剂后收集细胞,超声破碎,离心(12 000 r/min,15 min,4℃),取蛋白上清液进行蛋白含量测定。每孔加入35 μg的蛋白上样,在SDS-PAGE凝胶中电泳,蛋白转移到NC膜上,脱脂牛奶或牛血清白蛋白(BSA)封闭,分别用一抗iNOS、ARG1、P-STAT6、T-STAT和β-Actin孵育过夜,经洗膜、二抗孵育、洗膜后,最后ECL显影。独立实验重复3次。
3实验结果
3.1 MTT法考察百里醌对M0型巨噬细胞活力的影响 如图1所示,百里醌在12.5~50 μmo1/L剂量对静息态M0型巨噬细胞的细胞活力没有影响,即不具有细胞毒性。
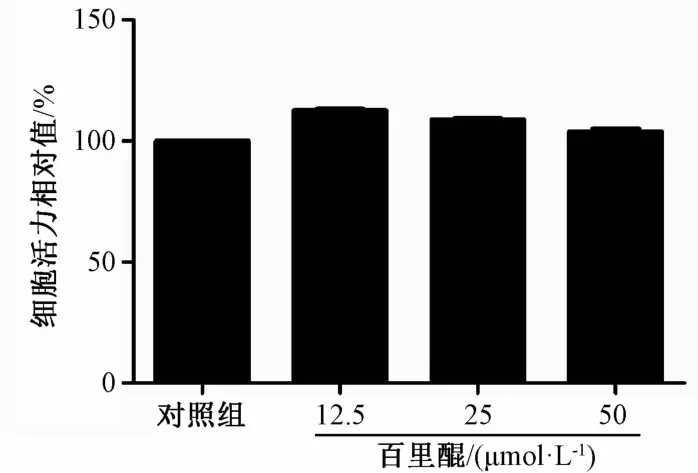
图1 百里醌对静息巨噬细胞活力的影响(n=3)Flg.1 Effects of TQ on restlng macrophage vlablllty (n=3)
3.2 Trans-we11小室迁移法考察M2型巨噬细胞造模前后的迁移能力变化及百里醌干预的影响 如图2所示,利用IL-4造模后,巨噬细胞迁移能力显著性提高(P<0.01)。与模型组相比,百里醌呈剂量依赖性降低巨噬细胞诱导为M2表型后提高的体外迁移数量(P<0.01)。
3.3 Trans-we11小室迁移法考察M2型巨噬细胞对乳腺癌4T1细胞的迁移力变化及百里醌干预的影响 如图3所示,IL-4造模后的M2型巨噬细胞显著性提高乳腺癌4T1细胞的体外迁移能力(P<0.01)。百里醌呈剂量依赖性降低M2型巨噬细胞对乳腺癌4T1细胞的迁移能力的提升(P<0.01)。

图2 M 2型巨噬细胞造模前后的迁移能力变化及百里醌干预的影响(n=3)Flg.2 M lgratlon capablllty of M 2 macrophages and the lnterventlon of TQ(n=3)

图3 M 2型巨噬细胞促乳腺癌4 T 1细胞的体外迁移及百里醌干预的影响(n=3)Flg.3 M lgratlon capablllty of 4T1 breast cancer cellsw lth M 2 macrophages and the lnterventlon of TQ(n=3)
3.4 百里醌对M2型巨噬细胞中Arg1和iNOS mRNA表达的影响 在M0型即静息态巨噬细胞中,Arg1在基因水平低表达。经IL-4(60 ng/mL)诱导6 h后,Arg1表达提高(P<0.01),百里醌呈剂量依赖性下调Arg1的基因表达(P<0.01)。见图4。

图4 百里醌对M2型巨噬细胞中A r g 1和i N 0 Sm RNA的影响(n=3)Flg.4 Effects of TQ on m RNA exp resslons of Arg1 and iN0S ln M 2 macrophages(n=3)
而巨噬细胞经IL-4诱导后,iNOS的基因表达显著下降(P<0.05),百里醌呈剂量依赖性提高iNOS的基因表达(P<0.01)。
3.5 Western b1ot法检测百里醌对M2型巨噬细胞中ARG1、iNOS蛋白水平的影响 如图5所示,在巨噬细胞向M2表型极化后,ARG1和iNOS的蛋白表达趋势与基因表达一致(P<0.01)。百里醌能抑制ARG1的蛋白表达,同时提升iNOS的蛋白表达(P<0.01)。

注:与对照组比较,##P<0.01,#P<0.05;与模型组比较,**P<0.01,*P<0.05图5 百里醌对M 2型巨噬细胞中ARG 1和l N 0 S蛋白水平的影响(n=3)Flg.5 Effects of TQ on proteln expresslons of ARG1 and lN0 S ln M 2 macrophages(n=3)
3.6 Western b1ot法检测百里醌对STAT6蛋白磷酸化水平的影响 如图6所示,在M0型巨噬细胞中,STAT6的蛋白磷酸化水平低,经IL-4激活后,其磷酸化水平提高(P<0.05)。百里醌呈剂量依赖性降低STAT6蛋白的磷酸化水平(P<0.01)。

注:与对照组比较,##P<0.01,#P<0.05;与模型组比较,**P<0.01,*P<0.05图6 百里醌对STAT 6蛋白磷酸化水平的影响(n=3)Flg.6 Effects of TQ on phosphorylatlon of STAT6(n=3)
4 讨论
巨噬细胞具有异质性和多样性,来自微环境不同信号可诱导其分化为不同的表型。M1型经典性激活和M2型替代性激活是巨噬细胞表型极端化后的两个主要亚群,在不同的生理和病理条件下发挥不同的生物功能。
在巨噬细胞极化过程中,Arg1与iNOS为一对竞争性酶,二者的表达和活性受到严格调控,两者间的动态平衡在维持巨噬细胞的功能稳定中发挥重要作用。Arg1为M2型巨噬细胞标志物,经IL-4、IL-13等诱导后高表达,生成鸟氨酸和尿素,为肿瘤细胞提供营养物质;而iNOS为M1型巨噬细胞标志物,在受到脂多糖(LPS)、干扰素γ(IFN-γ)等刺激下高表达,产生大量的一氧化氮,起杀伤肿瘤细胞的作用[10]。百里醌在干预M2型巨噬细胞极化中,抑制Arg1在基因和蛋白水平的表达,同时提高iNOS的表达,暗示着百里醌可逆转M2表型,使巨噬细胞表型向M1型极化。
在M2型替代性活化进程中,IL-4与其受体结合,激活酪氨酸激酶(JAK)使酪氨酸残基磷酸化,招募STAT6后从受体处分离,级联活化后的复合物入核,与相应的靶基因启动子结合,控制目的蛋白的表达[11]。百里醌可降低STAT6蛋白的磷酸化水平,使IL-4/STAT6介导M2表型极化的信号通路失活。
综上所述,百里醌是黑种草子中逆转巨噬细胞M2表型极化的活性成分,部分通过抑制IL-4/ STAT6信号通路的活化,调控Arg1/iNOS的表达消长而干预M2表型极化进程中巨噬细胞自身及其促乳腺癌细胞的体外迁移加剧。
参考文献:
[1] Mantovani A,A11avena P,Sica A,et al.Cancer-re1ated inf1ammation[J].Nature,2008,454(7203): 436-444.
[2] So1inas G,Germano G,Mantovani A,et al.Tumor-associated macroPhages(TAM)asmajor P1ayers of the cancer-re1ated inf1ammation[J].J Leukoc Biol,2009,86(5): 1065-1073.
[3] Mantovani A,A11avena P.The interaction of anticancer thera-Pies with tumor-associated macroPhages[J]. J ExP Med,2015,212(4): 435-445.
[4] 王原来,卞 卡,章丹丹.肿瘤中巨噬细胞表型极化的调控机制及中药干预的研究进展[J].中国中药杂志,2015,40(2): 180-184.
[5] 国家药典委员会.中华人民共和国药典: 2010年版一部[S].北京:中国医药科技出版社,2010: 324-325.
[6] 章丹丹,凌 霜,张洪平,等.黑种草子不同组分抑制亚硝酸盐积累、血小板聚集和血管收缩的体外实验研究[J].中成药,2013,35(7): 1376-1380.
[7] 章丹丹,聂绪强,潘会君,等.黑种草子总皂苷对炎症介质及ERK/MAPK信号通路的影响[J].中国中药杂志,2010,35(19): 2594-2598.
[8] 王原来,杨晓露,卞 卡,等.黑种草子抑制乳腺癌细胞增殖的组分筛选及机制分析[J].时珍国医国药,2013,24(6): 1289-1291.
[9] Woo C C,Kumar A P,Sethi G,et al.Thymoquinone: Potentia1 cure for inf1ammatory disorders and cancer[J].Biochem Pharmacol,2012,83(4): 443-451.
[10] Mi11s C D.Anatomy of a discovery: m1 and m2 macroPhages [J].Front Immunol,2015,6: 212.
[11] Wang N,Liang H,Zen K.Mo1ecu1ar mechanisms that inf1uence the macroPhage m1-m2 Po1arization ba1ance[J].Front Immunol,2014,5: 614.
M echanlsm of thymoqulnone on regulatlon M 2 phenotype polarlzatlon ofmacrophages
XU Yuan, TAN Xi, WANG Yuan-1ai, XIE Si-nan, ZHANG Dan-dan*
(Murad Research Institute for Modernized Chinese Medicine,Shanghai University of Traditional Chinese Medicine,Shanghai201203,China)
ABSTRACT:AIM To study themechanism of thymoquinone from Semen Nigellae on its regu1ation ofM2 PhenotyPe Po1arization ofmacroPhages in vitro.METH0DS IL-4(60 ng/mL)induced RAW264.7 ce11s to estab1ish the M2 macroPhagemode1.MTT assay was used tomeasure the ce11cytotoxicity of thymoquinone.Trans-we11assay was used formeasurement ofmigration caPabi1ity;qRT-PCR was used to determinemRNA exPression of Arg1 and iNOS.Western b1otwas used for Protein exPressions of ARG1,iNOS and PhosPhory1ation of STAT6.RESULTS Thymoquinone not on1y inhibited the increased migratory caPabi1ity ofmacroPhage towards M2 PhenotyPe,but a1so rePressed breast cancer ce11smigration with the aid of M2 macroPhages in vitro.Thymoquinone down-regu1ated the gene and Protein exPression of Arg1 whi1e uP-regu1ated the gene and Protein exPression of iNOS,and suPPressed the PhosPhory1ation of STAT6 Protein.C0NCLUSI0N Thymoquinone can reversemacroPhage Po1arization from M2 to M1 PhenotyPe and inhibits the Promotion of M2 macroPhages to breast cancer ce11smigration in vitro.IL-4/ STAT6 signa1Pathway is Part1y invo1ved to regu1ate the exPression between Arg1 and iNOS under the interference of thymoquinone.
*通信作者:章丹丹(1980—),女,博士,副研究员,主要从事肿瘤相关性炎症的机制及中药干预研究。Te1:(021)51322534,E-mai1: izhangdd@126.com
作者简介:徐 元(1992—),女,硕士生,主要从事抗炎中药筛选及相关机制的研究。Te1:(021)51322534,E-mai1: 2313390806@ qq.com
基金项目:上海市教育委员会科研创新项目(13YZ048);国家自然科学基金项目(81573673,81001666);上海市卫生和计划生育委员会科研课题(20144Y0143);上海高校选拔培养优秀青年教师基金资助项目(SZY07029)
收稿日期:2015-06-15
中图分类号:R966
文献标志码:A
文章编号:1001-1528(2016)02-0235-06

