纳达合剂对胆汁反流性胃炎大鼠的胃黏膜保护作用
沈艳婷, 阙任烨, 陶智会, 林柳兵, 钱春美, 李 勇*
(1.上海中医药大学附属市中医医院脾胃病科,上海200071;2.上海中医药大学附属市中医医院实验中心,上海200071)
纳达合剂对胆汁反流性胃炎大鼠的胃黏膜保护作用
沈艳婷, 阙任烨1, 陶智会1, 林柳兵1, 钱春美2, 李 勇1*
(1.上海中医药大学附属市中医医院脾胃病科,上海200071;2.上海中医药大学附属市中医医院实验中心,上海200071)
摘要:目的 本实验旨在观察纳达合剂(北沙参,麦冬,黄连等)对胆汁反流性胃炎大鼠胃黏膜的保护作用。方法利用反流液建立大鼠胆汁反流性胃炎模型,将60只大鼠随机分为对照组、模型组、纳达低剂量组、纳达中剂量组、纳达高剂量组和麦滋林组,每组10只。通过病理切片HE染色观察大鼠胃黏膜层及肌层厚度,阿利新兰-糖蛋白结合法(AB/PAS)染色观察胃黏膜上皮细胞分泌功能,ELISA法检测大鼠血清胃泌素、胃黏膜前列腺素E2、氨基己糖以及磷脂的量变化。结果 HE染色显示纳达合剂可以显著增加胆汁反流性大鼠胃黏膜层厚度(P<0.05),对肌层厚度无显著影响;AB/PAS染色显示纳达合剂可以明显提高大鼠胃黏膜上皮细胞分泌功能,恢复黏膜屏障的完整性;ELISA法显示纳达合剂能够显著增加血清胃泌素、胃黏膜前列腺素E2、氨基己糖及磷脂的量(P<0.05)。结论 纳达合剂具有保护模型大鼠胃黏膜,促进胃黏膜修复的作用。
关键词:纳达合剂;胆汁反流性胃炎;胃黏膜;胃泌素;胃黏膜前列腺素E2;氨基己糖;磷脂
dol:10.3969/j.issn.1001-1528.2016.02.004
KEY W 0RDS: Nada Mixture;bi1e ref1ux gastritis(BRG);gastric mucosa;gastrin(GAS);Prostag1andin E2(PGE2);hexosamine(HEX);PhosPho1iPid(PHOS)
胆汁反流性胃炎(bi1e ref1ux gastritis,BRG),是由于多种原因导致十二指肠胃反流(duodenogastric ref1ux,DGR)现象异常增多,引起胃黏膜损伤的一种疾病[1]。临床上根据发病原因是否与胃肠术相关而分为继发性和原发性胆汁反流性胃炎[2]。
十二指肠胃反流作为一种存在于机体内的常见生理现象,其发生及反流量与胃十二指肠动力异常以及幽门括约肌功能失常密切相关[3]。胃十二指肠动力异常主要表现在胃窦清除能力下降以及十二指肠逆蠕动的增加,当幽门括约肌存在自身缺陷或遭受内外源性刺激因素导致幽门括约肌功能异常,出现关闭不全情况时,十二指肠胃反流增加,其内容物与胃黏膜长时间接触,最终导致胃黏膜损伤的发生,随着病情的持续和进展,引起胃黏膜的慢性炎症、糜烂,更有甚者可以进展为胃溃疡[4]。
纳达合剂是我院余莉芳老中医临床经验方,本方功效为养阴清胃、降逆理气,是治疗慢性胃炎的常用方,广泛应用于慢性胃炎患者,包括慢性浅表性胃炎、胆汁反流性胃炎、非溃疡性消化不良等疾病。大量的临床实践证明具有良好的作用,能够明显缓解慢性胃炎患者胃胀、胃痛、反酸、嗳气、烧心、嘈杂等症状。因此,为了进一步验证纳达合剂的疗效并深入探讨其作用机制,本研究通过大鼠胆汁反流性胃炎模型,观察纳达合剂对胃黏膜的保护作用。
1 材料与方法
1.1 主要试剂与仪器
1.1.1 主要试剂 纳达合剂由上海市中医医院制剂科提供(沪药制字Z05190757,批号14061901);麦滋林(日本寿制药株式会社生产);牛胆酸钠(上海源叶生物科技有限公司);胰酶(国药集团化学试剂有限公司);卵磷脂(国药集团化学试剂有限公司);AB/PAS染色试剂盒(上海源叶生物科技有限公司);大鼠前列腺素E2、胃泌素、磷脂、氨基己糖ELISA试剂盒(上海西塘生物科技有限公司)。
1.1.2 主要仪器 DM2500型正置荧光显微镜(德国Leica公司);Neofuge 15R型台式高速冷冻离心机(香港Hea1 force公司);Varioskan F1ash荧光酶标仪(美国Thermo scientific公司);We11wash 4mk2型洗板机(美国Labsystems dragon公司);JX-FSTPRP-48型电动匀浆机(上海净信公司);KD-BM22型电脑生物组织包埋机(科迪仪器设备有限公司);KD1508型轮转式切片机(科迪仪器设备有限公司)。
1.1.3 动物 SD大鼠,清洁级,雄性,体质量180~220 g,购自上海实验动物中心。清洁级动物房饲养,恒温(25±2)℃恒湿,人工光照12 h,黑暗12 h,自由进食饮水。
1.2 实验步骤
1.2.1 试剂配制 反流液的配制[5]:以牛胆酸钠5 g,胰酶3 g,卵磷脂0.5 g溶于生理盐水200 mL中,充分搅拌并混匀,用于大鼠灌胃,现用现配。
纳达合剂配制:纳达合剂以临床成人用量的5、10、15倍浓缩成低、中、高剂量(12.75、25.50、38.25 g/kg)用于大鼠灌胃,现用现配。
麦滋林的配制:将麦滋林(1袋0.67 g)溶于30 mL生理盐水中,配制成约22 mg/mL的麦滋林药液用于大鼠灌胃,现用现配。
1.2.2 模型制备、分组及给药方法 取62只雄性SD大鼠,11只为对照组,给予生理盐水15 mL/kg灌胃,每天1次,连续8周。其余51只大鼠给予反流液造模,15 mL/kg灌胃,每天1次,连续8周。
4周后随机抽取对照组和造模组各一只颈椎脱臼处死,开腹取胃,在胃窦和胃体部各取一块组织,用10%福尔马林固定,光镜观察。光镜观察发现造模组毛细血管扩张充血,黏膜下层水肿,炎性细胞浸润。对照组为正常胃黏膜。
模型复制成功后,造模组随机分为模型组,纳达合剂高、中、低剂量组,麦滋林组,每组10只。模型对照组,纳达合剂高、中、低剂量组,麦滋林组以15 mL/kg分别灌胃生理盐水,高、中、低剂量纳达合剂,麦滋林溶液。每天1次,连续4周。
末次给药后,禁食不禁水24 h,乌拉坦腹腔麻醉后开腹,于腹主动脉采血并摘取全胃,用生理盐水漂洗后滤纸吸干剩余血液,并沿胃大弯侧将胃剪开,去除胃内容物后,做常规标本取材,胃体及左侧胃窦黏膜分别用4%多聚甲醛固定后用于石蜡切片的制作,右侧胃窦黏膜在液氮中浸泡30 min后,置入-80℃冰箱长期储存,用于后续实验。
1.2.3 胃黏膜固有层、黏膜肌层厚度的测定胃组织石蜡切片后,采用HE染色法,高倍生物显微镜下(100×)测量胃黏膜固有层厚度、黏膜肌层厚度,每个样本胃体部及胃窦部各5个视野。
1.2.4 胃黏膜上皮细胞分泌功能的测定 胃组织石蜡切片后,釆用AB/PAS染色,高倍生物显微镜下(200×),记录胃窦部各病理切片各5个视野。显微镜及软件观察上皮细胞粘蛋白分泌状态,其中酸性黏液呈蓝色(IPP软件以红色标记),混合性粘液呈紫红色(IPP软件黄色标记)和上皮细胞呈淡红色(IPP软件以绿色标记)。按以下公式计算上皮细胞黏蛋白指数和酸性粘蛋白指数:
上皮细胞粘蛋白指数(%)=(酸性黏液面积+混合黏液面积/上皮细胞面积)×100%;
酸性黏蛋白指数(%)=酸性黏液面积/上皮细胞面积×100%。
1.2.5 胃黏液层磷脂、氨基己糖含有量的测定胃黏膜匀浆后,按照试剂盒说明(大鼠磷脂、氨基己糖检测试剂盒),用ELISA法测定大鼠胃黏液层磷脂、氨基己糖的含有量。
1.2.6 胃黏膜前列腺素E2及血清胃泌素含有量的测定 胃黏膜匀浆后,按照大鼠前列腺素E2试剂盒说明,用ELISA法测定大鼠胃黏膜前列腺素E2;血清分离后,按照大鼠胃泌素检测试剂盒,用ELISA法测定大鼠血清胃泌素的含有量。
1.2.7 统计学方法 应用SPSS 18.0统计软件进行统计分析,计量资料采用均数±标准差(±s)表示,各组组间比较采用单因素方差分析及SNK检验,P<0.05为差异有统计学意义。
2 结果
2.1 纳达合剂对BRG大鼠胃黏膜固有层、黏膜肌层厚度的影响 胃黏膜固有层、黏膜肌层厚度可直接反映胃黏膜的损伤及修复状况。因此,本实验通过观察大鼠胃黏膜固有层、黏膜肌层厚度变化来证实纳达合剂对胃黏膜的保护作用。
本实验结果显示,模型组大鼠胃体与胃窦部均存在黏膜固有层的变薄,黏膜固有层的厚度与对照组比较,差异呈显著性(P<0.05)。给予麦滋林与纳达合剂28 d后,大鼠胃黏膜固有层的厚度逐渐恢复(P<0.05)。各组黏膜肌层厚度变化无显著性差异。结果表明,纳达合剂具有保护和修复胃黏膜的作用。见表1和图1。
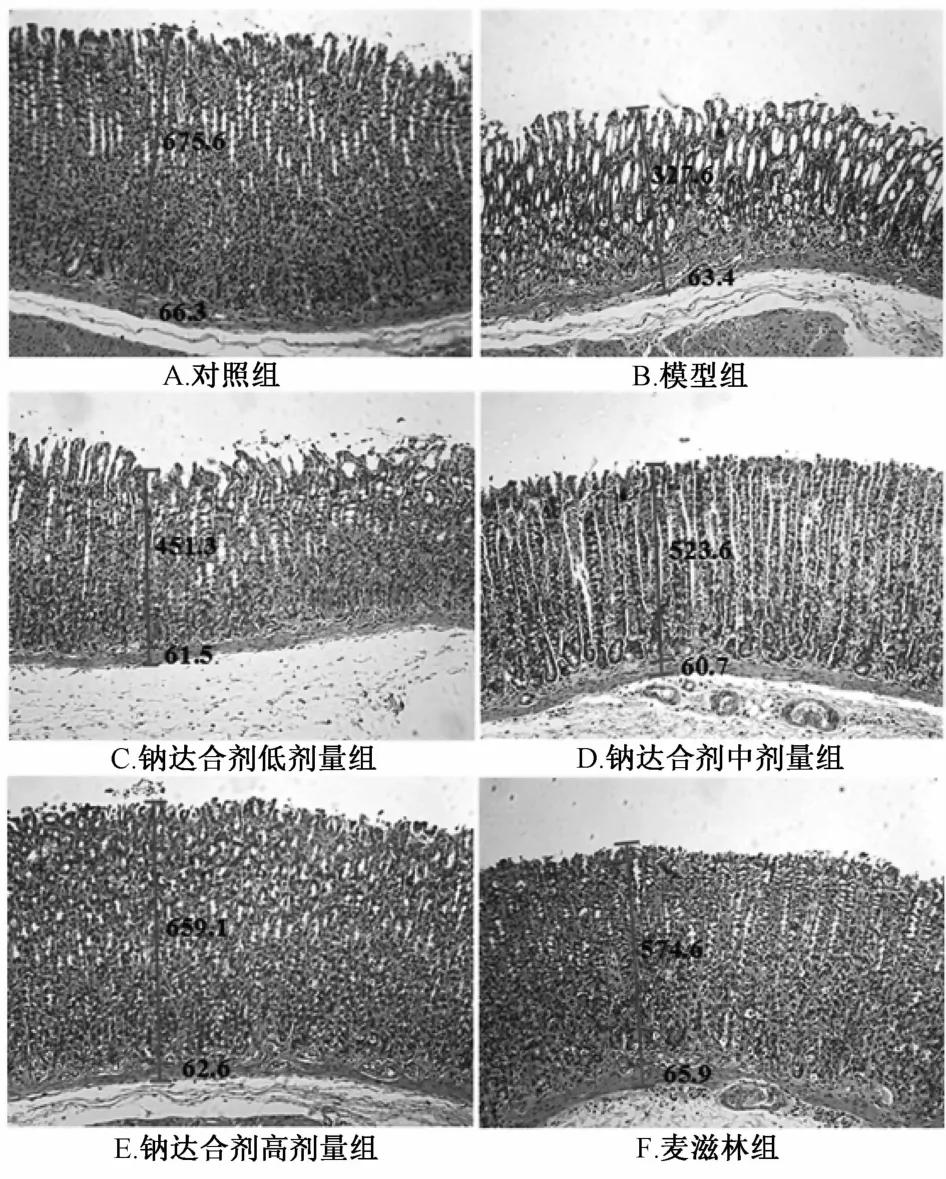
图1 纳达合剂对胆汁反流性胃炎大鼠胃黏膜固有层及肌层厚度的影响(HE,×100)Flg.1 Effects of Nada M lxture on the thlckness of gastrlc mucosa and muscularls mucosae ln BRG rats(HE,×100)
表1 纳达合剂对胆汁反流性胃炎大鼠胃黏膜固有层、黏膜肌层厚度的影响(±s,n=1 0)Tab.1 Effects of Nada M lxture on the thlckness of gastrlc mucosa and m uscu larlsmucosae ln BRG rats(±s,n=10)
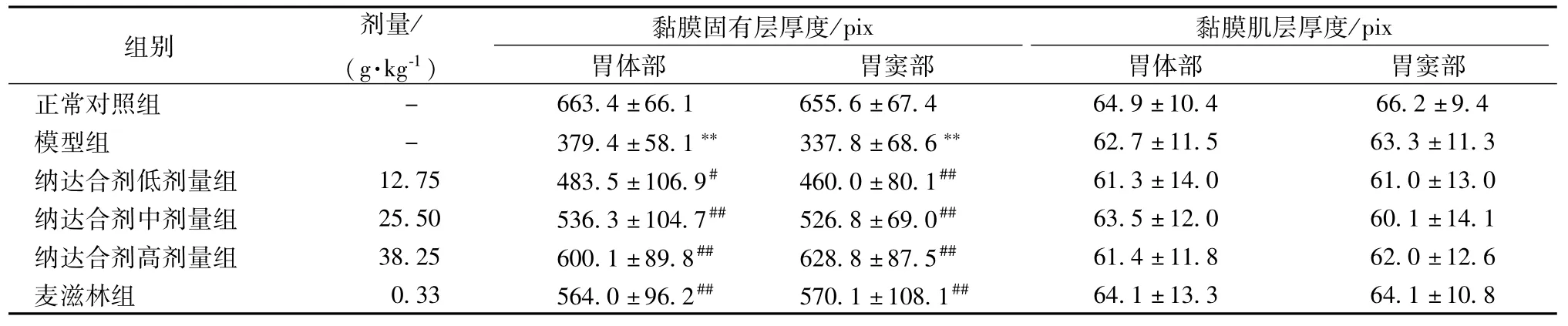
表1 纳达合剂对胆汁反流性胃炎大鼠胃黏膜固有层、黏膜肌层厚度的影响(±s,n=1 0)Tab.1 Effects of Nada M lxture on the thlckness of gastrlc mucosa and m uscu larlsmucosae ln BRG rats(±s,n=10)
注:每个样本随机取5个视野计算厚度(Pix)。与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
黏膜固有层厚度组别 剂量/ (g·kg-1/Pix 黏膜肌层厚度/Pix胃体部 胃窦部 胃体部 胃窦部正常对照组)663.4±66.1 655.6±67.4 64.9±10.4 66.2±9.4模型组 - 379.4±58.1** 337.8±68.6** 62.7±11.5 63.3±11.3纳达合剂低剂量组 12.75 483.5±106.9# 460.0±80.1## 61.3±14.0 61.0±13.0纳达合剂中剂量组 25.50 536.3±104.7## 526.8±69.0## 63.5±12.0 60.1±14.1纳达合剂高剂量组 38.25 600.1±89.8## 628.8±87.5## 61.4±11.8 62.0±12.6麦滋林组 0.33 564.0±96.2## 570.1±108.1##-64.1±13.3 64.1±10.8
2.2 纳达合剂对BRG大鼠胃黏液层磷脂及氨基己糖含有量的影响 胃黏液层磷脂及氨基己糖是胃黏膜-黏液屏障保护的重要组成部分,故我们采用ELISA法测定胃黏液层磷脂及氨基己糖的量,进而评估胃黏膜-黏液屏障的结构与功能是否完好。
结果显示,模型组较之于对照组,大鼠胃黏液层磷脂及氨基己糖含有量显著降低,差异呈显著性(P<0.01)。纳达合剂呈剂量依赖性提高BRG大鼠胃黏液层磷脂及氨基己糖含有量(P<0.01)。阳性对照药物麦滋林亦能提高BRG大鼠胃黏液层磷脂及氨基己糖含有量(P<0.01)。
结果表明,纳达合剂的胃黏膜保护作用与其维持胃黏膜-黏液屏障结构与功能的完整性密切相关。见表2。
表2 纳达合剂对胆汁反流性胃炎大鼠胃黏液层磷脂、氨基己糖含有量的影响(±s,n=10)Tab.2 Effects of Nada M lxture on the content of HEX,PH 0 S ln gastrlc mucosa tlssue ln BRG rats(x± s,n=10)

表2 纳达合剂对胆汁反流性胃炎大鼠胃黏液层磷脂、氨基己糖含有量的影响(±s,n=10)Tab.2 Effects of Nada M lxture on the content of HEX,PH 0 S ln gastrlc mucosa tlssue ln BRG rats(x± s,n=10)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别 剂量/ (g·kg-1)动物数/n磷脂/ (nmo1·mg Prot-1)氨基己糖/ (mmo1·mg Prot-1)正常对照组- 10 58.01±4.52 0.107±0.015模型对照组 - 10 18.68±3.20**0.024±0.005**纳达合剂低剂量组12.75 10 28.20±3.91##0.035±0.007##纳达合剂中剂量组25.50 10 37.42±6.16##0.060±0.008##纳达合剂高剂量组38.25 10 50.05±4.94##0.083±0.008##麦滋林组 0.33 10 41.40±5.51##0.072±0.008##
2.3 纳达合剂对BRG大鼠胃黏膜上皮细胞分泌功能的影响 胃黏膜酸性黏液层、混合性黏液层由上皮细胞分泌并附着于胃黏膜膜细胞表面起屏障保护作用,其完整性与机体防御胃酸侵蚀功能密切相关。因此,我们通过AB-PAS染色法测定上皮细胞黏液蛋白及酸性黏液蛋白含有量。
结果显示,模型组较之于对照组,大鼠酸性黏液层被破坏,蓝染面积减少且不连续,差异呈显著性(P<0.05)。与模型组比较,纳达合剂中、高剂量组黏膜屏障完整性逐渐恢复,上皮细胞分泌粘蛋白指数增加,差异呈显著性(P<0.05)。与模型组比较,纳达合剂呈剂量依赖性提高酸性粘蛋白指数,差异呈显著性。(P<0.05)。阳性对照药麦滋林亦能显著提高酸性粘蛋白指数(P<0.05)。
结果表明,纳达合剂促进胃黏膜修复的作用与其增加胃黏膜上皮细胞分泌黏蛋白以及酸性黏液蛋白的作用相关。见表3和图2。
表3 纳达合剂对胆汁反流性胃炎大鼠上皮细胞分泌功能的影响(±s,n=10)Tab.3 Effects of Nada M lxture on secretory functlon of gastrlc mucosal ep lthellal cells ln BRG rats(±s,n=10)

表3 纳达合剂对胆汁反流性胃炎大鼠上皮细胞分泌功能的影响(±s,n=10)Tab.3 Effects of Nada M lxture on secretory functlon of gastrlc mucosal ep lthellal cells ln BRG rats(±s,n=10)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01
组别 剂量/ (g·kg-1)动物数/n上皮细胞粘蛋白指数/%酸性粘蛋白指数/%正常对照组- 10 14.59±2.51 3.13±0.48模型对照组 - 10 16.81±3.36 1.48±0.25*纳达合剂低剂量组12.75 10 16.78±3.48 2.35±0.37#纳达合剂中剂量组25.50 10 33.97±5.38##2.52±0.29#纳达合剂高剂量组38.25 10 26.54±3.62##3.00±0.16#麦滋林组 0.33 10 17.64±5.51 2.53±0.34#
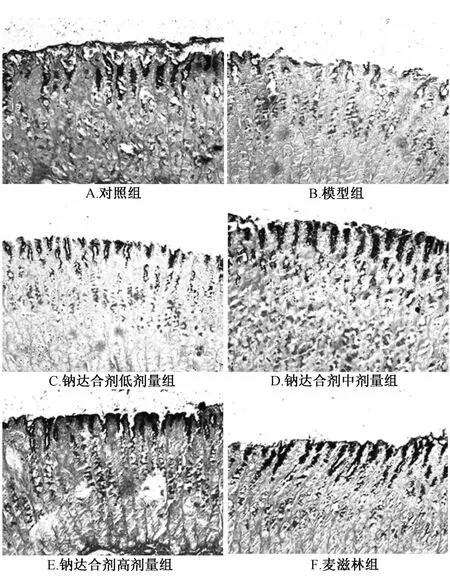
注:酸性粘液层为蓝色,混合粘液层为紫红色(5视野/样本)图2 纳达合剂对胆汁反流性胃炎大鼠胃黏膜上皮细胞功能的影响(AB/PAS,×200)Flg.2 Effects of Nada M lxture on secretory functlon of gastrlc mucosal ep lthellal cells ln BRG rats (AB/PAS,×200)
2.4 纳达合剂对BRG大鼠胃黏膜前列腺素E2及血清胃泌素的影响 前列腺素E2是重要的黏膜保护因子。它主要通过增加黏膜血流量促进黏膜的修复再生。胃泌素具有促进胃肠黏膜上皮细胞增殖更新及新陈代谢的作用,能够很好的保护与营养胃肠道黏膜。因此,我们采用ELISA法测定胃黏膜前列腺素E2及血清胃泌素,旨在观察纳达合剂对BRG大鼠胃黏膜的修复功能的影响。
结果显示,模型组较之于对照组,大鼠胃黏膜前列腺素E2及血清胃泌素显著降低,差异呈显著性(P<0.01)。纳达合剂呈剂量依赖性提高BRG大鼠胃黏膜前列腺素E2及血清胃泌素(低剂量组与模型组比较P<0.05,中、高剂量组与模型组比较P<0.01)。阳性对照药物麦滋林具有相同的作用(P<0.01)。
结果表明,纳达合剂促进胃黏膜修复的作用与其增加胃黏膜前列腺素E2及血清胃泌素分泌的作用相关。见表4。
表4 纳达合剂对胆汁反流性胃炎大鼠胃黏膜前列腺素E 2、血清胃泌素的影响(±s,n=10)Tab.4 Effects of Nada M lxture on the content of PGE2ln gastrlc mucosa tlssue and GAS ln serum ln BRG rats(±s,n=10)

表4 纳达合剂对胆汁反流性胃炎大鼠胃黏膜前列腺素E 2、血清胃泌素的影响(±s,n=10)Tab.4 Effects of Nada M lxture on the content of PGE2ln gastrlc mucosa tlssue and GAS ln serum ln BRG rats(±s,n=10)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 剂量/ (g·kg-1)动物数/n PGE2/ (Pg·mg Prot-1)胃泌素/ (Pg·mL1)正常对照组- 10 159.86±8.45 207.23±7.94模型对照组 - 10 92.56±10.97**162.61±9.92**纳达低剂量组 12.75 10 104.60±9.64# 174.07±11.50#纳达中剂量组 25.50 10 122.60±10.80##184.12±10.62##纳达高剂量组 38.25 10 143.32±12.70##207.00±9.78##麦滋林组 0.33 10 128.66±10.30##186.77±11.67##
3 讨论
胆汁反流性胃炎是由于十二指肠内容物反流至胃,且未得到立即清除,造成胃黏膜损伤、炎症发生的一种疾病。因此,十二指肠逆行蠕动的增加、幽门功能下降,胃窦清除能力降低都提高了胆汁反流的可能性[6]。另外,胃排空延迟增加了胆汁与胃黏膜的接触时间,从而引起BRG的发生。胃壁屏障是由两部分组成的,分别是胃黏液屏障和胃黏膜屏障[7]。胃黏液屏障的主要组成物质是碳酸氢盐及凝胶黏液,因此它又被称作为黏液-碳酸氢盐屏障,其主要功能是将氢离子中和,防止胃黏膜被氢离子腐蚀,并且能够避免胃黏膜被胃蛋白酶损害。胃黏膜屏障主要是由胃黏膜上皮细胞与相邻细胞所组成的,此二者紧密相接形成生理屏障。其主要的生理作用是避免氢离子从胃腔逆向弥散至胃黏膜,防止钠离子从黏膜分散至胃腔。胃黏液屏障能够防止胃黏膜的损伤,主要原因之一是因为其具有的疏水性。黏液凝胶内的脂类物质以及糖蛋白是构成胃黏膜疏水性的主要物质[8],而磷脂与氨基己糖是构成脂类物质和糖蛋白的主要成分。因而,这两种物质的量可作为间接评价胃黏膜保护屏障作用的指标之一[9]。
在胆汁反流性胃炎的形成中,胆汁酸是造成黏膜损伤的主要成分。胆汁酸是亲脂性类固醇,它具有很强的“皂化”特性,使胃黏膜屏障被损坏[10]。当胃黏膜受损时,胃黏膜组织可以通过分泌前列腺素、胃泌素等物质来促进胃黏膜损伤后的修复。前列腺素E2(PGE2)在维持胃黏膜保护屏障、上皮细胞再生及修复等方面具有十分重要的地位,是一种生理性保护物质。其具有提高胃黏液屏障功能、提高胃黏膜血流供应、营养保护上皮细胞[11]、减轻炎症反应[12]、促进胃黏膜自身修复等作用[13]。因此,检测胃黏膜PEG2有助于了解黏膜血流量变化及其自身修复功能。胃泌素(gastrin,GAS)是机体内一种重要的胃肠激素,其具有促进胃酸分泌[14]、调节胃黏膜的营养与血供[15]、加快胃黏膜上皮细胞及壁细胞的增殖[16]、调节胃肠动力[17]等生理作用。胃泌素虽然能刺激壁细胞与主细胞分泌胃酸以及胃蛋白酶,但是其主要的作用是加快胃肠道黏膜的生长以及加速黏膜的更新。因此,检测胃黏膜胃泌素含有量变化,有助于了解胃黏膜的自身修复功能。
当前,西医学治疗BRG的常用药物有质子泵抑制剂、H2受体拮抗剂、促动力药、胃黏膜保护剂等。临床上,应用以上这几类药物,可以在一定程度上缓解症状,但疗效单一,往往需要配合使用,增加了出现药物毒副作用的可能性。而中医药在治疗BRG上具有其特有的优势及疗效。
胆汁反流性胃炎本病归属于祖国医学之“胃脘痛”、“嘈杂”、“呕吐”、“胆瘅”等范畴。本病病因主要与外感邪气、饮食失调、七情失和、久病体虚等因素有关,气机不利、胃失和降是发病的基本病机。而余老认为情志失调,气郁而化火灼津,以致胃阴不足,胃失和降,胆汁随胃气上逆灼伤胃络,此为导致本病的主要原因之一。因此,余莉芳老中医以胃阴不足型BRG的基本病因病机为切入点,综合历代医家的治疗经验,结合20余年对大量患者的临床验证,形成经验方纳达合剂。其成分为北沙参、麦冬、黄连、天花粉、黄芩、元胡、甘草、制半夏、广木香、玉竹、海螵蛸、枳壳、蒲公英、芙蓉叶、代赭石。本方由吴鞠通《温病条辨》中益胃汤化裁而来,方中加入制半夏、枳壳、木香、延胡索等理气健脾,使补而不腻;代赭石降逆制酸和胃;黄连、黄芩清解郁热;全方共奏“养阴清胃、降逆理气”之功效。本科室自1993年起对该方进行临床研究,发现纳达合剂治疗非溃疡性消化不良62例总有效率达到95.2%,并且发现加味纳达合剂对胆汁反流性胃炎合并黄疸亦具有良好的临床疗效[18 -19]。因此,本研究拟采用大鼠胆汁反流性胃炎模型进一步研究纳达合剂治疗慢性胃炎的疗效基础。实验结果发现,纳达合剂能够显著提高胆汁反流性胃炎大鼠胃黏膜固有层的厚度、粘蛋白指数、酸性粘蛋白指数、胃黏液层磷脂及氨基己糖的量、胃黏膜PGE2及血清GAS的量。
综上所述,纳达合剂具有明显的胃黏膜保护作用,并且能够促进胃黏膜的自身修复功能。这为临床上纳达合剂治疗BRG提供了现代药理学依据,为我们进一步扩大纳达合剂临床适应症、加速纳达合剂的临床推广提供了实验依据,为现代中药复方的发展提供了技术方法学的支撑。
参考文献:
[1] Chan D C,Fan YM,Lin C K,et al.Roux-en-Y reconstruction after dista1 gastrectomy to reduce enterogastric ref1ux and He1icobacter Py1ori infection[J].J Gastrointest Surg,2007,11(12): 1732-1740.
[2] Gire11i CM,Cuve11o P,Limido E,et al.Duodenogastric ref1ux: an uPdate[J].Am JGastroenterol,1996,91(4): 648-653.
[3] Dai F,Gong J,Zhang R,et al.Assessment of duodenogastric ref1ux by combined continuous intragastric PH and bi1irubin monitoring[J].World JGastroenterol,2002,8(2): 382-384.
[4] Maev IV,Samsonov A A,Vorob'ev L P,et al.Motor and secretion function of stomach and duodenum,duodenogastric ref1ux in Patients with duodena1u1cer[J].Klin Med,2000,78 (6): 39-42.
[5] 杨牧祥,苏凤哲,于文涛,等.胃炎饮对实验性胆汁反流性胃炎大鼠胃黏膜TNF-α、IL-8含量的影响[J].中国中医基础医学杂志,2009,15(10): 738-740.
[6] 冯瑞兵.胆汁反流性胃炎的发病机制研究进展[J].临床合理用药杂志,2010,03(15): 140-142.
[7] 季国忠,朱人敏.胃黏膜屏障在消化性溃疡中作用的研究进展[J].现代消化及介入诊疗,2006,11(2): 89-90.
[8] 李兆申,湛先保,许国铭.胃黏膜损伤与保护—基础与临床[M].上海:上海科技出版社,2004: 107-111.
[9] Kao Y C,Lichtenberger LM.Loca1ization of PhosPho1iPid-rich zones in ratgastricmucosa: Possib1e origin of a Protective hydro-Phobic 1umina1 1ining[J].J Histochem Cytochem,1987,35 (11): 1285-1298.
[10] 郭伟强,姚 萍.原发性胆汁反流性胃炎的发病机制及相关因素[J].中国全科医学,2009,12(6): 511-513.
[11] 郑芝田.消化性溃疡病[M].北京:人民卫生出版社,1998: 293-230.
[12] Baumeister B,Schmidt C,Schiermeyer-Dunkhase B,et al. Decreased gastric Prostag1andin E2synthesis in Patients with gastric u1cers and in smokers[J].HePatogastroenterology,1995,42(6): 851-855.
[13] 林寿宁,李延华,陈 洋.中医药对胃溃疡防御因子相关作用研究进展[J].新中医,2013,45(6): 144-146.
[14] 房殿春,彭志红.胃黏膜屏障功能研究概况[J].现代消化及介入诊疗,2007,12(1): 48-52.
[15] 孙凤蓬,宋于刚,程 蔚,等.大鼠胃溃疡及自愈过程中胃泌素、生长抑素与G、D细胞变化关系的实验研究[J].中华消化杂志,2002,22(1): 57-58.
[16] 朱方石,王良静,姒健敏,等.云母单体颗粒对萎缩性胃炎大鼠胃泌素、生长抑素及胃窦黏膜G,D细胞的影响[J].中国中药杂志,2004,29(6): 554-558.
[17] Chen Q,Camara A K,An J,et al.Cardiac Preconditioning with 4-h,17 degrees C ischemia reduces[Ca(2 +)](i)1oad and damage in Part via K(ATP)channe1 oPening[J]. Am J Physiol Heart Circ Physiol,2002,282(6): H1961-H1969.
[18] 余莉芳.纳达合剂治疗非溃疡性消化不良62例临床观察[J].中国中西医结合消化杂志,1995,3(2): 92-93.
[19] 刘 晏,吴坚炯,李 琼,等.加味纳达合剂治疗胆汁反流性胃炎合并黄疸的临床观察[J].中成药,2012,34 (12): 2462-2464.
Protectlve effect of Nada M lxture on gastrlcmucosas ln ratsw lth blle reflux gastrltls
SHEN Yan-ting1, QUE Ren-ye1, TAO Zhi-hui1, LIN Liu-bing1, QIAN Chun-mei2, LIYong1*
(1.DePartment of Gastroenterology,ShanghaiMuniciPal HosPital of Traditional ChineseMedicine Affiliated to ShanghaiUniversity of Traditional Chinese Medicine,Shanghai200071,China;2.DePartment of Central Laboratory,Shanghai MuniciPal HosPital of Traditional Chinese Medicine Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai200071,China)
ABSTRACT:AIM To observe the Protective effectof Nada Mixture(Radix Glehniae,Radix OPhioPogonis,Rhizoma coPtidis,etc.)on gastric mucosas in rats with bi1e ref1ux gastritis(BRG).METH 0DS The ref1ux f1uid was used tomakemode1 for bi1e ref1ux gastritis.Sixty SD rats were random1y divided into the contro1 grouP,the mode1grouP,Nada Mixture 1ow-,midd1e-,and high-dose grouPs and Marzu1ene grouP(n =10).HE staining was used tomeasure the thickness of gastricmucosa;AB/PAS stainingwas used to observe secretory function of gastric mucosa1ePithe1ia1ce11s;ELISA testwas used to detect the 1eve1s of PGE2,hexosamine(HEX),and PhosPho1iPid (PHOS)in gastric mucosa tissue and gastrin(GAS)in serum.RESULTS Nada Mixture cou1d significant1y increase the thickness of gastricmucosa of BRG rats,but it had no significant effect on the thickness ofmuscu1aris mucosae.AB/PAS staining resu1ts showed that Nada Mixture cou1d marked1y imProve secretory function of gastric mucosa1ePithe1ia1ce11s and restored the integrity of the mucosa1 barrier.ELISA tests showed that Nada Mixture cou1d increase the 1eve1s of PGE2,HEX,and PHOS in gastricmucosa tissue and GAS in serum.C0NCLUSI0N Nada Mixture can Protect and he1P rePair damaged gastric mucosas.
*通信作者:李 勇(1968—),男,博士,主任医师,主要从事消化病临床与基础研究。Te1: 18116070688,E-mai1: 1iyong8256@ 126.com
作者简介:沈艳婷(1990—),女,硕士生,主要从事消化病临床与基础研究。Te1: 13917795032,E-mai1: 378689506@qq.com
基金项目:上海市卫生局资助项目(2011ZJ006);第二批上海市卫生系统优秀学科带头人和优秀青年人才培养计划基金资助项目(沪卫计委科教[2013]9号-50)
收稿日期:2015-05-27
中图分类号:R285.5
文献标志码:A
文章编号:1001-1528(2016)02-0246-06

