杜仲叶片不同发育时期数字基因表达谱分析
荆 腾,王 淋,乌云塔娜,杜红岩*
(1 中国林业科学研究院经济林研究开发中心,郑州 450003;2 国家林业局杜仲工程技术研究中心,郑州 450003)
杜仲叶片不同发育时期数字基因表达谱分析
荆腾1,2,王淋1,2,乌云塔娜1,2,杜红岩1,2*
(1 中国林业科学研究院经济林研究开发中心,郑州 450003;2 国家林业局杜仲工程技术研究中心,郑州 450003)
摘要:为在转录水平解析杜仲叶片发育过程中的基因表达模式,该研究通过数字基因表达谱技术对‘华仲6号’杜仲叶片从展叶(4月)到落叶(10月)不同发育时期的基因表达水平进行比较分析,共获得差异基因3 002个,其中1 764个表达量上调,1 238个下调,这些差异表达基因主要行使催化、氧化还原等功能,参与代谢过程和生物过程等;进一步Pathway富集分析发现,苯丙素类生物合成途径相关基因被富集,其中调控绿原酸合成的6个基因差异表达显著;对这些基因表达模式进行分析显示,4月中旬和9月中旬基因的表达量较高,暗示这两个时期对于绿原酸的合成具有重要作用。荧光定量RT-PCR检测6个绿原酸合成相关基因和12个随机选择的差异表达基因,验证结果显示表达谱测序结果可靠。该研究结果为揭示杜仲叶片在不同发育时期的分子调控机制奠定了基础,并为深入解析杜仲绿原酸合成机理,进而通过分子育种手段提高杜仲绿原酸含量提供新的路径。
关键词:杜仲叶片;数字基因表达谱;差异基因;绿原酸
杜仲(EucommiaulmoidesOliver)是中国特有的名贵木本药用树种,在中国27个省(市、自治区)均有栽培[1]。长期以来,人们以杜仲皮入药,其具有降压、补肾、强筋骨、保肝利胆、清热解毒等功效[2-4]。而现代药理学研究证实杜仲叶和杜仲皮的化学成分基本一致,具有同等功效,可以以叶代皮入药[5]。杜仲叶作为一种中药材已收录于2010版《中华人民共和国药典》。苯丙素类是杜仲中主要的药用活性成分之一,是衡量杜仲叶片药用价值的重要指标。迄今为止,杜仲中发现的苯丙素类共11种[6],其中研究最多的是绿原酸,绿原酸抗菌作用强,具有消炎、止血、抗肿瘤、降压等多种药理作用[7]。
过去对杜仲叶片的研究主要集中在化学成分的提取、测定和药理功效方面,在基因水平的研究相对较少。近年来,杜仲全基因组测序工作已初步完成,并将转录组测序技术应用到了杜仲研究领域,为杜仲数字基因表达谱的研究奠定了基础。由于基因的表达受时间、空间和内外因子的影响,是一复杂的动态过程,而基因表达谱的分析正是通过对基因时空表达的分析来探索生物体内复杂的生理过程[8]。
本研究应用数字表达谱技术对杜仲叶片从展叶(4月)到落叶(10月)的生长发育过程中基因表达情况进行分析,以相邻2个时期为对照,分别检测各个比较组合中的差异表达基因,应用生物信息学方法初步分析了这些差异基因所行使的功能和参与的代谢途径,以期了解杜仲叶片生长发育过程中的分子调控机制,获得绿原酸生物合成途径相关的酶基因,为相关基因的克隆与鉴定,进而为提高杜仲绿原酸含量的分子育种奠定基础。
1材料和方法
1.1材料及处理
试验材料选自国家林业局泡桐研究开发中心(河南郑州)的‘华仲6号’枝条,根据该树叶片以往生长发育特性,分别于2014年4月18日、5月18日、6月17日、7月17日、8月16日和9月20日选形态特征基本一致的叶片,迅速采集并放入液氮冷冻,后移至-80 ℃超低温冰箱保存备用。
1.2方法
1.2.1总RNA提取纯化及文库构建总RNA提取、纯化和文库构建委托北京诺禾致源公司完成。
1.2.2测序数据分析高通量测序(Illumina HiSeqTM2000/MiseqTM)得到的原始序列经去接头、去除不确定碱基信息比例大于10%的reads、去除低质量(质量值sQ≤5的碱基数占整个read长度50%以上的reads)筛选得到过滤序列,用于后续分析。通过测序Phred数值、GC含量等评估测序质量;用TopHat2软件将过滤后的测序序列进行基因组定位分析;采用HTSeq软件对各样品进行基因表达水平分析,使用的模型为union。采用RPM和RPKM[9]值进行标准化处理,将归一化后的表达数据作为分析对象。并采用DESeq方法[10]筛选出5个比较组合的差异表达基因,并对所有差异基因进行GO功能显著性富集分析和Pathway显著性富集分析。
1.2.3荧光定量RT-PCR检测为检测测序结果的可靠程度,本研究使用实时荧光定量PCR对6个绿源酸合成相关的基因以及随机选取12个基因进行表达量测定,其中12个基因为从Eu518 vs Eu418比较组合中随机选取的6个显著下调基因;从Eu920 vs Eu816比较组合中随机选取的6个显著上调基因。杜仲叶片各个时期样品RNA采用QiAgen公司RNA提取试剂盒(RNeasy Plant mini Kit)提取,cDNA第一链合成根据Inviterogen公司的SuperScriptTMⅢ First-Strand Synthesis System反转录成第一链,依据数字基因表达谱测序所得序列,通过Primer Premier 5.0软件设计引物,内参基因采用Actin(表1)。荧光定量PCR反应程序:95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火34 s,40个循环。反应结束后,以内参基因在不同时期叶片中的表达量为1.0,采用2-△△Ct法对表达量进行分析计算。实验3次重复。
2结果与分析
2.1测序数据评估
为分析杜仲叶片不同时期基因表达情况,构建了EuL418、EuL518、EuL617、EuL717、EuL816和EuL920共6个cDNA文库。对6个文库进行RNA测序,结果(表2)表明,6个文库经HiSeq2000/MiSeq高通量测序后得到的过滤序列分别为7 221 314、6 380 685、6 711 140、6 610 038、6 503 411和3 778 568,各占原始序列的99.47%、99.19%、99.28%、99.44%、95.59%和97.23%(测序错误率≤0.1%)。比例接近,且均达95.59%以上,说明cDNA文库构建和测序质量较高,去除杂质后的过滤序列可用于后续分析。
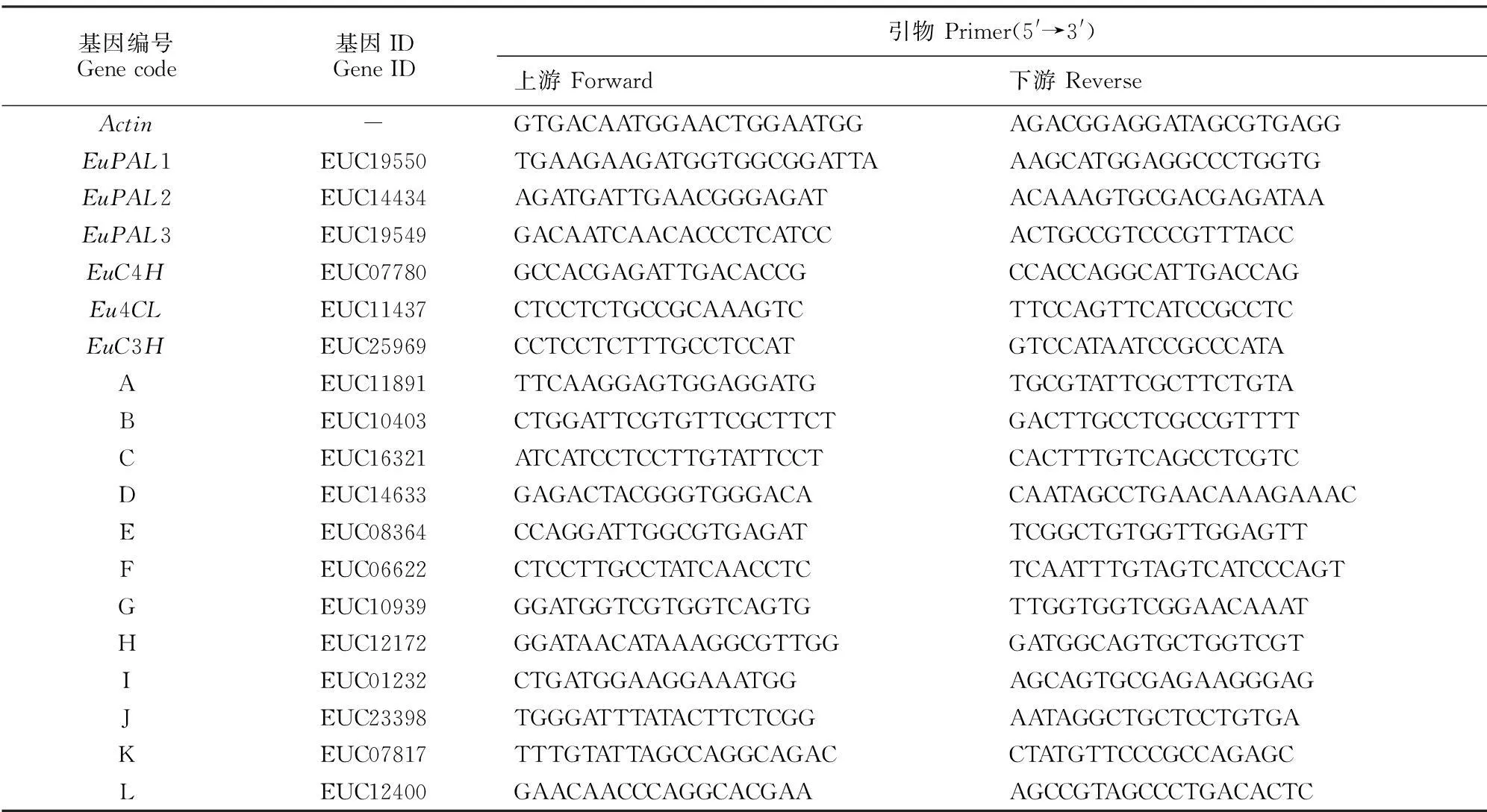
表1 荧光定量RT-PCR基因信息

表2 数据产出质量情况一览表
注:原始序列.高通量测序原始数据;过滤序列.过滤后的序列数据;过滤碱基.过滤序列的个数乘以长度,并转化为以G为单位;测序错误率.平均碱基错误率;Q20、Q30.分别计算Phred数值大于20、30的碱基占总体碱基的百分比;.GC含量.计算碱基G和C的数量和占总的碱基数量的百分比。
Note:Raw reads.Original data from the high-throughput sequencing;Clean reads.Sequence data after raw reads were filtered;Clean bases.Number of sequeneces times length of sequences,then converted to units of G,that is total number of bases;Error rate.Average error rate of sequencing;Q20 and Q30.Bases of phred values greater than 20 and 30 are calculated as a percentage of total bases;GC content.Percentage of bases of G and C to total bases.
利用TopHat2软件,将上述过滤序列对比到杜仲基因组序列,结果(表3)表明,6个cDNA文库样品得到的过滤序列中,分别有95.83%、96%、95.03%、95.1%、94.45%和95.27%的过滤序列可匹配到杜仲参考基因组。说明测序结果具有较高准确性,满足下一步数据分析要求。
2.2叶片发育不同时期基因表达差异分析
2.2.1不同发育时期差异基因的筛选在测序、组装和注释基础上,将不同发育时期杜仲叶片进行基因表达对比分析。本试验以杜仲叶片发育相邻2个时期为1个对照组合,共设计了5个对照组合,即EuL518 vs EuL418、EuL617 vs EuL518、EuL717 vs EuL617、EuL816 vs EuL717和EuL920 vs EuL816,来探究叶片不同发育时期差异基因。归一化数据利用DESeq分析从差异倍数和显著水平2个方面设定阈值进行差异基因筛选,其中满足|log2|>1 且校正值P<0.05为差异表达基因。根据5个组合筛选所得的差异表达基因(DEGs)列表绘制Venn图,结果(图1)表明,杜仲叶片不同时期产生的DEGs共计3 002个,占杜仲基因组总数的11.23%,其中有1 764个基因表达量上调,1 238个基因表达量下调,且5个相邻时期组合中没有共同的差异基因。在EuL518 vs EuL418的1 989个DEGs中,有上调基因780个,下调基因1 209个;在EuL617 vs EuL518的415个DEGs中,有上调基因271个,下调基因144个;在EuL717 vs EuL617的78个DEGs中,有上调基因46个,下调基因32个;在EuL816 vs EuL717的258个DEGs中,有上调基因133个,下调基因125个;在EuL920 vs EuL816的820个DEGs中,有上调基因534个,下调基因286个。随着杜仲叶片的发育,各个比较组合的差异基因数量各不相同,EuL518 vs EuL418组合差异基因数最多,占总DEGs的66.26%,而EuL717 vs EuL617组合差异基因数最少,仅占总DEGs的2.6%。

表3 测序序列与杜仲基因组比对情况一览表
注:测序序列总数.测序序列经过测序数据过滤后的数量统计(过滤序列);被定位序列总数.能定位到基因组上的测序序列的数量;多次定位序列数.在参考序列上有多个比对位置的测序序列的数量;定位到正链序列数、定位到负链序列数.测序序列比对到基因组上正链或负链的数量;完整比对序列数.为整段比对到外显子的测序序列数量;分段比对序列数.被定位序列中分段比对到2个外显子上的测序序列数量。
Note:Total reads.Number of filtered sequencing sequences(clean data);Total mapped.Number of mapped sequencing sequences;Multiple mapped.Number of sequences multiple mapped on reference sequences;Uniquely mapped.Number of sequences uniquely mapped on reference sequence;Reads map to ‘+’,Reads map to ‘-’.Number of sequences mapped on positive and minus strands of the genome;Non-splice reads.Number of sequences mapped in whole on an exons;Splice reads.Number of sequences mapped segmentedly on two exons in mapped sequences.
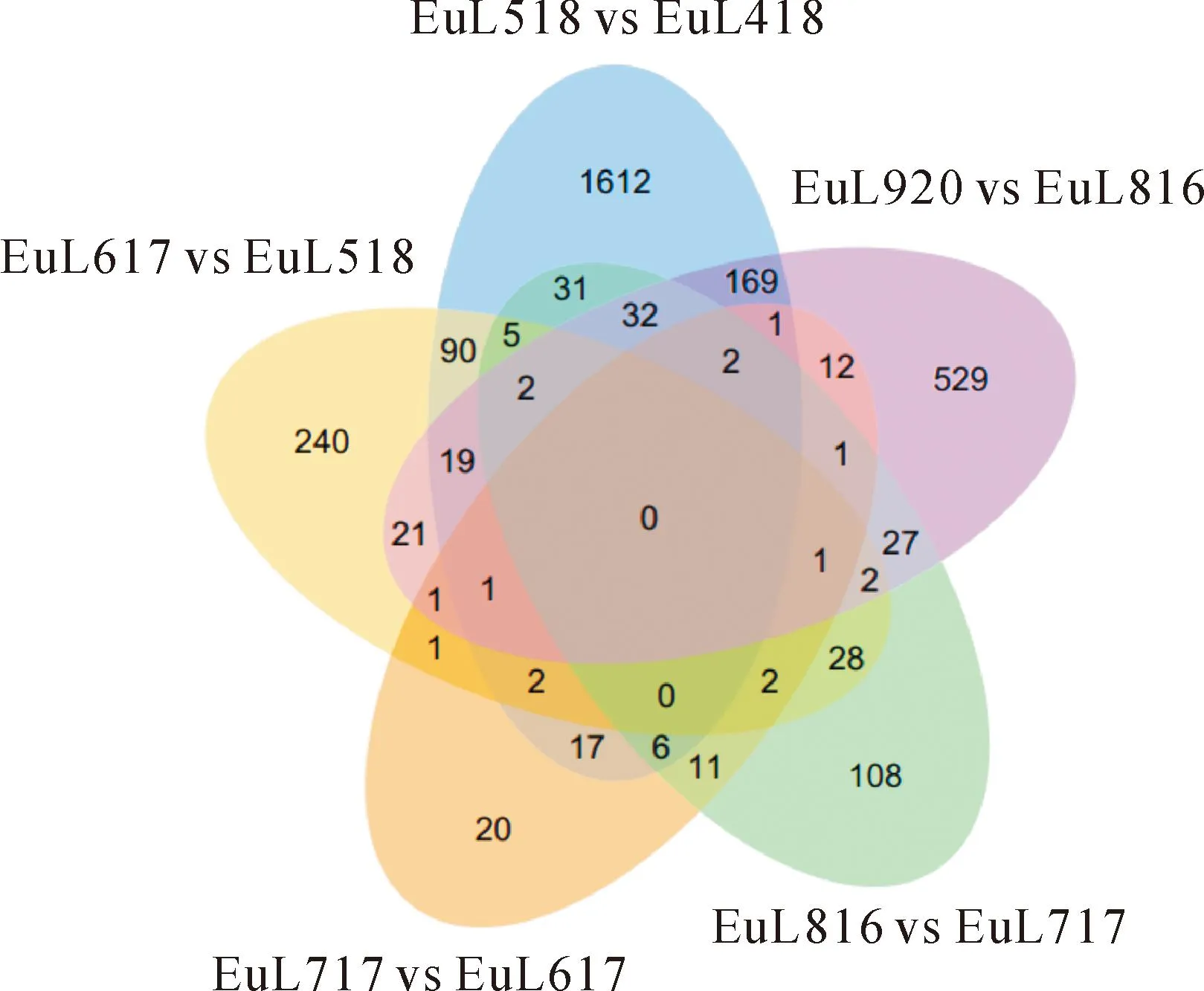
图1 差异基因Venn图
2.2.2不同发育时期差异基因的GO富集分析对差异基因进行Gene Ontology(GO)功能注释,可以确定差异基因及基因产物所在的细胞位置、分子功能以及参与的生物过程。本试验通过研究不同发育时期杜仲叶片差异基因的功能及差异显著基因的GO富集发现,5个相邻的比较组合分别获得1 394、585、212、413和954个GO注释。其中,属于生物过程分别为725、303、110、201和497个;属于细胞组分分别为146、54、19、35和109个;属于分子功能分别为523、228、83、177和348个。
另外,筛选在差异表达基因中显著富集的GO分类(P≤0.005),结果(表4)可以看出,不同组合显著富集的基因数量相差很大,所行使的功能也不尽相同。其中EuL518 vs EuL418比较组合显著富集的基因数最多,其中基因行使的主要分子功能是代谢活动和氧化还原活动,较多参与了生物过程和代谢过程;而EuL717 vs EuL617比较组合没有被显著富集的基因。
2.2.3不同发育时期差异表达基因的Pathway富集分析Pathway富集分析主要是确定差异表达基因参与的主要生化代谢途径和信号转导途径,为了研究杜仲叶片不同阶段发育时期中Pathway富集基因的变化规律,对相邻2个时期差异表达基因进行Pathway富集的进一步分析发现(图2),在EuL518 vs EuL418比较组合里共鉴定出105条代谢路径,注释到934个基因。通路主要集中在代谢通路、次生代谢物合成、丙酮酸代谢、植物激素信号转导、类胡萝卜素合成、黄酮类合成等,其中最显著富集的通路为次生代谢物合成,所涉及基因占总注释基因的12.4%;在EuL617 vs EuL518比较组合里共鉴定出51条代谢路径,注释到179个基因。通路主要集中在苯丙素类生物合成、光合作用、次生代谢物的合成、ABC转运蛋白等,其中最显著富集的通路为苯丙素类生物合成,所涉及基因占总注释基因的5.0%;在EuL717 vs EuL617比较组合里共鉴定出19条代谢路径,共注释到37个基因。通路主要集中在内质网中的蛋白质过程、苯丙氨酸及酪氨酸和色氨酸的合成、精氨酸和脯氨酸的代谢、苯丙素类生物合成等,其中最显著富集的通路为内质网中的蛋白质过程,所涉及基因占总注释基因的10.8%;在EuL816 vs EuL717比较组合里共鉴定出29条代谢路径,共注释到69个基因。通路主要集中在次生代谢物的合成、苯丙素类生物合成、淀粉和蔗糖代谢、亚麻酸代谢、植物激素信号转导等,其中最显著富集的通路为苯丙素类生物合成,所涉及基因占总注释基因的8.7%;在EuL920 vs EuL816比较组合里共鉴定出84条代谢路径,共注释到397个基因。通路主要集中在光合作用相关蛋白、苯丙素类生物合成、次生代谢物的合成、柠檬酸循环等,其中最显著富集的通路为光合作用相关蛋白,所涉及基因占总注释基因的2.0%。综上5组差异基因通路的富集可以看出,杜仲叶片在不同发育时期,进行着各种生物合成和代谢活动,多与各种次生代谢物质的合成代谢相关,说明杜仲叶片在发育的同时合成积累大量的活性物质。

表4 差异基因的GO功能显著性富集结果
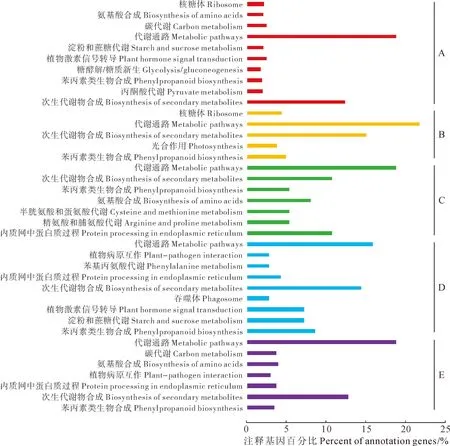
A.Eu518 vs Eu418比较组合;B.Eu617 vs Eu518比较组合;C.Eu717 vs Eu617比较组合;
*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
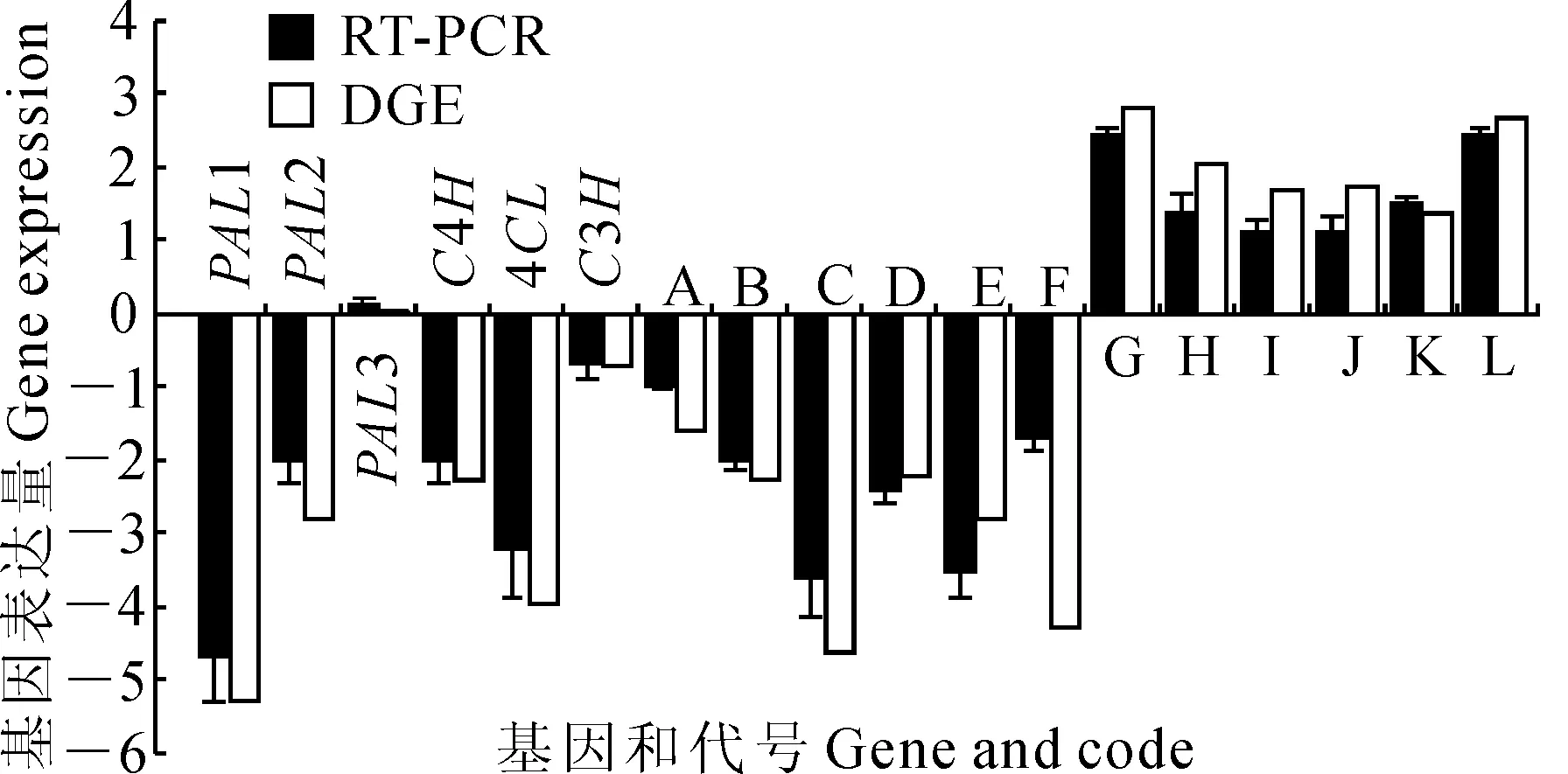
图4 DGE测序结果和RT-PCR表达量比对
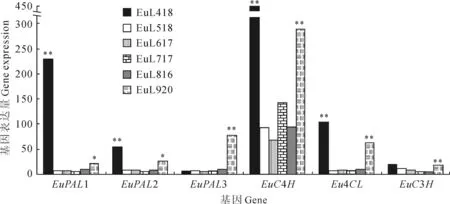
2.2.4杜仲绿原酸合成途径关键酶基因发掘对不同发育时期杜仲叶片DGE数据进行Pathway富集性分析发现,共有6个基因与绿原酸生物合成相关,其中包括苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)基因3个;肉桂酸-4-羟化酶(cinnamate 4-hydroxilase,C4H)基因1个;香豆酰-CoA连接酶(4-hydroxycinnamoyl-CoA ligase,4CL)基因1个;香豆酸-3-羟基化酶(coumaroylquinate 3′-monooxygenase,C3H)基因1个。不同时期基因的表达量显示,6个与杜仲绿原酸合成相关的基因在不同时期的叶片发育中均有表达,其中4月和9月中旬这2个时期基因表达量相对较高(图3)。
2.3荧光定量RT-PCR分析
利用相对定量法,从Eu518 vs Eu418组合(Eu418为对照)中将上述6个与杜仲绿原酸合成相关的基因(EuPAL1、EuPAL2、EuPAL3、EuC4H、Eu4CL、EuC3H)以及随机选择的6个显著下调的基因(A-F),和从Eu920 vs Eu816组合(Eu816为对照)中随机选择的6个显著上调的基因(G-L),表达量改变倍数的对数值进行比较(图4),结果显示:这18个基因RT-PCR表达量改变倍数和DGE结果虽然不完全成比例,但上下调趋势完全相同,大体趋势基本一致。说明这次数字表达谱测序结果具有较高的可信度。
3讨论
数字基因表达谱技术能快速检测植物在不同组织细胞、不同发育阶段以及在众多逆境环境胁迫下基因的表达差异,因此,数字基因表达谱技术在功能基因组学方面正在发挥着越来越重要的作用[11]。本实验采用数字基因表达谱技术对杜仲叶片不同生长发育时期的差异基因进行了比较研究,并将差异表达基因进行了GO和Pathway途径分类,为进一步研究杜仲药用的分子机理提供了必要的数据平台,为研究基因表达变化和多种活性成分之间的关系奠定了研究基础。
通过杜仲叶片不同发育时期基因表达对比分析发现,不同时期,杜仲叶片的差异基因的数量相差悬殊,行使的功能也不尽相同,说明杜仲叶片在生长发育过程中存在着丰富多样的生化进程。在EuL518 vs EuL418中,共检测到DEGs 1 989个,为5个对比组合中数量最多的,而据研究发现杜仲叶片从展叶到基本停止生长仅需要1个月左右,叶片大小在5月中旬就基本保持恒定不变[12-13],说明从4月中旬到5月中旬这一时期杜仲叶片外部形态和内部基因表达都发生了明显的变化。通过差异基因GO富集分析发现,这一时期的叶片中含有大量与微管合成、膜合成、细胞骨架等细胞组分相关的基因,而这些基因的表达正是参与细胞有丝分裂、细胞伸长、快速生长的必要原料,因此,推测杜仲叶片在生长发育过程中,主要通过调控细胞组分相关基因表达来影响叶片的生长。在EuL518 vs EuL418比较组合里共鉴定出105条代谢路径,其中最显著富集的通路为次生代谢物的合成,并且其中大多数次生代谢物途径相关酶基因出现下调表达;而EuL617 vs EuL518、EuL717 vs EuL617和EuL816 vs EuL717三个比较组合DEGs相对较少,经Pathway富集到的次生代谢物途径中相关的DEGs的数也很少;EuL920 vs EuL816比较组合的DEGs数量突然增多,且被Pathway富集到的次生代谢物途径中相关的DEGs大多数为上调。经大量杜仲叶中次生代谢物的成分测定发现,从5月到8月期间杜仲叶片内的次生代谢物变化处于相对平稳阶段,9月开始部分次生代谢物含量又开始上调[14-17],推测杜仲叶片内次生代谢物的增长速率与其合成途径相关基因的表达呈正相关性。我们可以根据这些基因的变化从中筛选出感兴趣的基因作为后续研究的基础。
苯丙素类化合物是杜仲中主要的药用活性成分,其中绿原酸作为苯丙素类重要的化合物之一,已得到了高度的重视[6,18]。迄今为止,杜仲中发现的苯丙素类化合物共11种,其中研究最多的是绿原酸,甚至有研究者认为绿原酸的含量直接决定着杜仲的利用价值[19]。目前,对杜仲绿原酸的研究主要集中在药理活性检测和成分提取方面,从基因表达水平对其进行研究鲜有报道,因此,本研究试图利用数字基因表达谱技术分析杜仲叶片中绿原酸代谢通路,确定相关酶基因。本研究中共发掘出6个与绿原酸合成相关的酶基因。其中,苯丙氨酸解氨酶(PAL),已被大量实验证明是绿原酸合成所必须的关键酶[20-21];肉桂酸-4-羟化酶(C4H)和香豆酰-CoA连接酶(4CL)是绿原酸奎宁酸和咖啡酰辅酶A缩合途径[22]与绿原酸香豆酰奎宁酸羟基化途径[23]共同上游关键酶;而香豆酸-3-羟基化酶(C3H)在绿原酸香豆酰奎宁酸羟基化合成途径中,可直接催化p-香豆酰奎宁酸生成绿原酸的关键酶基因[23]。对这6个基因的表达情况分析发现,不同基因在杜仲叶片发育时期均有表达,但表达差异相对较大,具有明显的偏好性,并以4月和9月基因的表达量较高。一般而言,基因表达量相对较高,且表达规律与绿原酸合成一致的基因可能就是关键的绿原酸合成调控基因。前人研究认为,杜仲叶片生长发育过程中绿原酸含量变化规律为4月中旬到5月中旬是杜仲叶片中绿原酸含量增长速度最快的阶段,随后一直到9月中下旬期间,绿原酸的含量变化相对较平缓,值得注意的是,从9月中下旬开始,绿原酸的含量增长速度突然上升[24]。EuPAL1和EuPAL2在4月中旬和9月中下旬的表达量显著增高,这2个基因的表达变化模式刚好与绿原酸含量变化规律相吻合,呈现出正相关的趋势,而EuPAL3只在9月中下旬有表达较高,说明同一家族基因成员在功能上应存在冗余;EuC4H和Eu4CL与EuPALs的基因表达模式相近,说明对杜仲叶片中绿原酸的合成应起到主要的作用;较比其他基因,EuC3H基因的表达量相对较低,因此,推测EuC3H基因通过香豆酰奎宁酸羟基化合成途径合成绿原酸应不是合成绿原酸的主要途径,这一结果与何柳相一致[25]。
植物数量性状的变化是由多个基因或者基因家族共同控制作用的结果,是一个相当复杂又协调有序的过程。单个基因表达情况的改变不足以反映特定功能或通路的整体变化情况,但是,个别功能重要的基因(主效基因)具有“Hub”节点的重要特性,它的功能改变可能对于整个网络来说是至关重要的。本研究首次利用DGE技术在转录水平上解析杜仲叶片生长发育过程中差异基因的表达模式以及功能分类,并分析了与杜仲叶片中重要药用活性成分绿原酸合成相关的酶基因,以期对杜仲绿原酸主效基因的筛选奠定理论基础,为挖掘杜仲中控制其它性状的关键基因提供参考,并为深入研究杜仲次生代谢产物的生物合成与代谢调控提供了理论基础。
参考文献:
[1]杜红岩.中国杜仲橡胶资源与产业发展报告[M].北京:社会科学文献出版社,2014:1.
[2]杜红岩.杜仲活性成分与药理研究新进展[J].经济林研究,2003,21(2):58-61.
DU H Y.The progress in research of the active component fromEucommiaulmoidesand its pharmacology[J].EconomicForestResearches,2003,21(2):58-61.
[3]李芳东.药用动植物种养加工技术:杜仲[M].北京:中国中医药出版社,2001:2.
[4]晏媛,郭丹.杜仲叶的化学成分及药理活性研究进展[J].中成药,2003,25(6):491-492.
YAN Y,GUO D.Research on chemical components and pharmacological activities inEucommialeaves[J].ChineseTraditionalPatentMedicine,2007,25(6):491-492.
[5]宣志红,浦锦宝,梁卫青.不同采收时期杜仲叶中活性成分变化规律的研究[J].中华中医药学刊,2013,31(6):1 336-1 338.
XUAN Z H,PU J B,LIANG W Q.Research onEucommialeaves acive ingredient variation in different harvest periods[J].ChineseArchivesofTraditionalChineseMedicine,2013,31(6):1 336-1 338.
[6]尉芹,马希汉,张康健.杜仲化学成分研究[J].西北林学院学报,1995,10(4):88-93.
WEI Q,MA X H,ZHANG K J.Research on the chemical ingredients inEucommiaulmoides[J].JournalofNorthwestForestryCollege,1995,10(4):88-93.
[7]辛晓明,冯蕾,王浩,等.杜仲的化学成分及药理活性研究进展[J].医学综述,2007,13(19):1 507-1 509.
XIN X M,FENG L,WANG H,etal.Study advancement about chemical composition and pharmacological actions ofEucommiaulmoides[J].MedicalRecapitulate,2007,13(19):1 507-1 509.
[8]陈欢,杨美英,王真慧,等.大豆籽粒不同发育时期基因表达谱分析[J].中国油料作物学报,2012,34(2):129-135.
CHEN H,YANG M Y,WANG Z H,etal.Gene expression profile of development soybean seeds[J].ChineseJournalofOilCropScineces,2012,34(2):129-135.
[9]MORTAZAVI A,WILLIAMS B A,SCHAEFFER L,WOLD B.Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].Nat.Methods,2008,5(7):621-628.
[10]ANDERS S,HUBER W.Differential expression analysis for sequence count data[J].GenomeBiology,2010,11(10):106-109.
[11]李超,荐红举,刘列钊,等.高温胁迫下油菜籽粒成熟期基因差异表达分析[J].西南大学学报,2014,36(11):19-25.
LI C,JIAN H J,LIU L Z,etal.Analysis of differential gene expression profiles ofBrassicanapusat seed maturation under heat stress[J].JournalofSouthwestUniversity,2014,36(11):19-25.
[12]杜红岩,杜兰英,谢碧霞,等.杜仲叶内杜仲胶形成积累的规律[J].中南林学院学报,2006,26(2):1-6.
DU H Y,DU L Y,XIE B X,etal.Dynamic accumulation of gutta-percha content inEucommiaulmoidesOliv.leaves[J].JournalofCentralSouthForestryUniversity,2006,26(2):1-6.
[13]赵红艳,王太霞,赵红棉,等.杜仲胶在杜仲叶发育过程中的含量变化研究[J].湖北农业科学,2012,51(18):4 065-4 068.
ZHAO H Y,WANG T X,ZHAO H M,etal.Study on the change of Gutta-Percha content inEucommiaulmoidesleaves during growth[J].HubeiAgriculturalSciences,2012,51(18):4 065-4 068.
[14]张康健,白明生,张檀,等.杜仲叶次生代谢物生长积累动态的研究[J].林业科学,2001,37(6):45-51.
ZHANG K J,BAI M S,ZHANG T,etal.A study on the growth feattures of inividuals and secondary metabolites ofEucommiaulmoidesleaves[J].ScientiaSilvaeSinicae,2001,37(6):45-51.
[15]张康健,马希汉,马梅,等.杜仲叶次生代谢物生长积累动态的研究[J].林业科学,1999,35(2):15-20.
ZHANG K J,MA X H,MA M,etal.A study on dynamic accumulation of metabolites during the growth ofEucmmiaulmoidesOliv[J].ScientiaSilvaeSinicae,1999,35(2):15-20.
[16]高致明,王太霞,喜进安.杜仲叶在生长发育过程中化学成分含量和结构的变化[J].河南农业大学学报,1997,31(2):145-148.
GAO Z M,WANG T X,XI J A.Study on changes of contents of chemical components and the structure ofEucommiaulmoidesOliv.leaves during growth[J].ActaAgriculturaeUniversitatisHenanensis,1997,31(2):145-148.
[17]成军,白焱晶,赵玉英,等.杜仲叶苯丙素类成分的研究[J].中国中药杂志,2002,27(1):38-39.
CHENG J,BAI Y J,ZHAO Y Y,etal.Studies on the phenylpropanoids fromEucommiaulmoides[J].ChinaJournalofChineseMateriaMedica,2002,27(1):38-39.
[18]向灿辉,靳洪莲,陈阳,等.杜仲叶绿原酸含量与抗氧化活性的相关性研究[J].食品工业,2013,34(12):149-151.
XIANG C H,JIN H L,CHEN Y,etal.Antioxidant activity analysis of chlorogenic acid extracted fromEucommialeaf[J].TheFoodIndustry,2013,34(12):149-151.
[19]张万锋.杜仲叶中绿原酸的生物合成机理探究[J].安康学院学报,2008,20(5):85-86.
ZHANG W F.Deteim ination and discussion on the biosynthesis of photogenic acid in theEucommiaulmoidesOliv[J].JournalofAnkangUniversity,2008,20(5):85-86.
[20]ZUCKER M,LEVY C C.Some factors which affect the synthesis of chlorogenic acid in disks of potato tuber[J].PlantPhysiol.,1959,34:108.
[21]ZUCKER M,NITSCH C,NITSCH J P.The induction of NicotianaⅡPhotoperiodic alteration of the chlorogenic acid concentration[J].Amer.Jour.Bot.,1965,52:271.
[22]ULBRICH B,ZENK M H.Partial purification and properties of hydroxycinnamoyl-CoA:quinate hydroxycinnamoyl transferase from higher plants[J].Phytochem.,1979,18:929.
[23]HOFFMANN L,MAURY S,MARTZ F.Purification,cloningand properties of an acyltransferase controlling shikimate and quinate ester intermediates in phenylpropanoid metabolism[J].J.Biol.Chem.,2003,278:95.
[24]杜红岩,刘昌勇,李钦,等.杜仲叶中3种主要活性成分含量的季节变化[J].中南林业科技大学学报,2011,31(8):6-9.
DU H Y,LIU C Y,LI Q,etal.Seasonal variation of three main active constituent contents in leaves ofEucommiaulmoides[J].JournalofCentralSouthUniversityofForestry&Technology,2011,31(8):6-9.
[25]何柳,陈士林,等.植物中绿原酸合成途径研究进展[J].药物生物技术,2013,20(5):463-466.
HE L,CHEN S L,etal.Research progress on synthesis of chlorogenic acia in plants[J].PharmaceuticalBiotechnology,2013,20(5):463-466.
(编辑:宋亚珍)
Analysis of Digital Gene Expression aboutEucommiaulmoidesOliver Leaves at Different Developmental Stages
JING Teng1,2,WANG Lin1,2,WUYUN Tana1,2,DU Hongyan1,2*
(1 Non-timber Forest Research and Development Center of Chinese Academy of Forestry,Zhengzhou 450003,China;2 The Eucommia Engineering Research Center of State Forestry Administration,Zhengzhou 450003,China)
Abstract:To clarify the gene expression patterns of Eucommia ulmoides Oliver leaves in the process of development at the transcription level,this study compared and analyzed the gene expression level of ‘Huazhong 6’ leaves in different development periods from expanding (April) to falling (October) by digital gene expression profile technology.A total of 3 002 different expression genes were obtained,in which 1 764 up-regulated expression and 1 238 down-regulated expression.These mainly function referred to catalytic activity or oxidoreductase activity,and involved in metabolic process and biological process.Through further pathway enrichment analysis,we found that several related genes of phenylpropanoid biosynthesis pathway were enriched,in which six significantly different expression genes were related to chlorogenic acid synthesis.The gene expression patterns showed that these genes are highly expressed in mid-April and mid-Septemeber,which suggested that these two periods play an important role for chlorogenic acid synthesis.By real-time fluorescent quantitative PCR,6 chlorogenic acid synthesis genes and 12 randomly different expression genes were detected,and the results verified the reliability of digital gene expression profile.This study lays a solid foundation for revealing the molecular regulation mechanism of E.ulmoides Oliver leaves in different development periods,and provides the reference for further clarifying the synthesis mechanism of E.ulmoides Oliver chlorogenic acid and then improve E.ulmoides Oliver chlorogenic acid content by means of molecular breeding.
Key words:Eucommia ulmoides Oliver leaf;digital gene expression profile;different expression gene;chlorogenic acid
中图分类号:Q789
文献标志码:A
作者简介:荆腾(1991-),男,在读硕士研究生,主要从事杜仲育种研究。E-mail:tengshanj315@163.com*通信作者:杜红岩,研究员,博士生导师,主要从事杜仲育种、栽培与综合利用的研究。E-mail:dhy515@126.com
基金项目:国家十二五科技支撑计划(2012BAD21B0502);国家公益性行业科研专项(201004029)
收稿日期:2015-11-06;修改稿收到日期:2015-12-10
文章编号:1000-4025(2016)02-0257-09
doi:10.7606/j.issn.1000-4025.2016.02.0257

