UV-B辐射增强对紫茎泽兰和艾草抗性生理特性的影响
李良博,张连根,唐天向,海梅荣,周 平*
(1 云南农业大学 农学与生物技术学院,昆明 650201;2 云南农业大学 学生处,昆明 650201)
UV-B辐射增强对紫茎泽兰和艾草抗性生理特性的影响
李良博1,张连根2,唐天向1,海梅荣1,周平1*
(1 云南农业大学 农学与生物技术学院,昆明 650201;2 云南农业大学 学生处,昆明 650201)
摘要:以外来入侵杂草紫茎泽兰(Eupatorium adenophorum L.)和本地土著杂草艾草(Artemisia argyi Levl)为材料,以自然光照为对照,用增强UV-B(0.46 mW·cm-2·h-1)对材料进行7周辐射处理,随后停止辐射增强进行恢复试验,观察2种植物的生长状况,测定分析其光合特性、氧化物和抗氧化物含量、抗氧化酶活性的变化,探讨在紫外UV-B辐射增强条件下2种植物光合作用、光保护及损伤修复能力的差异。结果表明:(1)随着辐射时间的增长,2类植物叶片开放的PSⅡ反应中心激发能捕获效率(Fv′/Fm′)和PSⅡ凌晨最大潜在最大光化学效率(Fv/Fm)受到轻微抑制,但紫茎泽兰最大净光合速率(Pn max)受到的抑制比艾草更明显。(2)2类植物叶片内过氧化产物丙二醛(MDA)和超氧基离子)的含量增加,但艾草中的相对累积比例比紫茎泽兰要高很多。(3)紫茎泽兰的抗氧化物抗坏血酸(ASA)和谷胱甘肽(GSH)的含量先增加后减少,艾草中的含量则保持在更高水平;2种植物的过氧化物酶(POD)和超氧化物歧化酶(SOD)活性都显著增强,抗坏血酸过氧化物酶(APX)活性都先增强后减弱,紫茎泽兰的过氧化氢酶(CAT)活性逐渐被抑制,而艾草则是先增强后减弱。研究认为,紫茎泽兰和艾草对UV-B辐射增强的光合作用和抗氧化系统响应过程类似但存在差异,对增强UV-B辐射环境的适应能力及抗逆性均较强。
关键词:UV-B辐射;紫茎泽兰;艾草;生理变化
外来植物入侵是全球变化的重要内容之一,并与土地利用变化、气候变化等协同作用,加剧着人类生存环境的恶化[1-2],成为环境科学和生态学的研究焦点。目前,关于外来植物入侵机理的研究已广泛开展,学者们基于一些研究成果提出了相关假说,如天敌逃逸假说(enemy release hypothesis,ERH)[3]、新式武器假说(novel weapon hypothesis,NWH)[4]和内在优势假说(inherent superiority hypothesis,ISH)[5]等等。其中内在优势假说指比起本地植物,入侵植物在进化过程中获得了更多的变异,从而能够忍受更广泛的生态条件、利用更多的资源类型。如银胶菊(PartheniumhysterophorusL.)和许多入侵力强的植物一样具有强大的无性繁殖能力,且其种子适应力、耐贫瘠能力强[6-7];在高浓度CO2的环境下,入侵植物飞机草(Chromolaenaodorata)的生物量和株高等形态指标显著高于本土植物异叶泽兰(Eupatoriumheterophyllum)[8];美洲商陆(Phytolaccaamericana)可以根据光环境的变化来调整形态和生理适应性[9]。强大的抗逆能力使入侵植物在不同环境下得以生存。然而,无论是入侵植物还是本土植物,在逆境胁迫下他们的生理生化指标变化存在差异[10]。
自1985年南极臭氧空洞被发现以来,在全球范围内的观测表明,近10年来全球臭氧层平均减少了2%~3%,并且这一过程还在加剧[11]。至2026年,预计臭氧层将减少约16%[12],UV-B辐射强度将增强约15%[13]。在UV-B辐射继续增强的全球变化背景下,由于每种植物防护和修复UV-B辐射损伤的能力不同,在生理上做出的反应也不尽相同。UV-B辐射增强对植物光合作用的影响主要表现在:植物光合系统反应中心被破坏、希尔反应活性降低、叶绿体和光合色素的损伤以及气孔关闭或阻力增大等方面,从而影响植物光合作用的净光合速率、净同化率和气孔传导率[14-15]。另外,UV-B辐射增强会导致植物体内自由基水平显著提高,打破活性氧(ROS)的平衡系统,产生氧化胁迫[16],而抗氧化系统的应激是植物清除过量ROS的主要防御机制[17]。正是因为每种植物防护和修复UV-B辐射损伤的能力不同,这将在植物种间竞争的过程中产生强大的选择压力。然而,人们很少关注紫外UV-B辐射增加对外来植物竞争和入侵能力有何影响,关于外来入侵植物对紫外UV-B辐射增加的响应机制和适应策略我们还知之甚少。
紫茎泽兰(EupatoriumadenophorumL.)属菊科多年丛生型半灌木草本植物,作为一种世界性入侵恶性杂草,它原产于南美洲墨西哥至哥斯达黎加一带,于20世纪40年代传入中国云南边境地区,现已在西南地区广泛分布,并仍以每年约20 km速度随西南风向东和向北传播蔓延,给当地的农、林、畜牧业生产造成了严重的经济损失,并给生态系统造成了巨大的负面影响[18-19]。由于危害范围广泛、程度严重,国内很多学者已经对其进行了大量研究,但目前中国对紫茎泽兰的控制和利用的方法普遍低效且耗资大[20]。艾草(ArtemisiaargyiLevl) 属菊科多年生草本或略成半灌木状植物,分布较广,局部地区为植物群落的优势种[21]。本研究以本地土著杂草艾草和外来入侵杂草紫茎泽兰为试验材料,在人工增加UV-B辐射强度的条件下,探讨外来入侵杂草紫茎泽兰与本地土著杂草艾草响应UV-B辐射增加光合作用、光保护和损伤修复能力的差异,为UV-B辐射持续增强的全球变化背景下入侵植物的控制和防除提供理论依据。
1材料和方法
1.1试验地概况
本试验于2014年6月开始在云南农业大学后山教学实验农场进行。云南农业大学位于昆明市北郊(25°08′N,102°45′E),海拔1 966 m,年平均温度15.1 ℃,年降雨量1 000 mm,干湿季节明显,每年5月到10月为雨季,11月至次年的4月为干季,属亚热带季风气候。
1.2试验设计
2012年5月在中国科学院昆明植物园周围收集紫茎泽兰种子,7月28日播种,株距为40 cm,行距为40 cm,为了创造一个仿原生态环境,播种后在土壤表面覆盖马尾松松针。2014年清明前后除去枯死的枝干后植株抽青;2014年6月底,随机拔除一半的紫茎泽兰植株后,带土移栽野外生长2年且长势相近的艾草植株,使紫茎泽兰和艾草植株数量比为1∶1。期间及时拔除试验地中的其它杂草,定时浇水,保持大棚内环境稳定。
试验地划分为两个试验区,一个为对照区,另一个为UV-B辐射增强区,两试验区之间设有保护行。试验环境背景UV-B辐射强度为0.4 mW·cm-2·h-1,在处理组试验区中,选择FS-40荧光灯(南京华强电子公司生产,属于UV-B光谱)作为增强紫外光源,模拟UV-B辐射强度增加15%,试验期间UV-B辐射强度达到0.46 mW·cm-2·h-1(紫外辐射强度使用日本TANDD公司TR-74ui辐照计测定)。随着植株生长不断调节紫外灯管高度,使其与植株顶端的距离始终保持在30~35 cm之间,保证植物的顶层叶片接受人工追加的UV-B辐射强度不因植物的生长而变化。2014年8月14日起开启紫外灯照射,每天的照射时间为9:00~17:00,每隔7 d采样1次,测定相关生理指标,试验时间为7周,10月2日停止照射;并在结束照射后第3周和第4周采样(即第10和11次采样)测定相同生理指标。
1.3测定指标及方法
从2014年8月14日开始,每隔7 d采样1次,对长势一致的健康叶片进行标记,紫茎泽兰和艾草处理组和对照组各10片,采样前一天晚上对其测定光合作用指标;观察植株形态并摘取两试验区植物顶端同龄成熟健康叶片(倒三叶)于-80 ℃超低温冰箱储存,用于其它指标的测定。由于艾草生长发育进入花期,叶片逐渐变小,实验材料取成熟叶片(不只倒三叶),恢复试验时停止采样。
1.3.1光合作用指标在晴天凌晨4:00~6:00,用Li-6400XT便携式光合作用测定系统(Li-Cor Inc.,Lincoln,NE,USA)测量标记的紫茎泽兰和艾草叶片的荧光参数和气体交换参数,分别为PSⅡ凌晨潜在最大光化学效率(Fv/Fm)和暗呼吸速率(Rd),光照强度设置为0 mol·m-2·s-1;在上午9:00~11:30测量开放的 PSⅡ反应中心激发能捕获效率(Fv′/Fm′)和最大净光合速率(Pn max),光照强度设置为800 mol·m-2·s-1。测定过程中使用开放气路,叶室温度设置为25.0 ℃,CO2浓度为380 mol·mol-1,并使用仪器自配的荧光光源(蓝光10%)以及CO2注入系统。
1.3.3抗氧化酶活性参考Nakano[26]方法测定抗坏血酸过氧化物酶(APX)活性,在波长290 nm下监测吸光值5 min内的减小情况,酶活性单位以每克新鲜叶片在每分钟变化的吸光度为准。参考Aebi[27]的方法测定过氧化氢酶(CAT)活性,在波长240 nm下监测吸光值3 min内的减小情况,酶活性单位以每克新鲜叶片在每分钟变化的吸光度为准。参考Polle[28]的愈创木酚法测定过氧化物歧化酶(POD)活性,在波长470 nm下监测吸光值5 min内的增大情况,酶活性单位以每克新鲜叶片在每分钟变化的吸光度为准。参考Giannopolitis[29]的氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性,在560 nm下的吸光度值,以NBT光还原的50%为1个酶活单位。
1.4数据分析
采用Excel 2003和SPSS 17.0(SPSS Inc,USA)软件统计分析试验数据,利用独立样本t检验和Duncan多重比较法进行差异显著性分析,显著水平设为0.05;采用Excel 2003进行作图。
2结果与分析
2.1UV-B辐射增强对2种受试植物光合特性的影响
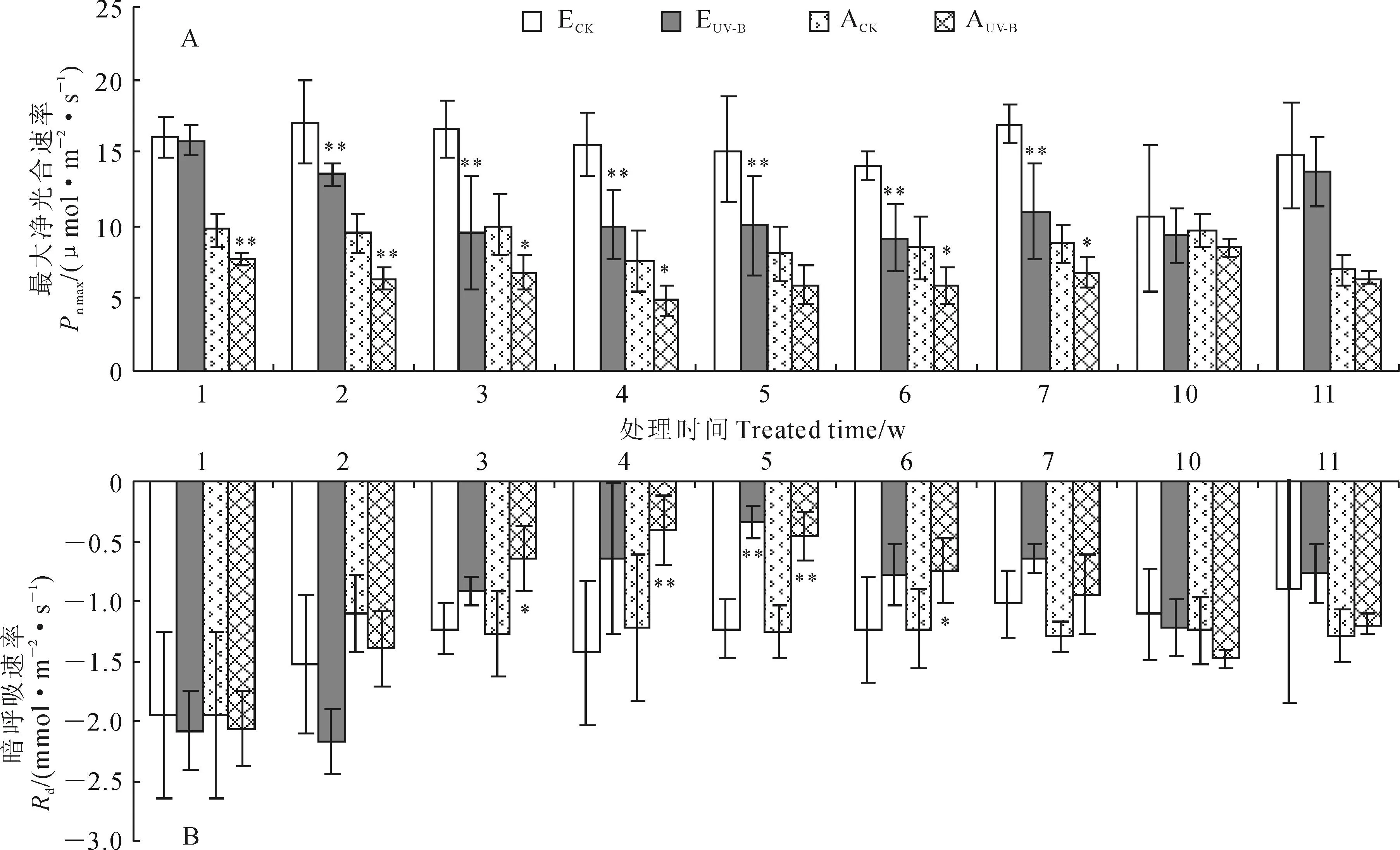
2.1.1最大净光合速率和暗呼吸速率在UV-B辐射下,紫茎泽兰对照组(ECK)、紫茎泽兰处理组(EUV-B)、艾草对照组(ACK)和艾草处理组(AUV-B)表现出不同的光合作用响应特征(图 1)。其中,紫茎泽兰在UV-B辐射后,EUV-B的Pn max在前3周急剧下降(P<0.01),第3周为ECK的60%,随后稳定在ECK的65%左右,在结束照射3周(处理第10周,下同)后恢复至对照水平(图1,A);而艾草处理组AUV-B的Pn max从第1周开始就比ACK显著下降(P<0.01),辐射后5周始终保持在ACK的80%左右,停止照射3周后(恢复实验)已基本与对照组一致(图1,A)。在增强UV-B辐射处理前2周,紫茎泽兰和艾草处理组的暗呼吸速率(Rd)变化趋势相似,它们在辐射前2周都有所加强,分别为相应对照组的1.4倍和1.3倍左右,辐射第3周之后又下降,被抑制降至对照组的30%左右,在辐射第6周后抑制作用减弱,维持在对照组的60%左右(图1,B)。可见,与对照相比较,紫茎泽兰和艾草处理组的最大净光合速率在增强UV-B辐射处理后显著减小,暗呼吸速率逐渐减小,但艾草的响应速度比紫茎泽兰快,2类杂草在停止增强辐射后恢复状况良好。
2.1.2叶绿素荧光参数紫茎泽兰和艾草对照组和处理组开放的 PSⅡ反应中心激发能捕获效率(Fv′/Fm′) (图 2,A)和PSⅡ凌晨最大潜在最大光化学效率(Fv/Fm)(图 2,B)的变化情况在增强UV-B辐射条件下的响应特征类似(图2)。其中,在增强UV-B辐射第2~5周,EUV-B的Fv′/Fm′比ECK极显著(P<0.01)或显著降低(P<0.05)10%左右,而在第6周和第7周差异不明显;AUV-B的Fv′/Fm′在UV-B辐射前4周比ACK有所降低,但只在第2周差异显著(P<0.05),第5周之后几乎没有影响;2种杂草Fv′/Fm′在停止UV-B辐射3-4周后基本恢复到对照组水平。同时,紫茎泽兰和艾草处理组的Fv/Fm在增强UV-B辐射期间都有所降低,但均在对照组的98%以上,且只有艾草在第2周显著下降;停止UV-B辐射3~4周后,2种杂草Fv/Fm与对照组都没有显著差异。这表明了增强UV-B辐射期两类植物叶绿素荧光只是稍稍被抑制。
2.2UV-B辐射增强对2种受试植物氧化伤害物含量的影响

每个点的值为平均值±标准差(n=7)。ECK、EUV-B、ACK和AUV-B分别表示紫茎泽兰对照组、紫茎泽兰处理组、

图2 紫茎泽兰和艾草叶片开放的 PSⅡ反应中心激发能捕获效率(A)和PSⅡ凌晨
2.3UV-B辐射增强对2种受试植物抗氧化物含量的影响
图4,A显示,紫茎泽兰EUV-B的ASA含量随增强UV-B辐射处理时间的延长表现为先增加后减少的变化趋势,并在处理第4周时达到极大值,此时约为ECK的1.2倍,至第7周之后几乎与ECK没有差异;艾草AUV-B的ASA含量在增强UV-B辐射初期就很高,一直保持在ACK的1.6~1.9倍之间,并维持着极显著差异(P<0.01)。同时,紫茎泽兰EUV-B和艾草AUV-B处理组中GSH的含量都呈现出一个先增加后减少的过程,分别在辐照处理第3周和第4周时达到极大值,此时分别为相应对照(ECK和ACK)的2.8倍和2.6倍;EUV-B在第7周后几乎与ECK一致,而AUV-B在第7周与处理第1周相近,仍为ACK的1.6倍(图4,B)。恢复实验时,紫茎泽兰EUV-B处理中ASA和GSH的含量与ECK中的一致。
2.4UV-B辐射增强对2种受试植物抗氧化酶活性的影响
紫茎泽兰和艾草对照组和处理组中几种重要的抗氧化酶活性的变化情况如图5所示。其中,抗坏血酸过氧化物酶(APX)活性在2类植物中都表现为先增加后降低的趋势,并在处理第2周活性增加至最大,此时EUV-B和AUV-B分别为相应对照的2.2倍和1.6倍;EUV-B的APX活性从第4周开始被显著抑制,约为ECK的60%,而AUV-B则在第3周开始被抑制,但直至第7周才达到显著水平(图5,A)。EUV-B处理的过氧化氢酶(CAT)活性在增强UV-B辐射处理前3周逐渐下降,并达到显著水平,在第3周和第4周不到ECK的50%,随后仍维持在较低水平;AUV-B处理的CAT活性在前2周有所增加,之后逐渐降低,在第6周时与对照组差异达极显著水平,仅为ACK的50%左右(图5,B)。过氧化物酶(POD)活性在2类植物中都随辐照处理迅速增加,并保持在显著较高水平,EUV-B处理POD活性在第4周时最大,AUV-B在第3周开始活性保持高的水平;在辐照处理过程中,EUV-B和AUV-B处理的POD活性分别是相应对照1.6~2.5倍和1.2~1.4倍左右(图5,C)。随着辐射时间的增加,2类植物中超氧化物歧化酶(SOD)活性都有所增加,EUV-B表现为逐渐增加趋势,在第7周时约为ECK的1.8倍,而AUV-B的SOD活性在前3周为ACK的1.5~3.0倍,后几周保持在2.5倍左右(图5,D)。恢复实验显示,EUV-B处理的上述4种抗氧化酶活性已恢复至ECK水平。
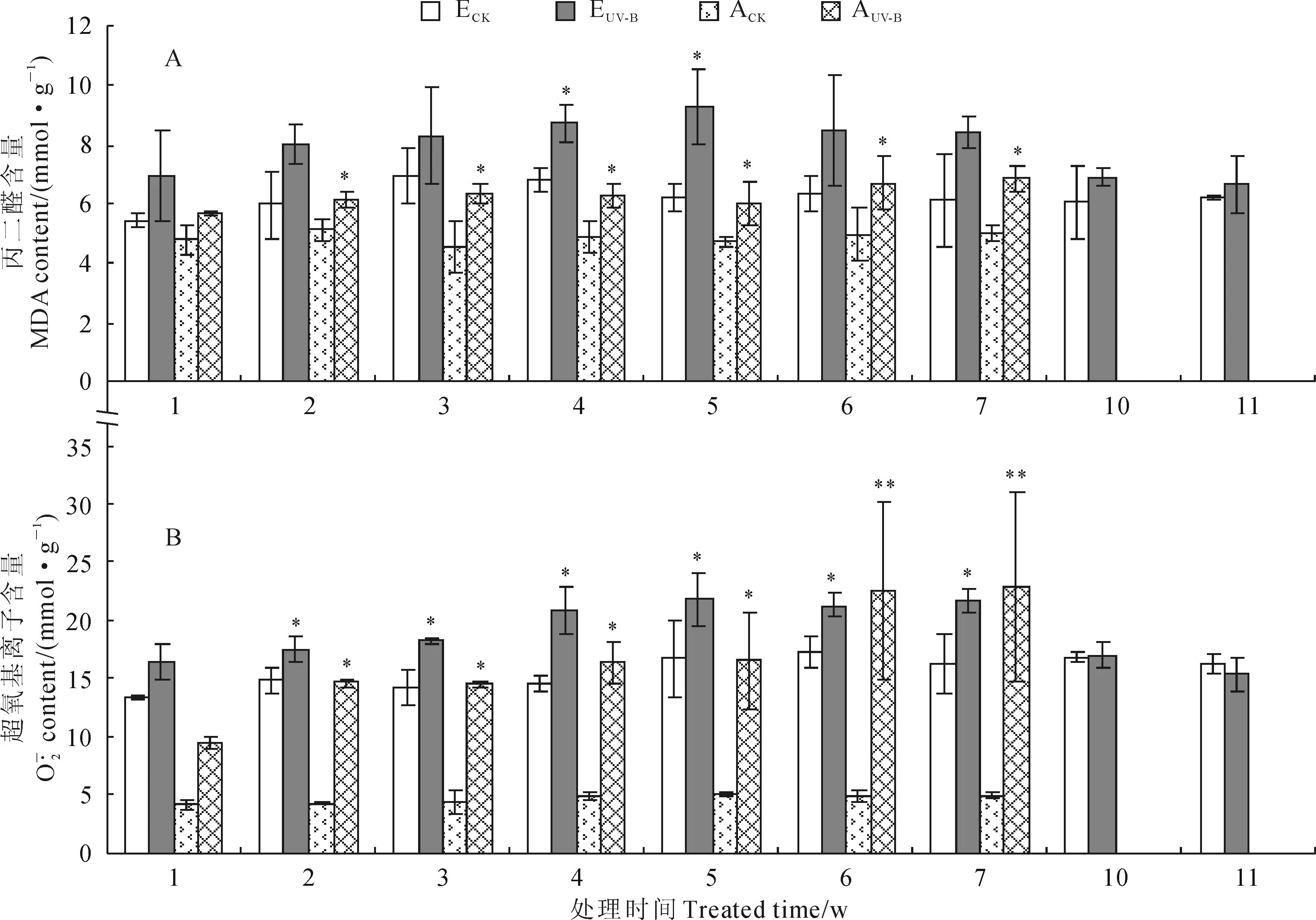
图3 紫茎泽兰和艾草叶片丙二醛(A)和超氧基离子(B)含量在不同辐射处理时间的变化

图4 紫茎泽兰和艾草叶片抗坏血酸(ASA)和谷胱甘肽(GSH)含量在不同辐射处理时间的变化
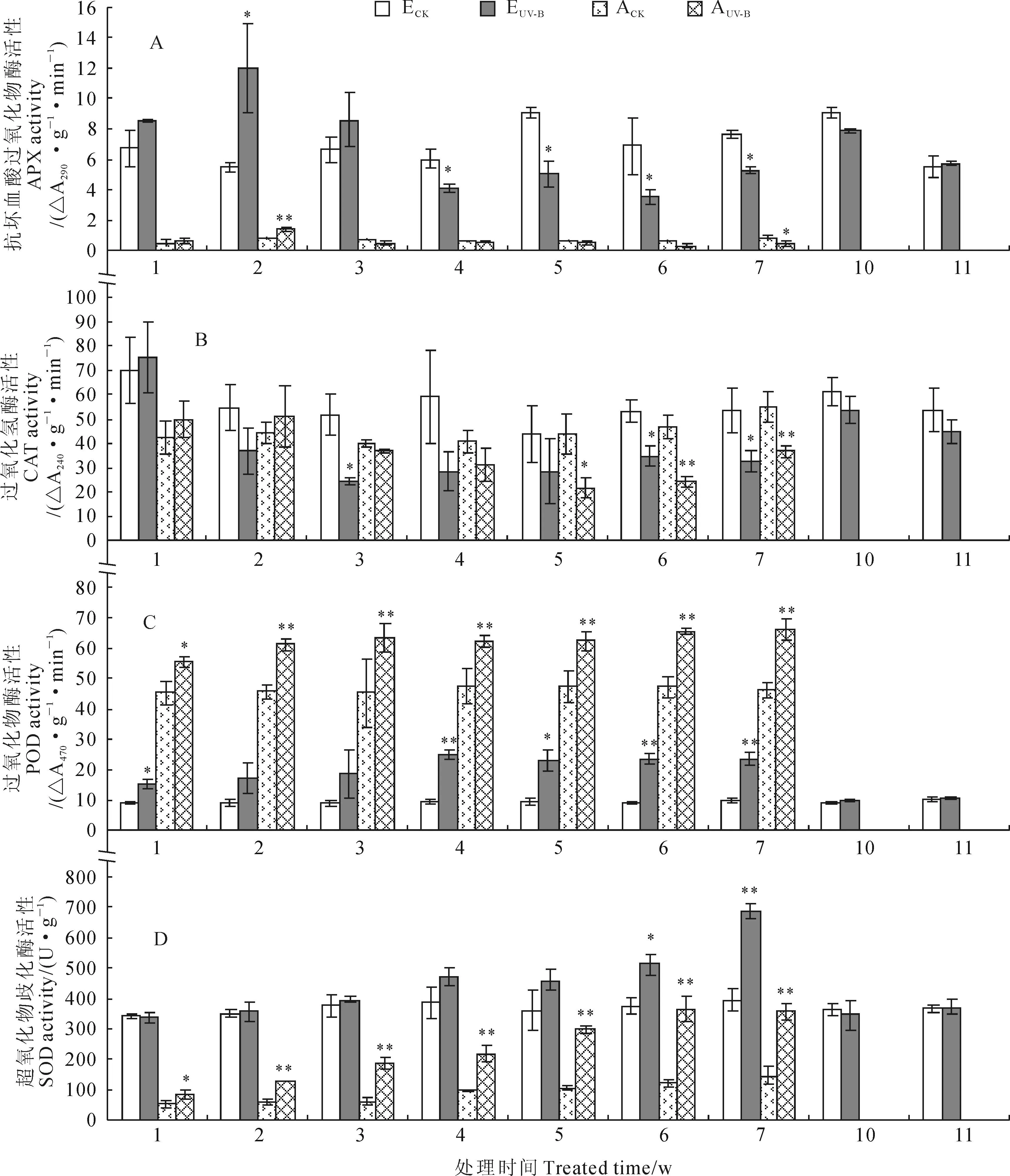
图5 紫茎泽兰和艾草叶片抗氧化酶活性在不同辐射处理时间的变化
3讨论
光合作用是植物利用光能的生理反应,对光照强度、光质的变化反应特别敏感;植物叶片净光合速率和叶绿素荧光参数的强弱反映了植物光合作用能力的强弱,后者更具有内在反馈光合能力的特点[30]。许多研究证实增强UV-B辐射对植物光合作用有着显著的影响,并且这种影响与UV-B辐射的时间长短和剂量的累积有关,同时不同植物对辐射敏感性也存在较大差异[15],但是很少有关于辐射后植物恢复的研究报道。本研究结果表明外来入侵植物紫茎泽兰和本土土著植物艾草在0.46 mW·cm-2·h-1的UV-B辐射强度下,它们的最大净光合速率显著下降,暗呼吸速率也逐渐降低,叶绿素荧光参数有些许降低,这与玉米(ZeamaysL.)和云杉(Piceaasperata)对UV-B辐射的响应相似,可能是膜系统和叶绿体光合结构损伤所致[31-32]。同时,本研究发现在增强UV-B辐射的前3周,紫茎泽兰处理组的最大净光合速率逐渐下降至对照60%,第4周之后保持在65%,而艾草处理组在辐射初期就下降到80%左右并保持这个速率;紫茎泽兰处理组的Fv′/Fm′ 和Fv/Fm在前3周逐渐下降,而艾草在前2周下降后趋于稳定,二者相比较而言,艾草对增强UV-B辐射的光合作用响应速度更为迅速,光合作用的适应能力相对较强。另外,研究还发现此增强UV-B辐射强度对2类杂草光合作用的抑制作用是可逆的。

综上所述,本实验发现外来入侵杂草紫茎泽兰与本地土著杂草艾草对UV-B辐射增强的光合作用和抗氧化系统响应过程类似但也存在差异;在光合作用方面,艾草的响应速度比紫茎泽兰快,而在抗氧化能力方面,紫茎泽兰氧化物清除能力比艾草强,2类杂草对UV-B辐射环境的适应能力及抗逆性都比较强。可能是艾草作为一种本土杂草在其长期生长进化过程中适应了高海拔地区高辐射的环境,而紫茎泽兰作为一种入侵杂草在其入侵并进化的过程中获得了更多的变异,从而能够忍受更广泛的生态环境。在UV-B辐射持续增强的全球变化背景下,2类植物都具有有效的生理反应变化机制来适应环境的变化,在野外相同条件下的竞争各有优势,两者竞争关系上生物量或相对生长速度的差异研究还需进一步开展。
参考文献:
[1]BRADLEY B A,BLUMENTHAL D M,WILCOVE D S,etal.Predicting plant invasions in an era of global change[J].TrendsinEcologyandEvolution,2010,25(5):310-318.
[2]朱丽,马克平.洲际入侵植物生态位稳定性研究进展[J].生物多样性,2010,18:547-558.
ZHU L,MA K P.On the niche stasis of intercontinental invasive plants[J].BiodiversityScience,2010,18:547-558.
[3]KEANE R M,CRAWLEY M J.Exotic plant invasions and the enemy release hypothesis[J].TrendsinEcologyandEvolution,2002,17:164-170.
[4]CALLAWAY R M,MARON J L.What have exotic plant invasions taught us over the past 20 years[J].TrendsinEcologyandEvolution,2006,21(7):369-374.
[5]MARON J L,VILA M,ARNASON J.Loss of enemy resistance among introduced populations of St.John’s Wort (Hyperiumperforatum)[J].Ecology,2004,85(12):3 243-3 253.
[6]KESER L H,DAWSON W,SONG Y B,etal.Invasive clonal plant species have a greater root-foraging plasticity than non-invasive ones[J].Oecologia,2014,174:1 055-1 064.
[7]高兴祥,李美,高宗军,等.外来入侵杂草银胶菊种子萌发特性及无性繁殖能力研究[J].生态环境学报,2013,22(1):100-104.
GAO X X,LI M,GAO Z J,etal.Seed germination characteristics and clone reproductive capacity ofPartheniumhysterophorusL.[J].EcologyandEnvironmentalSciences,2013,22(1):100-104.
[8]柴伟玲,类延宝,李阳平,等.外来入侵植物飞机草和本地植物异叶泽兰对大气CO2浓度升高的响应[J].生态学报,2014,34(13):3 744-3 751.
CHAI W L,LEI Y B,LI Y P,etal.Responses of invasiveChromolaenaodorataand nativeEupatorumheterophyllumto atmospheric CO2enrichment[J].ActaEcologicaSinica,2014,34(13):3 744-3 751.
[9]董周焱,柏新富,张靖梓,等.入侵植物美洲商陆对光环境的适应性[J].生态学杂志,2014,33(2):316-320.
DONG Z Y,BAI X F,ZHANG J Z,etal.Adaptability of an invasive plant phytolacca americana to varied light environment[J].ChineseJournalofEcology,2014,33(2):316-320.
[10]裴丽丽,郭玉华,徐兆师,等.植物逆境胁迫相关蛋白激酶的研究进展[J].西北植物学报,2012,32(5):1 052-1 061.
PEI L L,GUO Y H,XU Z S,etal.Research progress on stress related protein kinases in plants[J].ActaBot.Boreal.-Occident.Sin.,2012,32(5):1 052-1 061(in Chinese).
[11]PAUL J.Crutzen Ultraviolet on the increase[J].Nature,1992,356:104-105.
[12]KERR L B,MCELROY C T.Evidence for large upward trend of ultraviolet-B radiation linked to ozone depletion[J].Science,1993,262:1 032-1 034.
[13]United Nations Environment Programme (UNEP).Environmental effects of ozone depletion and its interactions with climatechange:2002 assessment[R].Nairobi,Kenya,2002.
[14]刘明雪,孙梅,王宇,等.植物UV-B受体及其介导的光信号转导[J].植物学报,2012,47(6):661-669.
LIU M X,SHUN M,WANG Y,etal.Arabidopsis UV-B photoreceptor and its light signal transduction in plants[J].Chin.BullBot.,2012,47(6):661-669.
[15]KAKANI VG,REDDY K R,ZHAO D,etal.Effect of ultra-violet-B radiation on cotton (GossypiumhirsutumL) morphology and anatomy[J].AnnalsofBotany,2003,91(77):817-826.
[16]SWINDELL W R,HUEBNER M,WEBER A P.Transcription profiling ofArabidopsisheat shock protein and transcription factor reveals extensive overlap between heat and non-heat stress response pathways[J].BMCGenomics,2007,8:125-134.
[17]ROSSEL J B,WILSON I W,POGSON B J,etal.Global changes in gene expression in response to high light inArabidopsis[J].PlantPhysical,2002,130:1 109-1 120.
[18]万方浩,刘万学,郭建英,等.外来植物紫茎泽兰的入侵机理与控制策略研究进展[J].中国科学:生命科学,2011,41(1):13-21.
WANG F H,LIU W X,GUO J Y,etal.Invasive mechanism and control strategy ofAgeratinaadenophora(Sprengel)[J].Sci.ChinaLifeSci.,2011,41(1):13-21.
[19]桂丽梅,苏梅,丁艳芬,等.紫茎泽兰的特征特性与综合开发利用研究进展[J].现代农业科技,2012,19:108-112.
GUO L M,SU M,DING Y F,etal.Research advances on characteristics and development ofEupatoriumadenophorumSprengel[J].ModernAgriculturalSciencesandTechnology,2012,19:108-112.
[20]周启武,于龙凤,王绍梅,等.入侵植物紫茎泽兰的危害及综合防控与利用[J].动物医学进展,2014,35(5):108-113.
ZHOU Q W,YU L F,WANG S M,etal.Harm,comprehensive control and utilization of invansion plantE.adenophorum[J].ProgressinVeterinaryMedicine,2014,35(5):108-113.
[21]史晓晶,宿婧,郝宝玲,等.艾草内生放线菌的分离与拮抗菌株的筛选[J].云南农业大学学报,2014,29(4):504-507.
SHI X J,SU J,HAO B L,etal.Isolation and screening antifungal activity of actinomycetes fromArtemisiaargyi[J].JournalofYunnanAgriculturalUniversity,2014,29(4):504-507.
[22]JUANA F,JOSE A,Prez-LVAREZ,etal.Thiobarbituric acid test for monitoring lipid oxidation in meat[J].FoodChemistry,1997,59(3):345-353.
[23]ERICH F E,ADELHEID H.Inhibition of nitrite formation from hydroxylammonium-chloride:a simple assay for superoxide dismutase[J].AnalyticalBiochemistry,1976,70:616-620.
[24]ARAKAWA N,TSUTSUMI K,SANCEDA N G,etal.Rapid and sensitive method for the determination of ascorbic acid using 4,7-diphenyl-1,10-phenanthroline[J].Agri.Biol.Chem.,1981,45:1 289-1 290.
[25]GRIFFITHS O W.Determination of glutathione and glutathione disulphide using glutathione reductase and 2-vinylpyridine[J].Anal.Biochem.,1980,106:207-212.
[26]AEBI H.Catalaseinvitro[J].MethEnzymol,1984,105:121-126.
[27]NAKANO Y,ASADA K.Hydrogen peroxide is scavenged by ascorbate peroxidase in spinach chloroplasts[J].PlantCellPhysiol.,1981,22:867-880.
[28]POLL A,OTTER T,SEIFERT F.Apoplastic peroxidases and lignifications in needles of Norway spinach chloroplasts[J].PlantPhysiology,1994,106:53-60.
[29]GIANNOPOLITIS G N,REIS S K.Superoxide dismutase I.Occurrence in higher plants[J].PlantPhysiol.,1977,59:309-315.
[30]梁文斌,薛生国,沈吉红,等.锰胁迫对垂序商陆光合特性及叶绿素荧光参数的影响[J].生态学报,2010,30(2):619-625.
LIANG W W,XUE SH G,SHEN J H,etal.Effects of manganese stress on photosythesis and chlorophyll fluorescence parameters ofPhytolaccaamericana[J].ActaEcologicaSinica,2010,30(2):619-625.
[31]龙云,刘芸,钟章成,等.酸雨和UV-B 对玉米幼苗光合速率和抗氧化酶活性的影响[J].生态学报,2009,29(9):4 956-4 966.
LONG Y,LIU Y,ZHONG ZH CH,etal.Effects of UV-B irradiation and acid rain on photosynthetic rate and antioxidant enzyme activities of maize seedlings[J].ActaEcologicaSinica,2009,29(9):4 956-4 966.
[32]韩超,申海玉,刘庆.云杉幼苗对气候变暖和UV-B辐射增强的光合响应[J].西北植物学报,2014,34(4):820-827.
HAN CH,SHEN Y H,LIU Q.Photosynthetic responses of Picea asperata seedling to climate warming and enhanced ultraviolet-B radiation[J].ActaBot.Boreal.-Occident.Sin.,2014,34(4):820-827.
[33]王锦旗,郑有飞,薛艳,等.紫外辐射对菹草成株生理特性的影响[J].生态学报,2014,35(18):1-13.
WANG J Q,ZHENG Y F,XUE Y,etal.Influence of ultraviolet radiation on physiological characteristics ofPotamogetoncrispus[J].ActaEcologicaSinica,2014,35(18):1-13.
[34]李韶山,王艳,刘颂豪.UV-B对水稻幼苗膜脂过氧化作用的影响[J].激光生物报,2000,9(1):24-26.
LI SH SH,WANG Y,LIU S H,etal.Effects of UV-B radiation on lipid peroxidation in rice seedlings[J].ActaLaserBiologySinia,2000,9(1):24-26.
[35]赵宝龙,刘鹏,王文静,等.5-氨基乙酰丙酸(ALA)对盐胁迫下葡萄叶片中AsA-GSH循环的影响[J].植物生理学报,2015,51(3):385-390.
ZHAO B L,LIU P,WANG W J,etal.Effects of 5-aminolevulinic acid on the AsA-GSH cycle in grape leaves under salt stress[J].PlantPhysiologyJournal,2015,51(3):385-390.
[36]张 辉,吕山花,张文会,等.植物对UV-B辐射增强应答的分子机制及信号级联研究进展[J].西北植物学报,2009,29(9):1 932-1 937.
ZHANG H,LÜ SH H,ZHANG H W,etal.Research advances on responsion molecular mechanisms and signal cascade for plants to enhanced ultraviolet-B radiation[J].ActaBot.Boreal.-Occident.Sin.,2009,29(9):1 932-1 937.
[37]吴杏春,林文雄,郭玉春,等.UV-B辐射增强对水稻叶片抗氧化系统的影响[J].福建农业学报,2011,16(3):51-55.
WU X CH,LIN W X,GUO Y CH,etal.Effect of enhancing ultraviolet-B radiation on antioxidant systems in rice seedling leaves[J].FujianJournalofAgriculturalSciences,2011,16(3):51-55.
[38]ESZTER H,TIBOR J,GABRIELLA S.Invitrosalicylic acid inhibition of catalase activity in maize:differences between the isozymes and a possible role in the induction of chilling tolerance[J].PlantScience,2002,163(6):1 129-1 135.
[39]吴业飞,吴鲁阳,张振文.紫外线-B辐射增强对葡萄叶片抗氧化系统的影响[J].西北农林科技大学学报,2008,36(12):161-166.
WU Y F,WU L Y,ZHANG ZHW,etal.Effect of enhanced ultraviolet-B radiation on antioxidant systems in grapevine seedling leaves[J].JournalofNorthwestA&FUniversity,2008,36(12):161-166.
(编辑:裴阿卫)
Influence of Enhanced UV-B on Physiological Characteristics ofEupatoriumadenophorumL.andArtemisiaargyiLevl
LI Liangbo1,ZHANG Lian’gen2,TANG Tianxiang1,HAI Meirong1,ZHOU Ping1*
(1 Faculty of Agronomy and Biotechnology,Yunnan Agricultural University,Kunming 650201,China;2 Faculty of Students’ Affairs Division,Yunnan Agricultural University,Kunming 650201,China)
Abstract:To investigate the differences in photosynthesis,protective ability and repair capability between the invasive weed Eupatorium adenophorum L.and the native weed Artemisia argyi Levl under the condition of enhanced UV-B radiation,we designed a seven-week experiment under the condition of UV-B radiation up to 0.46 mW·cm-2·h-1and an extra experiment after stopping radiation to observe the changes in both species’ growth conditions.Moreover,the effects on photosynthetic capacity,the contents of oxides and antioxidants as well as the activity of antioxidant enzymes were measured and analyzed.And the results showed as follows:(1)the maximum photosynthetic assimilation rate (Pn max),photochemical efficiency in the light and maximal quantum yield of PSⅡ were restrained,but the former was showed more repressive significantly in E.adenophorum L.as the durations of UV-B radiation increased.(2)The contents of malonaldehyde (MDA) and super-oxygen ion ) in both species were accumulated as the durations of UV-B radiation increased,but the increased proportion of them was more significant in A.argyi Levl.(3)The contents of antioxidants concluding ascorbate (ASA) and glutathione (GSH) turned out different tendencies that the contents tended to firstly increased and then decreased in E.adenophorum L.while to increased and maintained a high level in A.argyi Levl.Besides,the enzymatic activities of peroxidase (POD) and superoxide dismutase (SOD) were improved remarkably after radiation in both species.And the enzymatic activity of ascorbate peroxidase (APX) in both species firstly increased and then decreased.As for the enzymatic activity of catalase (CAT),it was gradually inhibited in E.adenophorum L.but firstly enhanced and then inhibited in A.argyi Levl.As a consequence,we found the physiological mechanism of photosynthesis and antioxidation of E.adenophorum L.and A.argyi Levl responded to enhanced UV-B radiation were similar with some differences.
Key words:UV-B radiation;Eupatorium adenophorum L.;Artemisia argyi Levl;physiological changes
中图分类号:Q945.78
文献标志码:A
作者简介:李良博(1990-),男,在读硕士研究生,主要从事外来入侵植物控制的研究。E-mail:403974397@qq.com*通信作者:周平,副教授,主要从事气象学与气候学研究。E-mail:289793918@qq.com
基金项目:国家自然科学基金项目(31160139)
收稿日期:2015-09-06;修改稿收到日期:2015-12-19
文章编号:1000-4025(2016)02-0343-10
doi:10.7606/j.issn.1000-4025.2016.02.0343

