4种发根农杆菌对朱砂根组培无菌叶片毛状根诱导的影响
胡 菊,毛美琴,杨 君,但 方,马明东
(四川农业大学 风景园林学院,成都 611130)
4种发根农杆菌对朱砂根组培无菌叶片毛状根诱导的影响
胡菊,毛美琴,杨君,但方,马明东*
(四川农业大学 风景园林学院,成都 611130)
摘要:以朱砂根(Ardisia crenata Sims)组培无菌叶片为材料,用4种发根农杆菌菌株(A4、ATCC15834、LBA9402和R1601)分别侵染进行毛状根诱导,比较朱砂根叶片毛状根诱导的最适培养基种类、预培养时间、侵染方式、共培养时间以及不同发根农杆菌的致根能力。研究表明:(1)朱砂根无菌叶片毛状根诱导最适培养基为1/2MS培养基,预培养2 d、共培养2 d,毛状根诱导率最高(31.87%)。(2)最佳侵染方式以剪好的幼叶和活化好的菌液(100 mg/L AS)一起在28 ℃、180 r/min黑暗条件下共振荡8~15 min。(3)4种发根农杆菌均能诱导朱砂根叶片毛状根产生,但A4、ATCC15834效果最好,其致根能力大小顺序依次为ATCC15834>A4>LBA9402>R1601。(4)PCR分子鉴定表明,发根农杆菌Ri质粒T-DNA已成功整合到宿主细胞核基因组中。
关键词:朱砂根;组培无菌叶片;发根农杆菌;毛状根
朱砂根(ArdisiacrenataSims)是隶属于紫金牛科(Myrsinaceae)紫金牛属(Ardisia)的双子叶常绿小灌木[1],是中国传统的观赏药用植物,分布于长江流域各省以及福建、台湾等地[2]。作为园林观赏植物,是紫金牛属植物中最具观果、观叶价值的代表种之一[3-4];而作为传统药用植物,利用历史已有四五百年,在《中国药典》(1997年版)中,是被收载记录的紫金牛属2种药用植物之一[5],通过理化鉴定、显色反应等显示其主要药用成分为岩白菜素和三萜皂苷[6-7],且具有成为继喜树碱和紫杉醇之后的新一代抗HIV和抗肿瘤的天然药物的重大潜力[8]。
目前对朱砂根的研究主要集中在药理、药材鉴定、化学成分分析方面,少有离体组织培养。随着基因工程的发展,已在多种植物上利用发根农杆菌成功诱导了毛状根,红豆杉[9]、喜树[10]、银杏[11]、杜仲[12]、乌桕[13]等是木本植物中最具代表性的。朱砂根三萜皂苷主要存在于其根部,而其它部位含量相对较低[14],发根中含有和原植物中相同或相似,含量相当或略高甚至更多,以及分化程度、遗传稳定性高且不易变异的次生代谢产物[15],还可从发根培养物中寻找新的化合物。建立毛状根培养体系,可以为朱砂根三萜皂苷的生产提供一条新途径。因此,通过分子生物技术手段进行朱砂根毛状根诱导显得十分迫切与必要。再者,目前在朱砂根上应用基因工程技术的研究相比于其他一些植物远远落后,建立一种高效、稳定的遗传转化体系,是朱砂根进行转基因技术应用的基础。但目前尚未见报道有关发根农杆菌介导朱砂根的研究。
本研究以朱砂根组培无菌叶片为受体,用4种发根农杆菌A4、ATCC15834、R1601和LBA9402分别侵染,并进行PCR分子鉴定。为后续试验准备丰富的试验材料,奠定朱砂根遗传转化与利用发根体系生产朱砂根有用次生代谢产物的基础,为朱砂根可持续开发利用及其次生代谢物质(三萜皂苷)的高效、规模化、工厂化生产提供科学依据和技术支撑,也为其它木本植物进行发根农杆菌转化提供借鉴。
1材料和方法
1.1实验材料
朱砂根无菌苗在成都市农林科学院林科所组培室,按照马明东等[16]方法培育朱砂根无菌苗。
A4、ATCC15834、R1601和LBA9402均购自于ATCC(美国标准生物品收藏中心),在四川农业大学风景园林学院分子实验室进行活化、超低温保存以及侵染转化。
1.2实验方法
1.2.1菌液制备及活化将保存于-80 ℃超低温冰箱中的4种发根农杆菌分别进行YMB固体平板划线,28 ℃暗培养1~2 d后挑取单菌落转入3 mL YMB液体培养基中,28 ℃、180 r/min暗培养活化24 h后,吸取0.5~1.0 mL菌液转入50 mL YMB液体培养基中,于28 ℃、180 r/min黑暗振荡培养,如此反复进行3次活化后,测定菌液OD600值达0.5~0.8时,收集菌液,用于侵染,对照组使用无菌水代替菌液。
1.2.2朱砂根叶片毛状根的诱导选取朱砂根健壮组培无菌叶片,用A4、ATCC15834、R1601和LBA9402分别进行侵染,诱导毛状根的产生,筛选毛状根诱导的最适培养基种类、预培养和共培养时间、侵染方式等,并对毛状根进行形态和PCR分子检测。
若无特别说明,幼叶的叶正面向上放置;预培养温度设为(25±1) ℃,黑暗培养。共培养温度设为(28±1) ℃,黑暗培养。除菌培养、继代培养温度为(25±1) ℃,光照8 h/d,光强1 500~2 000 lx。侵染的菌液以及共培养基均添加100 mg/L AS。发根时间从侵染的当天开始算起。每组试验生物学重复3次,结果取其平均值,CK则用无菌水代替菌液。
毛状根诱导率(%)= 产生毛状根的外植体数/总外植体数×100%
(1)基本培养基用活化好的OD600值为0.5~0.8的4种发根农杆菌,分别侵染朱砂根无菌叶片(近似1 cm×1 cm),比较MS、1/2MS培养基对发根诱导的影响,观察比较发根时间及毛状根特点。
(2)预培养时间预培养的目的是使被侵染的外植体细胞处于感受状态,利于发根农杆菌的吸附、转移和整合。预培养时间设为0、1、2和3 d。
(3)侵染方式采用3种侵染方式:(Ⅰ)用无菌针管吸取活化好的菌液在剪好的叶片上进行针刺划线;(Ⅱ)将剪好的叶片浸泡在活化好的菌液中;(Ⅲ)将剪好的叶片和活化好的菌液一起28 ℃、180 r/min黑暗共振荡8~15 min。
(4)共培养时间发根农杆菌的附着、T-DNA的转移和整合都是在共培养时间段内完成的,因此整个侵染转化过程中共培养时间的确定是最重要的环节之一。共培养时间设为1、2和3 d。
(5)毛状根的检测毛状根检测主要包括两方面,即形态特征检测和PCR分子检测。形态特征检测,主要记录和观察出根初始状态、根形态及颜色、向地性、长度等,并与组培苗根、自然根比较来进行初步判断。而分子检测则是收获毛状根,随机选取少量用于PCR分子检测。
发根的分子检测,选用SanPrep柱式质粒DNA小量抽提试剂盒(上海生工)提取发根农杆菌的质粒DNA,而采用改良CTAB法[17]提取朱砂根毛状根和无菌苗组培根的基因组总DNA。用于PCR的rolA基因正向引物为FrolA(5′-CGTTGTCGGAATGGCCCAGACC-3′),反向引物为RrolA(5′-CGTAGGTCTGAATATTCCGGTCC-3′)。将质粒DNA、毛状根DNA、无菌苗组培根DNA进行PCR扩增。选用PCR扩增体系25 μL:Buffer 2.5 μL,dNTPs 2.0 μL,上下游引物各1.0 μL,Taq酶0.35 μL,ddH2O 16.2 μL,模板DNA 2.0 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s;55 ℃退火30 s,72 ℃延伸30 s;34个循环,72 ℃保温延伸5 min,4 ℃下保存。
在PCR扩增产物中加入5 μL Loading Buffer,发根农杆菌质粒DNA扩增产物为阳性对照,朱砂根无菌苗组培根DNA扩增产物为阴性对照,用1%琼脂糖凝胶电泳进行电泳。电泳结果用EB染色10 min后于凝胶成像系统(UV260 nm)下紫外灯扫描观察分析。
2结果与分析
2.1发根诱导的培养基筛选
从表1可以得知,1/2 MS培养基是朱砂根叶片毛状根诱导的最佳培养基,不仅出根时间早、根突点数量多且生长情况良好。说明不同无机盐浓度的MS培养基对毛状根的诱导有着极大的影响,而MS培养基对发根的诱导效果较差,这可能与其所含无机盐浓度过高有关,推测朱砂根毛状根适合在含稍低无机盐浓度的1/2 MS培养基上生长。因此,后续试验选用1/2 MS培养基进行侵染。
2.2预培养时间筛选
从表2可得知,预培养2 d是最佳预培养时间,不仅发根诱导率最高达32%,而且出根时间早、数量多且生长状况良好。适当的预培养时间可以提高转化率,这可能是因为外植体经过一定时间的预处理可以减轻发根农杆菌在侵染过程中对其造成的胁迫伤害,并且能将要转化的外植体细胞进一步调整到适宜侵染的生理状态即感受状态。处于感受状态的细胞对发根农杆菌更敏感,更容易整合外源DNA,从而有利于Ri质粒T-DNA的转移,提高侵染能力,进而提高转化率。
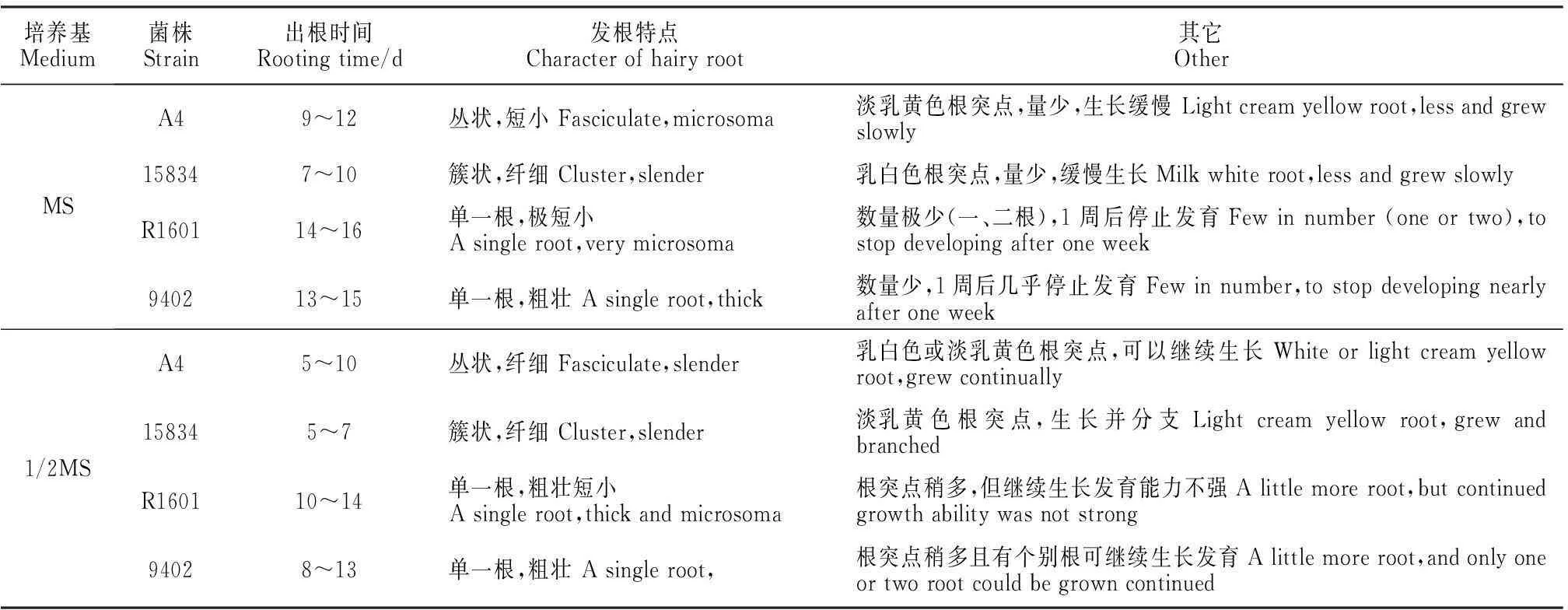
表1 不同培养基对毛状根诱导的影响
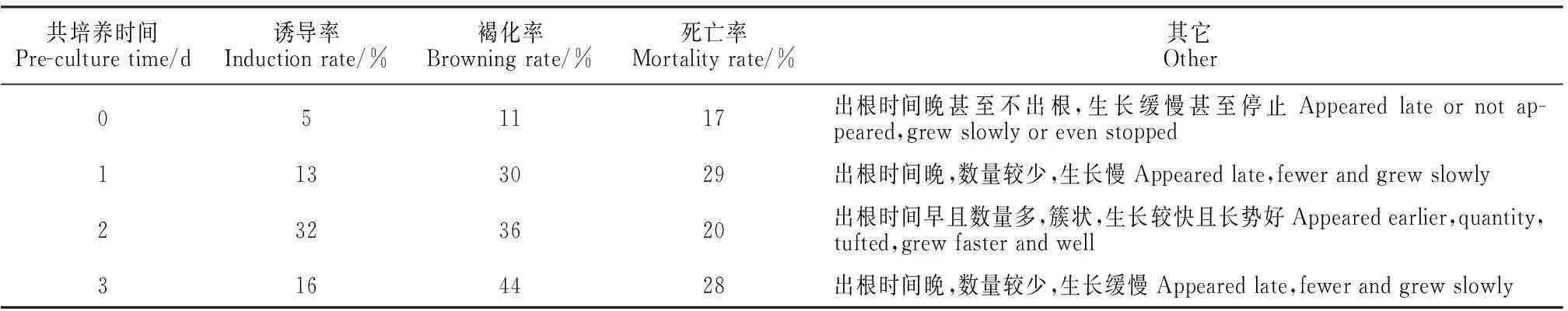
表2 预培养时间对毛状根诱导的影响
2.3侵染方式比较
从表3可以得知,3种侵染方式均能成功诱导产生毛状根,但方式Ⅲ诱导率(36.67%)较其它2种方式高得多,是最佳侵染方式。这可能是因为,针刺增加了划伤,使外植体更容易褐化死亡;浸泡虽然可以增加与菌株的接触时间,但是并不代表会有更多的菌株进入外植体;共振荡不仅增加了各个外植体与菌株的接触面积,而且同样增加了单个外植体与发根农杆菌的接触时间,从而增加了二者的亲和性,即增加接触机会,因此转化率得到了提高。
2.4共培养时间筛选
从表4可以得知,共培养2 d是最佳共培养时间,毛状根诱导率最高,可以达到31.87%;3 d的诱导率次之为12.36%;而1 d的诱导率仅为8.13%。由此可知,在侵染试验中适当的共培养时间有利于提高外植体转化率,但共培养时间过长,发根农杆菌大量生长会造成外植体严重损伤,从而降低毛状根的诱导率。
2.5不同菌株对叶片转化的比较
从表5和图1可以看出,4种菌株对朱砂根叶片的侵染能力是不同的,其大小顺序是:ATCC15834>A4>LBA9402>R1601。ATCC15834、A4菌株的致根能力明显比R1601、LBA9402强得多,分别为35.56%、29.35%,相同条件下,R1601、LBA9402对叶片诱导率低。4种菌株对朱砂根叶片有不同的转化能力,这可能与其所含Ri质粒的性质有关,即ATCC15834、A4菌株的Ri质粒上编码诱导发根的T-DNA片段比R1601、LBA9402菌株更容易转移整合到朱砂根细胞核基因组中去;还有可能是因为朱砂根外植体对发根农杆菌有一定的选择性、敏感性。
2.6毛状根检测
2.6.1毛状根形态检测从表6可以看出,朱砂根发根颜色偏淡,多为乳白色或乳黄色,粗细因菌株类型而异。丛状或簇状根突点产生的较细发根能够继续发育分化产生分支,生长良好,而较粗毛状根一般在1 cm左右长时停止生长。
2.6.2毛状根分子检测从PCR凝胶电泳分析图(图2、3)分析,根据发根农杆菌Ri质粒T-DNA上的rolA基因合成上、下游PCR引物,以毛状根基因组DNA为模板(3~6号为4个重复),菌株Ri质粒总DNA为阳性对照,朱砂根组培苗根总DNA为阴性对照,从毛状根的总DNA中扩增出了与阳性对照菌株Ri质粒总DNA扩增的特异性T-DNA片段大小一致约258 bp左右的特异性DNA片段。即A4、ATCC 15834所含的rolA基因目的条带已经转移并整合到了朱砂根叶片毛状根基因组中。
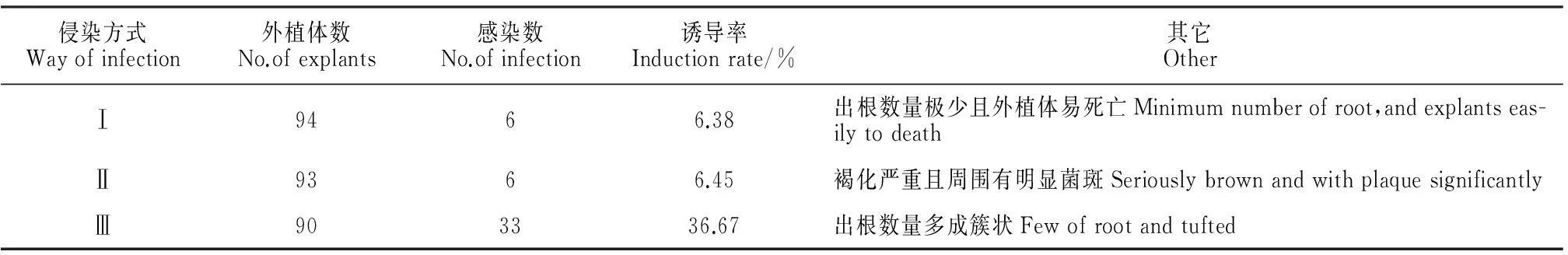
表3 不同侵染方式对毛状根诱导的影响

表4 不同共培养时间对发根诱导的影响
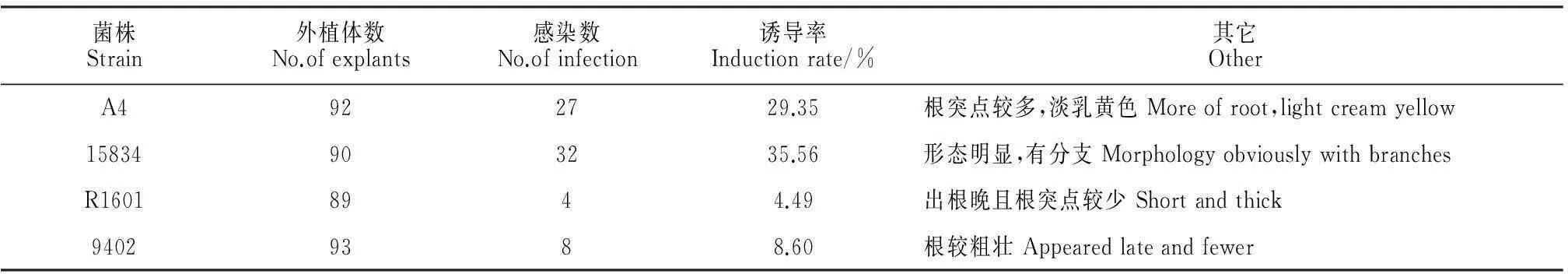
表5 不同菌株对叶片转化的比较

图1 不同发根农杆菌诱导的毛状根
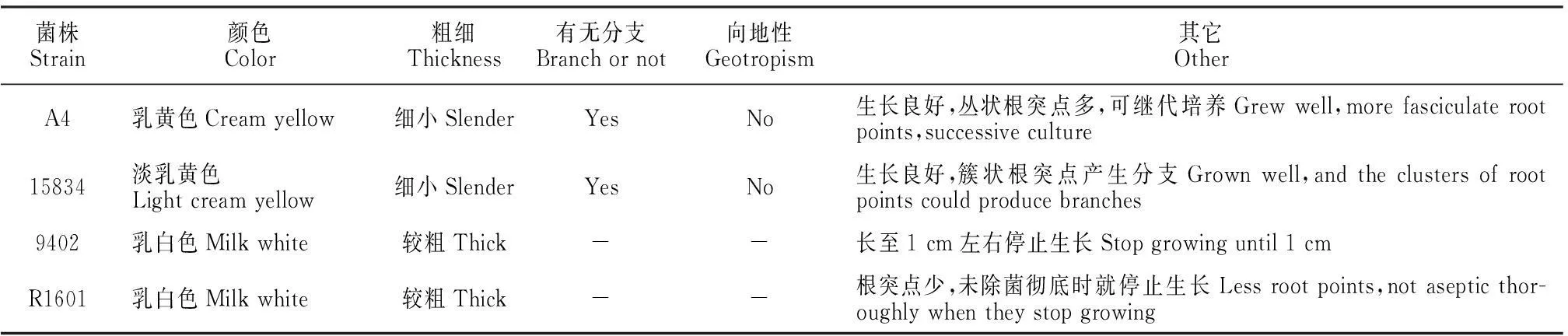
菌株Strain颜色Color粗细Thickness有无分支Branchornot向地性Geotropism其它OtherA4乳黄色Creamyellow细小SlenderYesNo生长良好,丛状根突点多,可继代培养Grewwell,morefasciculaterootpoints,successiveculture15834淡乳黄色Lightcreamyellow细小SlenderYesNo生长良好,簇状根突点产生分支Grownwell,andtheclustersofrootpointscouldproducebranches9402乳白色Milkwhite较粗Thick--长至1cm左右停止生长Stopgrowinguntil1cmR1601乳白色Milkwhite较粗Thick--根突点少,未除菌彻底时就停止生长Lessrootpoints,notasepticthor-oughlywhentheystopgrowing
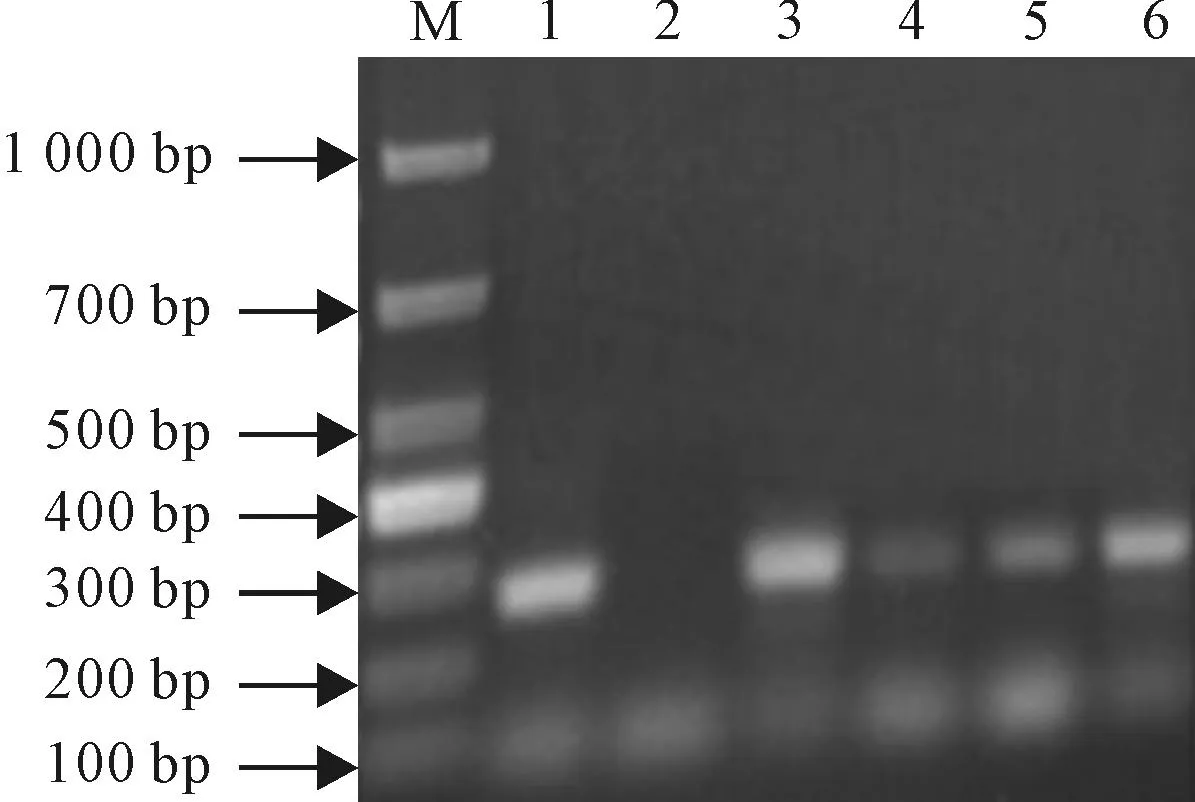
M.DL1000;1.A4的rolA扩增产物(阳性对照);2.组培苗根rolA
毛状根的检测是对侵染结果的检验。本试验中4种发根农杆菌都能侵染朱砂根无菌叶片,从形态上判断都是毛状根,而对A4、ATCC15834侵染幼叶产生的毛状根进行的PCR分子检测,同样证实了发根农杆菌Ri质粒上的T-DNA已整合进入宿主细胞。
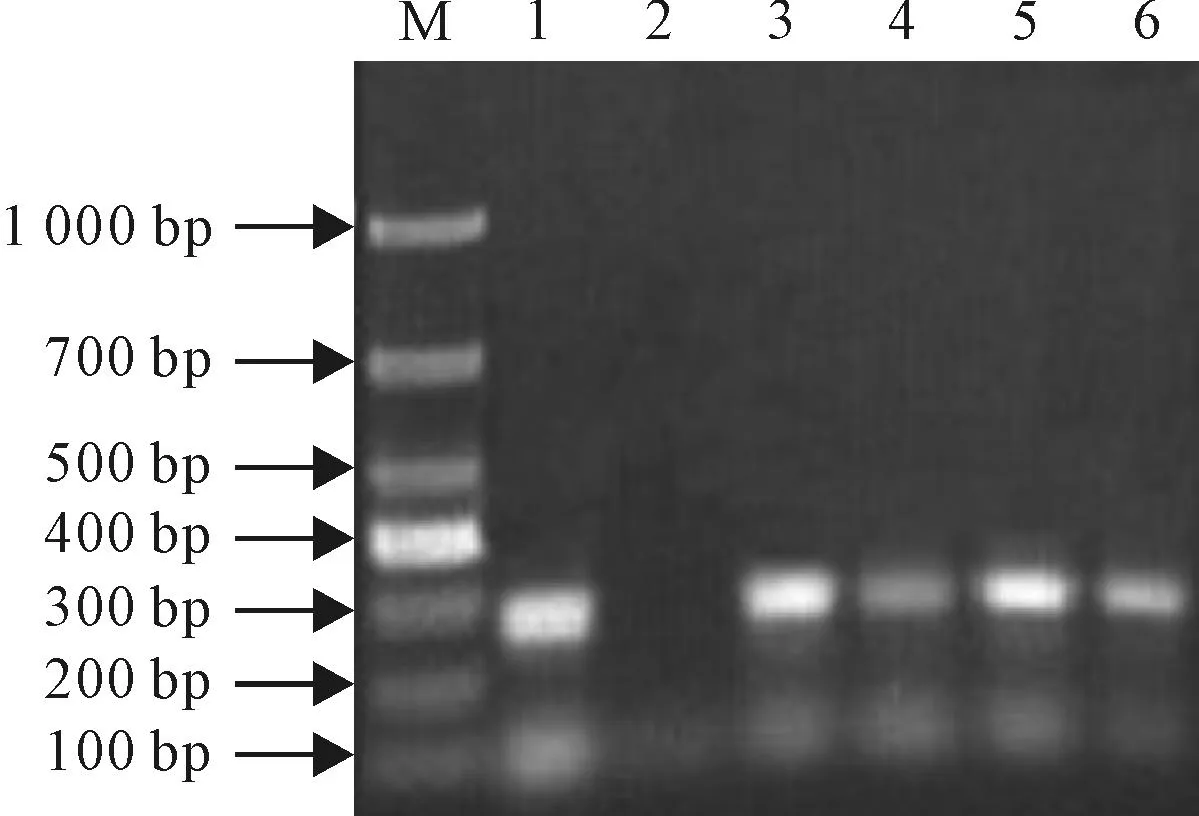
M.DL1000;1.ATCC15834的rolA扩增产物(阳性对照);
3讨论
自然界中,植物被认为是大量具有多种生物活性的次生代谢产物生物合成的化学工厂,但利用完整植株进行分离提取会对植物自然种质资源造成巨大威胁。由于遗传稳定、生长迅速等使得毛状根培养成为植物细胞培养中一个引人注目的体系,不仅可以避免因过度开发而对自然资源生物多样性造成损坏,还可以不依赖于季节性和地理差异性。本研究成功获得了激素自主、多分支的朱砂根毛状根,这使得开发并利用朱砂根毛状根进行工业化生产其所含的次生代谢产物三萜皂苷具有了可能性和发展潜力。毛状根的诱导受到多种因素的影响,包括外植体种类、培养基种类、预培养及共培养时间、侵染方式、菌株种类及活性等。
3.1培养基种类、预培养及共培养时间对毛状根诱导的影响
毛状根的生长对不同培养基成分表现出一定的差异性[18]。陈永芳等[19]研究发现在1/2 MS、MS、B5等固体或液体培养基中,MS液体培养基最有利于新疆紫草毛状根诱导。郭生虎等[20]研究表明乌拉尔甘草在1/2 MS、MS、B5、1/2 B5培养基中的1/2 MS培养基上生长最好、增殖率最高为79.2%。本研究中1/2 MS培养基更有利于朱砂根毛状根诱导,同样是对不同培养基成分效应的适应的结果。
大量研究表明,预培养时间对毛状根诱导率有一定的影响。王丽等[21]探讨龙葵毛状根诱导的研究表明不进行预培养诱导率最低,预培养2 d诱导率最高,而3 d、4 d则依次降低。本研究中预培养2 d可提高朱砂根毛状根诱导率达32%。共培养时间也是影响毛状根诱导率的一个方面。于艳丽等[22]对小金海棠的研究表明过早(1 d)转入除菌培养,虽可有效抑制细菌增殖,但明显降低了诱导率;过晚(4 d),细菌过度增殖,导致除菌较困难且诱导率大幅下降;适当的共培养时间(2 d)则可达最佳效果。本研究结果与此结果一致,共培养2 d朱砂根毛状根诱导率最高为31.87%。发根农杆菌转化所进行的组织培养不同于纯粹的组织培养,需要经过外植体吸附菌株、外植体与菌株共培养,因此选择适当的预培养及共培养时间有助于提高发根诱导率。
3.2不同菌株对毛状根诱导的影响
不同发根农杆菌菌株具有不同的致根能力,可能与不同菌株对不同宿主细胞的敏感性不同有关[23]。Moumita等[24]选用3种发根农杆菌菌株(ATCC15834、A4、LBA9402)以及2种外植体种类(叶片和茎段)对紫花丹进行毛状根诱导,结果表明ATCC15834侵染叶片诱导的毛状根出现时间最早、转化频率最高。发根农杆菌Ri质粒T-DNA片段上Vir区编码的产物肩负接收外界信号、加工T-DNA、转移及整合等功能,因此,不同Ri质粒类型决定发根农杆菌不同的致根能力。王跃华等[25]选用A4、R1601、ATCC15834、R1000对川黄柏的毛状根研究表明ATCC15834致根效果最好。Wu[26]在对杜仲无菌真叶毛状根诱导的研究中发现,所选的5种菌株LBA9402诱导率最高为100%,ATCC15834次之为80%,其次是ATCC39207、ATCC31798,而ATCC11325最低为0。本研究选用的4种发根农杆菌A4、ATCC15834、LBA 9402、R1601均是农杆碱型菌株,致根能力最强,是建立发根培养体系的首选菌株[27],结果也表明对于朱砂根无菌幼叶而言,4种菌株均能侵染,但致根能力不同,最有效的是菌株ATCC15834。
3.3毛状根的形态为非典型毛状根
本研究中所获得的毛状根均无根毛,为非典型毛状根,这与李想韵等[28]获得的桑树毛状根形态相一致。发根农杆菌侵染植物诱导的毛状根存在很大的异质性,究其原因最可能是Ri质粒上的T-DNA片段转移整合到植物细胞核基因组中是随机的,T-DNA片段整合到同一条染色体的不同位点上或者不同染色体上,产生的发根的性状都会不同,可能只有其中一种或几种整合方式能够表现出符合我们需要的性状。
乙酰丁香酮、光照、蔗糖浓度、外源激素等都会影响毛状根诱导。例如乙酰丁香酮是农杆菌毒性基因的酚类诱导剂之一。添加此化学试剂,发现可提高根癌农杆菌对拟南芥和颠茄的转化率[29-30]。研究显示,乙酰丁香酮对发根农杆菌介导转化胡萝卜[31]有促进作用。因此研究过程中加入适量的乙酰丁香酮有助于提高发根的诱导率。
本研究首次对园林观赏药用植物朱砂根进行毛状根诱导,选用的培养基、预培养及共培养时间、侵染方式、发根农杆菌菌株等是适合朱砂根叶片毛状根诱导的。本试验虽成功诱导了毛状根,但是从数量和质量上都有待提高,且很多介导因素还需更加完善,尤其是发根继代和增殖培养。要想使朱砂根的遗传转化研究取得长足发展,达到理想的转化水平,需进一步从相关因素着手分析原因,优化毛状根离体培养,从而去探寻新的生物视野。
参考文献:
[1]江香梅.富贵籽ArdisiacrenataSims[J].江西林业科技,2003,(4):58.
JIANG X M.ArdisiacrenataSims[J].JiangxiForestryScienceandTechnology,2003,(4):58.
[2]吴克智.富贵籽管理措施[J].中国花卉园艺,2001,(12):18-19.
WU K Z.Management and implementation ofArdisiacrenataSims[J].ChinaFlowers&Horticulture,2001,(12):19-20.
[3]张金锋.优良的室内常绿木本观果花卉——富贵籽[J].西南园艺,2006,34(1):44-49.
ZHANG J F.Excellent indoor evergreen woody viewing fruit flower——ArdisiacrenataSims[J].SouthwestHorticulture,2006,34(1):44-49.
[4]邓素芳,黄烯,赖钟雄,等.朱砂根的药用价值与观赏价值[J].亚热带农业研究,2006,2(3):176-178.
DENG S F,HUANG X,LAI Z X,etal.Progress in them edicinal and ornamental values ofArdisiacrenataSims[J].SubtropicalAgricultureResearch,2006,2(3):176-178.
[5]刘姩,李颖,郭济贤,等.中国紫金牛属的分类及其岩白菜素的含量[J].上海医科大学学报,1993,20(1):49-53.
LIU N,LI Y,GUO J X,etal.Studies on the taxonomy of the genusArdisia(Myrsinaceae) form China and the occurrence and quantity of bergenin in the genus[J].ActaAcademiaeMedicinaeShanghai,1993,20(1):49-53.
[6]靳志娟.紫金牛属植物化学成分和药理作用的研究进展[J].实用医技杂志,2008,15(25):3 432- 3 436.
JIN Z J.Development of chemical and pharmacological ofArdisia[J].JournalofPracticalMedicalTechniques,2008,15(25):3 432-3 436.
[7]ZHANG P C,ZHENG C F,WU C S,etal.Mass spectral fragmentation analysis of triterpene saponins fromArdisiacrenataSims by electrospray ionization Fourier transformion cyclotron resonance mass spectrometry[J].JournaloftheChemicalSociety,PerkinTransactions,2010,12(1):64-69.
[8]张伟,李锟,李东,等.朱砂根化学成分和药理作用研究进展[J].中国实验方剂学杂志,2011,17(11):279-282.
ZHANG W,LI K,LI D,etal.Development of chemical and pharmacological ofArdisiacrenata[J].ChineseJournalofExperimentalTraditionalMedicalFormulae,2011,17(11):279-282.
[9]JUNG A K,KWANG H B,YOUNG M S,etal.Hairy root cultures ofTaxuscuspidatefor enhanced production of paclitaxel[J].JournaloftheKoreanSocietyforAppliedBiologicalChemistry,2009,52(2):144-150.
[10]王伟,陆扬,李礼,等.喜树毛状根的诱导及其喜树碱含量分析[J].西北植物学报,2008,28(12):2 416-2 422.
WANG W,LU Y,LI L,etal.Induction of hairy roots fromCamptothecaacuminataand the content of camptothecin[J].ActaBot.Boreal.-Occident.Sin.,2008,28(12):2 416-2 422.
[11]刘树楠,孙天恩,李根保.银杏发根的转化及其悬浮培养无性系的建立[J].武汉大学学报·自然科学版,1998,44(4):238-240.
LIU S N,SUN T E,LI G B.Transformation of Ginkgo hairy root and establishment of its suspension culture clone[J].JournalofWuhanUniversity(Nat.Sci.Edi.),1998,44(4):238-240.
[12]杨蕊,张家辉,孙雪梅,等.杜仲毛状根培养条件优化及其桃叶珊瑚苷药用成分的研究[J].中国中药杂志,2009,34(15):1 902-1 905.
YANG R,ZHANG J H,SUN X M,etal.Hairy root culture optimization and aucubin medical composition production ofEucommiaulmoides[J].ChinaJournalofChineseMateriaMedica,2009,34(15):1 902-1 905.
[13]黄素梅,石丸幹二.乌桕毛状根培养与次生代谢产物累积研究[J].北方园艺,2011,(22):103-105.
HUANG S M,ISHIMARU K.Study on cultivating the hairy roots ofSapiumsebiferumand its second metabolites accumulation[J].NorthernHorticulture,2011,(22):103-105.
[14]KOIKE K,JIA Z H,OHURA S,etal.Minor triterpenoid saponins fromArdisiacrenata[J].ChemicalandPharmaceuticalBulletin,1999,47:434-435.
[15]CHILTON M D,TEPFER D A,PETIT A,etal.Agrobacterium rhizogenes inserts T-DNA into the genomes of the host plant root cells[J].Nature,1982,295:432.
[16]马明东,刘均利,蒲尚饶.朱砂根的组织培养与植株再生[J].中国中药杂志,2009,34(16):2 043-2 046.
MA M D,LIU J L,PU S R.Tissue culture and plant regeneration ofArdisiacrenata[J].ChinaJournalofChineseMateriaMedica,2009,34(16):2 043-2 046.
[17]周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005:16-17.
[18]于树宏,刘传飞,李玲,等.野葛毛状根离体培养与异黄酮生产[J].植物生理与分子生物学学报,2002,28(4):281-286.
YU S H,LIU C F,LI L.Pueraria lobata hairy root cultureinvitroand isoflavone production[J].JournalofPlantPhysiologyandMolecularBiology,2002,28(4):281-286.
[19]陈永芳,芦韦华,王芳,等.新疆紫草毛状根的诱导及培养[J].西北植物学报,2008,28(12):2 423-2 428.
CHEN Y F,LU W H,WANG F,etal.Induction and culture of hairy roots fromArnebiaeuchroma(Royle) Johnst.[J].ActaBot.Boreal.-Occident.Sin.,2008,28(12):2 423-2 428.
[20]郭生虎,王敬东,马洪爱.乌拉尔甘草毛状根的诱导及培养体系的建立[J].西北农业学报,2012,21(12):138-141,157.
GUO S H,WANG J D,MA H A.Inducement of hairy roots and establishment of culture system inGlycyrrhizauralensisFisch[J].ActaAgriculturaeBoreal-OccidentalisSinica,2012,21(12):138-141,157.
[21]王丽,刘琪,宁明明,等.龙葵毛状根诱导条件的研究[J].北方园艺,2015,(4):107-111.
WANG L,LIU Q,etal.Study on inducing hairy roots ofSolanumnigrumL.[J].NorthernHorticulture,2015,(4):107-111.
[22]于艳丽,王忆,韩振海,等.发根农杆菌介导转化小金海棠的影响因素[J].核农学报,2008,22(5):621-625.
YU Y L,WANG Y,HAN Z H,etal.Agrobacteriumrhizogenes-mediated transformation ofMalusxiaojinensisCheng et Jiang[J].JournalofNuclearAgriculturalScience,2008,22(5):621-625.
[23]DREWES F E,STADEN J V.Initiation of and solasodine production in hairy root cultures ofSolanummauritianumScop[J].PlantGrowthRegul.,1995,17(1):27-31.
[24]MOUMITA G,SAIKAT D,SOMNATH B,etal.Effect of different strains ofAgrobacteriumrhizogenesand nature of explants onPlumbagoindicahairy root culture with special emphasis on root biomass and plumbagin production[J].NaturalProductCommunications,2010,5(12):1 913-1 916.
[25]王跃华,苟小军,吴洁,等.川黄柏毛状根的诱导及活性成分的产生[J].中国中药杂志,2006,31(22):1 853-1 856.
WANG Y H,GOU X J,WU J,etal.Hairy roots induction ofPhellodendronchinenseand production of its active constituents[J].ChinaJournalofChineseMateriaMedica,2006,31(22):1 853-1 856.
[26]XIAO J W.Establishment and chemical analysis of hairy roots ofEucommiaulmoides[D].USA:Louisiana State University,2007.
[27]SEVóN,OKSMAN C KM.Agrobacteriumrhizogenes-mediated transformation:root cultures as a source of alkaloids[J].PlantaMedica,2002,68(10):859-868.
[28]李想韵,朱鸿,孙一铭,等.桑遗传转化体系的建立及槲皮素合成的研究[J].中国中药杂志,2010,35(11):1 391-1 394.
LI X Y,ZHU H,SUN Y M,etal.Establishment of transformation system in mulberry and biosynthesis of quercetin[J].ChinaJournalofChineseMateriaMedica,2010,35(11):1 391-1 394.
[29]SHEIKHOLESLAM S N,WEEKS D P.Acetosyringone promotes high efficiency transformation ofArabidopsisthalianaexplants byAgrobacteriumtumefaciens[J].PlantMolecularBiology,1987,8(8):291-298.
[30]MATHEWS H,BHARATHAN N,LITZ R E,etal.The promotion ofAgrobacteriummediated transformation inAtropabelladonnaL.by acetosyringone[J].JournalofPlantPhysiology,1990,136(4):404-409.
[31]MARIMUTHU S,KRISHNAMURHTY K,KARUNANANDHAM K,etal.Influence of acetosyringone concentration on induction of carrot hairy root byAgrobacteriumrhizogenes[J].AfricanJournalofMicrobiologyResearch,2014,8(26):2 486-2 491.
(编辑:宋亚珍)
封面植物介绍——陕西羽叶报春
陕西羽叶报春(Primula filchnerae Knuth)隶属于报春花科报春花属,一年生草本,株高8~40 cm,全株被多细胞柔毛。地上茎短或者近于无,须根少数或多数。叶多枚簇生,叶片卵形或卵状披针形,带叶柄长3.5~15 cm,宽2~5 cm,先端圆钝,羽状全裂,羽片3~4对,长8~25 mm,小裂片再不整齐浅裂;裂片两面均密生灰白色短茸毛;叶柄长2.5~5.5 cm,被腺毛,基部宽扁。花葶高8~40 cm,常1~多数自叶丛中抽出,中空,外被银白色粗腺毛。伞形花序具3~10(~12)花,花梗长1.5~2.5 cm;苞片线状披针形,长8~10 mm;花萼圆锥状,长5~10 mm,外被粗毛,宽约4 mm,先端5~6裂,裂片披针形,果期增大成圆锥状钟形;花冠初开时为紫色,开放后为粉红色,冠檐直径1.5~2.5 cm,下部呈管状,管部长5~8 mm,冠筒长于花萼约1/4;上部花冠于花萼外5深裂,裂片倒心形,每裂片先端再2浅裂,裂片先端圆,粉红并略带蓝紫色,裂片基部有倒心形先为橘黄色后渐变为紫红色的彩斑。花柱异长,长花柱花:雄蕊着生于冠筒近中部,花丝短或者近无;花药黄色;花柱长约6~8 mm,柱头略高于筒口;短花柱花:雄蕊常生于近花冠裂口处内侧;花柱内藏于花冠筒下部,长4~5 mm,柱头圆形,绿色。子房球状,胚珠多数,特立中央胎座。蒴果球形,外果皮膜质,成熟后不裂或者顶裂;种子圆球状,直径1.5 mm,成熟后黑褐色,有皱纹。花期2~4月,果期3~5月。
陕西羽叶报春为中国特有物种,陕西省地方重点保护植物。一般生于海拔900~1 000 m天然次生落叶阔叶林下、湿润且多砂石土壤上。分布地较为狭窄,自1904年2月德国植物学家W.Filchner在陕西南部的秦岭山区采到模式标本后,百余年来再未见到存活的植物。2006年在湖北省重新发现,2015年3月在陕西省也被重新发现。
(图文由陕西师范大学生命科学学院张建强提供)
Four Kinds ofAgrobacteriumrhizogeneson Sterile Leaves Induction ofArdisiacrenataSims
HU Ju,MAO Meiqin,YANG Jun,DAN Fang,MA Mingdong*
(College of Landscape Architecture,Sichuan Agricultural University,Chengdu 611130,China)
Abstract:With sterile leaves of Ardisia crenata Sims by tissue culture as explants,we performed hairy root induction by using four kinds of Agrobacterium rhizogenes strains,named A4,ATCC15834,LBA9402,R1601,respectively.The investigation selected optimal media types,pre-culture time,infection ways,co-culture time,and the ability of A.rhizogenes on hairy root induction.The study showed that 1/2 MS was the better medium for sterile leaves on hairy root induction,and hairy root induction rate was the highest (31.87%) under pre-cultured 2 d and co-cultured 2 d.It was the best way for infection that put sterile leaves and bacteria which was supplied with AS (100 mg/L) co-shake under dark,28 ℃ and 180 r/min for 8 to 15 min.All of the four strains could induce hairy root on A.crenata Sims,but ATCC15834 was the most effective strain,and A4 followed it.For ATCC15834,A4,LBA9402 and R1601,the ability of hairy root induction on A.crenata Sims was declining in turn.It demonstrated that T-DNA on Ri plasmid of A.rhizogenes had been integrated into the genome of the host cell successfully through molecular identification by PCR.
Key words:Ardisia crenata Sims;sterile leaves;Agrobacterium rhizogenes;hairy root
中图分类号:Q813.1+2;Q785
文献标志码:A
作者简介:胡菊(1986-),女,在读博士研究生,主要从事园林植物培育与利用。E-mail:1029191614@qq.com*通信作者:马明东,教授,硕,博士生导师,主要从事园林植物培育与利用。E-mail:1670364138@qq.com
基金项目:四川省教育厅攻关项目(2006A016)
收稿日期:2015-11-20;修改稿收到日期:2016-01-13
文章编号:1000-4025(2016)02-0411-08
doi:10.7606/j.issn.1000-4025.2016.02.0411

