OsPT6基因过表达对低磷条件下菜用大豆结瘤及固氮的影响
刘 伟,杨立飞,朱文莉,刘丹丹,朱月林
(南京农业大学 园艺学院,南京 210095)
OsPT6基因过表达对低磷条件下菜用大豆结瘤及固氮的影响
刘伟,杨立飞,朱文莉,刘丹丹,朱月林*
(南京农业大学 园艺学院,南京 210095)
摘要:采用砂培方法,以转OsPT6基因的菜用大豆(T3株系)与其非转基因(NT)受体品种为实验材料,研究了两者在低磷条件下的生长发育指标,植株有效磷、全磷、全氮、豆血红蛋白和籽粒蛋白质含量以及谷氨酰胺合成酶活性的差异,并对植株结瘤及固氮相关基因表达进行检测,为阐明转OsPT6基因菜用大豆在低磷条件下结瘤及固氮相关机理提供理论依据。结果显示:(1) 转基因植株的株高、茎粗、花数和荚数、根瘤数均显著高于NT 植株。(2)转基因植株根、茎、叶及根瘤中有效磷,全株总磷、总氮含量,根瘤中的豆血红蛋白含量、功能叶片中谷氨酰胺合成酶的活性和籽粒蛋白质含量均显著高于NT植株。(3)相关性分析表明,豆血红蛋白含量、谷氨酰胺合成酶活性、总磷、总氮含量4个指标间均呈显著正相关关系。(4)GmENOD40a、GmENOD40b、GmGS1β1、GmGS1β2基因在转基因植株中的表达量显著高于NT植株。研究表明,OsPT6基因过表达增强了菜用大豆在低磷条件下的结瘤及固氮能力,该研究结果为进一步研究其调控机理奠定了基础。
关键词:OsPT6基因;菜用大豆;磷积累;结瘤;固氮
菜用大豆[Glycinemax(L.) Merr.]也称毛豆,是一种特用大豆,指在鼓粒盛期(R6)至初熟期(R7)即籽粒饱满,荚色、籽粒呈翠绿时采摘作为蔬菜食用的大豆[1]。其营养价值高,含有人体必需的多种营养成分,如蛋白质、游离氨基酸、矿物质和多种维生素等,菜用大豆深受中国及东南亚地区消费者喜爱,并逐渐受到欧美国家消费者的青睐[2-3]。菜用大豆市场需求量逐年增加,发展迅速,在中国东南沿海一带,菜用大豆不仅是区域特色明显的优势农作物,同时也是主要出口创汇蔬菜[4-5]。
磷为菜用大豆生长的必需元素之一,除参与生长发育过程外,还参与大豆蛋白质和油脂含量的合成。此外,大豆根瘤的形成、氮的固定和氨的转化以及随后氨基酸的合成更离不开磷[6]。由于风化的密集性侵蚀和自由离子及氧化铝强大的磷固定,热带、亚热带和温带地区的土壤中磷含量比较低,尤其在中国南方的酸性土壤里,无机磷的浓度低于6 μmol/L,游离磷的比例也远远低于植物根系吸收的比例[7-8]。近年来,许多学者对植株磷吸收和新陈代谢的机制研究发现,无机态磷通过根细胞膜进入植物体内是由同一或不同家族的多个磷转运蛋白来完成的[9-11]。Pht1是植物中已发现的磷转运蛋白基因家族之一,在水稻中有13个成员在磷吸收、转运、再分配等方面起着不同作用,OsPT6基因在水稻中既负责土壤中磷素的吸收又有转运功能[12-13]。
在经济欠发达地区或国家,人口增长与食物短缺的矛盾突出,同时因水土流失、土地盐碱化导致的耕地减少、土壤肥力降低以及连作障碍等情况加剧发生,转基因技术正逐渐成为解决这些问题的最有效方式之一。根据国际农业生物技术应用服务组织(ISAAA)2014年统计表明,转基因大豆种植面积为7.3×107hm2,占全世界大豆种植面积的77%[14]。
目前,转基因大豆研究已成为国内外大豆分子生物学的研究热点。Hinchee[15]首次报道成功获得大豆转基因植株,美国孟山都公司将EPSPS基因转入大豆,培育出“农达”转基因大豆并大面积产业化[16]。抗草甘膦转基因大豆(RR大豆)和高油酸大豆(HO大豆)在国际上的种植面积不断增加,转基因大豆类型不断增加。谷晓娜等[17]对hrpZpsta转基因大豆疫霉根腐病和灰斑病抗性进行了研究;朱琳峰等[18]对Cp4-epsps抗草甘膦转基因大豆相关性状进行研究;尹青女等[19]向大豆受体导入热激转录因子8(Heat shock factor 8)基因,以加强目的基因hsf70的表达和增加转基因大豆的抗逆性。中国研究者主要在大豆抗病虫害、抗逆性及大豆油分等重要农艺性状方面获得转基因植株。然而,关于低磷条件下转OsPT6基因的菜用大豆结瘤固氮的相关研究尚属空白。本研究以实验室前期获得的稳定遗传的转OsPT6基因的3个株系为实验材料[20],研究了OsPT6基因在菜用大豆中过量表达对整个植株生理、农艺性状及结瘤固氮的影响,揭示了转OsPT6菜用大豆提高磷的高效利用,也可以为后续分子育种和转基因大豆产业化奠定基础。
1材料和方法
1.1实验材料
转OsPT6基因菜用大豆材料为本实验室提供T3代纯合体转基因株系[20](以菜用大豆‘NY-1001’为转化受体品种)。3份转基因材料编号分别是15L-1、15L-2和15L-3;其转基因拷贝数均为单拷贝[20]。非转基因菜用大豆品种‘NY-1001’为对照。
1.2实验方法
1.2.1石英砂培养采用砂培以磷酸二氢钾作为磷源,浓度经预备实验确定为 20 μmol/L。菜用大豆种子用70%乙醇灭菌,用无菌水冲洗7~8次,然后浸种。2 h后转移到培养皿中,置于25 ℃恒温箱中避光催芽,待主根长到4~5 cm,开始长须根时,用本实验室保存的日本慢生根瘤菌(Bradyrhizobiumjaponicum)菌液侵染后,移栽到砂培周转箱(380 cm×275 cm×140 cm),装砂高12 cm,每箱5株,营养液培养。营养液组成:K2SO4600 μmol/L;MgSO4·7H2O 200 μmol/L;CaCl2·2H2O 600 μmol/L;H3BO35 μmol/L;ZnSO4·7H2O 0.75 μmol/L;MnSO4·H2O 1 μmol/L;CoSO4·7H2O 0.2 μmol/L;CuSO4·5H2O 0.2 μmol/L;Na2MoO4·H2O 0.03 μmol/L;Fe-Na EDTA 10 μmol/L。移栽后定期浇灌营养液,并且每周用无菌水冲洗石英砂。
1.2.2转基因菜用大豆鉴定菜用大豆生长30 d,用天根公司DNA提取试剂盒提取幼叶DNA,-20 ℃保存备用。分别以GUS引物(5′-TGGTGACG-CATGTCGCGCAAGAC-3′和5′-GGTGATGATAATC-GCCTGATGCAG-3′)、OsPT6引物(5′-CCGACGCCT-ATGACCTCTTCT-3′和5′-GACATCTCCTCCAGC-GACTTCC-3′),利用PCR技术确定GUS和OsPT6基因表达,从而鉴定转基因植株。PCR引物由南京金斯瑞生物科技有限公司合成。PCR扩增反应体系10 μL:PremixTaq酶5 μL(TaKaRa),10 μmol/L上、下游引物各0.5 μL,10 ng·μL-1DNA 0.5 μL,ddH2O 3.5 μL。PCR反应热循环程序为:94 ℃预变性5 min,94 ℃变性1 min,61.4 ℃复性1 min,72 ℃延伸2 min,30个循环;72 ℃延伸10 min,最后4 ℃保存。特异性引物扩增产物用1.5%琼脂糖、EB染色检测。
为了确认所用试验材料均是转基因菜用大豆,利用TaKaRa公司RNA提取试剂盒提取植株叶片RNA,用TaKaRa反转录试剂盒(PrimeScript®RT reagent Kit with gDNA Eraser)进行反转录,以非转基因植株(NT)为对照,以大豆GmSKIP16(5′-GAGC-CCAAGACATTGCGAGAG-3′和5′-CGGAAGCGGA-AGAACTGAACC-3′)为内参基因[21],采用qRT-PCR方法检测OsPT6基因在叶片中的相对表达量。荧光定量PCR反应程序:95 ℃预变性30 s后,95 ℃变性5 s,60 ℃退火20 s,40个循环。根据Ct值计算相对表达量。
1.2.3植株生长发育指标测定大豆鼓粒初期之前,磷素营养水平是产量形成的关键因素[22],因而本研究在砂培生长35 d,游标卡尺测茎粗;直尺测株高。取鲜样,用叶面积测定仪测叶面积。取植株,测地上部、地下部质量以及根瘤数;然后105 ℃下杀青30 min,70 ℃烘箱中72 h至恒重,测量干物质量。用光合仪测定植株的第二片真叶的光合效率;叶绿素测定仪测定叶绿素含量;叶绿素a、叶绿素b和类胡萝卜素含量用紫外分光光度计测量。在生长过程中测量单株花数、单株有效荚数、单株粒数、单株产量等生长发育指标。
1.2.4植株有效磷、全磷、全氮以及大豆籽粒中蛋白质含量的测定35 d苗龄时测定全磷、全氮含量,首先准确称取0.10 g烘干的植物样品,采用H2SO4-H2O2消化法[23]。全氮用凯氏定氮仪测定。全磷测定采用钼锑抗比色法。考马斯亮蓝染色法测定大豆籽粒中蛋白质含量[24]。
1.2.5豆血红蛋白含量和谷氨酰胺合成酶活性的测定35 d苗龄时测定豆血红蛋白含量,参照王树起等[24]的方法,并作适当修改。取一定量的新鲜根瘤,液氮研磨成粉,放入4 ℃、0.1 mol/L磷酸缓冲溶液混合均匀(体积比为1∶4),4 ℃、1 000 r/min离心15 min,取上清液,4 ℃、40 000 r/min离心15 min,所得上清液在540 nm下测量吸光值。谷氨酰胺合成酶活性测定使用苏州科铭生物技术有限公司试剂盒[25]。
1.2.6荧光定量PCR分析取新鲜根瘤0.10 g,用TaKaTa RNA试剂盒提取RNA,质量检测合格的RNA使用宝生物的M-MLV反转录试剂盒按照说明进行反转录合成cDNA。以GmCons6(5′-AGATAGGGAAATGGTGCAGGT-3′和5′-CTAATGGCAATTGCAGCTCTC-3′)为内参基因[26],利用qRT-PCR检测与结瘤和固氮相关基因的相对表达量。4个相关基因包括2个早期的结瘤素基因:GmENOD40a(5′-TCTCTCTTGAGTGGCAGAA-GCA-3′和5′-TGGAGTCCATTGCCTTTTCG-3′)和GmENOD40b(5′-GAGTGGCGGAAGCAGA-TACAC-3′和5′-CTACATAGCCATAGAGACCC-CAATG-3′),2个胞质谷氨酰胺合成酶基因:GmGS1-β1(5′-GCTTTTCTTAGTAGGATTTGGTCTC-3′和5′-TAACAATCGGAAAACGAGGGA-3′)和Gm-GS1β2(5′-GTGGAAGCCATGAGCAAAACT-3′和5′-CGAGGGAAAGGAATAGAAAACA-3′)[27-28]。荧光定量PCR反应程序:95 ℃预变性30 s后,95 ℃变性5 s,60 ℃退火20 s,40个循环。根据Ct值计算相对表达量。
1.2.7数据统计和分析所得数据由统计软件Excel和SPSS 19.0进行分析。
2结果与分析
2.1转OsPT6基因菜用大豆植株的确认
如图1,A 所示,GUS基因呈阳性,而且出现预期的OsPT6基因条带。如图1,B所示,3个重复株系的叶片中OsPT6基因表达均有较高水平,而对照非转基因植株中没有表达。因此,确定这些植株就是转基因植株,可以作为本研究实验材料。
2.2生长发育指标的比较
低磷处理后,转基因植株生长状态良好,与NT植株相比,植株较高,叶面积较大,根系发达,叶片较多且浓绿,而NT植株叶片出现枯斑,叶边缘干枯死亡(图2,A~C)。低磷处理75 d后,转基因植株仍有较多叶片,而NT 植株叶片脱落严重(图2,D)。低磷处理90 d后,收获种子,转基因植株单株豆粒数和单株总豆粒重量显著高于NT植株,说明转基因植株磷素营养状态明显优于NT植株(表1)。
由表1可知,低磷营养液培养,转基因与非转基因菜用大豆的长势有明显差异。转基因植株的叶面积、株高、茎粗、根长、地下部重显著高于NT植株,有利于植株营养生长,并为提高产量打下基础。转基因植株单株花数较NT植株增加24.00%~34.67%,其荚数、种子数和种子重量也显著高于NT。转基因大豆根瘤数也显著高于非转基因大豆。表明转基因菜用大豆在低磷条件下通过对更多磷的吸收促进根瘤的产生,从而影响大豆相关氮代谢。
2.3有效磷、总磷及总氮含量的比较
在低磷条件下,转基因植株根、茎、叶以及根瘤中有效磷浓度均显著高于NT植株(图3,A);转基因植株总磷干重含量介于0.89~0.96 mg·g-1之间显著高于NT植株的0.71 mg·g-1,转基因植株全株总氮含量介于1.57~1.69 mg·g-1之间,显著高于NT植株的0.98 mg·g-1(图3,B);表明过表达OsPT6基因增强了转基因植株对磷和氮的吸收和转运能力。
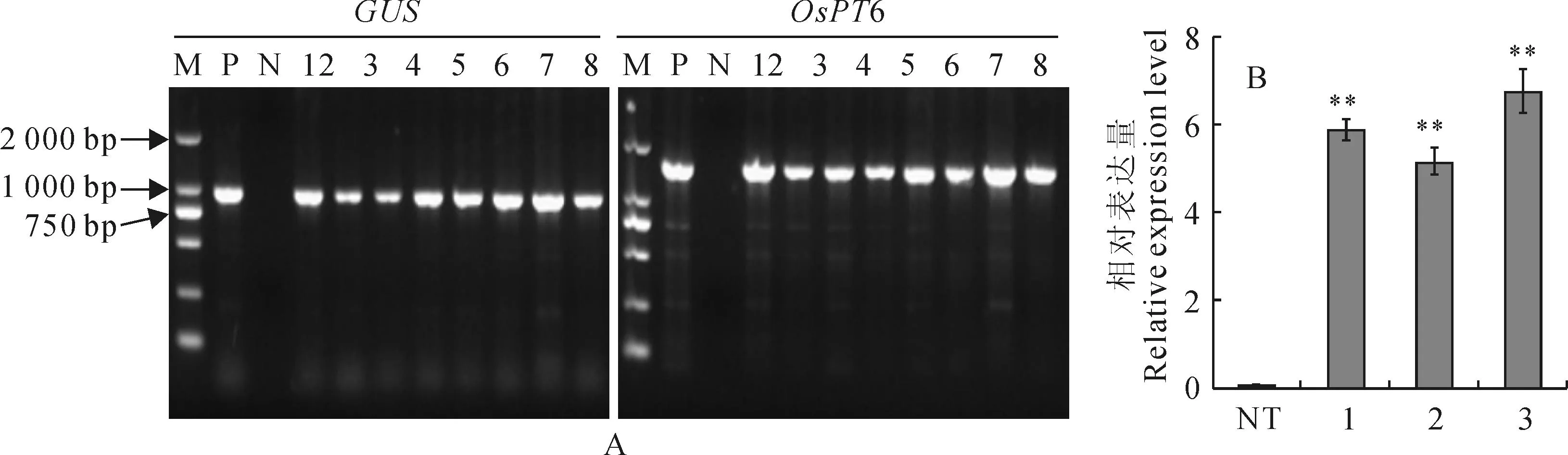
A.T3代转基因植株GUS和OsPT6基因的PCR检测:M.Marker;P.阳性对照;N.阴性对照;

A.低磷处理45 d;B、C.A中叶片的放大图像;D.低磷处理75 d。OsPT6 T3.T3代转基因植株;NT.非转基因植株
2.4豆血红蛋白和谷氨酰胺合成酶活性以及大豆籽粒蛋白质含量的比较
豆血红蛋白在根瘤菌与豆科植物共生后出现,常常作为衡量豆科植物共生固氮作用活性的指标[29]。由图4,A可知,豆血红蛋白主要存在于根瘤中,并且转基因植株的豆血红蛋白含量(107.3~124.13 μg·g-1)较NT植株(60.5 μg·g-1)增加了77.36%~105.17%,且差异显著。因此低磷条件下,相比于NT植株而言,转基因植株根瘤的固氮能力得到提升,使大豆的固氮效率显著升高。
谷氨酰胺合成酶(GS;EC6.3.1.2)是植物氮同化途径中最为关键的催化酶之一,对植物氮吸收、同化和利用效率有极重要的作用;GS活性越高越有利于蛋白质合成[30]。由图4,B可知,谷氨酰胺合成酶在功能叶片中活性明显高于根瘤;在功能叶片中,转基因植株谷氨酰胺合成酶的活性(130.96~142.45 U·g-1)较NT植株(70.33 U·g-1)增加了86.21%~102.59%。
在低磷条件下转基因株系15L-1、15L-2和15L-3大豆籽粒蛋白质含量分别为(38.71±0.5)%、(40.14±0.2)%和(37.25±0.3)%,而NT 植株的蛋白质含量为(31.85±0.4)%,转基因植株和非转基因植株之间存在显著差异。
2.5相关性分析
Pearson相关性分析表明,菜用大豆以下各生理指标均呈现出正相关关系(表2)。其中,GS活性与总磷含量存在显著正相关(P<0.05),与总氮含量存在极显著正相关(P<0.01);豆血红蛋白含量与总磷含量存在显著正相关(P<0.05);总磷含量与总氮含量间存在显著正相关(P<0.05);籽粒蛋白质含量与其他各生理指标均存在正相关关系。以上相关性分析结果进一步证明了磷在大豆生长发育中起着不可替代的作用,转基因植株较NT植株具有更强的磷吸收、富集以及转化能力。
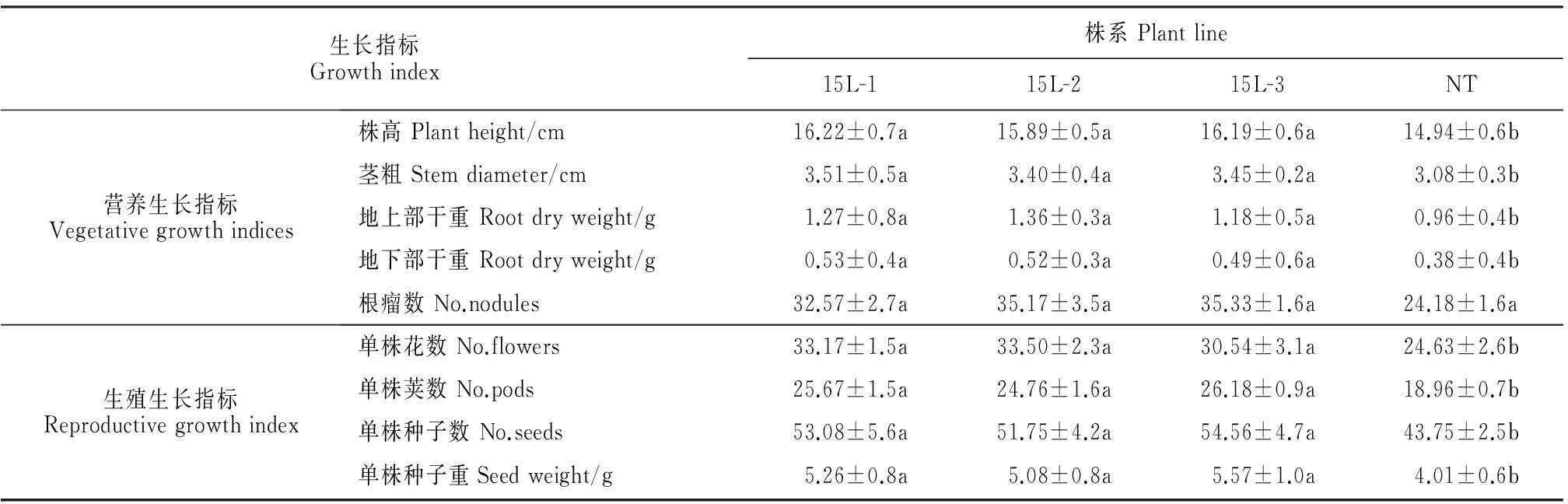
表1 低磷条件下转基因植株与NT的生长指标差异
注:表中数据为平均数±标准差(n=8).同行不同小写字母表示同一磷处理条件下株系间Duncan’s多重比较在0.05水平差异显著。
Note:The data represent the means±SD (n=8).Different normal letters within same row indicate a significant difference between the plant lines according to Duncan’s new multiple range test under the same phosphorus condition (P<0.05).
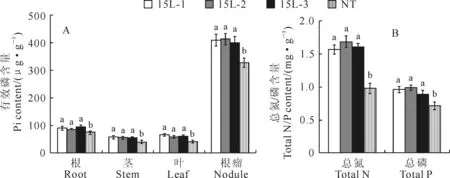
同一组不同小写字母表示Duncan’s多重比较在0.05水平上差异显著;下同
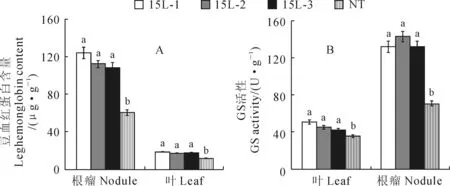
图4 转基因植株与NT植物根瘤和叶片中豆血红蛋白含量(A)和谷氨酰胺合成酶活性(B)
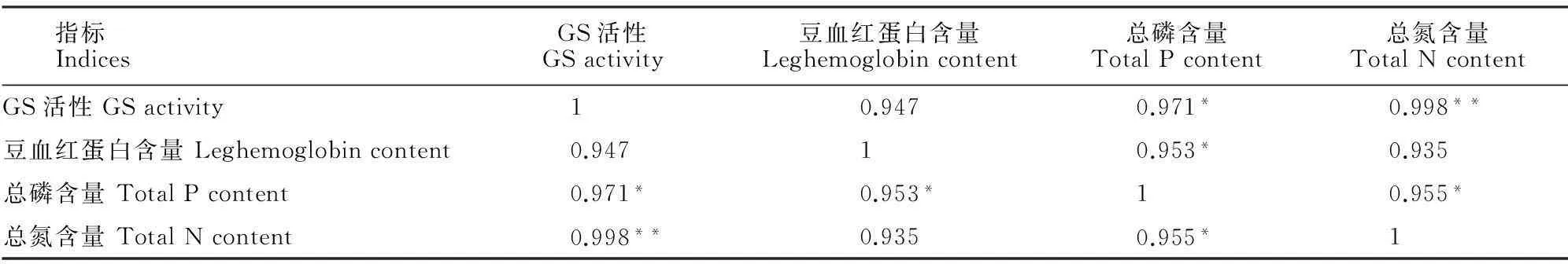
指标IndicesGS活性GSactivity豆血红蛋白含量Leghemoglobincontent总磷含量TotalPcontent总氮含量TotalNcontentGS活性GSactivity1 0.9470.971*0.998**豆血红蛋白含量Leghemoglobincontent0.94710.953*0.935总磷含量TotalPcontent0.971*0.953*10.955*总氮含量TotalNcontent0.998**0.9350.955*1
注:*表示在0.05水平显著相关;**表示在0.01水平显著相关。
Note:* indicates significant correlation at 0.05 level;** indicate significant correlation at 0.01 level.
2.6转基因和NT植株结瘤及固氮相关基因表达量的比较
为了探究OsPT6基因过表达对结瘤及固氮相关基因表达的影响,利用qRT-PCR检测GmENOD40a、GmENOD40b、GmGS1β1、GmGS1β2基因的相对表达量。结果显示,与NT植株相比,这4个基因在转基因植株中的表达量均显著升高(图5)。
3讨论
磷对菜用大豆生长具有重要作用,磷素缺乏会影响植株生长;具体表现为对地上部生长的抑制,如植株矮小,叶片小及叶片出现枯斑等[31-32]。磷利用效率的提高有利于增加低磷条件下植株的产量,如PHF1介导磷转运蛋白的转录后调控,在水稻中OsPHF1基因过表达,提高了植株对磷的吸收能力,在大田试验中单株产量显著增加[11]。本研究中,低磷处理30 d后,转基因植株生长良好,生长状态如株高、茎粗等方面较NT植株优势显著;随着培养时间延长,NT植株出现叶片失绿、花少、荚少、籽粒少等缺磷症状,这是由于转基因体内磷素营养高于NT植株的结果。
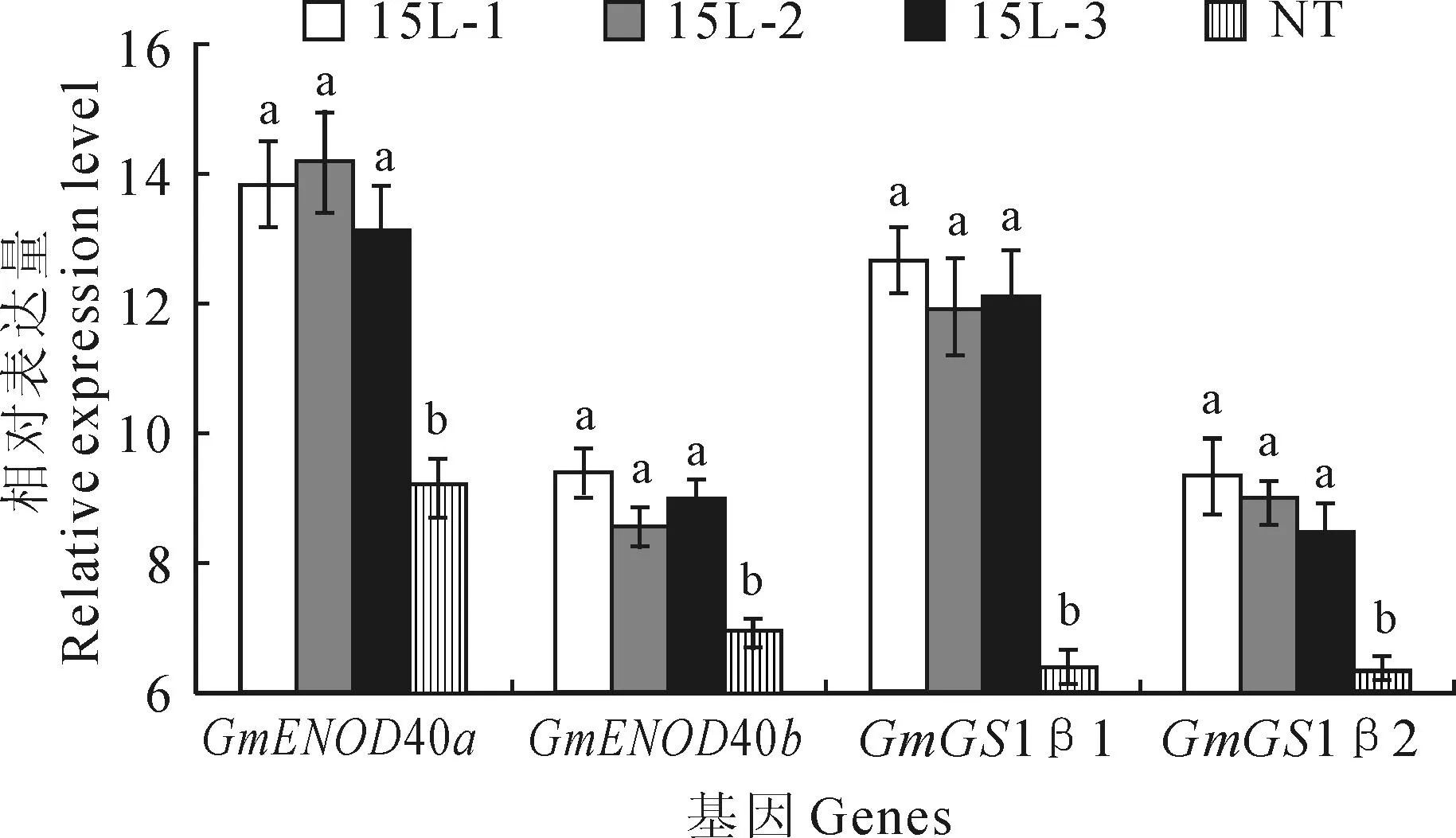
图5 转基因植株和NT植株根瘤中的结瘤及
在植物体内,磷转运蛋白在磷素的吸收和转运过程起着重要的作用[33-34]。在低磷条件下转烟草(NicotianatabacumL.)NtPt1基因的水稻,叶片中磷积累量较非转基因植株提高了41% 。水稻中OsPT8基因的过表达使得叶片和根中磷积累显著增加[35]。本研究中,低磷条件下转OsPT6基因的菜用大豆植株中有效磷、总磷的含量均显著高于NT植株,表明OsPT6基因过表达在转基因植株中发挥作用,提高了大豆植株对低磷环境的耐受能力、磷素的摄取能力,提高植株体内磷素的积累和磷的利用效率,这与Seo等[36]在水稻上的研究结果一致。此外,转基因菜用大豆植株茎和叶片的有效磷含量均较NT植株显著增加,表明在转基因植株中OsPT6基因过表达有利于磷从根部向地上部转运。转基因植株中的根瘤数、总氮含量显著高于NT植株,表明OsPT6基因过表达提高菜用大豆的结瘤及固氮能力。
豆血红蛋白作为氧的载体,本身不能固氮,但它能增加类菌体对氧的吸收率,同时提高固氮酶的活性[37]。低磷条件下,转基因菜用大豆植株根瘤的豆血红蛋白含量显著高于NT植株,固氮酶的活性得到提升,使大豆的固氮效率显著升高。植物中所有的氮均必须经过谷氨酰胺合成酶(GS)催化反应途径才能进一步形成氨基酸并最终转变积累为蛋白质,对于菜用大豆生长和籽粒蛋白质合成影响很大[38]。本研究中转基因植株GS活性显著高于NT植株,有利于菜用大豆的生长以及籽粒蛋白质合成,提高菜用大豆品质。相关性分析表明,低磷条件下转基因与NT植株的总磷、总氮、豆血红蛋白和谷氨酰胺合成酶4个指标间均呈正相关,也进一步证明了磷氮之间存在互作效应,磷的高效利用能促进氮的吸收;豆血红蛋白含量和GS的活性提高,从而提高结瘤及固氮能力。
GmENOD40a和GmENOD40b作为大豆根瘤早期结瘤素基因,在根瘤发育和氮运输过程中起着重要作用[27]。本研究中,GmENOD40a和GmENOD40b在转基因植株的表达量显著高于NT植物。研究表明GmGS1β1、GmGS1β2作为豆科特有的基因,其表达受外界环境的影响,是环境因子调节植物氮素同化的重要分子靶点[39]。低磷条件下,GmGS1β1、GmGS1β2在转基因菜用大豆植株中的表达水平显著高于NT植株。这表明这4个基因的高表达有助于转基因植株结瘤及固氮。
综上所述,在低磷条件下,OsPT6基因过表达增强了菜用大豆植株结瘤固氮相关基因(GmENOD40a、GmENOD40b、GmGS1β1、GmGS1β2)的表达水平,提高了磷素、氮素的积累和豆血红蛋白含量及谷氨酰胺合成酶活性,从而增强菜用大豆的结瘤固氮能力,有利于植株的生长发育。
参考文献:
[1]盖钧镒,王明军,陈长之.中国毛豆生产的历史渊源与发展[J].大豆科学,2002,21(1):7-13.
GAI J Y,WANG J M,CHEN C Z.The historical origin and development of China’s soybean production[J].SoybeanScience,2002,21(1):7-13.
[2]MIMURA M,COYNE C J,BAMBUCK M W,etal.SSR diversity of vegetable soybean [Glycinemax(L.) Merr.][J].GeneticResourcesandCropEvolution,2007,54(3):497-508.
[3]张玉梅,胡润芳,林国强.菜用大豆品质性状研究进展[J].大豆科学,2013,32(5):698-702.
ZHANG Y M,HU R F,LIN G Q.Research progress of soybean quality traits[J].SoybeanScience,2013,32(5):698-702.
[4]DONG D K,FU X J,YUAN F J,etal.Genetic diversity and population structure of vegetable soybean [Glycinemax(L.) Merr.] in China as revealed by SSR markers[J].GeneticResourcesandCropEvolution,2014,61(1):173-183.
[5]刘欣,姚晗珺,章强华,等.浙江省出口菜用大豆使用农药现状及风险分析[J].大豆科学,2011,30(2):298-302.
LIU X,YAO H J,ZHANG Q H,etal.Status of pesticide and risk analysis of exporting vegetable soybeans in Zhejiang Province[J].SoybeanScience,2011,30(2):298-302.
[6]王树起,韩晓增,严君,等.缺磷胁迫对大豆根系形态和氮磷吸收积累的影响[J].土壤通报,2010,(3):644-650.
WANG S Q,HAN X Z,YAN J.Phosphorus deficiency stress of soybean root morphology and the influence of the accumulation of nitrogen and phosphorus absorption[J].ChineseJournalofSoilScience,2010,(3):644-650.
[7]WANG Y X,TIAN J,LIM B L,etalOverexpressingAtPAP15 enhances phosphorus efficiency in soybean[J].PlantPhysiology,2009,151(1):233-240.
[8]LI Y D,WANG Y J,TONG Y P,etal.QTL maping of phosphorus deficiency tolerance in soybean (GlycinemaxL.Merr.)[J].Euphytica,2005,142:137-142.
[9]AI P H,SUN S B,ZHAO J N,etal.Two rice phosphate transporters,OsPht1;2andOsPht1;6,have different functions and kinetic properties in uptake and translocation[J].PlantJournal,2009,57(5):798-809.
[10]GUO C J,ZHAO X L,LIU X M,etal.Function of wheat phosphate transporter geneTaPHT2;1 in translocation and plant growth regulation under replete and limited supply conditions[J].Planta,2013,237(4):1 163-1 178.
[11]LU P,SHOU H X,XU G H,etal.Improvement of phosphorus efficiency in rice on the basis of understanding phosphate signaling and homeostasis[J].CurrentOnioninPlantBiology,2013,16:1-8.
[12]SMITH F W,MUDGE S R,RAE A L,etal.Phosphate transport in plants[J].Plant&Soil,2003,248(2):71-83.
[13]RAE A L,CYBINSKI D H,etal.Characterization of two phosphate transporters from barley;evidence for diverse function and kinetic properties among members of the Pht1 family[J].PlantMolecularBiology,2003,53(2):27-36.
[14]李相全,张忠亮,涛波,等.抗草甘膦转基因大豆对土壤酶活性及微生物数量的影响[J].大豆科学.2015,34(8):648-653.
LI X Q,ZHANG Z L,TAO B,etal.Effects of genetic modified glyphosate resistant soybean on soil activity and microoranisms [J].SoybeanScience,2015,34(8):648-653.
[15]HANSEN G,WRIGHT M S.Recent advances in the transformation of plants[J].TrendsPlantScience,1999,(4):226-231.
[16]WIDHOLM J,KAUFFMAN H E.Status of soybean transformation methods[J].WorldSoybeanResearchConferencesVISymposium,1999:62-67.
[17]谷晓娜,刘振库,王丕武,等.hrpZPsta在转基因大豆中定量表达与疫霉根腐病和灰斑病抗性相关研究[J].中国油料作物学报,2015,(1):35-40.
GU X N,LIU Z K,WANG P W.Gene expression and disease resistance of transformedhrpZPstagene in transgenic soybean[J].ChineseJournalofOilCropSciences,2015,(1):35-40.
[18]朱琳峰,彭焕,黄文坤,等.抗草甘膦转基因大豆Cp4-epsps基因快速简便的LAMP检测方法[J].植物保护,2015,(3):86-92.
ZHU L F,PENG H,HUANG W K.Rapid and simple detection ofCp4-epspsgene in glyphosate-resistance soybean by loop-mediated isothermal amplification [J].PlantProtection,2015,(3):86-92.
[19]尹青女,吕慧颖,朱保葛,等.农杆菌介导法将热激转录因子8基因转入大豆[J].分子植物育种,2004,2(6):783-787.
YI Q N,LÜ H Y,ZHU B G.Agrobacterium-mediated transformation ofhsf8 into soybean[J].MolecularPlantBreeding,2004,2(6):783-787.
[20]WEN Y,CHEN G H,YANG L F,etal.Overexpression of the rice phosphate transporter geneOsPT6 enhances tolerance to low phosphorus stress in vegetable soybean[J].ScientiaHorticulturae,2014,177:71-76 .
[21]FAN C M,WANG X,HU R B,etal.The pattern of phosphate transporter 1 genes evolutionary divergence inGlycinemaxL.[J].MCPlantBiol.,2013,(13):48.
[22]吴冬婷,张晓雪,龚振平,等.磷素营养对大豆磷素吸收及产量的影响[J].植物营养与肥料学报,2012,18(3):670-677.
WU D T,ZHANG X X,GONG Z P.Effects of phosphorus nutrition on P absorption and yields of soybean[J].PlantNutritionandFertilizerScience,2012,18(3):670-677.
[23]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000:183-187.
[24]王树起,韩晓增,乔云发,等.不同供N方式对大豆生长和结瘤固氮的影响[J].大豆科学,2009,28(5):859-862.
WANG S Q,HAN X Z,QIAO Y F.Different ways for N impact on soybean growth and nitrogen fixation of nodules[J].SoybeanScience,2009,28(5):859-862.
[25]董友魁,刘德恒,韩艳红,等.钼肥对鲜食大豆主要光合生理指标的影响[J].大豆科学,2015,34(6):349-352.
DONG Y K,LIU D H,HAN Y H.Effect of molybdenum on main photosynthetic characteristics of vegetable soybean[J].SoybeanScience,2015,34(6):349-352.
[26]LIBAULT M,THIBIVILLIERS S,BILGIN D D,etal.Identification of four soybean reference genes for gene expression normalization[J].PlantGenom.,2008,(1):44-54.
[27]KOUCHI H,HATA S.Isolation and characterization of novel nodulin cDNAs representing genes expressed at early stages of soybean nodule development[J].Mol.Gen.Gene,1993,(238):106-119.
[28]MASALKAR P,WALLACE I S,HWANG J H,etal.Interaction of cytosolic glutamine synthetase of soybean root nodules with the C-terminal domain of the symbiosome membrane nodulin 26 aquaglyceroporin[J].Biol.Chem.,2010,(285):23 880-23 888.
[29]赵亚兰,尉亚辉.豆血红蛋白的研究进展[J].西北植物学报,2000,20(4):684-689.
ZHAO Y L,WEI Y H.Progress in the study of leghemoglobin[J].ActaBot.Boreal.-Occident.Sin.,2000,20(4):684-689.
[30]王晓波,滕婉,何雪,等.大豆谷氨酰胺合成酶基因的分类及根瘤特异表达GmGS1β2基因功能的初步分析[J].作物学报,2013,39(12):2 145-2 153.
WANG X B,TENG W,etal.Classification of glutamine synthetase gene and preliminary functional analysis of the nodule-predominantly expressed geneGmGS1β2 in soybean[J].ActaAgronomicaSinica,2013,39(12):2 145-2 153.
[31]LYNCH J P,BROWN K M.Root strategies for phosphorus acquisition[J].TheEcophysiologyofPlant-PhosphorusInteractions,Springer,Berlin,2008:83-116.
[32]陈怀珠,赵艳红,杨守臻,等.磷胁迫下不同基因型大豆的症状表现及耐性极限研究[J].大豆科学,2008,27(1):165-169.
CHEN H Z,ZHAO H Y,YANG S Z,etal.Symptoms and tolerant limit of different genotype soybeans under phosphorus stress [J].SoybeanScience,2008,27(1):165-169.
[33]NUSSAUME L,KANNO S,JAVOT H,etal.Phosphate import in plants:focus on the PHT1 transporters[J].FrontiersinPlantScience,2011,2:83.
[34]PARK M R,BAEK S H,etal.Over expression of a high-affinity phosphate transporter gene from tobacco (NtPT1) enhances phosphate uptake and accumulation in transgenic rice plants[J].PlantSoil,2007,292:259-269.
[35]JIA H F,REN H Y,GU M,etal.The phosphate transporter geneOsPht1;8 is involved in phosphate homeostasis in rice[J].PlantPhysiology,2011,156(3):1 164-1 175.
[36]SEO H M,JUNG Y H,SONG S Y,etal.Increased expression ofOsPT1,a high-affinity phosphate transporter,enhances phosphate acquisition in rice[J].BiotechnologyLetters,2008,30(10):1 833-1 838.
[37]PETER J L,MIFLIN B J.Glutamate synthase and the synthesis of glutamate in plants[J].PlantPhysiologyandBiochemistry,2003,41(6):555-564.
[38]黄冰艳,高伟,苗利娟,等.谷氨酰胺合成酶基因研究进展及其在植物氮代谢调控中的应用[J].中国农学通报,2010,26:53-57.
HUANG B Y,GAO W,MIAO L J.Research progress on glutamine synthetase genes and its application on the genetic control of nitrogen metabolism in plants[J].ChineseAgriculturalScienceBulletin,2010,26:53-57.
[39]CAI H M,XIE W B,LIAN X M.Comparative analysis of differentially expressed genes in rice under nitrogen and phosphorus starvation stress conditions[J].PlantMol.Biol.Rep.,2013,31:160-173.
(编辑:宋亚珍)
Effects ofOsPT6 Gene Overexpression on Nodulation and Nitrogen Fixation of Vegetable Soybean under Low Phosphorus Conditions
LIU Wei,YANG Lifei,ZHU Wenli,LIU Dandan,ZHU Yuelin*
(College of Horticulture,Nanjing Agricultural University,Nanjing 210095,China)
Abstract:By using sand culture,we made comparisons between the T3transgenic lines overexpressed a rice (Oryza sativa L.) phosphate transporter gene OsPT6 and their non-transgenic (NT) host cultivar to examine the differences in the traits of growth and development,the concentrations of available phosphorus,total phosphorus,total nitrogen,and leghemoglobin,the activities of glutamine synthetase and the contents of seed proteins in vegetable soybean under low phosphorus conditions.In addition,the relative expression levels of some genes related to the nodulation and nitrogen fixation in roots were also measured.The purpose of this research was to provide the theoretical basis for elucidating the mechanisms of nodulation and nitrogen fixation in the roots of the transgenic plants under phosphorus deficiency.The results showed that:(1)the plant height,stem diameter,numbers of flowers,pods and root nodules of the transgenic plants were significantly higher than those of the NT plants.(2)The concentrations of available phosphorus in roots,stems,leaves and nodules,the contents of phosphorus and nitrogen of the whole plant,the concentrations of leghemoglobin in the nodules and the activities of glutamine synthetase in functional leaves of the transgenic plants were significantly higher than those of the NT plants.(3)The mutually significant positive correlations were observed among the concentrations of leghemoglobin,total phosphorus,total nitrogen,and the activity of glutamine synthetase.(4)The relative expression levels of GmENOD40a,GmENOD40b,GmGS1β1,GmGS1β2 genes in transgenic plants were significantly higher than those in the NT plants.The above results indicated that the overexpression of OsPT6 gene enhances the ability of nodulation and nitrogen fixation in the transgenic vegetable soybean under low phosphorus conditions,which lays the foundations for the further studies on their regulation mechanisms.
Key words:OsPT6 gene;vegetable soybean;phosphorus accumulation;nodulation;nitrogen fixation
中图分类号:Q786;Q789
文献标志码:A
作者简介:刘伟(1989-),男,在读硕士研究生,主要从事蔬菜栽培生理与生物技术研究。E-mail:cawayliu@163.com*通信作者:朱月林,教授,主要从事蔬菜栽培生理与生物技术研究。E-mail:ylzhu@njau.edu.cn
基金项目:国家转基因生物新品种培育科技重大专项(2014ZX08004-005-007);作物遗传与种质创新国家重点实验室开放基金(ZW2013006),江苏高校优势学科建设工程项目(2014PAPD)
收稿日期:2015-11-25;修改稿收到日期:2016-01-06
文章编号:1000-4025(2016)02-0266-08
doi:10.7606/j.issn.1000-4025.2016.02.0266
——固氮微生物

