邻甲氧基环己醇液相脱氢制备愈创木酚的热力学分析
鲁 航,李瑞江,朱学栋,朱子彬
(华东理工大学 大型工业反应器工程教育部工程研究中心,上海 200237)
邻甲氧基环己醇液相脱氢制备愈创木酚的热力学分析
鲁 航,李瑞江,朱学栋,朱子彬
(华东理工大学 大型工业反应器工程教育部工程研究中心,上海 200237)
采用Benson基团贡献法计算了邻甲氧基环己醇和愈创木酚的标准摩尔生成焓、标准摩尔熵和摩尔等压热容,确定了反应焓变、吉布斯自由能变和平衡常数与温度的函数式;利用UNIFAC基团贡献模型建立了邻甲氧基环己醇-愈创木酚-水三元体系液相活度系数关联式;考察了氢分压、温度及水醇比对脱氢平衡转化率的影响。实验结果表明,对邻甲氧基环己醇催化脱氢制备愈创木酚的液相反应体系,随温度的升高,平衡常数逐渐增大,在温度低于458 K时,平衡常数远小于1;降低氢分压、增加水醇比均可提高反应的平衡转化率。为邻甲氧基环己醇脱氢制备愈创木酚反应过程研究及生产工艺开发提供了理论依据。
邻甲氧基环己醇;愈创木酚;液相脱氢;Benson基团贡献法;UNIFAC基团贡献模型
愈创木酚,又名邻羟基苯甲醚,是一种重要的精细化工中间体,广泛应用于医药、香料及染料的合成[1-3]。目前,按原料来分,愈创木酚的工业制备方法主要分为邻氨基苯甲醚法和邻苯二酚法[4]。邻氨基苯甲醚法是以邻氨基苯甲醚为原料,经重氮化、水解制得愈创木酚,该法存在生产成本高、环境污染严重等缺点;邻苯二酚法是以邻苯二酚为原料,在催化剂作用下与甲基化试剂反应制得愈创木酚,该法原料价格较高,催化剂的价格昂贵且寿命短。
以邻甲氧基环己醇为原料,在催化剂作用下脱氢制备愈创木酚是一种新工艺[5],该工艺具有原料成本低,产品收率高,分离工艺简单等特点。但目前有关邻甲氧基环己醇液相脱氢制愈创木酚反应的基础热力学数据缺乏,无法为该工艺的开发提供理论指导。
本工作对邻甲氧基环己醇液相脱氢制备愈创木酚的反应体系进行了系统的热力学分析,用Benson基团贡献法估算了邻甲氧基环己醇和愈创木酚的标准摩尔生成焓(ΔfHm⊖)、标准熵(Sm⊖)和热容(Cpm)等基础参数,计算了该反应的焓变(ΔrHm),自由能变(ΔrGm)和平衡常数(K)与温度的关联式;用UNIFAC基团贡献模型关联了邻甲氧基环己醇-愈创木酚-水三元体系的液相活度系数。并探讨了温度、氢气分压和水醇摩尔比(q)对脱氢反应平衡转化率的影响,为邻甲氧基环己醇脱氢制备愈创木酚工艺和反应器的开发提供指导。
1 热力学计算
1.1 气态热力学计算
采用Benson基团贡献法[6-11]计算邻甲氧基环己醇和愈创木酚的,计算公式见式(1)和(2)。
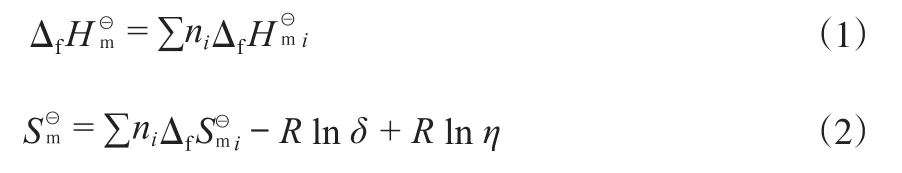
式中,ni为第i种基团的个数;δ为分子的对称数;η为光学异构体的数量。
C7H14O2和C7H8O2各基团的贡献值见表1。根据Cpm=∑niCpm得到不同物质在不同温度时的热容,经多项式回归得Cpm与T之间的函数关系式及邻甲氧基环己醇与愈创木酚的ΔfHm⊖( g)和Sm⊖(g),结果见表2。氢气数据来源于参考文献[12]。

表1 C7H14O2和C7H8O2的标准热力学中各基团的贡献值Table 1 Standard thermodynamic group contributions of C7H14O2and C7H8O2

表2 各物质的热力学数据Table 2 Thermodynamic data of the compounds
1.2 液态热力学计算
1.2.1 液态组分焓的估算

各组分298 K时的ΔvHm⊖采用基团加和法[9]估算,计算式见式(4)。

式中,ni表示第i种基团的个数;εi是基团i对气化能的贡献。通过计算得到298 K时邻甲氧基环己醇的,愈创木酚的64.30 kJ/mol。代入式(3)计算得到液相邻甲氧基环己醇和愈创木酚的标准摩尔生成焓,分别为-500.21 kJ/mol和-308.23 kJ/mol,其结果见表3。1.2.2 液态组分熵的估算


式中,Tb为组分沸点,A和B为经验常数。邻甲氧基环己醇的Tb=471.15 K,A=93.35,B=-208.93;愈创木酚的Tb=478.15 K,A=30.00,B=-53.20[9]。根据式(5)和(6)计算得到液相邻甲氧基环己醇与愈创木酚的标准熵,分别为262.10 J/(mol·K)和274.17 J/(mol·K),其结果见表3。
1.2.3 液态组分热容的估算
各组分的液态热容采用Ruzicka-Domalski基团贡献法[13-14]估算。

式中,R为气体常数;T为热力学温度,K;参数D=∑nidi;E=∑niei;F=∑nifi。各基团的贡献值见表4。根据式(7)计算得到的邻甲氧基环己醇和愈创木酚的液相热容,其结果见表3。

表3 液相化合物的热力学数据Table 3 Thermodynamic data of the liquid phase compounds

表4 液态热容的基团贡献值Table 4 Group contributions of the liquid heat capacities
2 反应吉布斯函数和平衡常数
根据式(8)~(11)计算该液相反应的ΔrHm,ΔrSm,ΔrGm,K。


根据式ΔrCpm=Δz+ΔbT+ΔoT2得到反应的ΔrCpm,见公式(12)。


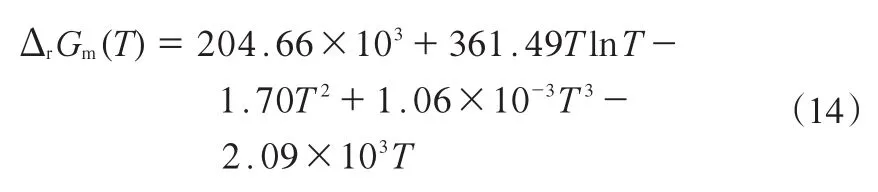
各温度下液相反应的反应焓,吉布斯能变及平衡常数见表5。由表5可看出,温度对反应焓变影响较小,随温度的升高,反应焓变略有下降;温度对平衡常数影响较明显,随温度升高,平衡常数逐渐增大,在低于458 K时,平衡常数远小于1。
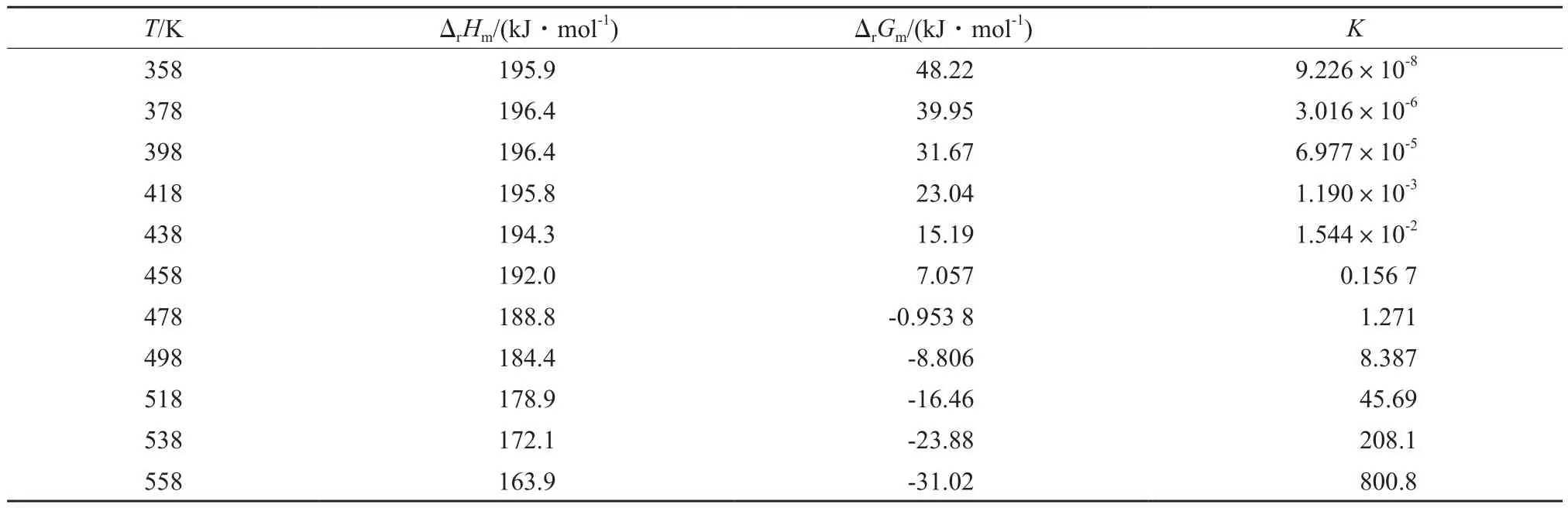
表5 不同温度下反应的ΔrHm,ΔrGm,KTable 5 ΔrHm,ΔrGmandKof the reaction at different temperature
3 体系的气液平衡和反应平衡分析
3.1 邻甲氧基环己醇-愈创木酚-水三元体系液相活度系数的关联
邻甲氧基环己醇-愈创木酚-水三元体系相互具有强烈的缔合作用。由于非理想性,该三元体系液态需用活度代替浓度进行修正。UNIFAC模型吸取了ASOG模型和UNIQUAC模型各自的优点,将二者很好的结合[15-16],本工作采用UNIFAC模型推算该三元体系气液平衡的关联方程,三元体系液态活度系数的计算式见式(15)。

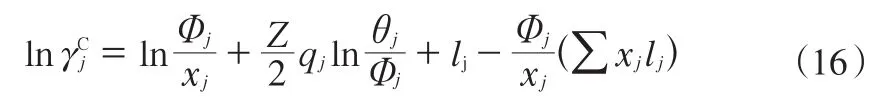

表6 UNIFAC基团划分及相应的基团参数Table 6 UNIFAC group division and the corresponding group parameters

3.2 温度和氢分压、水醇比对反应平衡转化率的影响
邻甲氧基环己醇脱氢生成愈创木酚的反应式见图1。对于液相反应,平衡常数与各物质平衡组成的关系式见式(18)。

图1 邻甲氧基环己醇脱氢生成愈创木酚的反应式Fig.1 Reaction formula of dehydrogenation of 2-methoxycyclohexanol to guaiacol.

式中,a1和a2分别表示邻甲氧基环己醇和愈创木酚的活度,p(H2)为氢气的分压。设水与邻甲氧基环己醇以摩尔比q进入反应体系,反应的平衡转化率为α,则邻甲氧基环己醇与愈创木酚的浓度计算式分别见式(19)和(20)。
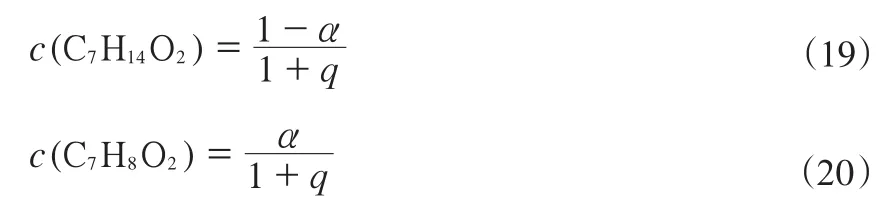
将式(19)和(20)代入式(18)中得出平衡转化率与平衡常数的关系式(21)。

3.2.1 温度和氢分压对反应平衡转化率的影响
水醇比q=3时,氢分压对平衡转化率的影响见图2。由图2可知,反应温度和氢气分压对反应的平衡转化率均有较大的影响。平衡转化率随着温度的升高而增大,这是因为该脱氢反应为强吸热反应,升温有利于反应的正向进行。工业中取反应温度范围为500~550 K,此时反应平衡转化率较高,即使在氢分压高达1 MPa的条件下也可达到0.75。氢气分压越高,平衡转化率越低,工业反应中需通入大量水蒸气来降低氢气分压至0.1 MPa以下,以保证反应平衡转化率能够达到0.9,同时为反应提供热量。

图2 不同氢分压下反应平衡转化率随温度的关系Fig.2 Effects of temperature on the equilibrium conversion under different hydrogen partial pressure.p(H2)/MPa:■ 0.05;● 0.1;▲ 0.5;▼ 1.0Reaction condition:q=n(water)∶n(2-methoxycyclohexanol)=3.
3.2.2 水醇比对反应平衡转化率的影响
氢分压在0.1 MPa时水醇比对反应平衡转化率的影响见图3。由图3可知,该反应的平衡转化率随着水醇比的提高而有些许增长,这主要是通过影响邻甲氧基环己醇与愈创木酚的活度,但温度到达一定程度后反应平衡转化率已经很高,再增加水醇比对反应的转化率提高效果也不显著,且太高的水醇比会使得反应体积太大,工业中目前选取水醇比为3~5较为适宜。
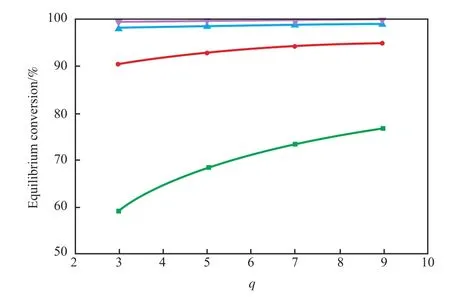
图3 不同温度下反应平衡转化率随水醇比的关系Fig.3 Effects ofqon the equilibrium conversions at different temperature.Temperature/K:■ 458;● 478;▲ 498;▼ 518 Reaction condition:p(H2)=0.1 MPa.
4 结论
1)采用Benson基团贡献法对邻甲氧基环己醇和愈创木酚的热力学数据进行了计算,得到了邻甲氧基环己醇和愈创木酚的标准摩尔生成焓(-500.21 kJ/mol和-308.23 kJ/mol)和标准熵(262.10 J/(mol·K)和274.17 J/(mol·K))及热容随温度的关系式。
2)对邻甲氧基环己醇催化脱氢制取愈创木酚的液相反应体系进行了热力学分析,得到了反应的的焓变、吉布斯自由能变和平衡常数与温度的函数式,研究发现随温度升高,平衡常数逐渐增大,低于458 K时平衡常数远小于1。
3) 采用UNIFAC模型建立了邻甲氧基环己醇-愈创木酚-水三元体系液相活度系数关联式,升高温度、降低氢分压、增加水醇比均可提高反应的平衡转化率。
符 号 说 明


[1] 何远楼. 复方愈创木酚磺酸钾口服溶液中盐酸异丙嗪稳定性研究[J].今日药学,2013,23(1):23-25.
[2] 周亚婷,杨昌楠,刘宇,等. 乙醛酸法合成香兰素的研究[J].化工科技,2011,19(4):27-30.
[3] 叶曦雯,牛增元,李引,等. 基于重氮化-偶合显色反应的纺织品中禁用偶氮染料快速定性筛选方法[J].分析化学,2013,41(7):1107-1110.
[4] 李光明,刘有智,张巧玲,等. 愈创木酚制备方法研究与进展[J].化工中间体,2010, (5):20-25.
[5] 万华化学集团股份有限公司. 一种愈创木酚的制备方法:103709018 A[P].2014-04-09.
[6] Benson S W,Crickshank F R,Goldend D M,et al. Additivity roles for the estimation of thermochemical properties[J].Chem Rev,1969,69(3):279-323.
[7] Cohen N,Benson S W. Estimation of additivity methods,heat formation of organic compounds by additivity methods[J]. Chem Rev,1993,93(7):2419-2438.
[8] 马沛生. 化工数据[M].北京:中国石化出版社,2003,138-143.
[9] 赵国良,靳长德. 有机物热力学数据的估算[M].北京:高等教育出版社,1983:164-169.
[10] 舒婷,胡春第. 碳酸二甲酯与邻苯二酚合成愈创木酚的热力学分析[J].化学工业与工程,2009,26(3):244-247.
[11] 高海霞,孔岩. 邻苯二酚与甲醇合成愈创木酚的热力学分析[J].化学工业与工程,2014,31(4):18-21.
[12] 印永嘉,奚正楷,张树永,等. 物理化学简明教程[M].北京:高等教育出版社,2007:421.
[13] Poling B E,Prausnitz J M,O’Connell J P. The properties of gases and liquids[M].赵红玲,王凤坤,陈圣坤,等译. 北京:化学工业出版社,2006:152-157.
[14] 朱庆才,畅延庆. 1,4-环己烷二甲酸催化加氢制备1,4-环己烷二甲醇的热力学分析[J].2015,44(6):712-718.
[15] 高光华,童景山. 化工热力学[M].2版. 北京:清华大学出版社,2007:272-282.
[16] 张继龙,赵志仝,乔燕,等. 酯交换制油酸甲酯的基团贡献法热力学分析[J].2012,63(6):1684-1690.
(编辑 平春霞)
Thermodynamic analysis of liquid phase dehydrogenation of 2-methoxycyclohexanol to guaiacol
Lu Hang,Li Ruijiang,Zhu Xuedong,Zhu Zibin
(Large Industrial Reactor Engineering Research Center of the Ministry of Education,East China University of Science and Technology,Shanghai 200237,China)
The standard molar enthalpies of formation,standard molar entropies and molar heat capacities of 2-methoxycyclohexanol and guaiacol were calculated based on the Benson group contribution method,and the enthalpy changes,Gibbs free energy changes and equilibrium constants of the liquid phase dehydrogenation reaction of 2-methoxycyclohexanol to guaiacol were obtained as functions of temperature. The liquid phase activity coefficients of the 2-methoxycyclohexanolguaiacol-water system were predicted by means of the UNIFAC group contribution model. The effects of hydrogen partial pressure,temperature and molar ratio of water to 2-methoxycyclohexanol on the reaction equilibrium conversion were investigated. The results showed that the equilibrium constants of the dehydrogenation reaction increased with temperature rise and was far less than 1 below 458 K. It was indicated that decreasing the hydrogen partial pressure and increasing the molar ratio of water to 2-methoxycyclohexanol could improve the reaction equilibrium conversion.
2-methoxycyclohexanol;guaiacol;liquid phase dehydrogenation;Benson group contribution method;UNIFAC group contribution model
1000-8144(2016)12-1427-07
TQ 013.1
A
10.3969/j.issn.1000-8144.2016.12.003
2016-07-22;[修改稿日期] 2016-08-22。
鲁航(1992—),男,安徽省芜湖市人,硕士生,电话 13127761598,电邮 Y30140880@mail.ecust.edu.cn。联系人:李瑞江,电话18917103626,电邮ruijiangli@ecust.edu.cn。

