早期应用尼洛替尼治疗慢性髓性白血病的疗效观察
石小岩,王 睿,傅 迪,胡 荣,张国君,廖爱军
中国医科大学附属盛京医院血液科,沈阳 110004
早期应用尼洛替尼治疗慢性髓性白血病的疗效观察
石小岩,王睿,傅迪,胡荣,张国君,廖爱军*
中国医科大学附属盛京医院血液科,沈阳 110004
[摘要]目的观察早期应用尼洛替尼治疗慢性髓性白血病(CML)的疗效及不良反应。方法观察我院2013年11月至2015年8月收治的10例CML患者,使用高杉尖三酯碱和/或羟基脲将白细胞降至20×109/L以下后口服尼洛替尼治疗。其中慢性期8例,每日口服尼洛替尼600 mg;加速期2例,每日口服尼洛替尼800 mg。监测患者治疗前后的血液学、细胞遗传学、分子生物学、血液生化学等指标,评价其疗效及不良反应。结果所有患者治疗满3个月时均达到CHR。8例慢性期患者中,7例达到CCyR,1例达到PCyR。2例BCR-ABLIS转录水平<1%,6例>1%而<10%。2例加速期的患者中,1例达到CCyR,1例无细胞遗传学缓解。2例BCR-ABLIS转录水平>1%而<10%。在治疗满6个月的9例患者中,7例慢性期患者均达到CCyR。3例达到MMR,3例BCR-ABLIS转录水平>0.1%而<1%,1例BCR-ABLIS转录水平>1%而<10%。2例加速期患者中,1例维持CCyR,另外1例细胞遗传学依旧未发生缓解。2例分子生物学均达到MMR。1例慢性期患者在治疗第8个月时发生急髓变。在治疗满12个月的6例患者中,4例慢性期患者均为CCyR。3例为MMR,1例BCR-ABLIS转录水平<1%。2例加速期患者中,1例为CCyR,1例细胞遗传学依旧未发生缓解。2例均为MMR。10例患者均未发生严重的不良反应。常见的不良反应为1~2级的血红蛋白减少、皮疹、关节及肌肉酸痛等。结论早期应用尼洛替尼治疗慢性髓性白血病安全有效。
[关键词]尼洛替尼;早期应用;慢性髓性白血病;不良反应
0引言
慢性髓性白血病(CML)为一种起源于多能造血干细胞的恶性克隆性疾病。根据病程分为3期:慢性期(CP)、加速期(AP)、急变期(BP)。CML的重要发病机制是Ph染色体[即t(9;22)(q34;q11)]的形成[1],Ph染色体表达BCR-ABL融合基因,其编码的BCR-ABL融合蛋白(以P210为主)具有很强的酪氨酸激酶活性,可导致细胞增殖、凋亡及粘附失控[2]。自21世纪以来,靶向治疗药物酪氨酸激酶抑制剂(TKI)在CML的治疗上取得了很好的疗效。但一代TKI伊马替尼耐药及不耐受的发生率可达20%,严重影响患者的治疗效果。目前在国内上市的TKIs包括一代伊马替尼和二代尼洛替尼和达沙替尼。相较于一代TKI,二代TKI具有缓解快、缓解程度深、引起BCR-ABL激酶域突变少的特点[3]。国外的一些指南如美国国立综合癌症网络(NCCN)、欧洲白血病网络(ELN)、欧洲肿瘤内科学会(ESMO)等均已将二代TKI尼洛替尼作为CML-CP患者的一线治疗。笔者将二代TKI尼洛替尼应用于CML患者的早期治疗,观察其疗效及不良反应。现报道如下。
1资料与方法
1.1患者基本资料选择2013年11月至2015年8月我院收治的CML患者10例均在使用高杉尖三酯碱和/或羟基脲将白细胞降低至20×109/L以下后,选择口服尼洛替尼(商品名:达希纳,瑞士诺华公司,进口序列号:AMN107,规格:150 mg/粒或200 mg/粒)进行治疗。患者均符合2015年版NCCN指南中CML的诊断标准[4]。其中男8例,女2例,中位年龄45岁,中位随访时间12个月,慢性期8例,加速期2例,见表1。
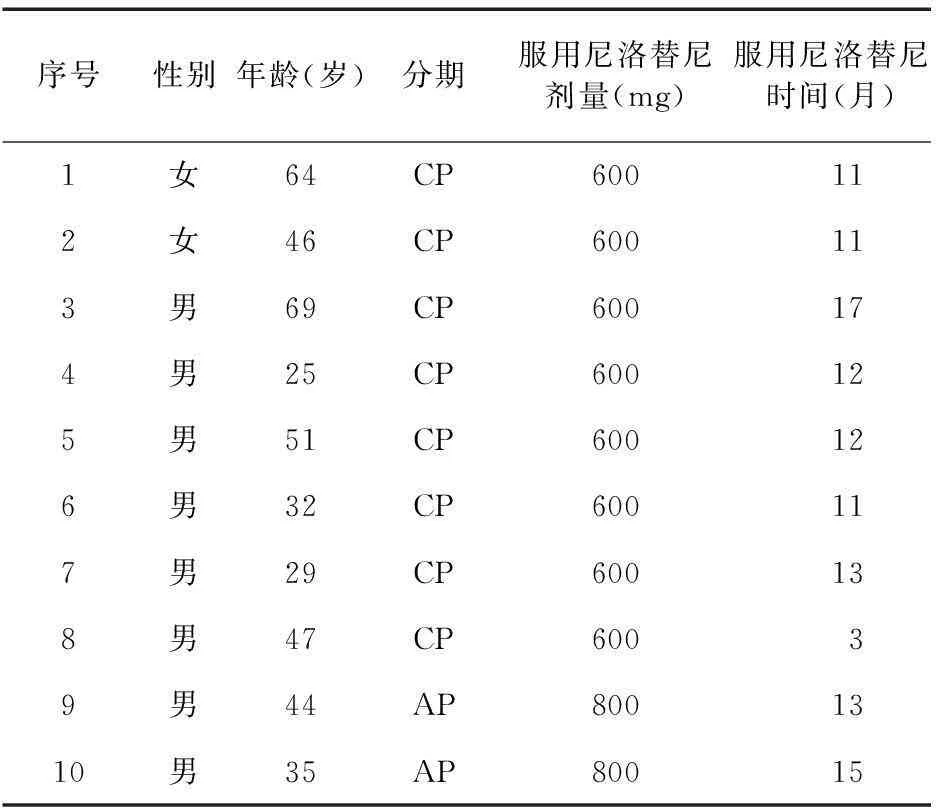
表1 患者的一般情况
1.2研究方法使用高杉尖三酯碱和/或羟基脲将10例CML患者的白细胞降低至20×109/L以下,之后口服尼洛替尼,服药前均禁食2 h,服药后均禁食1 h。处于慢性期的患者口服尼洛替尼300 mg,2次/d;处于加速期的患者口服尼洛替尼400 mg,2次/d。根据患者治疗效果和耐受情况调整药物剂量。于治疗前和治疗后第3、6、12个月复查骨穿,进行细胞遗传学和分子生物学检查,同时监测患者的心电图、血常规、肝肾功能、血清离子、心肌酶谱、血脂系列等血液生化指标。
1.3疗效及不良反应评价根据2015年版NCCN指南中CML的诊断标准,评价患者的疗效、不良反应、总体生存和疾病进展情况。
2结果
2.1疗效评估截至2015年8月,10例患者全部存活。口服尼洛替尼治疗满3个月的10例患者均达到血液学缓解(CHR)。在8例慢性期的患者中,1例(1/8)达到部分细胞遗传学反应(PCyR),7例(7/8)达到完全细胞遗传学反应(CCyR)。8例患者均未达到主要分子生物学反应(MMR),但BCR-ABLIS转录水平在1%以下的有2例(2/8),分别为0.28%和0.56%;1%~10%的有6例(6/8)。在2例加速期的患者中,细胞遗传学反应未发生缓解的有1例(1/2),该患者除了具有t(9;22)异常外,还具有2p-异常。达到 CCyR的有1例(1/2)。在分子生物学反应上,2例(2/2)患者的BCR-ABLIS转录水平为1%~10%。在口服尼洛替尼治疗满6个月的9例患者中,7例慢性期患者的细胞遗传学反应均为CCyR。在分子生物学反应上,除1例患者BCR-ABLIS转录水平由5.43%升至8.51%外,其余患者的BCR-ABLIS转录水平均有所下降,达到MMR有3例(3/7),3例(3/7)患者BCR-ABLIS转录水平为0.1%~1%,1例(1/7)患者BCR-ABLIS转录水平为1%~10%。在2例加速期的患者中,同时具有t(9;22)和2p-异常的患者细胞遗传学依旧未发生缓解,另外1例(1/2)患者维持CCyR。在分子生物学反应上,2例(2/2)患者均达到MMR。1例患者在治疗满8个月时转变为急性髓细胞白血病M2a型,但未检测到酪氨酸激酶域突变及复杂的染色体核型。在口服尼洛替尼治疗满12个月的6例患者中,4例慢性期患者的细胞遗传学反应均维持CCyR。在分子生物学反应上,2例(2/4)维持MMR,1例(1/4)达到MMR,1例(1/4)由0.25%降至0.15%。2例加速期患者中,同时具有t(9;22)和2p-异常的1例(1/2)细胞遗传学仍未发生缓解,1例(1/2)维持CCyR。但在分子生物学反应上,2例(2/2)均维持MMR,见表2。
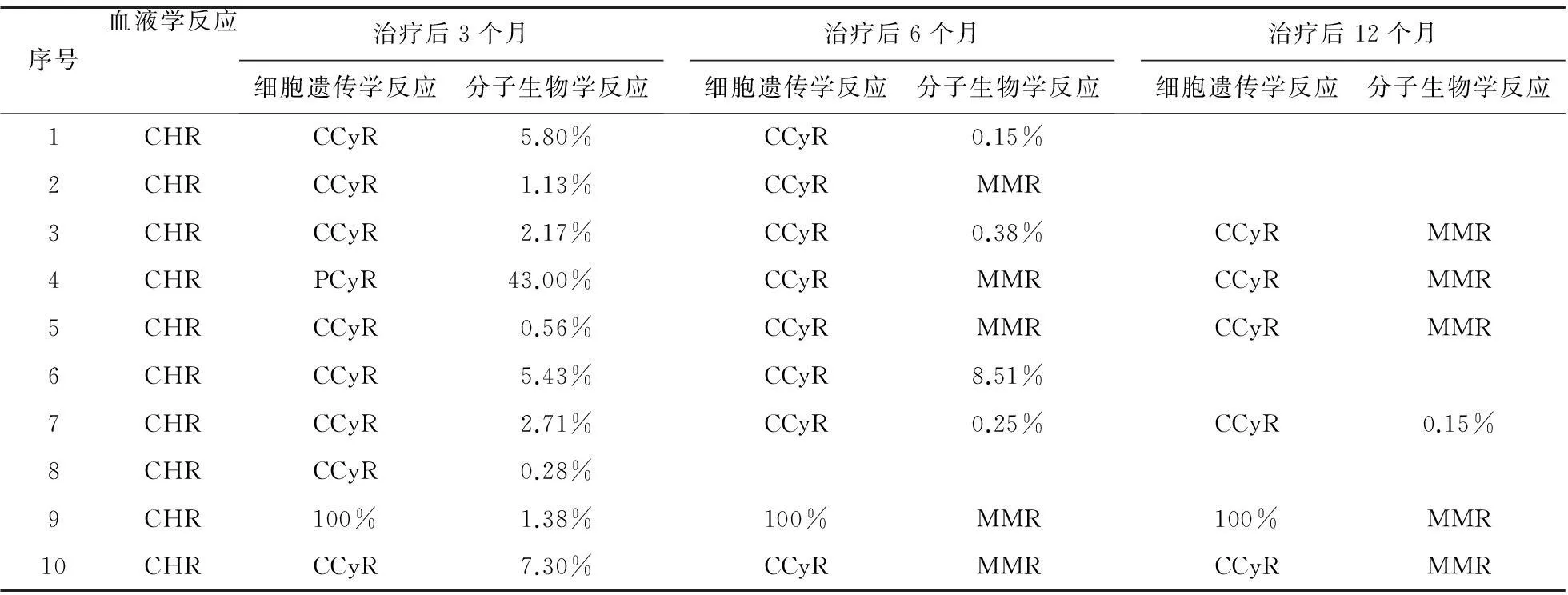
表2 10例患者的治疗效果
2.2不良反应评估10例中3例未发生任何不良反应。10例患者的血液学耐受良好:3例(3/10)发生1~2级血红蛋白减少,2例(2/10)发生1~2级白细胞减少,1例(1/10)发生1级血小板减少。10例出现的主要非血液学不良反应为皮疹和关节及肌肉酸痛等。有5例(5/10)发生了1~2级的皮疹,3例(3/10)出现了1~2级的关节及肌肉酸痛,2例(2/10)出现了胆红素和转氨酶1~2级的升高,2例(2/10)出现了眼结膜轻度充血,2例(2/10)出现了面部轻度水肿,2例(2/10)出现1级脱发,1例(1/10)出现了1~2级的头疼,1例(1/10)出现轻度腹胀。以上不良反应均可自行缓解或经对症处理后缓解,均未影响患者的治疗。
3讨论
尼洛替尼为伊马替尼的衍生物,是一种以氨基嘧啶为基础的ATP竞争性抑制剂。尼洛替尼更容易和BCR-ABL的ATP结合位点结合,对BCR-ABL的选择性和抑制性要强于其他TKIs[5]。在体外培养的Ph染色体阳性的细胞中,尼洛替尼抑制BCR-ABL所需的最低有效浓度显著低于伊马替尼[6]。有研究表明,伊马替尼的吸收依赖于OCT-1(一种转运蛋白),低表达OCT-1细胞对伊马替尼反应欠佳,而尼洛替尼的吸收完全不依赖于OCT-1[5]。同时,伊马替尼引起BCR-ABL激酶域的突变约为尼洛替尼的2倍,更易产生耐药,导致治疗失败。在能够检测到的伊马替尼引起的90种BCR-ABL激酶域突变中,除T315I、Y253H、E255K/V和F359C/V外,使用尼洛替尼治疗均有效。尼洛替尼可以降低耐药的发生。对于慢性期的患者,使用尼洛替尼治疗后转为加速或急变期的例数也明显少于伊马替尼[7]。对于中高危患者,尼洛替尼可以降低其疾病进展的风险[8]。因此,在CML的治疗上,尼洛替尼具有明显的优势。
一项由35个国家参与的评价尼洛替尼一线治疗CML-CP的临床试验(ENESTnd)表明,尼洛替尼300 mg 2次/d口服组在CCyR率和MMR率上显著优于伊马替尼400 mg 1次/d口服组。服药后12个月,两组的CCyR率分别为80%、65% (P<0.001),MMR率分别为44%、22%(P<0.001)[9]。不良反应多为1~2级,且发生在治疗初期,多数反应为自限性。尼洛替尼300 mg 2次/d口服组因不良反应停药的发生率低于伊马替尼400 mg 1次/d口服组[10]。在我国一项评价尼洛替尼一线治疗CML-CP的临床试验(ENESTchina,n=267)中,治疗后6、12、24个月,尼洛替尼300 mg 2次/d口服组、伊马替尼400 mg 1次/d口服组的CCyR率分别为66%、57%,78%、81%,84%、87%,但差异无统计学意义。治疗后12、24个月,两组的MMR率分别为56%、31%(P<0.000 1),68%、53%(P=0.009 6),两组患者达到MMR的中位时间分别为5.55、10.86个月。尼洛替尼300 mg 2次/d口服组患者的症状得到了更好的缓解,且治疗时间短[11]。
本研究显示,我院收治的10例早期应用尼洛替尼治疗的CML患者中,治疗后3个月,CHR率为100%,CCyR率为80%(8/10);2例(2/10)患者BCR-ABLIS转录水平在1%以下,9例(9/10)BCR-ABLIS转录水平在10%以下。治疗后6个月,CCyR率为89%(8/9),9例(9/9)患者BCR-ABLIS转录水平在10%以下,8例(8/9)BCR-ABLIS转录水平在1%以下;MMR率为56%(5/9)。治疗后12个月,6例患者的CCyR、MMR率均为83%(5/6),同时具有t(9;22)和2p-异常的患者,虽未获得细胞遗传学缓解,但也维持MMR。有报道,使用TKI治疗CML时,第3、6、12个月患者的BCR-ABL转录水平对PFS和OS有重要的预测价值,尤其是第3个月的BCR-ABL转录水平(即早期的分子生物学反应)至关重要。有报道一组282例患者,治疗后3个月,BCR-ABL转录水平<10%的患者的8年OS具有明显优势(93% vs.57%,P<0.001)。尼洛替尼可更快地降低CML患者的BCR-ABL转录水平[12]。但ENESTnd试验中,尼洛替尼在CCyR和MMR上的优势并没有转化成PFS和OS上的优势,尽管如此,尽早达到CCyR和MMR,对改善患者的生活质量及降低疾病进展的风险有重要意义。早期分子生物学和细胞遗传学反应与预后的相关性得到了越来越多的研究证实。Marin等[13]认为,如果延长临床试验时间,尼洛替尼在PFS、OS方面会获得明确的优势。早期达到MMR,对远期停药具有指导意义。维持MMR4.52年,可能停止TKIs治疗[14]。
尼洛替尼的主要不良反应为血液学及非血液学不良反应。血液学不良反应主要包括贫血、白细胞减少及血小板减少;非血液学不良反应主要包括皮疹、液体潴留、胃肠道反应、生化代谢异常及心血管不良反应[10]。在应用TKIs治疗CML的过程中,患者的依从性,尤其是服用药物第1年的依从性对治疗效果有很大影响[15]。本研究显示,在我院收治的10例早期应用尼洛替尼治疗的CML患者中,均未发生3~4级不良反应,且发生的不良反应均可自行缓解或经对症处理后缓解,均未影响患者的治疗。
总之,早期应用尼洛替尼治疗CML患者的疗效显著,安全性较高。但本研究的样本量很小,需要进一步扩大样本量,以观察CML患者早期应用尼洛替尼治疗的疗效及不良反应。
参考文献:
[1]Piccaluga PP,Paolini S,Bertuzzi C,et al.First-line treatment of chronic myeloid leukemia with nilotinib:critical evaluation[J].Journal of Blood Medicine,2012,3:151-156.
[2]Blay JY,Mehren M.Nilotinib:a novel,selective tyrosine kinase inhibitor[J].Semin Oncol,2011,38(1):S3-S9.
[3]Ursan ID,Jiang R,Pickard Em,et al.Emergence of BCR-ABL kinase domain mutations associated with newly diagnosed chronic myeloid leukemia:A Meta-analysis of clinical trials of tyrosine kinase inhibitors[J].Journal of Managed Care & Specialty Pharmacy,2015,21(2):114-122.
[4]National Comprehensive Cancer Network.NCCN Clinical Practice Guidclines in Oncology:Chronic Myelogenous Leukemia,V.1.2015
[5]Rosti G,Castagnetti F,Gugliotta G,et al.Second-generation BCR-ABL inhibitors for frontline treatment of chronic myeloid leukemia in chronic phase[J].Oncology Hematology,2012,82:159-170.
[6]Rosti G,Palandri F,Castagnetti F,et al.Nilotinib for the frontline treatment of Ph+ chronic myeloid leukemia[J].Blood,2009,114(24):4933-4938.
[7]Hochhaus A,Saglio G,Larson RA,et al.Nilotinib is associated with a reduced incidence of BCR-ABL mutationsin chronic phase vs imatinib in patients with newly diagnosed chronic myeloid leukemia[J].Blood,2013,121:3703-3708.
[8]Abruzzese E,Breccia M,Latagliata R,et al.Second-generation tyrosine kinase inhibitors in first-line treatment of chronic myeloid leukaemia (CML)[J].Bio Drugs,2014,28:17-26.
[9]Pavey T,Hoyle M,Ciani O,et al.Dasatinib,nilotinib and standard-dose imatinib for the first-line treatment of chronic myeloid leukaemia:systematic reviews and economic analyses[J].Health Technology Assessment,2012,16(42):1-8.
[10]Kantarjian HM,Hochhaus A,Saglio G,et al.Nilotinib versus imatinib for the treatment of patients with newly diagnosed chronic phase,Philadelphia chromosome-positive,chronic myeloid leukaemia:24-month minimum follow-up of the phase 3 randomised ENESTnd trial[J].Oncology,2011,12:841-851.
[11]Wang J,Shen X,Saglio G,et al.Phase 3 study of nilotinib vs imatinib in Chinese patients with newly diagnosed chronic myeloid leukemia in chronic phase:ENESTchina[J].Blood,2015,125(18):2771-2778.
[12]Marin D,Ibrahim AR,Lucas C,et al.Assessment of BCR-ABL1 transcript levels at 3 months is the only requirement for predicting outcome for patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors[J].J Clin Oncol,2012,30(3):232-238.
[13]Marin D.Initial choice of therapy among plenty for newly diagnosed chronic myeloid leukemia[J].Hematology Am Soc Hematol Educ Program,2012:115-121.
[14]Ross DM,Hughes TP.How I determine if and when to recommend stopping tyrosinekinase inhibitor treatment for chronic myeloid leukaemia[J].British Journal of Haematology,2014,166(1):3-11.
[15]Santoleri F,Sorice P,Lasala R,et al.Patient adherence and persistence with imatinib,nilotinib,dasatinib in clinical practice[J].PLoS One,2013,8(2):1-7.
Observation of the early treatment of chronic myeloid leukemia with nilotinibSHI Xiao-yan,WANG Rui,FU Di,HU Rong,ZHANG Guo-jun,LIAO Ai-jun*(Department of Hematology,Shengjing Hospital of China Medical University,Shenyang 110004,China)
[Abstract]ObjectiveTo observe the therapeutic effect and adverse effect of nilotinib in the early treatment of chronic myeloid leukemia.MethodsTen newly diagnosed CML patients in our hospital from November 2013 to August 2015 accepted the treatment of homoharringtonine or hydroxyurea to control the white blood cell under 20×109/L,then 8 cases in chronic phase accepted nilotinib 600 mg twice daily,and 2 cases in accelerated phase accepted nilotinib 800 mg twice daily.The hematologic,cytogenetic and molecular biological response,biochemical index were recorded to evaluate the therapeutic effect and adverse effect.ResultsTen cases who accepted three months of treatment all achieved CHR.Among 8 cases in chronic phase,7 cases achieved CCyR and 1 case achieved PCyR.The BCR-ABLIStranscriptional level was below 1% for two cases and the BCR-ABLIStranscriptional level was 1%~10% for six cases.One case in accelerated phase achieved CCyR,the other case did not accept cytogenetic response.Both BCR-ABLIStranscriptional level was 1%~10%.Among 9 cases accepted six months of treatment,7 cases in chronic phase were CCyR.Three cases accepted MMR,the BCR-ABLIStranscriptional level was 0.1%~1% for 3 cases and 1%~10% for 1 case.Two cases in accelerated phase accepted MMR,in which one case kept CCyR,the other case still did not accept cytogenetic response.One case in chronic phase became AML at the 8th month after treatment.Among the 6 cases accepted 12 months of treatment,four cases in chronic phase were CCyR.Three cases were MMR,the BCR-ABLIStranscriptional level was below 1% for one case.Two cases in accelerated phase were MMR,in which one case kept CCyR,the other case still did not accept cytogenetic response.There was no serious adverse effect during the treatment.The common adverse effects at 1~2 level included hemoglobin decreasing,rashs,joint and muscle pain and so on.ConclusionIt is safe and effective for the early treatment of chronic myeloid leukemia with nilotinib.
Key words:Nilotinib;Early treatment;Chronic myeloid leukemia;Adverse effect
DOI:10.14053/j.cnki.ppcr.201601015
*通信作者
收稿日期:2015-10-16

