人参皂苷Rh2对高脂膳食大鼠心肌缺血再灌注时内皮祖细胞的影响
周 芹,王 晞,王 龙*
1.武汉大学人民医院麻醉科,武汉 430060;2.武汉大学心血管病研究所,武汉 430060
·论著·
人参皂苷Rh2对高脂膳食大鼠心肌缺血再灌注时内皮祖细胞的影响
周芹1,王晞2,王龙1*
1.武汉大学人民医院麻醉科,武汉 430060;2.武汉大学心血管病研究所,武汉 430060
[摘要]目的观察人参皂苷Rh2对高脂膳食大鼠心肌缺血再灌注(IR)时内皮祖细胞数量的影响。方法健康成年雄性SD大鼠,体重180~240 g,高脂饲料喂养24周后,随机分为缺血再灌注组(GIR组)、人参皂苷Rh2组(Rh2组)、假手术组(GS组),另设正常对照组(N组),给予基础饲料喂养24周。每组6只,记录各组大鼠体重。在高脂饲养基础上,采用结扎冠状动脉左前降支30 min,再灌注120 min的方法建立心肌缺血再灌注模型,GS组只穿线不结扎。Rh2组大鼠于缺血再灌注前30 min腹腔注射人参皂苷Rh2 10 mg/kg,GS组、GIR组大鼠于术前30 min腹腔注射等体积生理盐水。于再灌注120 min后处死大鼠,测定血脂水平以及血清血管内皮生长因子(VEGF)水平,流式细胞仪计数大鼠外周血内皮祖细胞(Endothelial progenitor cells,EPCs)的数量。结果喂养24周后,与正常对照组比较,其余组大鼠体重与血脂水平均升高(P<0.05),假手术组大鼠外周血EPCs数量与血清VEGF水平较正常对照组稍有下降,差异有统计学意义(P<0.05);与假手术组比较,缺血再灌注组与人参皂苷Rh2组大鼠外周血内皮祖细胞数量及血清VEGF水平均有升高,且人参皂苷Rh2组升高更为显著(P<0.05)。结论人参皂苷Rh2可增加高脂膳食大鼠心肌缺血再灌注后外周血内皮祖细胞数量,从而减轻心肌缺血再灌注损伤,可能与提高血清VEGF水平相关。
[关键词]高脂;缺血再灌注;人参皂苷Rh2;内皮祖细胞;血管内皮生长因子
0引言
随着人们物质生活水平的提高与饮食结构的改变,肥胖者占人群比重越来越大。伴随而来的高脂血症及其相关疾病的发病率呈逐年增加趋势,其中高脂血症是动脉粥样硬化独立的危险因素[1],可加重心肌缺血及再灌注损伤,甚至能削弱麻醉药缺血预处理的保护作用[2-3]。因此,寻找病理状态下有效的心肌保护药物靶点是目前研究的热点。
心肌缺血再灌注过程中常伴有内皮功能紊乱,有研究发现,循环内皮祖细胞(Endothelial progenitor cells,EPCs)与心肌损伤后修复、血管新生密切相关[4]。近年人参皂苷Rh2被证实具有抗肥胖与耐缺氧作用[5-6],且对缺血心脏具有广泛保护作用,但其对高脂病理状态下的心肌保护作用及机制未见报道。本研究观察人参皂苷Rh2对高脂病理状态下大鼠心肌缺血再灌注是否具有保护作用及其对循环EPCs的影响。
1材料与方法
1.1实验动物饲养与分组健康成年雄性SD大鼠24只(购于湖南斯莱克景达实验动物有限公司),体重180~240 g,适应性喂养1周后,随机分为正常对照组(N组)、假手术组(GS组)、缺血再灌注组(GIR组)、人参皂苷Rh2组(Rh2组),每组6只。正常对照组给予基础饲料,其余3组给予高脂饲料(配方为1%胆固醇、5%猪油、10%鸡蛋黄粉、0.2%丙基硫氧嘧啶、83.8%基础饲料),各组大鼠自由饮水,室温20~23 ℃,12 h昼夜循环,喂养24周。
1.2药物干预与心肌缺血再灌注大鼠模型的建立Rh2组大鼠于手术前30 min腹腔注射人参皂苷Rh2 10 mg/kg,GS组和GIR组大鼠于术前30 min腹腔注射等体积生理盐水,GS组只穿线不结扎。心肌缺血再灌注模型建立如下:术前禁食12 h,大鼠称重,按40 mg/kg标准,腹腔注射2%戊巴比妥钠麻醉,背位固定于实验用木板。常规消毒、铺巾,大鼠四肢皮下插入心电图针形电极,BIOPAC16导生理记录仪记录肢体导联心电图。颈部正中切开皮肤,钝性分离肌肉至气管并插管,连接小动物呼吸机(潮气量8~10 mL/kg,呼吸频率70次/min,呼吸比1∶1)。于胸骨左缘3~4肋间纵行切开皮肤约3 cm,逐层钝性分离皮下、肌肉组织,钳夹断开左侧3、4肋骨开胸,小心提起心包并剪开,充分暴露心脏。在肺动脉圆锥和左心耳之间,可见冠状动脉左前降支(LAD),穿一5-0带针缝线于动脉走形下方,打松结,将表面有一凹槽的聚乙烯硬管约0.5 cm置于活结内再系紧压于心脏表面,此时可见心尖变白,心电图表现ST段显著抬高或T波高耸、QRS波变高变宽(如图1)为缺血成功。30 min后于凹槽处剪开结扎线,抽出聚乙烯硬管即可恢复血流,心尖复红、抬高的ST段慢慢回落或QRS波幅逐渐降低为再灌注成功的标志(如图2)。再灌注时间为120 min。

图1 大鼠心肌缺血时心电图表现
1.3指标测定
1.3.1各组大鼠体重与血清各指标的测定各组大鼠均喂养24周,麻醉后称重。正常对照组直接心脏采血,其余组缺血30 min再灌注120 min后心脏采血于促凝管,静置2 h后以3 000 r/min,离心15 min,分离血清后放4 ℃冰箱,待测。应用全自动生化分析仪检测血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)水平。采用ELISA法检测大鼠血清VEGF,按试剂盒(欣博盛Rat VEGF ELISA Kit,货号ERC103)说明书操作检测,使用RT-2100C酶标仪测定样品OD值后,按标准曲线换算成VEGF含量,每个样本重复3次,取平均值。
1.3.2外周血EPCs的提取及数量的测定参照文献[6]采用Ficoll密度梯度离心法提取大鼠外周血中的单个核细胞。大鼠心脏采血1~2 mL于EDTA抗凝管中,与PBS缓冲液1∶1等量混匀。将混匀后的血液样本缓慢加入离心后的淋巴细胞分离液中(体积比例为2∶3),在20 ℃以1 600 r/min离心25 min。离心后样本分层明显,用取样枪小心吸取单个核细胞层(中间云絮样白膜层),PBS缓冲液洗涤3次去除杂质、细胞碎片后重新悬浮于0.5%的胎牛血清BSA 80 μL中,依次加入FCR封闭试剂20 μL、FITC标记的CD34与PE标记的CD133抗体各10 μL,4 ℃避光孵育30 min。再加入0.5%BSA缓冲液2 mL离心洗涤2次,去除多余未结合的抗体,最后重悬于0.5%BSA缓冲液600 μL中,待流式细胞仪(美国BD公司)分析检测大鼠外周血EPCs数量,结果以EPCs数量占外周血单个核细胞数量的百分比表示。根据前向角散射(FSC)与侧向角散射(SSC)设置第1个细胞门,在散点图中圈选单个核细胞区域(图3A,R1);依据CD34异硫氰荧光素(FITC)与SSC高度设置第2个门,圈选出CD34阳性的细胞群区域(图3B,R2);依据CD34 FITC与CD133藻红蛋白(PE)设第3个细胞门,圈定CD34和CD133双阳性的细胞群区域,即大鼠外周血EPCs(图3C,右上象限)。

图2 大鼠心肌再灌注时心电图表现
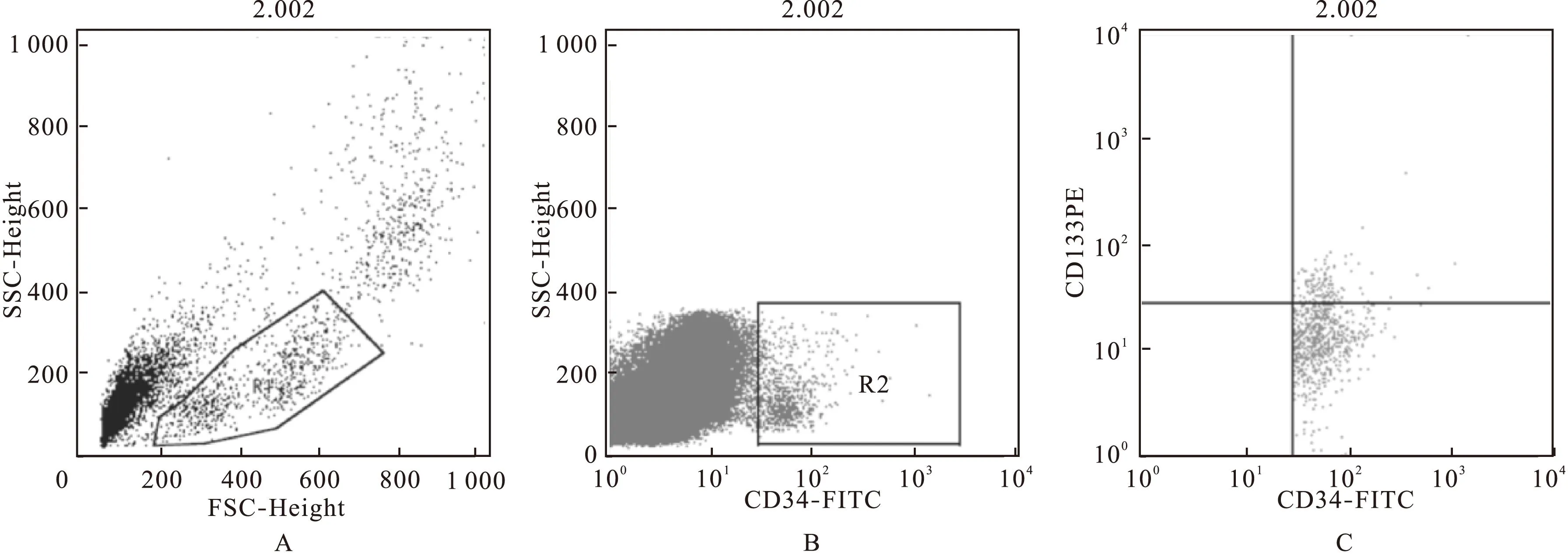
图3 大鼠外周血EPCs流式细胞仪检测图像

2结果
2.1各组大鼠体重与血脂水平的比较各组大鼠体重及血脂水平见表1。24周前各组大鼠体重差异无统计学意义。喂养24周后,与正常对照组相比,其余各高脂喂养组大鼠体重明显增加,血脂水平均有升高,差异有统计学意义(P<0.05)。
2.2各组大鼠外周血EPCs数量的比较与正常对照组比较,假手术组大鼠外周血内皮祖细胞数量较正常对照组有所下降,人参皂苷Rh2组则明显升高,差异有统计学意义(P<0.05),缺血再灌注组与正常对照组比较差异无统计学意义(P>0.05);与假手术组比较,缺血再灌注组与人参皂苷Rh2组大鼠外周血内皮祖细胞数量均有升高,且Rh2组升高更为显著,差异有统计学意义(P<0.05),见图4。
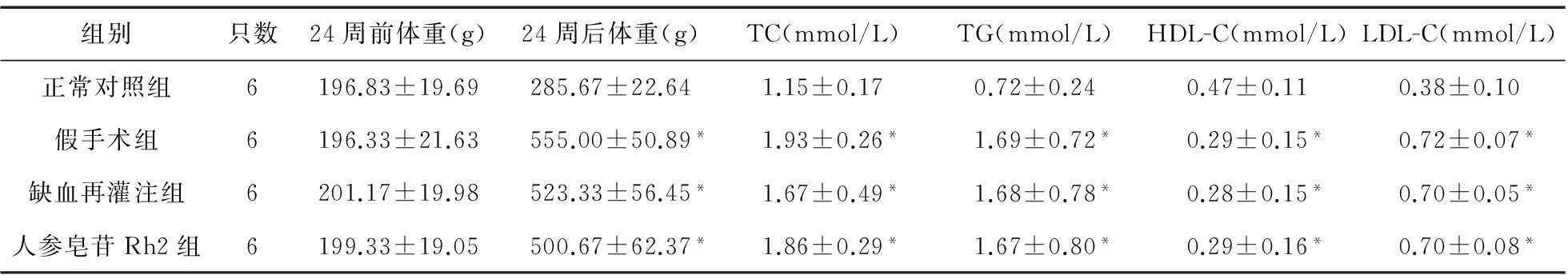
表1 各组大鼠体重情况与血脂水平
注:*与正常对照组比较,P<0.05
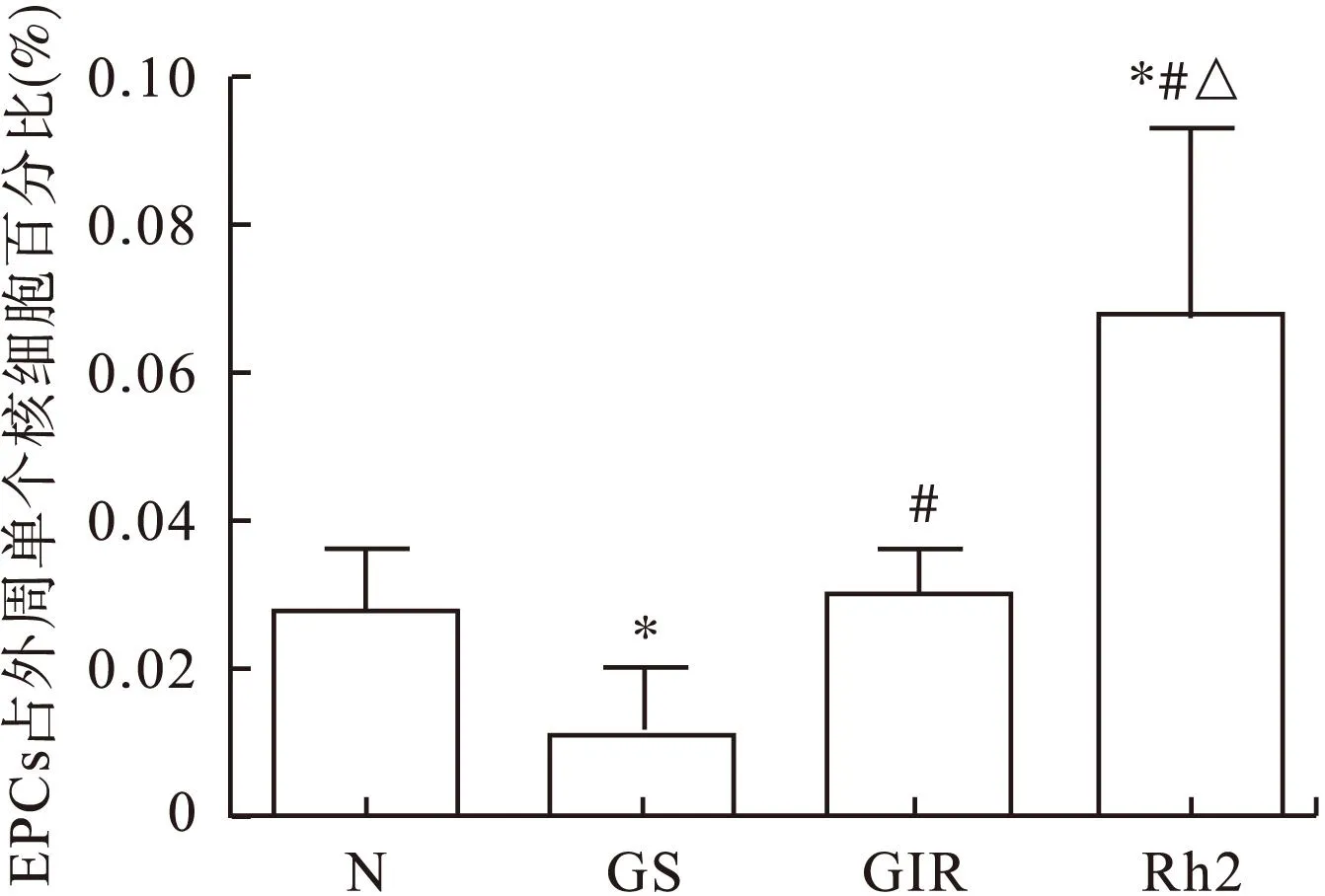
图4 各组大鼠外周血EPCs数量
△与缺血再灌注组比较,P<0.05
2.3各组大鼠血清VEGF水平的比较正常对照组、假手术组、缺血再灌注组及人参皂苷Rh2组大鼠血清VEGF含量分别为(37.75±0.74)、(22.11±0.87)、(40.47±0.92)、(80.23±7.97) pg/mL。与正常对照组比较,假手术组血清VEGF水平下降,缺血再灌注组与人参皂苷Rh2组血清VEGF水平均升高,差异有统计学意义(P<0.05);与假手术组比较,缺血再灌注组与人参皂苷Rh2组大鼠血清VEGF水平均有升高,且人参皂苷Rh2组升高更为显著,差异有统计学意义(P<0.05),见图5。

图5 各组大鼠血清VEGF水平
△与缺血再灌注组比较,P<0.05
3讨论
近年来肥胖病理状态的危害是诸多学者关注的焦点,其产生的危害主要通过脂质在组织、细胞内蓄积以及脂代谢紊乱,导致包括内皮细胞、单核细胞在内的多种炎症细胞激活,进而引起血管内皮细胞及器官实质细胞功能障碍,且与致死性心血管疾病的发病密切相关[7]。营养过剩、高脂饮食与肥胖导致毒性脂质在心脏沉积过多,导致相关缺血性心血管疾病发病率呈逐年增加趋势,而随着介入、溶栓治疗的广泛开展,伴随而来的心肌缺血再灌注损伤也引起了学者们的注意。许多研究表明,缺血再灌注损伤的主要机制与内皮细胞损伤密不可分,尽管内皮细胞损伤并不是心肌梗死的起因,但其功能紊乱却加重心肌梗死区的扩大,促进心功能恶化。因此,保护内皮细胞功能成为减轻缺血再灌注损伤的关键[8]。
EPCs是血管内皮细胞的前体细胞,可表达干细胞以及内皮细胞的相关抗原,研究发现,EPCs通过参与内皮细胞修复及血管的再内皮化而促进血管新生[4],在心血管病变的发生与发展中具有重要作用。循环内皮祖细胞于1997年被首次报道,随后有关EPCs的研究日益增多,其在发生血管损伤时,可由骨髓动员至外周血,迁移、黏附到损伤相关区域,然后增殖、分化为成熟的内皮细胞,实现损伤血管再内皮化,维持内皮细胞的单层性以及完整性,从而起到修复损伤血管内膜的作用。目前研究观点认为,EPCs不仅参与胚胎血管生成,也参与出生后的血管发生及损伤内皮的修复过程[9]。正常状态下,循环中的EPCs分化为内皮细胞来修复受损的内皮,从而保持血管内皮层的完整[10],一旦EPCs数量及功能受损,内皮损害和修复之间的平衡被打破,内皮层的完整性即遭到破坏。
血脂浓度长期异常,可损伤心血管内皮细胞,进而使内皮依赖性血管舒张功能减弱,导致冠状动脉痉挛,加速动脉粥样硬化的发生,加重心血管疾病的发展。动物研究发现,心肌缺血再灌注时,高脂动物心肌梗死面积增加,对缺血再灌注损伤的耐受性降低[5,11-12]。本研究中,正常SD大鼠摄入高脂饮食24周后产生明显代谢障碍,表现为体重及血脂水平明显上升,且高脂假手术组大鼠外周血EPCs数量较正常对照组大鼠减少,说明高脂状态下循环EPCs数量降低,与其他学者研究结果一致[1]。EPCs数量的降低,血管内膜损伤及修复功能减弱也许能解释高脂大鼠心肌缺血再灌注损伤较正常大鼠更为严重的原因。
人参皂苷Rh2的化学名为原人参二醇-3-氧-B-D-吡喃葡萄糖苷,最早在1983年由红参中提取出来。早期研究大多证实其具有较强的抗肿瘤活性,且对正常细胞毒性较小。随着学者对人参皂苷Rh2研究的深入,发现该皂苷具有其他的药理活性,包括抗炎、抗肥胖及耐缺氧作用[5]。在体及离体研究[13]发现,人参皂苷Rh2对阿霉素诱导的心肌毒性具有保护作用,包括减少心肌损伤相关酶的释放,拮抗抗氧化分子的减少,并改善心肌脂质过氧化物丙二醛的积累。最近有研究表明,人参皂苷Rh2能够明显促进人脐静脉内皮细胞增殖、迁移及管腔结构形成,具有促进血管新生作用[14]。本研究在大鼠高脂模型的基础上,建立心肌缺血再灌注模型,再给予人参皂苷Rh2腹腔注射干预后观察大鼠外周血EPCs数量的变化,探讨其保护作用。对比发现心肌缺血再灌注可促使外周血EPCs数量增多,可能与心肌缺血再灌注损伤后EPCs骨髓动员相关。本研究发现,给予人参皂苷Rh2腹腔注射干预后,外周血EPCs数量升高更为明显,提示人参皂苷Rh2可起到内皮修复及保护受损心肌的作用。
血管内皮生长因子(VEGF)是生长因子家族成员,是血管新生的调控因子。研究发现,VEGF可诱导EPCs向成熟内皮分化,促进血管内皮细胞增殖及血管形成[15]。在组织缺血情况下,外周血VEGF水平升高,促进EPCs的动员、分化及归巢,参与血管新生过程[16],在EPCs的调节机制中具有重要作用。近年王伟等[17]研究发现,通过腺病毒载体转染VEGF165基因,可以促进内皮祖细胞分泌VEGF,提高内皮祖细胞的增殖能力,表明VEGF对EPCs具有调控能力。本研究发现,各组大鼠血清VEGF的变化与外周血EPCs数量变化趋势基本相同。高脂假手术组大鼠血清VEGF水平较正常对照组大鼠降低,缺血再灌注组与人参皂苷Rh2组血清VEGF含量升高,且后者升高明显。这提示高脂大鼠外周血EPCs的降低可能与血清VEGF的降低相关,心肌缺血再灌注能提高血清VEGF水平,而人参皂苷Rh2提高心肌缺血再灌注高脂大鼠外周血EPCs数量,可能与其明显升高血清VEGF水平相关。
然而外周血EPCs的鉴定方法至今仍未统一,本实验采用密度梯度离心提取外周血单个核细胞后,以CD34与CD133双标记仅可代表一部分EPCs水平,有关EPCs的鉴定仍需进一步完善。加之有关EPCs的调节机制众多,包括细胞因子、氧化应激等。人参皂苷Rh2通过何种机制提高血清VEGF水平,动员EPCs,是否还具有其他调节作用及保护作用及其机制如何还需进一步研究。
参考文献:
[1]陈树春,宋光耀,刘娜,等.高脂饮食对大鼠骨髓内皮祖细胞水平的影响及作用机制[J].中华老年医学杂志,2013,32(11):1233-1237.
[2]Zhang FJ,Ma LL,Wang WN,et al.Hypercholesterolemia abrogates sevoflurane-induced delayed preconditioning against myocardialinfarct in rats by alteration of nitric oxide synthase signaling[J].Shock,2012,37(5):485-491.
[3]Song T,Lv LY,Xu J,et al.Diet-induced obesity suppresses sevoflurane preconditioning against myocardial ischemia-reperfusion injury:role of AMP-activated protein kinase pathway[J].Exp Biol Med (Maywood),2011,236(12):1427-1436.
[4]Ii M,Nishimura H,Iwakura A,et al.Endothelial progenitor cells are rapidly recruited to myocardium and mediate protective effect of ischemic preconditioning via imported nitric oxide synthase activity[J].Circulation,2005,111(9):1114-1120.
[5]朱伟,易琼,王鲁,等.人参皂苷Rh2的药理学研究进展[C].中国畜牧兽医学会2010学术年会暨第二届中国兽医临床大会论文集,2010:1328-1330.
[6]Duda DG,Cohen KS,Scadden DT,et al.A protocol for phenotypic detection and enumeration of circulating endothelial cells and circulating progenitor cells in human blood[J].Nat Protoc,2007,2(4):805-810.
[7]Abdurrachim D,Ciapaite J,Wessels B,et al.Cardiac diastolic dysfunction in high-fat diet fed mice is associated with lipotoxicity without impairment of cardiac energetics in vivo[J].Biochim Biophys ACTA,2014,1842(10):1525-1537.
[8]王多,刘艳萍,刘全.稳心颗粒剂在大鼠心肌缺血再灌注损伤时对冠脉内皮细胞的影响[J].中国老年学杂志,2014,34(7):3700-3701.
[9]Balaji S,King A,Crombleholme TM,et al.The role of endothelial progenitor cells in postnatal vasculogenesis:implications for therapeutic neovascularization and wound healing[J].ADV Wound Care(New Rochelle),2013,2(6):283-295.
[10]Lee PS,Poh KK.Endothelial progenitor cells in cardiovascular diseases[J].World J Stem Cells,2014,6(3):355-366.
[11]Apaijai N,Chattipakorn SC,Chattipakorn N.Roles of obese-insulin resistance and anti-diabetic drugs on the heart with ischemia-reperfusion injury[J].Cardiovasc Drugs THER,2014,28(6):549-562.
[12]Wensley I,Salaveria K,Bulmer AC,et al.Myocardialstructure,function and ischaemic tolerance in a rodent model of obesity with insulin resistance[J].Exp Physiol,2013,98(11):1552-1564.
[13]Wang H,Yu P,Gou H,et al.Cardioprotective effects of 20(S)-ginsenoside Rh2 in vitro and in vivo[J].Evid Based Complement Alternat Med,2012,9(3):506214.
[14]吕超,黄慧梅,畅婉琳,等.麝香保心丸促进血管新生作用的活性成分筛选[J].药学实践杂志,2014,32(5):344-351.
[15]Aicher A,Zeiher AM,Dimmeler S.Mobilizing endothelial progenitor cells[J].Hypertension,2005,45(3):321.
[16Poynter JA,Manukyan MC,Wang Y,et al.Systemic pretreatment with dimethyloxalylglycine increases myocardial HIF-1α and VEGF production and improves functional recovery after acute ischemia/reperfusion[J].Surgery,2011,150(2):278-283.
[17]王伟,刘德红,李卓成,等.转染VEGF基因对内皮祖细胞生长的影响研究[J].中国实验诊断学,2015,19(3):355-358.
Effect of ginsenoside Rh2 on endothelial progenitor cells number of high fat diet rats with myocardial ischemia-reperfusionZHOU Qin1,WANG Xi2,WANG Long1*(1.Department of Anesthesiology,Renmin Hospital of Wuhan University,Wuhan 430060,China;2.Department of Cardiology,Renmin Hospital of Wuhan University,Wuhan 430060,China)
[Abstract]ObjectiveTo observe the effect of ginsenoside Rh2 on endothelial progenitor cells(EPCs) number of high fat diet rats with myocardial ischemia-reperfusion (IR).MethodsHealthy adult male SD rats weighing 180~240 g with high fat diet for 24 weeks,were randomly divided into three groups:ischemia-reperfusion group (GIR group,n=6),ginsenoside Rh2 group(Rh2 group,n=6) and sham operation group(GS group,n=6).Another rats were fed with basic diet for 24 weeks as normal control group(N group,n=6). The weight of rats in each group was recorded. Based on the high fat diet,the myocardial ischemia-reperfusion model was established by ligated left anterior descending coronary artery for 30 min and 120 min for reperfusion. The rats in GS group were operated without ligation. The rats in Rh2 group was intraperitoneal injected ginsenoside Rh2 at the dose of 10 mg/kg at 30 min before establishing the IR models,while rats in GIR group and GS group were treated with saline.At 120 min after reperfusion,the rats were sacrificed,serum lipid levels and vascular endothelial growth factor (VEGF) level were tested,the number of peripheral blood progenitor cells (EPCs)was counted by flow cytometry.ResultsAfter 24 weeks,compared to the N group,the body weight and serum lipid levels of rats in other groups were elevated(P<0.05),the number of peripheral blood EPCs and serum VEGF level of rats in GS group decreased (P<0.05). Compared to the GS group,the number of peripheral blood EPCs and serum VEGF level of rats in both GIR and Rh2 groups increased,and the change of Rh2 group was more significant (P<0.05).ConclusionThe ginsenoside Rh2 could increase the number of EPCs in high fat diet rats with myocardial ischemia-reperfusion potentially involving with increased serum VEGF level,which is beneficial to alleviate the myocardial ischemia-reperfusion injury.
Key words:High fat;Ischemia-reperfusion;Ginsenoside Rh2;Endothelial progenitor cells;Vascular endothelial growth factor
DOI:10.14053/j.cnki.ppcr.201601001
*通信作者
基金项目:湖北省自然科学基金项目(2014CKB497)
收稿日期:2015-06-17

