PEG化青霉素降低红细胞溶血的研究
饶秀丽
江西济民可信集团有限公司,南昌 102600
PEG化青霉素降低红细胞溶血的研究
饶秀丽
江西济民可信集团有限公司,南昌 102600
[摘要]目的采集葡萄糖-6-磷酸脱氢酶(G6PD)缺陷的动物模型血液,评价PEG化青霉素降低红细胞溶血的作用。方法1%乙酰苯肼皮下注射大鼠制备G6PD缺陷的动物模型,取其红细胞制成混悬液,比较青霉素和PEG化青霉素的溶血作用,以及两组的红细胞脆性、红细胞膜流动性。结果青霉素组出现明显的红细胞溶血,且随着浓度变化和孵育时间延长溶血具有增加的趋势,溶血率高达25%,而PEG化青霉素组未见明显溶血;另外,红细胞脆性实验结果表明,PEG化青霉素对红细胞膜的作用非常轻微,H50%为43.6%,显著低于青霉素组(52.9%);红细胞膜流动性结果表明,PEG化青霉素对红细胞膜的流动性影响非常轻微。结论PEG化青霉素的溶血率较低,为该药的体内研究和进一步新型药物制剂开发奠定基础。
[关键词]PEG化青霉素;红细胞溶血;红细胞脆性;红细胞膜流动性
0引言
青霉素属于临床上的常用药物,多用于针对嗜血杆菌、革兰阳性或阴性球菌等多种感染的治疗[1-3]。青霉素本身毒性低、活性强、临床疗效稳定且安全[4],但由于青霉素类药物的滥用,导致患者出现过敏性休克、溶血反应、器官或组织过敏等不良反应,临床常采用针对性的药物治疗来对抗过敏反应,但溶血反应病情发作危急,抢救不当可导致死亡,目前尚无很好的解决办法[5-6]。张桂兰等[6]报道,青霉素引起自身免疫性溶血死亡1例,黎世尧[7]和曾宏等[8]也报道青霉素致急性溶血1例。PEG为美国FDA批准的药用级注射辅料,无毒、无免疫原性、无抗原性,可与蛋白质、多肽、氨基酸等活性药物分子进行化学键合,键合后PEG可将其许多优越性能赋予被修饰活性药物分子,很大程度上延长药物体内作用时间,提高生物利用度,增加药效,还可减少原型药物的不良反应[9-10]。前期研究发现,PEG化青霉素的生物利用度提高了2.6倍,药效几乎为青霉素的2倍。在前期研究的基础上,笔者拟采用PEG修饰青霉素降低其溶血不良反应,现报道如下。
1材料与仪器
1.1药品与试剂注射用青霉素钠[以下简称PEN,国药准字:H13021633,批号:141108;规格:0.6 g(100万U),石药集团中诺药业石家庄有限公司];青霉素钠原料药(国药准字:H14021785,纯度:99.2%,批号:141211,国药集团威奇达药业有限公司);mPEG-OH(分子量约4 800 Da,北京凯正生物工程发展有限责任公司),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl,浙江普康化工有限公司),4-二甲氨基吡啶(DMAP,上海共价化学科技有限公司),NaCl和乙酰苯肼(以下简称APH,国药集团化学试剂北京有限公司),生理盐水(北京双鹤药业股份有限公司)。
1.2仪器与设备Varioskan Flash全波长多功能酶标仪(北京平利洋医疗设备有限公司),BP210S型电子天平(北京Sartorius仪器系统有限公司),SIGMA3-15台式离心机(德国SIGMA公司),LRH-70生化培养箱(北京恒奥生物科技有限公司)。
1.3动物SD大鼠,雄性,250~280 g,由中国医学科学院实验动物研究所提供,合格证号:SCXK京2014-0001。
2方法
2.1PEG化青霉素的制备精密称取480.7 mg mPEG-OH,青霉素钠原料药36.2 mg,溶解于2 mL无水二氯甲烷中,然后加入43.7 mg的EDC·HCl(缩合剂)和12 mg的DMAP(催化剂),搅拌24 h,取出反应产物,减压浓缩至一定体积,迅速加入定量的无水乙醚,轻微振荡,冰浴5 h,可见白色絮状沉淀物,用胶头滴管吸取上层乙醚并弃去。再以适量的异丙醇,反复多次洗涤沉淀物(PEG-PEN不溶于异丙醇,参与反应物溶解,除杂),最后将沉淀物于30~40 ℃真空干燥,称重,即为PEG化青霉素(PEG-PEN),经HPLC检测,纯度达96%以上,载药量为7%。
2.2红细胞悬浮液的制备选用对红细胞内G6PD活性有干扰作用的强氧化剂乙酰苯肼(APH)为造模药,复制G6PD缺陷(G6PD酶活性降低)大鼠模型。以1%APH生理盐水溶液l mL/100 g体重给健康雄性大鼠皮下注射,每天上午1次,连续2次,在体给药实验组于造模第2天晚上禁食,12 h后,腹主动脉取血,小心注入含有血液保养液的试管内抗凝保存,用生理盐水小心洗涤,1 500 r/min离心4 min,重复5~6次,直至上清液清亮,配制成所需浓度(10%、50%)的红细胞混悬液[11]。
2.3溶血率与时间关系
2.3.1受试液的配制取注射用青霉素钠1瓶,加入适量生理盐水稀释溶解,将溶解后的注射用青霉素钠转移至100 mL容量瓶,再加生理盐水稀释至100 mL,即得浓度为6‰的青霉素注射剂。精密称取PEG化青霉素约430 mg(含青霉素30 mg),用10 mL生理盐水溶解,使用前临时配制,即得浓度为6‰ 的PEG化青霉素溶液。
2.3.2红细胞溶血率的测定移取以上配制好的6‰青霉素注射剂和PEG化青霉素各200 μL至1.5 mL的洁净EP管中,阴性对照管加200 μL生理盐水,阳性对照管加200 μL蒸馏水;然后用移液枪吸取10%红细胞悬液200 μL,添加到各管中,低速涡漩30 s,使红细胞悬液与受试物混合均匀。各管置于37 ℃生化培养箱中孵育,分别于0.5、1、2、3、4、5、6 h将受试物从生化培养箱中取出,观察血样凝集反应(红细胞聚集成块,轻微振荡后能完全分散即假凝集,轻微振荡后凝集物不能分散则为真凝集)。各管1 500 r/min离心,精密吸取上清液150 μL,转移到96孔酶标板,用酶标仪于540 nm下测定吸光度(OD),按以下公式计算溶血百分率,各管平行3复孔[12]。溶血率计算公式(%)=(样品管OD值-阴性对照管OD值)/(阳性对照管OD值-阴性对照管OD值)×100%。
2.4溶血率与浓度关系
2.4.1系列浓度受试液的配置取以上配制好的6‰青霉素注射剂,依次用生理盐水倍半稀释成青霉素浓度为6‰、3‰、1.5‰、0.75‰、0.375‰、0.19‰、0.1‰、0.05‰的系列溶液,同样的方法可制备系列等浓度的PEG化青霉素溶液。
2.4.2红细胞溶血率的测定移取以上配制好的青霉素和PEG化青霉素系列溶液各250 μL至1.5 mL的洁净EP管中,培养箱中孵育时间为3 h,其余同上述红细胞溶血率的测定方法。
2.5红细胞渗透脆性试验
2.5.1NaCl系列溶液的制备将1% NaCl溶液和蒸馏水进行配比,制备成浓度为0.17%~0.82%的系列NaCl溶液,备用。
2.5.2受试药的配制精密称取青霉素钠原料药12 mg与以上不同浓度的NaCl溶液4 mL混合均匀,即得浓度为3‰的系列青霉素NaCl溶液;精密称取PEG化青霉素43 mg(含青霉素3 mg),与以上不同浓度的NaCl溶液1 mL混合均匀,即得浓度为3‰的系列PEG化青霉素NaCl溶液;取以上不同浓度的NaCl溶液1 mL,作为空白对照。
2.5.3红细胞渗透脆性的测定用移液枪精密吸取50%红细胞悬液20 μL,加入到已添加药物的系列NaCl溶液(3‰青霉素或3‰ PEG化青霉素)中,各管置于37 ℃生化培养箱中孵育3 h,其余同上述红细胞溶血率的测定方法,以生理盐水管为阴性对照管,蒸馏水管为阳性对照管,则可计算出各管的溶血百分率。最后采用合适的数学模型,建立NaCl浓度与溶血率的关系,计算PEG化青霉素组(PEG-PEN组)、青霉素组(PEN组)和空白组各自的H50%(当红细胞溶血率为50%时所对应的NaCl浓度)。
2.6红细胞膜流动性以四氢呋喃作溶剂配制2×10-3mol/L的储存液,于棕色瓶中4 ℃低温保存,四氢呋喃工作液临用前以等渗PBS稀释。采用PBS配置浓度6‰青霉素和PEG化青霉素溶液,加入适量浓度为50%的红细胞悬液,再与四氢呋喃工作液等体积混匀,于37 ℃水浴孵育2 h,检测偏振荧光(激发光波长:362 nm,发射光波长:430 nm),以空白组为基准,按下列公式计算荧光强度I,荧光偏振度P和微粘度η,比较两组药物对红细胞膜流动性的影响。P=IVV-GIVH/IVV+GIVH;η=2P/(0.46-P),式中IVV和IVH分别是起偏和检偏器光轴为垂直和水平方向时测得的荧光强度,G是校正因子。
2.7统计学处理所获数据采用SPSS 13.0处理,各处理组之间的差异进行样本t检验。
3结果
3.1溶血率与时间关系见图1。由图1数据分析可知,PEG化青霉素的红细胞溶血百分率明显低于青霉素注射剂,说明PEG修饰技术具有一定的抗红细胞溶血作用。青霉素注射剂诱导的红细胞溶血随时间延长,具有明显增长趋势;当时间超过3 h后,其增长趋势出现了一个拐点,相对比较缓慢。而PEG化青霉素红细胞溶血率曲线比较平缓,基本维持在5%左右,表明PEG修饰技术可以明显减少青霉素的红细胞溶血现象。

图1 PEG化青霉素和青霉素诱导的溶血与时间的关系
3.2溶血率与浓度关系见图2。由图2数据分析可知,在低浓度条件下,青霉素注射剂的溶血率较小,当药物浓度增大时,尤其当青霉素浓度较高时,青霉素注射剂的溶血率达到25%左右,恰好与文献报道青霉素注射剂一般在高浓度时出现红细胞溶血现象相一致[6]。而PEG化青霉素的溶血率仅为3%~6%,几乎没有出现明显的溶血现象,表明PEG修饰技术具有一定的抗红细胞溶血作用。

图2 溶血与不同浓度的PEG化青霉素和青霉素的对比研究
3.3红细胞渗透脆性PEG-PEN组、空白组和PEN组的红细胞脆性具体数据结果见图3,由图3可见,PEG化青霉素的红细胞溶血率明显低于青霉素注射剂,说明青霉素经PEG修饰后,对红细胞膜的刺激作用大量减小。PEG-PEN组对红细胞脆性的影响小于空白组。PEN组、空白组和PEG-PEN组红细胞脆性曲线均符合Boltzmann方程,其H50%分别为52.9%、48.0%和43.6%。见表1。
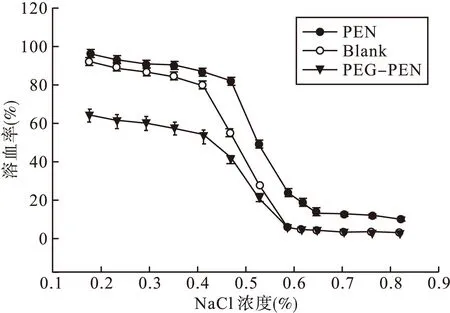
图3 PEG化青霉素、青霉素和空白溶液红细胞脆性的对比研究

组别曲线方程H50%空白组y=2.5648+87.34841+e(x-0.4867)/0.0387,r=0.998948.0PEG-PEN组y=2.0703+60.06531+e(x-0.4926)/0.0411,r=0.998443.6PEN组y=11.7759+81.55811+e(x-0.5247)/0.0345,r=0.998952.9
3.4红细胞膜流动性与空白组比较,PEN组的荧光偏振度明显增大,微粘度明显增大,红细胞膜流动性下降显著;PEG-PEN组荧光偏振度与PEN组相比显著减少,基本与空白组数据相近,表明PEG修饰技术具有稳定红细胞膜、降低流动性的作用。见表2。
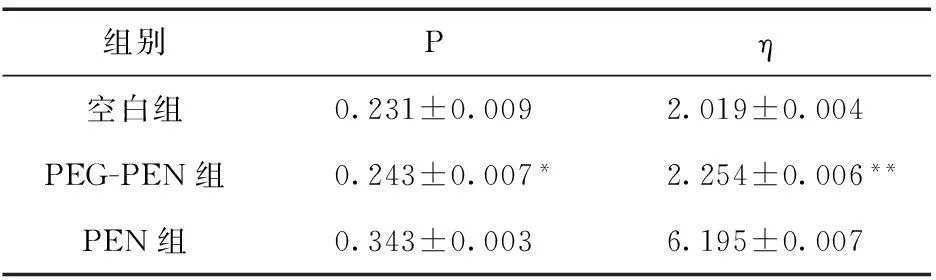
表2 各组药物对红细胞膜流动性的影响
注:与PEN组比较,*P<0.05,**P<0.01
4讨论
青霉素注射剂溶血不良反应主要出现在大剂量用药患者,且患者多为体质较弱的老年人,可能因为这些特殊人群红细胞膜较脆弱,溶血的几率比健康人群大。故本实验采用对红细胞内G6PD活性有干扰作用的强氧化剂乙酰苯肼(APH)进行造模,制作G6PD缺陷(G6PD酶活性降低)大鼠模型,模拟临床上这种红细胞膜较脆弱的症状,便于比较PEG化青霉素与青霉素诱导的红细胞溶血的差异。
青霉素为半抗原药物,临床过敏反应较多,体质较弱的患者出现溶血几率增大,停用后很快得以改善,可以确定溶血反应由青霉素引起。研究认为,其可能的机制为青霉素进入机体后,分子中的β-内酰胺环打开,与血浆和组织蛋白结构中的氨基共价结合,由半抗原变成药物性全抗原,其中一种主要的大抗原决定簇诱导产生的抗体IgG在血管中与吸附青霉素的红细胞相互作用,造成红细胞溶解而致溶血[7]。PEG为无毒、无免疫原性、生物相容性良好的药用高分子辅料,已通过美国FDA批准上市销售。PEG与青霉素结合后,由于大分子长链状结构,可缠绕包裹于青霉素小分子药物表面,掩盖该药物本身的免疫原性,故可以很大程度上减少青霉素诱导红细胞溶血的几率。目前,国外已有大量报道采用PEG修饰技术,降低活性药物的红细胞溶血[13-15]。Gajbhiye等[16]采用PEG修饰来减少PPI 5.0G树状聚合物的红细胞溶血现象。当PPI 5.0G树状聚合物的浓度为0.1%、0.2%、0.3%和0.4%时,红细胞溶血率分别为9.2%±1.06%、12.2%±2.18%、14.7%±1.02%和16.9%±1.93%;而PPI 5.0G树状高聚合物经PEG修饰后,其红细胞溶血率下降为1.5%±0.35%、2.3%±0.52%、2.9%±0.42%和3.4%±0.33%。Gajbhiye等发现,PPI 5.0G树状聚合物经PEG修饰后的溶血率显著下降,可能原因是PEG大分子具有包裹和屏蔽作用,掩盖了PPI 5.0G树状聚合物的荷电性和离子效应,从而减少其与红细胞膜的相互作用。从PEG化青霉素和青霉素红细胞溶血率的对比研究发现,在低剂量情况下,两者无明显差别,在高剂量情况下,青霉素出现了明显的红细胞溶血现象,而PEG化青霉素的溶血率始终保持在3%~6%。从PEG化青霉素和青霉素红细胞渗透脆性结果分析,两者的H50%分别为43.6%和52.9%,PEG-PEN组H50%值小于空白组(48.0%)。可能的原因是PEG本身为血溶性良好的药用高分子辅料,加之其长链状的大分子体系,能缠绕并附着在红细胞周围,从而减少红细胞之间的聚集,类似固化了整个红细胞体系的空间布局,大大减少了红细胞之间相互碰撞出现溶血的几率。红细胞膜流动性实验结果表明,PEG化青霉素对红细胞膜的影响非常轻微,可为PEG修饰技术降低青霉素诱导的红细胞溶血现象提供一些科学解释。
综上所述,PEG化青霉素可以很大程度上降低原型药物的溶血不良反应,可能与PEG药用辅料的无毒、无免疫原性及大分子体系的缠绕包裹减少红细胞之间的碰撞有关。另外,由于PEG化青霉素可以降低免疫原性,使得由于青霉素的抗原性引发的过敏反应,如药疹、荨麻疹、哮喘等可能减少,有待于进一步研究。
参考文献:
[1]尹金花,高健,陈学礼,等.青霉素压力下金黄色葡萄球菌对β-内酰胺类抗生素的耐药表型变化[J].中国兽医杂志,2014,50(11):3-6.
[2]赵林梅.对青霉素类抗菌药物临床使用情况的调查分析[J].当代医药论丛,2015,13(1):5-6.
[3]宁来忠,黄榕,祁伯祥,等.青霉素V钾片与青霉素G注射剂联合治疗小儿呼吸道感染[J].中南药学,2003,1(4):237-238.
[4]余翠花,方平飞,朱运贵,等.青霉素类、单环β-内酰胺类及碳青霉烯类抗生素在5种常用输液中的稳定性[J].中南药学,2012,10(12):943-945.
[5]张兴艳,王霆,李苌清,等.青霉素类抗生素高分子聚合物的研究进展[J].中南药学,2011,9(7):520-524.
[6]张桂兰,王鸣琴.青霉素引起自身免疫性溶血死亡1例[J].临床医药实践杂志,2002,11(12):933.
[7]黎世尧.青霉素致急性溶血1例[J].医药导报,2000,19(4):393.
[8]曾宏,刘翠红,彭艳,等.青霉素引起溶血反应一例报告[J].中国局解手术学杂志,2001,10(3):230.
[9]张海艳,王堃,胡春生,等.聚乙二醇修饰小分子药物的研究进展[J].生物技术通讯,2015,26(1):135-139.
[10]Zhang M,Li X,Gong YD,et al.Properties and biocompatibility of chitosan films modified by blending with PEG[J].Biomaterials,2002,23(13):2641-2648.
[11]郑平原,易爱纯,胡咏华.松黄颗粒对小鼠迟发型变态反应及血清半数溶血值影响的实验研究[J].中南药学,2009,7(8):586-589.
[12]Liu XY,Li JR,Wang NJ,et al.Alleviation of PEGylated puerarin on erythrocyte hemolysis induced by puerarin in glucose-6-phosphate dehydrogenasedeficient rats[J].Chinese Herbal Medicines,2013,5(1):47-52.
[13]Neu M,Germershaus O,Behe M,et al.Bioreversibly crosslinked polyplexes of PEI and high molecular weight PEG show extended circulation times in vivo[J].J Control Release,2007,124(1-2):69-80.
[14]Noh SM,Park MO,Shim G,et al.Pegylated poly-l-arginine derivatives of chitosan for effective delivery of siRNA [J].J Control Release,2010,145(2):159-164.
[15]Zhu SJ,Hong MH,Tang GT,et al.Partly PEGylated polyamidoamine dendrimer for tumor-selective targeting of doxorubicin:the effects of PEGylation degree and drug conjugation style [J].Biomaterials,2010,31(6):1360-1371.
[16]Gajbhiye V,Kumar PV,Tekade RK,et al.PEGylated PPI dendritic architectures for sustained delivery of H2receptor antagonist[J].Eur J Med Chem,2009,44(3):1155-1166.
Study on reducing hemolysis by PEGylated penicillinRAO Xiu-li (Jiangxi Jiminkexin Group Co.,LTD,Nanchang 102600,China)
[Abstract]ObjectiveTo analyze the effects of PEGylated penicillin (PEG-PEN) on reducing hemolytic via the glucose-6-phosphate dehydrogenase (G6PD)-deficient rats’ blood.MethodsThe rat model with G6PD-deficiency was established via sc injecting 1% acetylphenyl-hydrazine. Then the G6PD-deficient erythrocyte suspension obtained from the rat model was used to evaluate the hemolytic effects of PEN and PEG-PEN by detecting the hemolytic activity,erythrocyte osmotic fragility and membrane fluidity of erythrocytes.ResultsIt was found that PEN could cause serious hemolysis to the erythrocyte suspension with the increase of drug concentration and the prolongation of drug incubation time,the hemolytic rate of PEN was up to 25%,while no significant hemolysis was found in PEG-PEN group.Additionally,the result of erythrocyte osmotic fragility indicated that PEG-PEN exerted a slight effect on the erythrocyte membranes,the H50%was much less than that of PEN(43.6% vs.52.9%). Erythrocyte membrane fluidity indicated that the effect of PEG-PEN on erythrocyte membrane fluidity was very slight.ConclusionPEG-PEN plays an important role in reducing the side effect of hemolysis induced by PEN. The low hemolytic activity of PEG-PEN makes it a favorable candidate forinvivotests and PEG-PEN could also provide useful insight for the further formulation development as an innovative drug.
Key words:PEGylated penicillin;Hemolysis;Erythrocyte osmotic fragility;Membrane fluidity of akaryocyte
DOI:10.14053/j.cnki.ppcr.201601004
收稿日期:2015-06-29

