心脏后负荷增加大鼠不同阶段心脏全基因表达差异的研究
田国祥,李彦川,张薇,王晓兵,马晓慧,魏万林
· 论著 ·
心脏后负荷增加大鼠不同阶段心脏全基因表达差异的研究
田国祥1,李彦川2,张薇1,王晓兵1,马晓慧2,魏万林3
目的探讨后负荷增加型大鼠不同时间点心脏全基因谱差异表达情况。方法纳入雄性SD大鼠70只,术前随机取10只进行处理,相关参数作为基线数据;其余60只,随机分为模型组(2周亚组、8周亚组、18周亚组)和假手术组(2周亚组、8周亚组、18周亚组),每组30只(每亚组10只)。模型组大鼠采用缩窄腹主动脉的方法建立心脏后负荷增加模型,假手术组大鼠腹主动脉只穿线不进行缩窄。各组大鼠分组后分别在术前、术后2周、8周、18周采用小动物超声实时影像系统及颈动脉插管检测大鼠心脏结构及血流动力学相关指标。完成上述步骤后,处死大鼠,取左心室,进行大鼠心脏RNA建库,使用Illumina HiSeqTM2500/MiseqTM对文库进行高通量测序,并进行生物信息分析。结果在术后第2周、第8周、第18周,模型组大鼠平均动脉压、左室重量、左室舒张末内径、左室舒张末压较基线显著升高(P均<0.05),心脏每搏输出量、左室射血分数、左室内压最大上升速率较基线显著下降(P均<0.05);假手术组大鼠平均动脉压、左室舒张末内径、心脏每搏输出量、左室射血分数、左室内压最大上升速率与基线比较则无显著变化(P均>0.05);大鼠后负荷增加模型建立成功。模型组与假手术组大鼠在第2周、第8周相较基线时差异表达的基因个数有升高趋势,至第18周差异表达的基因个数有所回落。模型组较假手术组在同时间段差异表达的基因明显增加。在第2周、第8周、第18周,模型组与假手术组大鼠心脏差异表达的基因个数分别为119、43和49个基因,差异基因的个数随时间有显著下降。不同时间点模型组与假手术组大鼠心脏差异表达的基因功能富集(GO)及通路富集(KEGG)有很大差异。结论腹主动脉缩窄后负荷增加大鼠与假手术组比较,在术后早期差异基因明显增加,术后中晚期差异基因数量逐渐下降;不同时间点差异基因功能及相关通路有很大差异。
心脏;后负荷;基因表达;大鼠
心力衰竭(心衰)是由心肌组织中某些相关基因表达与调控异常引起的[1],既往通过对心脏基因表达谱的研究,已发现细胞凋亡、信号转导等多条心衰相关分子途径[2-4]。但目前对心衰基因表达谱的研究多为横断面而非纵向序贯性研究,不同的心衰阶段心脏基因表达谱存在较大的差异,这种横断面研究不能观察心衰发展过程中基因表达谱的差异[5]。本研究设计对后负荷增加型大鼠心衰不同阶段心脏全基因谱的表达情况进行检测,以期发现在心衰不同发展阶段表达差异的基因系列,寻找干预心衰的新靶点。
1 材料与方法
1.1 实验动物及分组雄性SD大鼠,SPF级,体重200~220 g,70只。由北京维通利华实验动物技术有限公司提供。屏障动物房饲养,温度20~25℃,相对湿度40%~60%,每笼5只,自由饮食,每日更换垫料。70只大鼠,术前随机取10只进行处理,相关参数作为基线数据;其余60只,随机分为模型组(2周亚组、8周亚组、18周亚组)和假手术组(2周亚组、8周亚组、18周亚组),每组30只(每亚组10只),在术后2周、8周、18周分别进行相关处理。
1.2 方法
1.2.1 心脏后负荷增加大鼠模型造模方法采用Cutilleta[6]及Anversa[7]等缩窄腹主动脉的方法建立大鼠后负荷增加心衰模型。大鼠适应性饲养1周,术前12 h禁食,自由饮水。测量体质量后用10%水合氯醛300 mg/kg腹腔注射麻醉。麻醉后,经左脊肋角区去毛,备皮,1%碘伏消毒,纵向切开皮肤,切口长约2 cm,钝性分离肌层,暴露腹主动脉,分离左肾动脉起始部上段腹主动脉约1 cm,以直径为0.7~0.8 mm的不锈钢探针(或使用7-8号注射针,磨圆针头)与腹主动脉一起使用4号线结扎,抽出探针形成腹主动脉狭窄(50%~60%),6号丝线缝合肌层,4号线缝合手术切口,同时腹腔一次性注射青霉素10万u预防感染。假手术组腹主动脉只穿线不进行缩窄,其他手术步骤同模型组。
1.2.2 小动物超声实时影像系统及颈动脉插管检测大鼠心脏结构及血流动力学相关指标各组大鼠分组后分别在术前、术后2周、8周、18周采用小动物超声实时影像系统(采用加拿大产Visual Sonics Vevo@2100小动物超声仪,MS250线阵探头,探头频率为21MHz)及颈动脉插管(采用Powerlab八导电生理记录仪,ML870,澳大利亚AD Instruments公司)检测左室舒张末压、收缩期左心室内压上升的最大变化速率,舒张期左心室内压下降的最大变化速率,动物血压等血流动力学指标检测。
1.2.3 大鼠心脏组织取材各组大鼠分别在术前、2周、8周、18周,麻醉后,取动脉血,离心,收集血清后放入液氮中冻存。剖杀动物,快速取心脏、冲净、称重,取左心室,切成绿豆大,装入冻存管,放入液氮中保存。送北京诺和致源生物信息科技有限公司进行高通量测序。
1.2.4 心脏标本建库测序流程由北京诺和致源生物信息科技有限公司按照以下步骤进行:①Total RNA样品检测;②文库构建;③文库质量检测;④上机测序(图1)。
1.2.5 生物信息分析流程由北京诺和致源生物信息科技有限公司按照以下步骤进行:①原始序列数据;②测序数据质量评估;③参考序列比对分析;④基因表达水平分析;⑤RNA-seq整体质量评估;⑥基因差异表达分析;⑦差异基因GO富集分析;⑧差异基因KEGG富集分析;差异基因蛋白互作网络分析。本研究使用Illumina HiSeqTM2500/ MiseqTM对文库行高通量测序(图2)。
1.3 统计学方法采用SPSS 15.0软件进行数据的统计学处理,计算各组动物的实验数据平均值及标准差,不同时间段两组间均数的比较采用成组t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 腹主动脉缩窄对大鼠心脏重构及血流动力学的影响假手术组大鼠平均动脉压术后第2周、第8周、第18周随时间变化有升高趋势,但各时间点血压无显著统计学差异(P均>0.05);模型组大鼠在术后第2周、第8周血压显著升高,到第18周时血压稍有回落,各时间点血压与基线及同时间点假手术组比较,差异均有统计学意义(P均<0.05)。 假手术组大鼠各时间点心脏每搏输出量及左室射血分数与基线比较无统计学差异(P均>0.05),模型组大鼠从术后第2周、第8周、第18周与基线及同时间段假手术组比较均有明显下降(P均<0.05)。假手术组大鼠左室重量在术后第2周、第8周、第18周呈增加趋势,第18周时假手术组左室重量与基线有统计学差异(P均>0.05);模型组大鼠左室重量在术后第2周、第8周呈显著增加趋势,至第18周出现回落,模型组左室重量与基线及同时间段假手术组比较均有显著增加(P均<0.05)。假手术组大鼠左室舒张末内径和左室舒张末压在术后第2周、第8周、第18周呈略微增加趋势,第18周时假手术组左室舒张末压与基线有统计学差异(P>0.05);模型组大鼠左室舒张末内径和左室舒张末压在术后第2周、第8周、第18周呈显著增加趋势,与基线及同时间段假手术组比较均有显著增加(P均<0.05)。假手术组大鼠心率(BPM)在术后第2周、第8周、第18周变化不明显(P>0.05);模型组大鼠心率在术后第2周显著增加,较基线及同时间段假手术组显著增加(P均<0.05),在第8周及第18周呈回落趋势。假手术组大鼠在各时间点左心室内压最大上升速率与基线比较无显著统计学差异(P均>0.05),模型组大鼠术后第2周、第8周、第18周与基线及同时间段假手术组比较均有明显下降(P均<0.05)(表1)。
2.2 不同时间和组别大鼠心脏差异表达基因数量比较假手术组大鼠在第2周、第8周相较基线时差异表达的基因个数有升高趋势,至第18周差异表达的基因个数有所回落,分别为568、1938、1097个基因。模型组大鼠在第2周、第8周相较基线时差异表达的基因个数亦呈升高趋势,至第18周差异表达的基因个数同样回落,分别为1615、2770、1558个基因(表2)。模型组较假手术组在同时间段差异表达的基因明显增加。在第2周、第8周、第18周,模型组与假手术组大鼠心脏差异表达的基因个数分别为119、43和49个基因,差异基因个数随时间显著下降(图3)。
2.3 模型组和假手术组不同时间点差异基因GO富集柱状图基因个体(Gene Ontology简称 GO, http://www.geneontology.org/)是基因功能国际标准分类体系。GO分为分子功能(Molecular Function)、生物过程(biological process)、和细胞组成(cellular component)三个部分。基因或蛋白质可以通过ID对应或者序列注释的方法找到与之对应的GO编号,而GO编号可用于对应到Term,即功能类别或者细胞定位。通过差异基因GO(Gene Ontology,GO)富集柱状图,可直观观察到模型组和假手术组大鼠心脏在术后第2周、第8周和第18周时在生物过程、细胞组分和分子功能富集的GO term上差异基因的个数分布情况(图4)。从图4a中可以看出,差异基因主要集中于生物过程中的小分子代谢过程、代谢过程和细胞代谢过程及分子功能中结合功能中;从图4b中可以看出,差异基因比较分散,但在生物过程中的细胞粘附及生物粘附稍微突出;从图4c中可以看出,差异基因主要集中于生物过程中的氧化还原过程及单一的器官代谢过程以及分子功能中的氧化还原活动。
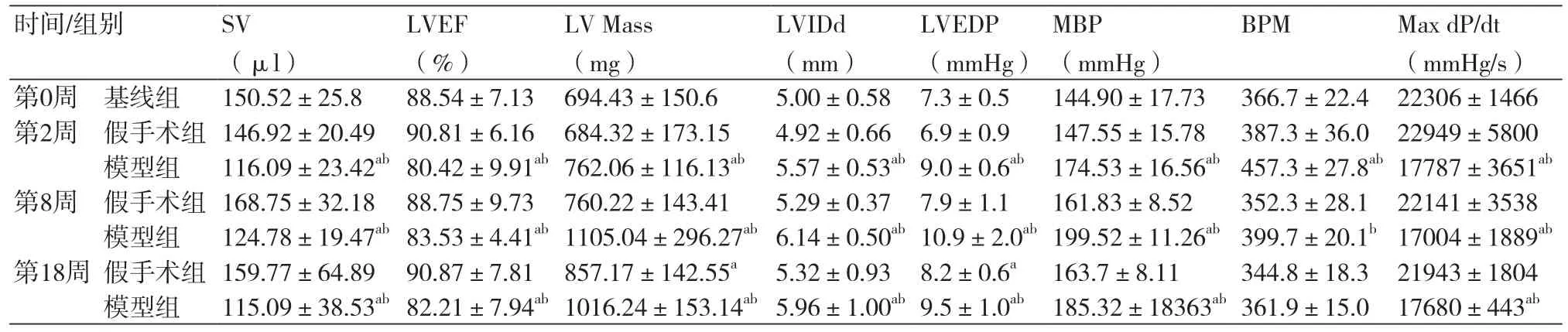
表1 小动物超声实时影像系统及颈动脉插管比较不同时间大鼠心脏结构及血流动力学相关指标(n=10)
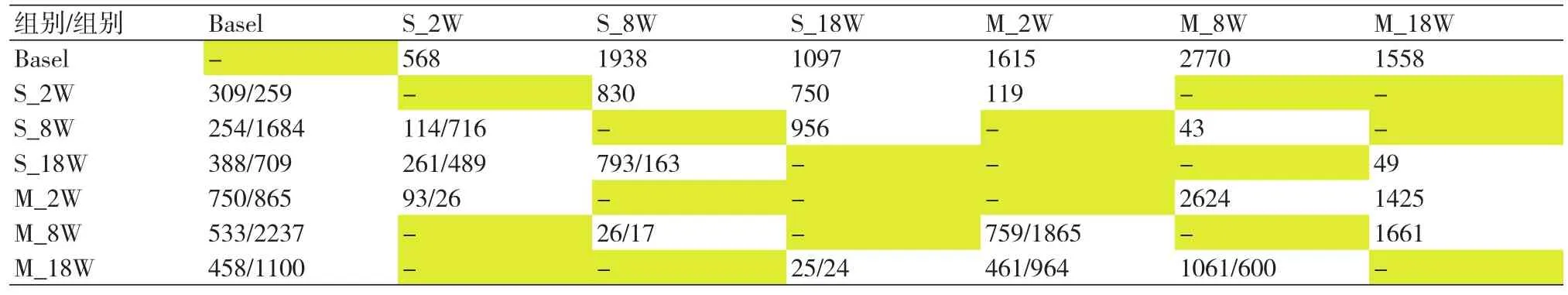
表2 不同时间和组别大鼠心脏差异表达基因数量比较
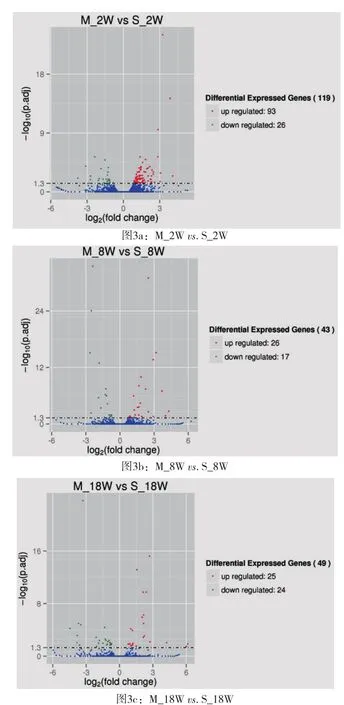
图3 差异基因火山图[有显著性差异表达的基因用红色点(上调)和绿色点(下调)表示,无显著性差异表达的基因用蓝色点表示;横坐标代表基因在不同样本中表达倍数变化;纵坐标代表基因表达量变化差异的统计学显著性]
2.4 模型组和假手术组不同时间点差异基因KEGG富集分析结果KEGG(Kyoto Encyclopedia of Genes and Genomes)是系统分析基因功能、基因组信息数据库,它有助于把基因及表达信息作为一个整体网络进行研究。KEGG富集程度通过Rich factor、Qvalue和富集到此通路上的基因个数来衡量。其中Rich factor指该代谢途径(pathway)中富集到的差异基因个数与注释基因个数的比值。Rich factor越大,表示富集的程度越大。Qvalue是做过多重假设检验校正之后的Pvalue,Qvalue的取值范围为[0,1],越接近于零,表示富集越显著。从图5a中可看出,差异基因主要富集于癌症蛋白聚糖、点状粘附及癌症MicroRNAs等通路中;从图5b中可看出,差异基因主要主要富集于紧密连接、p53信号通路、点状粘附等通路中;从图5c中可看出,差异基因主要富集于PI3K信号通路、HIF-1信号通路等。
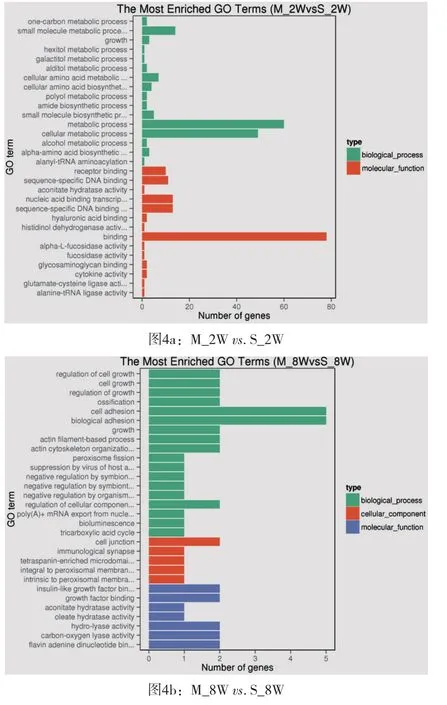
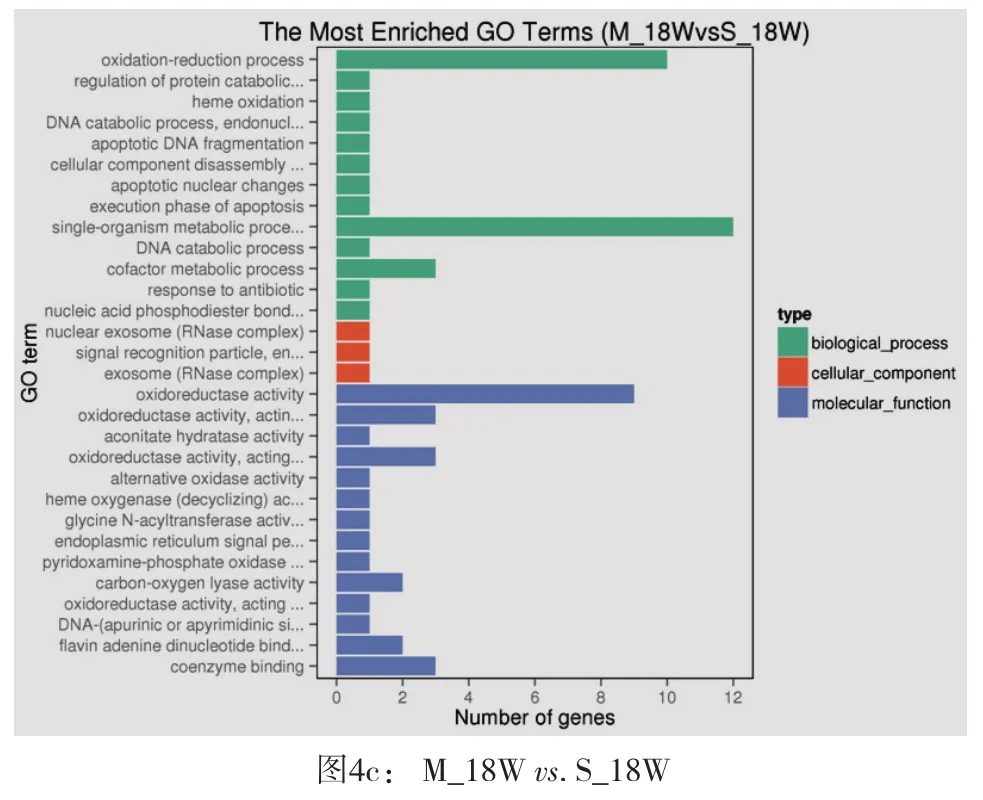
图4 GO富集柱状图[纵坐标为富集的GO term,横坐标为该term中差异基因个数。不同颜色用来区分生物过程、细胞组分和分子功能。富集最显著的30个GO term在图中展示,如果不足30条,则全部展示]
3 讨论
3.1 关于心脏后负荷增加大鼠模型的建立本研究采用Cutilleta[6]或Anversa[7]等缩窄腹主动脉的方法建立大鼠心脏后负荷增加模型,并采用小动物超声实时影像系统及颈动脉插管检测大鼠心脏结构及血流动力学相关指标。结果显示与基线比较,模型组大鼠平均动脉压在术后第2周明显上升,至第8周血压有非常显著升高,而第18周时血压则稍有回落,各时间点血压与基线及同时间点假手术组比较,差异均有统计学意义(P均<0.05);随着平均动脉压及心脏后负荷的增加,大鼠左心室重量、左室舒张末内径、左室舒张末压较基线显著升高(P均<0.05),心脏每搏输出量、左室射血分数、左室内压最大上升速率较基线显著下降(P均<0.05);表明模型组大鼠心脏功能进行性衰退并发生心脏肥大性重构。而假手术组大鼠在术后第2周、第8周、第18周时平均动脉压、左室舒张末内径、心脏每搏输出量、左室射血分数、左室内压最大上升速率与基线比较则无显著变化(P均>0.05),表明假手术组大鼠心脏血流动力学及心脏结构与基线比较未有显著变化。因此通过缩窄大鼠腹主动脉建立的心脏后负荷增加模型是成功的。
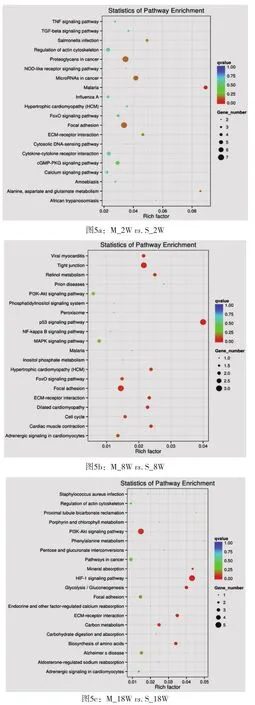
图5 差异基因KEGG富集散点图[纵轴表示pathway名称,横轴表示Rich factor,点的大小表示此pathway中差异表达基因个数多少,而点的颜色对应于不同的Qvalue范围。图中挑选了富集最显著的20条pathway条目进行展示,若富集的pathway条目不足20条,则全部展示]
3.2 不同时间点模型组与假手术组心脏差异表达基因对各时间亚组大鼠心脏基因表达水平进行分析,结果显示,假手术组大鼠在术后第2周、第8周相较基线时差异表达的基因个数有升高趋势,至第18周差异表达的基因个数有所回落,分别为568、1938、1097个基因。模型组大鼠在第2周、第8周相较基线时差异表达的基因个数亦呈升高趋势,至第18周差异表达的基因个数同样回落,分别为1615、2770、1558个基因。表明心脏后负荷增加大鼠模型组较假手术组在同时间段差异表达的基因数量明显增加。进一步分析显示,在术后第2周、第8周、第18周,模型组与假手术组大鼠心脏差异表达的基因数量分别为119、43和49个基因,差异基因的数量随时间推移有下降趋势(图3)。
GO分类是一种基因功能国际标准分类体系,其中GO可分为分子功能、生物过程、和细胞组成三个部分。对模型组和假手术组大鼠心脏不同时间差异基因进行GO富集柱状图分析,在术后第2周亚组,差异基因主要集中于生物过程中的小分子代谢过程、代谢过程和细胞代谢过程及分子功能中结合功能中;在术后第8周亚组,差异基因比较分散,但在生物过程中的细胞粘附及生物粘附稍微突出;在术后第18周亚组,差异基因主要集中于生物过程中的氧化还原过程及单一的器官代谢过程以及分子功能中的氧化还原活动。表明在腹主动脉缩窄,心脏后负荷增加的情况下,在术后不同时间段心脏代谢及重构过程中基因表达有非常大的差异[3,9]。
在生物体内,不同基因相互协调行使其生物学功能,通过通路(pathway)显著性富集能确定差异表达基因参与的最主要生化代谢途径和信号转导途径。KEGG(Kyoto Encyclopedia of Genes and Genomes)是系统分析基因功能、基因组信息数据库的方法,它有助于把基因及表达信息作为一个整体网络进行研究。作为Pathway相关的主要公共数据库(Kanehisa,2008),KEGG提供的整合代谢途径查询十分出色,包括碳水化合物、核苷、氨基酸等的代谢及有机物的生物降解,不仅提供了所有可能的代谢途径,而且对催化各步反应的酶进行了全面的注解,包含有氨基酸序列、PDB库的链接等等,是进行生物体内代谢分析、代谢网络研究的强有力工具。本研究中,在术后第2周亚组,模型组与假手术组差异基因主要富集于癌症蛋白聚糖、点状粘附及癌症MicroRNAs等通路中;在术后第8周亚组,差异基因主要富集于紧密连接、p53信号通路、点状粘附等通路中;在术后第18周亚组,差异基因主要富集于PI3K信号通路、HIF-1信号通路等。在术后不同时间段差异基因通路有很大差异。后面课题组需要进一步将不同时间段差异基因的功能及相关通路进行深入分析[10]。
[1] 祝善俊,徐成斌. 心力衰竭基础与临床[M]. 北京:人民军医出版社,2001.
[2] 陈金星,王硕仁,朱陵群,等. 心肌梗死后心力衰竭大鼠心脏基因表达谱及活血益气方药对其心脏的影响[J]. 中国中西医结合杂志,2005,25(1):45-8.
[3] 张其鹏,张丹,刘贝,等. 心力衰竭相关基因和蛋白质数据库的初构[J]. 北京大学学报(医学版),2002,34(3):276-80.
[4] 张幼怡,韩启德. 心脏重塑时基因表达谱改变及基因调节网络的初步研究[J]. 北京大学学报(医学版),2002,34(5):585-9.
[5] 田国祥,魏万林,张薇,等. 心力衰竭患者心脏全基因及能量代谢相关基因表达谱的研究进展[J]. 中国循证心血管医学杂志,2014,6(3):370-1.
[6] Cutilletta AF,Rudnik M,Zak R,et al. Muscle and non-muscle cell RNA polymerase activity during the development of myocardial hypertrophy[J]. J Mol Cell Cardiol,1978,10(8):677-87.
[7] Anversa P,Olivetti G,Melissari M,et al. Morphometric study of myocardial hypertrophy induced by abdominal aortic stenosis. Lab Invest,1979,40(3):341-9.
[8] 苏丹,严浩然,吴大正. 压力过载型心肌肥厚大鼠模型的制备及评价[J]. 同济大学学报(医学版),2008,29(6):32-5.
[9] Tan FL,Moravec CS,Li J,et al. The gene expression fingerprint of human heart failure[J]. Proc Natl Acad Sci USA,2002,99(17):11387-92.
[10] 王尧玲,肖献患. 心血管疾病基因表达谱研究进展[J]. 中南大学学报(医学版),2004,29(4):483-5.
本文编辑:姚雪莉
Study on the difference of cardiac gene expression at different stages of cardiac afterload in rats
TIAN Guo-xiang*, LI Yan-chuan, ZHANG Wei, WANG Xiao-bing, MA Xiao-hui, WEI Wan-lin.*Department of Fourth Cadres Ward, PLA Army General Hospital, Beijing 100700, China.
WEI Wan-lin, E-mail: wei_wanlin@126.com
ObjectiveTo investigate the differential expression of cardiac whole gene at different time points after afterload increasing rats.Methods10 of 70 male SD rats were randomly selected for the preoperative treatment, relevant parameters were collected as the baseline data; the rest of 60 rats were randomly divided into model group (2- weeks’ subgroup, 8- weeks’ subgroup, 18 weeks’ subgroup) and sham operation group (2-weeks’ subgroup, 8-weeks’ subgroup, 18 weeks’ subgroup) with 10 rats in each subgroup. Rats in the model group were treated with coarctation abdominal aorta to establish the model of cardiac afterload increase, and the abdominal aorta of the sham operation group was not constricted. Cardiac structure and hemodynamics were measured before operation, 2 weeks, 8 weeks and 18 weeks after operation by small animal ultrasound real-time imaging system and carotid artery cannulation. Then rats were sacrificed and the left ventricle was harvested. The rat cardiac RNA library was constructed. The library was sequenced using Illumina HiSeqTM2500 / MiseqTMand the bioinformatics analysis was performed.ResultsAt 2 weeks, 8 weeks, and 18 weeks after surgery, The mean arterial pressure, left ventricular mass, left ventricular end-diastolic dimension and left ventricular end-diastolic pressure of model group were significantly higher than those of baseline (P<0.05). Left ventricular ejection fraction (LVE) and left ventricular pressure (LVP) were significantly lower than baseline (P<0.05). There were no significant changes in mean arterial pressure, left ventricular end diastolic diameter, stroke volume, left ventricular ejection fraction, and left ventricular pressure in sham - operated rats compared with baseline (P>0.05). The rat model of afterload increase was established successfully. The number of genes differentially expressed between the model group and the sham-operated group increased at the 2nd week and the 8th week compared with the baseline, and the number of the differentially expressed genes decreased at the 18th week. Compared with the sham group, the expression of genes in the model group was significantly increased at the same time. At the 2nd week, 8th week and 18th week,the number of genes differentially expressed between the model group and the sham operation group were 119, 43 and 49 genes respectively, and the number of different genes decreased significantly with time. At different time points, there was a significant difference in gene functional enrichment (GO) and pathway enrichment (KEGG) between the model group and the sham-operated group.ConclusionCompared with the sham-operated group, the number of differentially expressed genes in the early postoperative period increased significantly, and the number of the differentially expressed genes in the middle and late post-operation decreased gradually. There were significant differences in the function of different genes and related pathways at different time points.
Heart; Afterload; Gene expression; Rat
R541
A
1674-4055(2016)12-1435-06
国家自然科学基金面上项目(81273971)
1100700 北京,陆军总医院干四科;2300410 天津,天士力研究院药理毒理研究中心;3100700 北京,陆军总医院心内科
魏万林,E-mail:wei_wanlin@126.com
10.3969/j.issn.1674-4055.2016.12.07

