超声心动图对不同主动脉瓣病变患者主动脉瓣置换前后左室功能变化评估价值研究
于 岩, 曹军英, 于 馨, 梁凯迪
北部战区总医院 超声诊断科,辽宁 沈阳 110016
主动脉瓣疾病是较常见的心脏瓣膜病,发病率和病死率逐年上升[1]。 主动脉瓣病变包括主动脉瓣狭窄(aortic stenosis,AS)和主动脉瓣关闭不全(aortic incompetence,AI),其会引起左室压力或容量负荷增加,从而诱发左室重构[2]。 左室重构是心脏对慢性容量或压力超负荷的适应性改变,是心脏受累的表现,最终会导致心力衰竭[3]。 主动脉瓣置换(aortic valve replacement,AVR)是治疗此类患者的主要手段之一[4]。 超声心动图是一种无创性评估患者心脏瓣膜病的重要方法,不仅能够准确获取心脏运动功能的定量数据,还可明确诊断心脏瓣膜病变情况,有助于患者及时诊断及选择合适的治疗方案[5]。 本研究旨在探讨超声心动图对不同主动脉瓣病变患者AVR 前后左室功能变化的评估价值。 现报道如下。
1 对象与方法
1.1 研究对象 选取北部战区总医院2019 年1—12 月收治的行单独AVR 的主动脉瓣疾病患者61 例为研究对象。其中,男性38 例,女性23 例;年龄35 ~ 71 岁,平均年龄(55.59 ±11.46)岁;AS 28 例(AS 组),AI 33 例(AI 组)。 纳入标准:经超声心动图等相关检查确诊为单纯主动脉瓣病变;术前行冠状动脉造影无明显严重的冠状动脉狭窄(狭窄率<50%);窦性心律;左室射血分数>45%;行AVR 治疗。排除标准:同期行其他心脏手术;非首次心脏手术;合并有严重的肝肾功能不全;未能完成随访。 患者及其家属均签署知情同意书。 本研究经医院伦理委员会批准。
1.2 仪器与方法 采用Philips iE33 彩色多普勒超声诊断仪检查,探头频率1 ~5 MHz。 二维测量各心腔内径,包括左房前后径、室间隔厚度、左室舒张末期内径、左室后壁厚度、肺动脉收缩压、左室射血分数。 常规PW 采集二尖瓣舒张早期峰速(E);PW-TDI 采集二尖瓣瓣环侧壁舒张早期峰速(e’);计算E/e’值。 所有检查均由2 名超声医师采用单盲独立测量。
1.3 观察指标 比较AS 组和AI 组术前、术后1 周、术后1 年的超声心动图指标。
1.4 统计学方法 采用SPSS 19.0 统计学软件对数据进行处理。 计量资料以均数±标准差(±s)表示,组间比较采用t 检验或重复测量方差分析。 以P <0.05 为差异有统计学意义。
2 结果
AS 组:与术前比较,术后1 周的室间隔厚度、左室舒张末期内径、左室后壁厚度、肺动脉收缩压降低,术后1 年的左房前后径、室间隔厚度、左室舒张末期内径、左室后壁厚度、E/e’、肺动脉收缩压降低且左室射血分数升高,差异有统计学意义(P<0.05);与术后1 周比较,术后1 年的左房前后径、左室后壁厚度、肺动脉收缩压降低且左室射血分数升高,差异有统计学意义(P<0.05)。 见表1。
AI 组:与术前比较,术后1 周、术后1 年的左房前后径、室间隔厚度、左室舒张末期内径、左室后壁厚度、E/e’、肺动脉收缩压降低且左室射血分数升高,差异有统计学意义(P<0.05);与术后1 周比较,术后1 年的左室舒张末期内径降低,差异有统计学意义(P<0.05)。 见表2。
表1 AS 组术前、术后1 周、术后1 年超声心动图指标比较(±s)
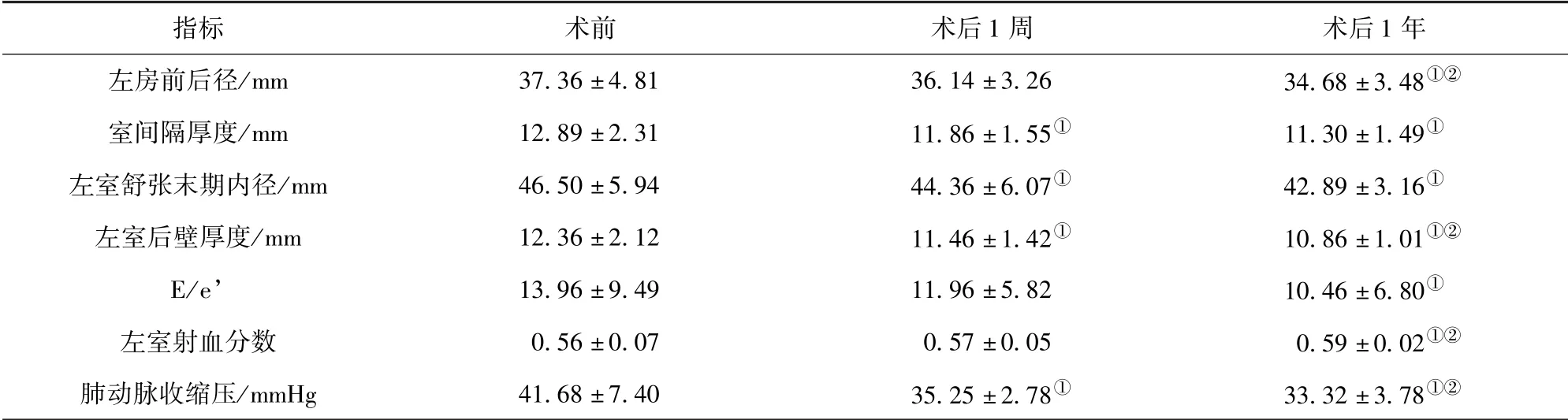
表1 AS 组术前、术后1 周、术后1 年超声心动图指标比较(±s)
注:与术前比较,①P<0.05;与术后1 周比较,②P<0.05;1 mmHg =0.133 kPa
指标 术前 术后1 周 术后1 年左房前后径/mm 37.36 ±4.81 36.14 ±3.26 34.68 ±3.48①②室间隔厚度/mm 12.89 ±2.31 11.86 ±1.55①11.30 ±1.49①左室舒张末期内径/mm 46.50 ±5.94 44.36 ±6.07①42.89 ±3.16①左室后壁厚度/mm 12.36 ±2.12 11.46 ±1.42①10.86 ±1.01①②E/e’ 13.96 ±9.49 11.96 ±5.82 10.46 ±6.80①左室射血分数 0.56 ±0.07 0.57 ±0.05 0.59 ±0.02①②肺动脉收缩压/mmHg 41.68 ±7.40 35.25 ±2.78①33.32 ±3.78①②
表2 AI 组术前、术后1 周、术后1 年超声心动图指标比较(±s)
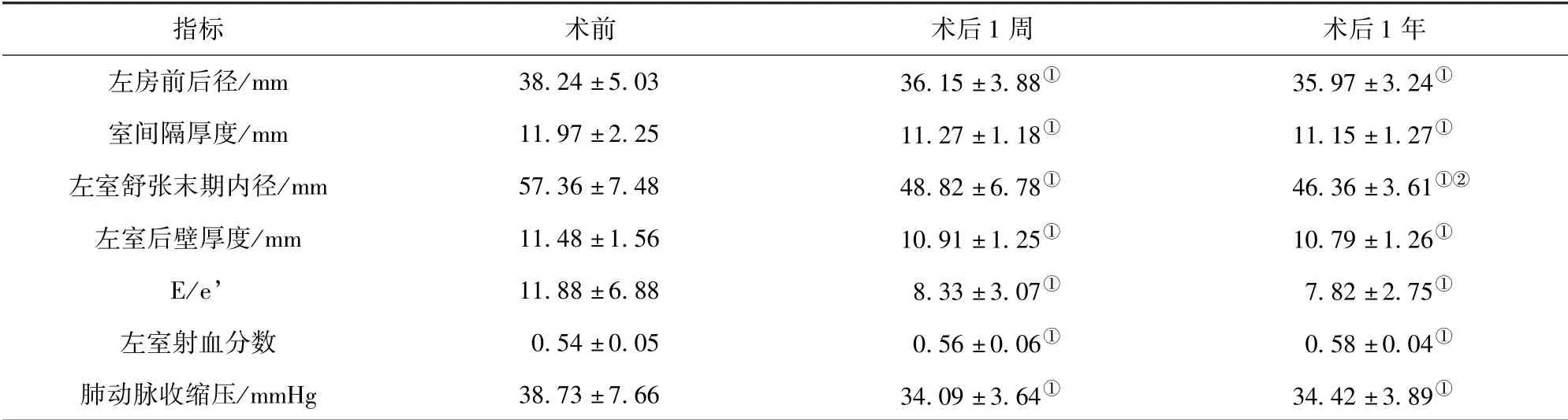
表2 AI 组术前、术后1 周、术后1 年超声心动图指标比较(±s)
注:与术前比较,①P<0.05;与术后1 周比较,②P<0.05
指标 术前 术后1 周 术后1 年左房前后径/mm 38.24 ±5.03 36.15 ±3.88①35.97 ±3.24①室间隔厚度/mm 11.97 ±2.25 11.27 ±1.18①11.15 ±1.27①左室舒张末期内径/mm 57.36 ±7.48 48.82 ±6.78①46.36 ±3.61①②左室后壁厚度/mm 11.48 ±1.56 10.91 ±1.25①10.79 ±1.26①E/e’ 11.88 ±6.88 8.33 ±3.07①7.82 ±2.75①左室射血分数 0.54 ±0.05 0.56 ±0.06①0.58 ±0.04①肺动脉收缩压/mmHg 38.73 ±7.66 34.09 ±3.64①34.42 ±3.89①
3 讨论
长期的主动脉瓣病变会引起左室压力或容量负荷增加,导致左室向心性肥厚或离心性肥厚,继而出现左室重构[6]。AVR 对缓解左室扩大及恢复心功能具有明显的临床效果,早期手术治疗可能会改善患者的病理性结构,抑制心脏重塑,改善患者预后[7]。 AVR 可使增大的心腔恢复正常,肥厚的心肌逐渐消退,阻止左室重构,改善心功能。 及时的手术治疗对缩小增大的左心具有明显效果,并能恢复患者相应的心脏射血能力,对缓解临床症状及恢复左心功能均有极大帮助[8],患者在AVR 术后血流动力学指标可明显改善[9]。 有研究表明,AVR 术后,由于患者左室流出道阻塞解除或减轻,左室质量指数逐渐减少,射血分数增加,心功能在较短时间内即可恢复[10]。
本研究AS 组相关结果显示:与术前比较,术后1 周的室间隔厚度、左室舒张末期内径、左室后壁厚度、肺动脉收缩压降低,术后1 年的左房前后径、室间隔厚度、左室舒张末期内径、左室后壁厚度、E/e’、肺动脉收缩压降低且左室射血分数升高,差异有统计学意义(P<0.05);与术后1 周比较,术后1 年的左房前后径、左室后壁厚度、肺动脉收缩压降低且左室射血分数升高,差异有统计学意义(P<0.05)。 即室间隔厚度、左室后壁厚度、左室大小、肺动脉收缩压在AVR术后1 周内得到改善,而左室收缩功能和舒张功能、左房大小则在AVR 术后短期内无明显改善,但左室收缩功能在术后1 年内改善较明显,左室舒张功能在AVR 术后1 周至1 年的变化不显著。 这说明,AS 患者左室壁厚度、左室大小在AVR 术后短期内即可恢复,而左室舒张功能在AVR 术后1 年内恢复较慢。
本研究AI 组相关结果显示:与术前比较,术后1 周、术后1 年的左房前后径、室间隔厚度、左室舒张末期内径、左室后壁厚度、E/e’、肺动脉收缩压降低且左室射血分数升高,差异有统计学意义(P <0.05);与术后1 周比较,术后1 年的左室舒张末期内径降低,差异有统计学意义(P <0.05)。即左房和左室大小、室间隔和左室后壁厚度、左室收缩功能和舒张功能、肺动脉收缩压均在AVR 术后1 周即改善,而左室大小在AVR 术后1 周至1 年的时间内明显变小。 这说明,AI 患者左室壁厚度、左室收缩和舒张功能在AVR 术后短期内即可恢复,而左室大小在术后1 周至1 年的时间内恢复更明显。
AS 组以左室质量回归为主,术前左室压力负荷导致左室舒张功能严重障碍,使AVR 术后左室舒张功能恢复较慢;AI 组以左室容积回归为主,术前左室明显的容量负荷致使左室增大,AVR 术后1 周至1 年左室大小恢复非常明显。这说明,AVR 是使重构的心脏恢复的有效方法,术后早期即可使增大的心腔回缩,增加的心肌质量回归,阻止心室扩大,抑制心肌肥厚,从而逆转心室重构,改善心功能,这与既往研究[11-13]结果一致。
AVR 术后左室重构的恢复是个长时间的过程,需要长期定期观察。 本研究随访时间较短,纳入患者数量较少,下一步将继续扩大样本量、延长随访时间,以更深入进行相关研究分析。
综上所述,超声心动图能够有效评价不同主动脉瓣病变患者AVR 前后的左室重构及功能。 AVR 后,主动脉瓣病变患者的心脏结构及瓣膜功能均得到不同程度的改善。 超声心动图对主动脉瓣病变的治疗时机及方案选择具有重要意义。

