骨化性气管支气管病临床病理特点并文献复习
朱旭友,易祥华,梁 军,宇小婷,顾 俊,张 龙同济大学附属同济医院病理科,上海 200065
骨化性气管支气管病临床病理特点并文献复习
朱旭友,易祥华,梁 军,宇小婷,顾 俊,张 龙
同济大学附属同济医院病理科,上海 200065
目的探讨骨化性气管支气管病的临床病理特点。方法回顾性分析1例骨化性气管支气管病患者的临床、实验室检查、影像学及病理学特征并文献复习。结果骨化性气管支气管病临床表现无特异性,高分辨CT扫描前、侧壁可见点状高密度影,后壁(膜部)无高密度影,气管镜表现为支气管开口处见多发结节病灶,结节病理活检示黏膜下骨化、慢性炎症细胞浸润,表面呼吸上皮鳞状上皮化生伴轻度不典型增生。结论骨化性气管支气管病比较少见,高分辨CT具有提示意义,支气管镜下表现具有特征性,其确诊需结合病理活检。
骨化性气管支气管病;诊断;支气管镜
骨化性气管支气管病(traeheobrochopathia osteochondroplastica,TO)是一种气道疾病,病因不明,临床表现无特异性,易发生误诊或漏诊。该病比较少见,文献大多为病例报道。现回顾性分析本院诊断的1例TO病例的临床病理特点,并结合相关文献进行复习。
1 临床资料
患者,女,58岁,因发热1周入院。1周前无明显诱因下突然发热,最高体温39.8℃,以夜间为主,伴畏寒、寒战,伴有咳嗽、干咳,偶有心悸,无盗汗、消瘦、胸痛,体温可自行降至正常,后再次高热。于同济大学附属同济医院门诊就诊,行血常规检查提示白细胞7.9×109/L,CPR 97.24 mg/L,行胸片检查提示左肺炎症,予抗感染、补液等对症支持治疗后,体温较前下降,复查血常规提示白细胞6.1×109/L,CPR大于160 mg/L超线性。为进一步诊治,门诊以“社区获得性肺炎”收住院。既往有冠心病心肌缺血病史5年余,平素自觉心悸不适时服用保心丸缓解症状,有重症肌无力病史6年,曾服用新斯的明治疗,自述近2年未服用药物;无吸烟史,无肝炎、结核和疟疾病史,无糖尿病、脑血管疾病和精神疾病史,无手术、外伤和输血史,无食物和药物过敏史。
入院检查补体C4:0.71 g/L(0.1~0.4 g/L);免疫球蛋白G:16.9 g/L(7~16 g/L);免疫球蛋白M:0.38 g/L(0.4~2.3g/L);降钙素原:0.06ng/L(正常<0.05ng/mL);丙氨酸氨基转移酶:54 U/L(7~40 U/L);天门冬氨酸氨基转移酶:41 U/L(13~35 U/L);肌酸激酶:279 U/L(26~140 U/L);铁:10.3 μmol/L(10.7~32.2 μmol/L);乳酸脱氢酶:344 U/L(140~271 U/L);低密度脂蛋白胆固醇:3.17 mmol/L(<3.12 mmol/L);乳酸:2.4 mmol/L(0.7~2.1 mmol/L);D-二聚体测定:2.02 mg/L(<0.55 mg/L);纤维蛋白原:4.66 g/L(2.0~4.5 g/L);25羟基维生素D:20.81 nmol/L(37.7~144 nmol/L);总钙:2.44 mmol/L(2.08~2.54 mmol/L),磷:1.28 mmol/L(0.81~1.45 mmol/L)。心肌酶谱、风湿免疫、空腹血糖、甲状腺功能、尿沉渣、尿常规和粪便常规均未见明显异常;呼吸道九项、乙肝五项和丙肝均阴性。超声心动图:左房增大,少量心包积液;肺功能:轻度阻塞性通气功能障碍,弥散功能轻度减退,残总比正常。T-spot检查阴性。CT示两肺纹理增多,两肺上叶见少许斑点条索影,左肺上叶舌段见片状密度稍高影,内见支气管充气征,部分实变。气管壁不光整,表面凹凸不平,并可见点状高密度影(图1);后壁(膜部)无高密度影(图2)。
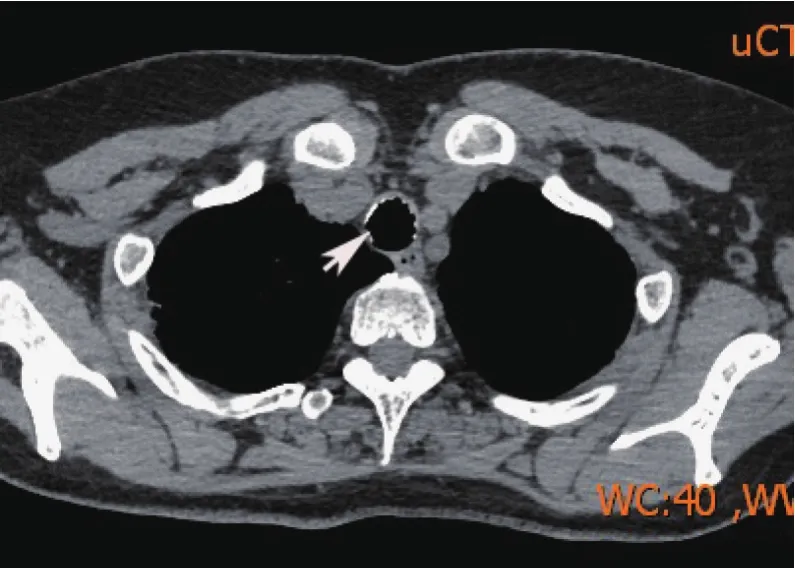
图1 CT示气管壁不光整,表面凹凸不平,并可见点状高密度影(箭头)Fig.1 CT shows imperfect and uneven surface of the trachea wall with point-like high-density shadow(arrow)
完善相关检查后行支气管镜活检,支气管镜可见自声门下至隆突及左侧支气管开口处见多发结节病灶(图3),活检质硬,气管尚通畅,隆突锐利,左主支气管及各叶、段支气管开口通畅,黏膜光滑,未见新生物。右主支气管及各叶段支气管开口通畅,黏膜光整,未见新生物。两侧各叶、段支气管间嵴未见增宽。病理取气管内结节活检示黏膜下骨化、慢性炎症细胞浸润,表面呼吸上皮鳞状上皮化生伴轻度不典型增生(图4),部分区可见黏膜下红染无结构物。DNA倍体检测未见DNA倍体异常细胞。结合临床、影像学及病理诊断为骨化性气管支气管病。入院予以抗感染、对症治疗,病情好转出院,现门诊随访中。回顾分析患者全部资料,未发现患者有其他骨化处。
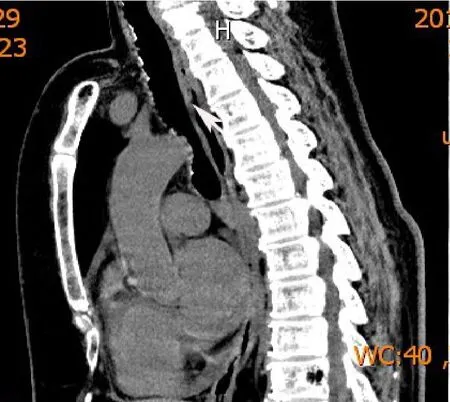
图2 示支气管膜部未见钙化病灶(箭头)Fig.2 There are no calcified lesions in bronchial membrane in CT scans(arrow)
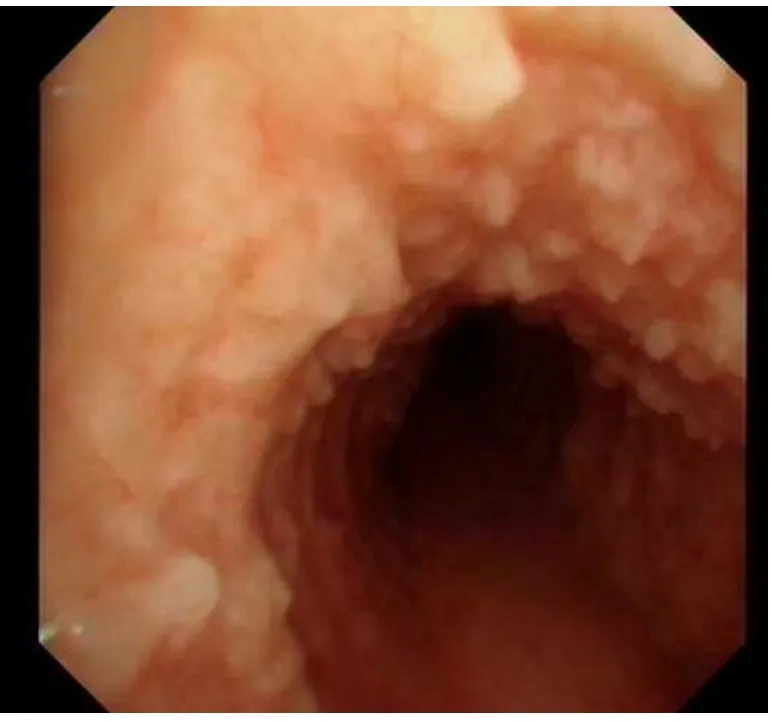
图3 支气管前壁、侧壁弥漫性大小不等结节状突起,部分融合,突向管腔,管腔不规则狭窄,后壁正常Fig.3 Diffuse nodular bulge of variable sizes can be seen in bronchial anterior and lateral wall,with partial fusion,penetration toward tubal antrum and irregular stenosis of lumen.Posterior wall is normal
2 讨论
TO是一种以大气道黏膜下多发性骨质或软骨组织结节状增生,并突向管腔,导致管腔狭窄的良性气道病变。本病比较少见,主要患者群在北欧地区,占所有病例的1/4[1],2000年以前报道病例较少,之后可见陆续有人报道[2-3],临床表现无特异性,一般多发生在50~80岁人群,男性患者略多,男女患病率差异无统计学意义[4],无家族倾向性,与吸烟关系不明显,大多无自觉症状,症状多与管腔狭窄有关,部分患者表现为轻度咯血、咳嗽、劳累后呼吸困难及气喘;部分表现为逐渐加重的咳嗽、咳痰、痰中带血或血痰、活动后气喘、声嘶及反复呼吸道感染症状。少数患者气管插管或尸检时发现,常易漏诊或误诊为支气管炎或哮喘。本例患者因反复发热入院,合并感染,经抗炎治疗后好转,无气喘气流阻塞等症状,管腔基本无阻塞。
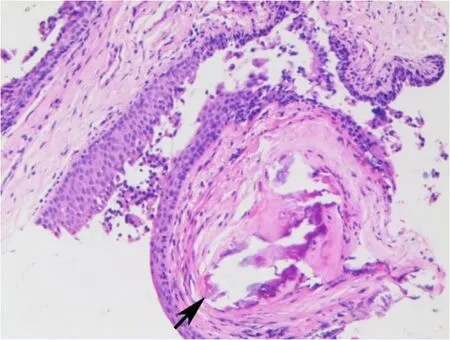
图4 黏膜下见骨化(箭头)、慢性炎症细胞浸润,表面呼吸上皮鳞状上皮化生伴不典型增生(HE×100)Fig.4 Biopsy of the nodules demonstrates submucosal ossification(arrow),chronic inflammation infiltration,and squamous metaplasia of the surface respiratory epithelia with mild atypical hyperplasia(HE×100)
目前TO的发病原因和机制尚不清楚。其发生可能与慢性感染、慢性炎症、变性、机械刺激、先天异常、遗传、化学物质刺激、代谢紊乱和选择性IgA缺乏症等有关[5]。体内内分泌激素水平或钙磷代谢的异常等与骨化性气管支气管病有一定的关系。有学者认为油烟可能也是致病因素之一。部分患者有长期化学接触史,脱离接触物后,症状改善。因此慢性刺激在该病的发生、发展中可能起一定的作用。骨形成蛋白2可能在结节的形成过程中起了重要作用,并与转化生长因子β1协同促进了黏膜下结节的生长[1]。本例患者患有重症肌无力6年可能与TO的发生存在一定关系,其钙磷指标正常,风湿免疫指标均在正常指标范围内,补体C4、免疫球蛋白G轻度偏高,免疫球蛋白M稍低,从检查结果并未发现其特异性的辅助诊断价值。通常认为TO是在黏膜下层和固有层的弹力层中未分化的结缔组织细胞经过化生,形成软骨细胞,从而导致钙质聚积导致局部骨性结节形成。
TO的确诊需要结合高分辨CT扫描、纤支镜下特征性表现和病理形态观察。CT扫描时要注意层距、层厚、窗位和窗宽,一般用2 mm以下的层厚扫描显示病变较清楚;胸片及普通厚层CT难以显示病灶,仅可见管腔狭窄、肺不张和阻塞性肺炎等并发症所致改变。典型的CT表现为气管及支气管前、侧壁散发或多发分布斑点钙化状小突起,突向管腔,大多数突起直径在1~3 mm,有的结节较大,达到l0 mm。病变主要累及气管下2/3及主支气管,叶、段支气管偶见,气管内病变仅见于前、侧壁,后壁(膜部)多无结节。病变严重时,气管壁弥漫增厚,管壁塌陷,管腔缩小,但不会有气管软化的现象[6]。当病变发生在叶或段支气管时,常导致管腔狭窄,加上黏液栓塞,极易引起肺不张。因此部分患者表现为肺炎。本例患者CT主要就表现肺炎。
气管镜表现具有特征性,其图像通常具有诊断意义[7],镜下显示为气管的前壁和侧壁有多个结节样突起,大小不等,常无蒂,呈灰白色或灰黄色,可散发也可融合成片,质硬,典型的呈鹅卵石样改变,突入管腔,病变严重时可呈现管腔内“钟乳石”样改变。气管内壁不光整,呈波浪起伏状,管壁多发性钙化斑和小斑片高密度影。而喉部和段支气管较少被侵犯。通常气管镜下可以分成3类:①散在型,气管支气管黏膜散在分布数个结节;②弥漫型,黏膜上可见均匀分布的结节;③融合型,邻近的结节可以融合成团块状。本例患者自声门下至隆突及左侧支气管开口处见多发结节状病灶,鹅卵石样外观。这些结节都很硬。活检难度较大,常常导致组织取样不够或难取到典型病灶。常需要用较大的鳄齿钳。
病理表现气管、支气管黏膜上皮下可见软骨灶或骨化灶,有些骨化灶可见造血骨髓[8],其表面覆盖的黏膜无改变或轻度萎缩,黏膜下淋巴细胞、组织细胞浸润等炎症细胞浸润,部分病例表现为黏膜上皮鳞状化生伴不典型增生,有些病例仅表现为乳头状黏膜伴鳞状上皮化生。主要鉴别诊断有:①复发性多软骨炎,气管支气管软骨塌陷,黏膜光滑无结节,常累及鼻软骨、耳软骨等;②支气管结核,气管镜下可见病变黏膜瘢痕狭窄,管壁增厚,不规则,管腔不光整,膜部往往受累及,病理为肉芽肿性炎;③气管-支气管淀粉样变,气管、支气管可形成结节状,可以是弥漫性或局限性突出管腔,但可累及膜部,光镜瘤样结节成于红染、无定形物,常围绕血管沉积,散在淋巴细胞、浆细胞浸润,周围异物巨细胞反应,可继发钙化、骨化,刚果红染色阳性;④老年性气管支气管软骨钙化,临床症状不明显,气管壁不增厚,支气管镜下无结节样改变;⑤支气管结石病:属少见疾病,指在气道内存在钙化物质,钙化物类似砂石,结石破入支气管腔时,呈急慢性炎症,周围肺组织可显支气管扩张和/或阻塞性肺炎改变;⑥气管乳头状瘤,少见,多见成人吸烟者,多位于段或亚段支气管,肺外周者极罕见,病理表现为鳞状化生的细胞乳头状增生。
TO为良性病程,预后良好,目前,TO的治疗缺乏统一的指南,对于疗效的判定结果不完全一致,需要有更完善的病例资料、更多的病例及长时间的疗效评估各种治疗方法[3],目前无直接致死的报道,对有症状患者,给予抗感染等对症处理。还可根据不同情况采用支气管镜下治疗,如微波、激光和冷冻等,对有明显气道狭窄者还可通过支气管镜下介入治疗,改善通气功能,减轻症状、提高患者生活质量。
[1] Prakash UB.Tracheobronchopathia osteochondroplastica[J]. Semin Respir Crit Care Med,2002,23(2):167-175.
[2] Ying Zhu,Ning Wu,Hai-Dong Huang,et al.A clinical study of tracheobronchopathia osteochondroplastica:findings from a large chinese cohort[J].PLoS One,2014,9(7):e102068.
[3] 朱盈,郭盛昌,胥武剑,等.骨化性气管支气管病临床分析[J].中国呼吸与危重监护杂志,2012,11(6):592-595.
[4] Jabbardarjani HR, Radpey B, Kharabian S, et al. Tracheobronchopathia osteochondroplastica:presentation of ten cases and review of the literature[J].Lung,2008,186(5):293-297.
[5] DincerHE,Dunitz JM.Tracheobronchopathiaosteochondroplastica and selective IgAdeficiency[J].J Bronchology Interv Pulmonol,2012,19(1):54-56.
[6] Jindal S,Nath A,Neyaz Z,et al.Tracheobronchopathia osteochondroplastica—a rare or an overlooked entity?[J].Case Rep,2013,7(3):16-25.
[7] DecalmerS,WoodcockA,GreavesM,etal.Airway abnormalities at flexible bronchoscopy in patients with chronic cough[J].Eur Respir J,2007,30(6):1138-1142.
[8] Huang CC,Kuo CC.Chronic cough:tracheobronchopathia osteochondroplastica[J].CMAJ,2010,182(18):E859.
Traeheobrochopathia osteochondroplastica:clinicopathological features and literature review
ZHU Xuyou,YI Xianghua,LIANG Jun,YU Xiaoting,GU Jun,ZHANG Long
Department of Pathology,Tongji Hospital,Tongji University School of Medicine,Shanghai 200065,China
ObjectiveTo investigate the clinicopathological features of traeheobrochopathia osteochondroplastica.MethodsThe clinical manifestations,laboratory findings,imaging and pathological features of one patient with traeheobrochopathia osteochondroplastica were retrospectively analyzed,and the related literatures were reviewed.ResultsThe clinical manifestations of traeheobrochopathia osteochondroplastica were not specific.High-resolution CT indicated point-like high density shadow of anterior and side wall,which was not found in posterior wall(membrane). Bronchoscopic examination revealed multiple nodules at the opening of the bronchus.The biopsy of the nodules demonstrated submucosal ossification,chronic inflammatory infiltration,and squamous metaplasia of the surface respiratory epithelia with mild atypical hyperplasia.ConclusionTraeheobrochopathia osteochondroplastica is a rare disease.High-resolution CT has significant clue to the diagnosis,and there are characteristic presentations under bronchoscope.Pathological biopsy is needed to confirm the diagnosis.
Traeheobrochopathia osteochondroplastica;Diagnosis;Bronchoscopy
R563
A
2095-378X(2016)04-0267-04
10.3969/j.issn.2095-378X.2016.04.012
2016-05-27)
朱旭友(1983—),男,主治医师,研究肿瘤病理学
易祥华,电子信箱:yixhxf@163.com

