Bcl-2和Bcl-6在胃癌患者中的表达及意义
何兴桢,邹兵,李曦,杨安
(1.安徽医科大学北京大学深圳医院临床学院,广东 深圳 518036;2.北京大学深圳医院消化内科,广东 深圳 518036)
Bcl-2和Bcl-6在胃癌患者中的表达及意义
何兴桢1,邹兵2,李曦2,杨安2
(1.安徽医科大学北京大学深圳医院临床学院,广东 深圳 518036;2.北京大学深圳医院消化内科,广东 深圳 518036)
目的 观察B淋巴细胞瘤-2(Bcl-2)和B淋巴细胞瘤-6(Bcl-6)在胃癌患者中的表达情况,并探讨其临床意义。方法选取2013年1月至2014年1月期间在北京大学深圳医院就诊并诊断为胃癌的患者30例(胃癌组)及正常对照者30例,采用免疫组化的方法检测并比较两组受检者Bcl-2和Bcl-6的表达情况。结果胃癌组患者Bcl-2表达为(0.588±0.210),明显高于正常组的(0.397±0.171),差异有统计学意义(P<0.05);胃癌组患者Bcl-6表达为(0.255±0.083),明显低于正常组的(0.334±0.112),差异有统计学意义(P<0.05)。结论Bcl-2和Bcl-6的表达水平与胃癌的发生、发展相关,为胃癌的诊断、治疗提供新的靶点。
胃癌;B淋巴细胞瘤-2;B淋巴细胞瘤-6;临床意义
胃癌是最常见的消化道恶性肿瘤[1],我国作为胃癌的高发国家,每年新发胃癌病例数约占全球的40%,发病率以及死亡率均高于世界平均水平的两倍。有数据显示,在中国至2005年胃癌已经成为发病率和死亡率居首位的恶性肿瘤,显然也成为严重威胁人民身体健康的疾病[2-3]。胃癌的发病机制未完全阐明,已知与感染、环境、饮食、遗传等因素有关[4]。近年来,肿瘤的发生、发展与细胞凋亡的关系越来越受到关注。肿瘤最为明显的特点是细胞增殖和凋亡的平衡被打破,表现为细胞正常的凋亡程序被抑制,而增殖能力被增强[5]。已有研究表明胃癌的发生、发展与细胞凋亡调控机制异常密切相关[6]。Bcl-2(B-cell lymphoma-2)和Bcl-6(B-cell lymphoma-6)都属于B细胞淋巴瘤(B cell lymphoma,Bcl)家族基因,是凋亡相关的基因。本研究采用免疫组织化学法对胃癌患者及健康对照组Bcl-2和Bcl-6的表达情况进行检测后对比分析,进一步探讨胃癌的发生机制。
1 资料与方法
1.1 一般资料 选取2013年1月至2014年12年在北京大学深圳医院行内镜检查,内镜下诊断为胃癌并且最终经过病理诊断明确的30例患者作为胃癌组,以30例内镜下表现正常,且没有糜烂或溃疡,或萎缩等其他表现者(活检最终符合病理诊断)作为对照组。胃癌组患者的平均年龄(47.7±12.5)岁,对照组平均年龄(38.6±9.6)岁。在选取研究对象时,使胃癌组和对照组男女比例1:1。提取患者血清5 mL备检测,本研究获得医院伦理委员会批准和患者的知情同意。
1.2 标本的采集和处理 所有标本来自于胃镜活检的取得的病理组织标本,石蜡进行包埋。
1.3 Bcl-2和Bcl-6的表达及其吸光度检测 采用常规免疫组织化学法检测Bcl-2和Bcl-6表达,并测定吸光度值。具体如下:石蜡切片经二甲苯脱蜡,10 min× 2遍;100%、95%、85%、75%、50%梯度酒精水化5 min;PBS冲洗5 min×3遍;3%H2O2液室温下封闭10 min;高温抗原修复;磷酸盐缓冲液(PBS)冲洗5 min;置入免疫组化封闭液山羊血清室温下孵育30 min;加入一抗,4℃过夜。PBS冲洗5 min×3遍;加入二抗室温下孵育30 min;PBS冲洗5 min×3遍,DBA显色,PBS冲洗;苏木素复染;脱水、透明、封片;每张切片在高倍视野下光镜随机观察3个部位,并测定该部位吸光度值,取平均值。
1.4 统计学方法 应用SPSS16.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同胃组织标本中Bcl-2和Bcl-6的表达水平比较 免疫组化结果提示胃癌组织中Bcl-2表达明显高于正常组织;胃癌组织(d)中Bcl-6表达明显低于正常组织,见图1。

图1 不同胃组织标本中Bcl-2和Bcl-6的表达水平(×100)
2.2 不同胃组织标本中Bcl-2和Bcl-6表达的吸光度比较 本研究利用吸光度间接反应Bcl-2和Bcl-6的表达水平。Bcl-2:胃癌组织吸光度(0.588± 0.210)明显高于正常组(0.397±0.171)(t=3.049,P= 0.003),提示胃癌组织中Bcl-2表达明显高于正常组织,见图2;Bcl-6:胃癌组织吸光度(0.255±0.083)明显低于正常组织(0.334±0.112)(t=2.430,P=0.016),提示胃癌组织中Bcl-6表达明显低于正常组织,见图2。
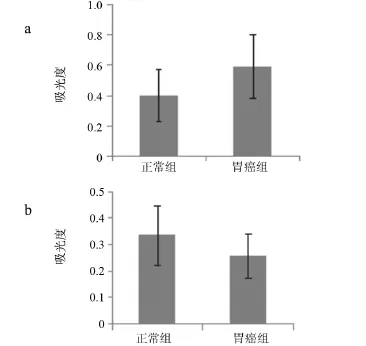
图2 不同胃组织标本中Bcl-2和Bcl-6表达的吸光度
3 讨论
细胞凋亡是由基因调控的细胞自主性死亡过程,具有维持机体内环境稳定的作用。已有研究表明细胞凋亡和细胞增殖在肿瘤的形成过程中发挥重要作用[7]。
Bcl-2作为第一个被发现的抑制细胞凋亡的基因,该基因及其表达的蛋白均可增加细胞抵抗力,抑制组织细胞凋亡,延长细胞寿命[8]。已有研究发现Bcl-2蛋白在口腔鳞状细胞癌、胰腺癌、乳腺癌等肿瘤细胞异常高表达[9-11]。同时,在小鼠前列腺癌模型中发现,抑制Bcl-2表达可使肿瘤缩小,Bcl-2能促进肿瘤发生[12]。国内外研究表明胃癌形成与Bcl-2高表达相关[13-14]。胃癌患者血清Bcl-2表达明显高于正常组,可能与Bcl-2在胃癌细胞中被激活,参与抑制肿瘤细胞凋亡相关。本实验发现胃癌组患者Bcl-2表达明显高于正常组,与国内外研究结果相一致,表明细胞凋亡机制参与肿瘤的发生。研究Bcl-2促进胃癌的发病机制有利于为胃癌的早期诊断提供新方向;下调Bcl-2的表达,缩小肿瘤,有望成为胃癌治疗的新手段。
Bcl-6是Ye等[15]从染色体异常的淋巴瘤细胞中克隆得到的。其编码的锌指蛋白作为一种转录抑制因子,在细胞分化、细胞周期发育中具有重要的功能。已有研究发现其在恶性淋巴瘤中高表达[16],具有导致淋巴瘤的作用[17]。但是由于胃组织与淋巴组织功能、结构、机制等存在差异,因此Bcl-6在胃癌的发生过程中是否具有作用需要进一步研究证实。本实验采用免疫组织化学法测量并比较胃癌患者组和正常对照组Bcl-6的表达情况。发现胃癌组患者Bcl-6表达明显低于正常组,且差异有统计学意义。Toney等[18]的研究结果与本实验一致。Hirata等[19]发现Bcl-6在体细胞恶性肿瘤中表达,且与组织分型相关,并且首次报道了Bcl-6在未分化的胃癌组织中低表达。这些结果表明Bcl-6是胃癌肿瘤发展过程中的重要调节因素。具体机制尚未阐明,考虑与Bcl-6抑制炎症趋化因子有关[18],而炎症因子具有抑制机体免疫、促进胃癌细胞进展的作用。但是也有学者研究发现Bcl-6在一些实体肿瘤包括卵巢癌、胆囊癌、肠癌[20-22]中异常高表达,与Bcl-6在胃癌中的表达相反,表明Bcl-6在胃癌中的作用机制与其他肿瘤存在差异,有待进一步研究证实。由于本实验是对胃癌组织Bcl-6表达的初步探讨,收集的标本数量有限。同时本实验采用免疫组化法测定Bcl-6蛋白表达,与Western-blot方法相比存在局限性。后期可以加大样本量同时将胃癌标本根据病理类型、分化程度、分期、有无淋巴结转移等条件分组,分别测量并比较Bcl-6的表达情况,进一步分析Bcl-6与胃癌发病的关系。
总之,Bcl-2、Bcl-6在胃癌患者组织中差异性表达,可能参与了胃癌的发生、发展过程。进一步加深了解Bcl-2、Bcl-6凋亡相关蛋白与胃癌的关系,可为胃癌的诊断、治疗、判断预后以及监测复发提供新的方向。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]张雯,王金万.胃癌的流行病学及其分型[J].中国全科医学,2010, 13(11):16-17.
[3]邹文斌,蔡全才.胃癌危险因素研究进展[J].中国实用内科杂志, 2014,37(11):415-420.
[4]孙洋,黄晓俊,陈鹭.胃癌相关危险因素的研究进展[J].世界华人消化杂志,2015,23(30):4831-4837.
[5]Youness ER,Nemi ME,Oraby FS,et al.Evaluation of apoptotic marker Bc12,CD4+,human hepatocyte growth factor and metalloproteinase-9 as tumor markets for patients with hepatocellttlar carcinoma[J].Indian J Clin Biochem,2014,29(3):351-356.
[6]颜红柱,钟南哲,李维卿,等.ATP2A2通过钙离子浓度变化参与肿瘤发生机制的研究进展[J].第二军医大学学报,2013,34(11): 1248-1252.
[7]黄恒星,左洪,万文明.青年及老年人胃癌的临床病理学特点及对比分析[J].江西医药,2012,47(2):124-126.
[8]Lei L,Jiao W,Zhen Z,et al.Lipopolysaccharide-induced apoptosis in a murine intestinal endocrine cell line by modulation of Bcl-2,Bax and caspase-3[J].Mol Med Rep,2013,8(6):1649-1654.
[9]Juneja S,Chaitanya NB,Agarwal M.Immunohistochemical expression of Bcl-2 in oral epithelial dysplasia and oral squamous cell carcinoma[J].Indian J Cancer,2015,52(4):505-510.
[10]Masood A,Azmi AS,Mohammad RM.Small molecule inhibitors of Bcl-2 family proteins for pancreatic cancer therapy[J].Cancers(Basel),2011,3(2):1527-1549.
[11]崔凯,王焕.Bcl-2蛋白在乳腺癌中的表达及其临床意义的研究[J].中国社区医师,2012,14(4):259.
[12]Desai D,Sinha I,Null K,et al.Synthesis and antitumor properties of selenocoxib-1 against rat prostate adenocarcinoma cells[J].Int J Cancer,2010,127(1):230-238.
[13]王艳良.胃癌患者血清Bcl-2的表达水平及意义[J].中国继续医学教育,2015,7(6):171-172.
[14]Sundbland AS,Tamago R.Expression of MIB-1/KI 67 andBcl-2 in gastric carcinoma:Relationship with clinic pathological factors[J]. Acta Gastroenterol Lalinoam,2005,25(2):67-72.
[15]Ye BH,Lista F,LoCoco F,et al.Alterations of a zinc finger-encoding gene,BCL-6,in diffuse large-cell lymphoma[J].Science,1993,262 (5134):747-50.
[16]Green MR,Vicente-Duenas C,Romero-Camarero I,et al.Transient expression of Bcl6 is sufficient for oncogenic function and induction of mature B-cell lymphoma[J].Nat Commun,2014,5:3904.
[17]马蓉,吴建中,仲悦娇,等.弥漫大B细胞淋巴瘤血清VEGF和β 2-MG蛋白与Bcl-6和Ki-67表达临床相关性分析[J].中华肿瘤防治杂志,2014,21(17):1343-1346.
[18]Toney LM,Cattoretti G,Graf JA,et al.Bc1-6 regulates chemokine gene transcripion in macrophages[J].Nat Immunol,2000,l(3): 214-220.
[19]Hirata Y,Ogasawara N,Sasaki M,et al.BCL6 degradation caused by the interaction with the C-terminus of pro-HB-EGF induces cyclin D2 expression in gastric cancers[J].Br J Cancer,2009,100(8): 1320-1329.
[20]Yi QW,Mi DX,Wei WW,et al.BCL6 is a negative prognostic factor and exhibits pro-oncogenic activity in ovarian cancer[J].Am J Cancer Res,2015,5(1):255-266.
[21]Peir-In L,Chien-Feng L,Li-Tzong C,et al.BCL6 overexpression is associated with decreased p19ARF expression and confers an independent prognosticator in gallbladder carcinoma[J].Tumor Biol, 2014,35(2):1417-1426.
[22]Paola S,Francescom M,Marta B,et al.Morphological and quantitative analysis of BCL6 expression in human colorectal carcinogenesis [J].Oncology Reports,2014,31(1):103-110.
Expression and significance of Bcl-2 and Bcl-6 in patients with gastric cancer.
HE Xing-zhen1,ZOU Bing2,LI Xi2, YANG An2.1.Peking University Shenzhen Hospital/Clinical College of Anhui Medical University,Shenzhen 518036, Guangdong,CHINA;2.Department of Gastroenterology,Peking University Shenzhen Hospital,Shenzhen 518036, Guangdong,CHINA
ObjectiveTo observe the expression of B-cell lymphoma-2(Bcl-2)and B-cell lymphoma-6 (Bcl-6)in patients with gastric cancer,and to discuss its clinical significance.MethodsThirty patients diagnosed as gastric cancer(gastric cancer group)and 30 normal controls(normal group)in Peking University Shenzhen Hospital from January 2013 and January 2014 were selected.The expression levels of Bcl-2 and Bcl-6 were detected by immunohistochemical SP method and compared between the two groups.ResultsThe expression of Bcl-2(0.588±0.210)in gastric cancer group was significantly higher than that in normal group(0.397±0.171),and the difference was statistically significant(P<0.05).The expression of Bcl-6(0.255±0.083)in gastric cancer group was significantly lower than that in normal group(0.334±0.112),and the difference was statistically significant(P<0.05).ConclusionThe expression of Bcl-2 and Bcl-6 may be closely related to the occurrence and development of gastric cancer,which provides a new target for the diagnosis and treatment of gastric cancer.
Gastric cancer;B-cell lymphoma-2(Bcl-2);B-cell lymphoma-6(Bcl-6);Clinical significance
R735.2
A
1003—6350(2016)19—3112—03
10.3969/j.issn.1003-6350.2016.19.005
2016-04-23)
广东省深圳市卫生计生系统科研项目(编号:201507019)
邹兵。E-mail:zb0909@aliyun.com

