脐血干细胞移植与肝再生增强因子联合治疗急性肝衰竭的实验研究
田佳,张墨阳,周忠义,谢晓红
(海南省人民医院重症医学科,海南 海口 570010)
脐血干细胞移植与肝再生增强因子联合治疗急性肝衰竭的实验研究
田佳,张墨阳,周忠义,谢晓红
(海南省人民医院重症医学科,海南 海口 570010)
目的 观察脐血干细胞移植与肝再生增强因子联合治疗急性肝衰竭大鼠的疗效,以期为肝脏组织工程修复提供依据。方法建立肝衰竭大鼠模型40只,按照随机数表法将大鼠随机分为对照组(采用腹腔注射生理盐水)、脐血干细胞移植组(移植组,采用腹腔移植2×107脐血干细胞)、脐血干细胞移植联合肝再生增强因子组(联合组,采用腹腔移植2×107脐血干细胞联合注射肝再生增强因子50 μg·kg-1·d-1)和肝再生增强因子组(增强因子组,采用腹腔注射肝再生增强因子50 μg·kg-1·d-1),每组各10只。用DAPI标记肝细胞。大鼠肝衰竭造模成功后,经治疗一个月后分别取四组大鼠的肝组织制作冰冻切片,并于荧光显微镜下观察肝组织中DAPI标记的细胞计数。结果移植组肝脏归巢及定植的干细胞为(12.6±2.0)个细胞/100倍视野,多于增强因子组的(8.1±3.4)个细胞/100倍视野,差异有统计学意义(P<0.05),增强因子组到肝脏归巢及定植的干细胞又多于对照组的(3.1±3.4)个细胞/100倍视野,差异有统计学意义(P<0.05),而联合组肝脏归巢及定植的干细胞为(18.1±3.4)个细胞/100倍视野,多于以上各组,差异有统计学意义(P<0.05)。结论不同干预手段对脐血干细胞归巢、定植于肝脏有一定影响,联合组的干细胞归巢率优于单行移植组和增强因子组。因此脐血干细胞移植联合肝再生增强因子是一种较为理想的急性肝衰竭治疗手段。
脐血干细胞;肝脏归巢;急性肝衰竭;肝再生增强因子;定植
急性肝功能衰竭起病急、病死率高、疾病进展快,严重威胁着人类的生命质量。目前较为公认的治疗方法为同种异体肝移植,但是国内可开展该项治疗的医院较少,对技术要求较高,且供体肝脏来源及治疗费用的限制,因此制约了该项目的普及治疗[1]。目前普遍采用的治疗方法为内科综合治疗,但是所取得的疗效有限。尽管人类的肝脏具有较为强大的再生功能,且肝衰竭患者肝脏局部虽表达高水平的促肝细胞增殖因子,但是肝脏的再生能力仍不足,急性肝衰竭导致肝脏不能为机体提供足够的肝功能支持,所致肝脏损伤及衰竭现象加重[2]。因此寻找一种高效、利用度高、供体来源相对容易、价格合理的方法,是该病治疗亟待解决的问题。若能够补充一定数量的异体干细胞,同时还能抑制机体的免疫排斥反应,既能起到阻止干细胞进一步坏死的作用,同时还能够保护现有的肝细胞,为减少肝功能的损伤提供支持,又为移植肝细胞免遭受异体的免疫排斥。为其提供足够的生长调节剂时间,达到修复肝脏,治愈肝衰竭的目的[3]。采用传统的抗病毒及保肝治疗已难以逆转肝功能的好转,而原位肝移植是目前治疗最理想的手段。但由于供体、手术费用昂贵和长期使用免疫抑制剂等诸多因素阻碍了其推广[4]。目前,干细胞移植研究在医学领域,取得了令人瞩目的成就。间充质干细胞作为新型的生物治疗手段,近年来受到了广泛的关注,其具有在一定调解下可诱导向下一跨胚层分化的作用,通过旁分泌及自分泌等机制受到周围组织环境等调控,促进组织修复的作用[5]。脐血干细胞属于中胚层的一类多能干细胞,其具有强大的分化潜能,可在特定条件下可以分化成脂肪细胞、成骨细胞和肝细胞等多种细胞。而干细胞移植的一个关键点也取决于其是否能有效的在肝脏中归巢与定植。由于骨髓间充质来源的干细胞取材有创性较大,且细胞数量在短时间内难以达到需求,加上个体分化差异[6]。但是脐带血间充质干细胞具有脐血干细胞的优势,且来源更为充足。肝再生增强因子是近年来发现的机体自身产生的一种细胞因子,其具有促进肝细胞增殖及修复的作用,可通过直接刺激肝细胞,从而发挥促增殖的免疫调控作用[7-8]。由于脐血干细胞一直具有简单易行、对受体影响小、应用灵活、价格相对低廉等优点,近年来发展较快,有望成为急性肝功能衰竭较为有效且有广阔应用前景的治疗方法[9]。本研究建立肝衰竭大鼠模型,通过研究三种不同干预手段对肝衰竭大鼠进行治疗观察,了解脐血干细胞其在肝脏的归巢、定植及对肝再生的作用,对其产生的不同结果进行统计学分析,为脐血干细胞移植联合肝再生增强因子治疗急性肝衰竭提供理论依据,并阐明移植中促干细胞归巢的作用。
1 材料与方法
1.1 实验动物 实验于2014年6月至2015年12月在海南医学院分子实验室完成。取4周龄孕40 d大鼠40只,雌性,体质量为200~250 g;40只8周龄、体质量(200±10)g的雄性清洁级SD大鼠,均由海南医学院实验动物中心提供动物合格证号:许可证号:SCXK (粤)2015-0020。实验过程符合2006年科学技术部发布的《关于善待实验动物的指导性意见》,对动物处置符合动物伦理学要求。
1.2 主要试剂及仪器 主要试剂及仪器的名称和来源见表1。
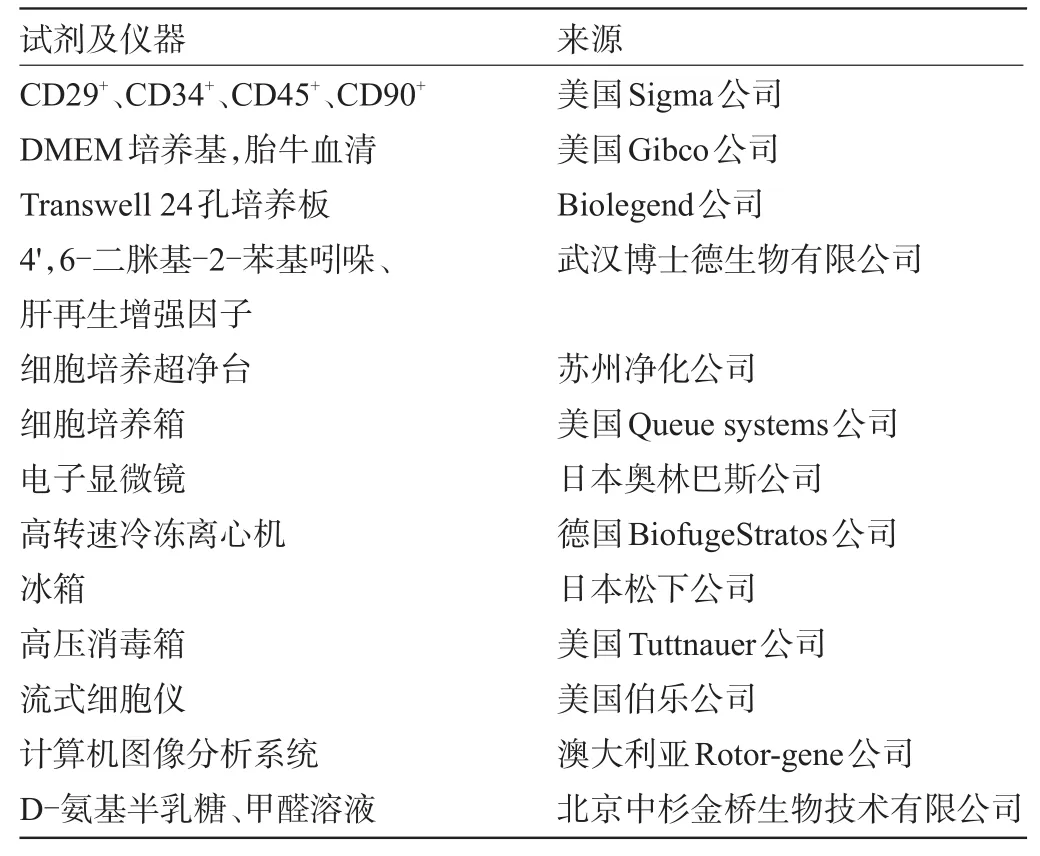
表1 主要试剂及仪器
1.3 方法
1.3.1 脐血干细胞的分离、培养[10]取40只雌性大鼠颈椎脱臼法处死,无菌条件下剖腹抽取脐血干细胞,以DMEM培养基悬浮组织,移入10 cm2的培养皿中,置37℃恒温培养箱中消化1.5 h,弃消化液,磷酸盐缓冲液(PBS)清洗3次,加入含血清培养基后置5% CO2,37℃,饱和湿度的孵箱中培养。在24 h首次换液后,1 000 r/min离心5 min,弃上清后采用完全培养基进行重悬,计数板计数之后,浓度调整到5×109/L,接种在培养瓶中,每3 d换液,待细胞长至90%~95%融合,以0.25%胰蛋白酶消化传代,5×105个细胞数接种于25 mL培养瓶,标记为P1,后每3~4 d换液,待细胞达到融合生长后继续传代,体积分数5%的CO2培养箱单重进行贴壁培养,运用倒置显微镜下观察细胞生长状况和形态变化。使用P3代细胞进行下一步实验。
1.3.2 形态学观察[11]将生长状态良好的P3代细胞以5×104/mL种植于10 cm2培养皿中,每天在倒置相差显微镜下观测细胞状态并拍照,待细胞70%~80%融合,PBS洗3次,4%多聚甲醛15 min固定,双蒸水冲洗,显微镜下拍照。
1.3.3 细胞表面抗原免疫荧光鉴定[12]4%多聚甲醛固定细胞之后,3%过氧化氢消除内源性过氧化物酶15 min,使用PBS洗三次,0.5%的曲拉通打孔15 min,PBS洗3次,5%BSA封闭30 min,甩干,不洗,滴加兔多克隆抗体CD44、CD34、CD105,4℃过夜后,PBS洗5次,滴加生物素标记二抗羊抗兔,PBS洗5次,常温30 min,滴加SABC-FITC,SABC-CY3室温30 min之后,PBS洗5次,Hoechst33258染核5 min,抗荧光淬灭封片剂封片,荧光显微镜拍照。
1.3.4 DAPI标记脐血干细胞[13]取P3代脐血干细胞,待细胞60%~70%融合时,培养液中加入终浓度为1 μg/mL的DAPI溶液,孵育12 h后用PBS洗涤至少6次,去除未与细胞结合的DAPI,在荧光显微镜下观察细胞标记情况。
1.3.5 急性肝衰竭大鼠模型制备[14]取40只雄性大鼠,经大鼠大鼠腹腔内注射注射1.2 g/kg的D-氨基半乳糖,建立急性肝衰竭模型。肝脏组织病理学证实模型成功。
1.3.6 分组处理 40只雄性大鼠,按照随机数表法将大鼠随机分为四组。对照组采用腹腔注射生理盐水、移植组采用腹腔移植2×107脐血干细胞,第1天2 mL,之后每天0.5 mL,连续注射6 d、联合组采用腹腔移植2×107脐血干细胞联合注射肝再生增强因子50 μg·kg-1·d-1,共6 d、增强因子组采用腹腔注射肝再生增强因子50 μg·kg-1·d-1,共6 d,每组各10只。用DAPI标记肝细胞。以上各组治疗后均动态观测1个月。
1.4 主要观察指标 对脐血干细胞的培养鉴定,造模情况、脐血干细胞归巢定植情况。大鼠急性肝衰竭后,经治疗一个月后分别取四组大鼠肝组织制作冰冻切片,并于荧光显微镜下观察肝组织中DAPI标记的细胞计数。
1.5 统计学方法 所有采集的数据应用SPSS21.0统计软件进行分析。其中对符合正态分布资料的数据以均数±标准差(±s)表示,遵循正态分布而且方差齐性,两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠脐血干细胞的分离培养 早期分离培养的细胞呈圆形,随后逐渐伸展,呈梭形的脐血干细胞显著增多,散在或呈簇状分布,见图1。
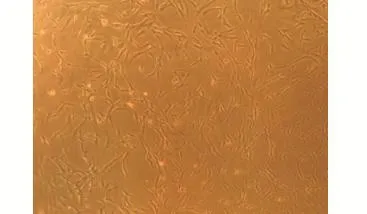
图1 大鼠脐血干细胞的分离培养(×100)
2.2 大鼠脐血干细胞表面标志物测定 免疫荧光法结果显示细胞均一性较好,CD105+、CD44+、CD34+的阳性率分别为6.18%、62.59%、73.66%,传代贴壁生长的梭形细胞为脐血干细胞,见图2。
图2 大鼠脐血干细胞表面标志物测定(×100)
2.3 动物情况 大鼠于急性肝衰竭造模成功后半天内开始活动、进食和饮水。①对照组:2只于第二天后死亡,余8只均存活。②增强因子组:2只大鼠因门静脉注入干细胞后止血不彻底而死亡,成活8只。③移植组:1只大鼠于注入干细胞后即出现呼吸困难、四肢无力而死亡,成活9只。④联合组:有1只大鼠因移植后出现凝血功能障碍而死亡,成活9只。对照组中3只、脐血干细胞门静脉移植组、脐血干细胞门静脉移植联合注射集落刺激因子组和脐血干细胞门静脉移植联合中药灌胃组各有3只出现显著的腹部膨隆,解剖腹腔发现大量清亮腹水。
2.4 脐血干细胞归巢情况 脐血干细胞移植术后一个月,在荧光显微镜观察肝组织中带有蓝色荧光的DAPI标记阳性的脐血干细胞细胞:肝脏归巢及定植的干细胞联合组>移植组>增强因子组>对照组,各组比较差异具有统计学意义(P<0.05),见表2。

表2 脐血干细胞归巢情况(个细胞/100倍视野)
3 讨 论
多种原因引起的急性肝功能衰竭其病情危急、发病迅速、致死率极高,当疾病浸入终末期时,传统的药物治疗效果有效,不能及时有效发挥租用,目前临床上较为公认有效的方法为人工肝及肝移植之劳,但是由于要求条件较高且供体来源缺乏限制了其应用的开展[15]。间充质干细胞作为一种新型的生物治疗手段,近年来不断被大家认识。其能够诱导跨胚层分化,通过自分泌、旁分泌等机制发挥免疫调节及修复靶向组织的作用,在肝衰竭之后,间充质干细胞能够靶向趋化、定植、归巢,诱导分化为肝细胞,促进肝细胞的再生,并表达肝细胞的相关功能,从而发挥修复肝脏[16]。以往应用骨髓间充质干细胞,但是由于其取材困难、数量有限,因此限制了其应用。脐带血具有某些生物特性,含有较多的造血祖细胞及干细胞,其具有较强的体外集落形成能力,可刺激细胞进入生长周期,且具有较强的自分泌和增殖能力,其能力优于骨髓及外周血干细胞,因此近年来受到了广泛关注[17]。脐血中具有T淋巴细胞群,其抗原抗体表达弱,因此排异反应较弱,且细胞毒性较低,加上免疫系统不成熟,因此排斥反应较少,一般情况下不会出现抗宿主反应。同时脐血干细胞还具有间充质干细胞的特性,具有多向分化的潜能,可在细胞因子的诱导下向靶细胞分化,加上其还具有较强的体外增殖能力,因此是组织工程修复的良好种子细胞[18]。
本研究通过建立肝衰竭大鼠模型,以探讨该病有效的细胞治疗效果。D-氨基半乳糖是公认的建立急性肝衰竭动物模型的药物,其主要通过干扰肝脏内UTP代谢,导致肝细胞RNA及蛋白质代谢障碍,从而诱导肝细胞坏死,造模之后我们通过病理检查发现,急性肝衰竭肝组织出现大量溶解现象,肝小叶结构崩解、嗜酸性粒细胞增多,炎症细胞浸润[19]。本研究通过成功建立急性肝衰竭模型,在造模之后,通过研究三种不同干预手段对肝衰竭大鼠进行治疗观察,了解脐血干细胞其在肝脏的归巢、定植及对肝再生的作用,对其产生的不同结果进行统计学分析,为脐血干细胞移植联合肝再生增强因子治疗急性肝衰竭提供理论依据,并阐明移植中促干细胞归巢的作用。
我们通过腹腔移植的方法,其移植数量较大,且操作简单、并发症小、腹腔内无明显的粘连,可提高大鼠的存活率,大量临床研究表明该移植途径具有较高的安全性及可行性。通过四组不同干预手段的治疗,结果提示,联合组的肝脏归巢及定植的干细胞多于移植组,而移植组的肝脏归巢及定植的干细胞又多于增强因子组,增强因子组的肝脏归巢及定植的干细胞又多于对照组,各组比较差异均具有统计学意义(P<0.05)。不同干预手段对脐血干细胞归巢、定植于肝脏有一定影响,联合组的干细胞归巢率优于移植组和增强因子组。肝再生增强因子是一种有效骨干再生因子,有研究发现通过肝再生因子的治疗,可降低肝衰竭大鼠的死亡率,促进肝再生,降低转氨酶水平。本研究联合使用脐血干细胞及肝再生增强因子治疗之后,有效促进了肝衰竭大鼠恢复,促进脐血干细胞的定植归巢,进而促进肝脏的肝细胞增殖及修复[20]。
综上所述,脐血干细胞移植联合肝再生增强因子是一种较为理想的急性肝衰竭治疗手段,可促进肝脏再生,改善肝脏组织及功能,提高存活率,且通过肝再生增强因子的移植可有效促进脐血干细胞向肝细胞增殖分化。D-氨基半乳糖有效模拟了人体的急性肝衰竭病情,所采用的同种异体移植的方式与临床上实际情况相似,为进一步临床治疗提供了应用依据,我们将进一步深入探讨该治疗的免疫调控机理,为将来的临床应用奠定基础。
[1]Ezzat TM,Dhar DK,Newsome PN,et al.Use of hepatocyte and stem cells for treatment of post-resectional liver failure:are we there yet [J].Liver Int,2011,31(6):773-784.
[2]张丹,王允野.骨髓间充质干细胞在肝纤维化中的研究进展[J].中国实用医药,2014,9(12):249-250.
[3]罗建蓉,贾永前.人脐血间充质干细胞的体外分离、培养[J].中国医药导刊,2010,12(12):2124-2127.
[4]张在祺,姚鹏,杨大伟,等.Fibroscan对自体骨髓干细胞移植治疗失代偿期肝硬化的疗效评估[J].世界华人消化杂志,2012,20(18): 1630-1637.
[5]Abdulrazzak H,Moschidou D,Jones G,et al.Biological characteristics of stem cells from foetal,cord blood and extraembryonic tissues [J].J R Soc Interface,2010,7 Suppl 6:S689-706.
[6]师玲玲,刘赴平,王立生,等.人脐血间充质干细胞移植治疗大鼠急性肝损伤[J].暨南大学学报(自然科学与医学版),2011,32(2): 188-193.
[7]Bakhtina A,Tohfafarosh M,Lichtler A,et al.Characterization and differentiation potential of rabbit mesenchymal stem cells for translational regenerative medicine[J].In Vitro Cell Dev Biol Anim,2014, 50(3):251-260.
[8]Manuyakorn W,Howarth PH,Holgate ST.Airway remodelling in asthma and novel therapy[J].Asian Pac J Allergy Immunol,2013,31 (1):3-10.
[9]乔飞,张馨,盛云峰,等.脐带血干细胞治疗肝硬化失代偿期疗效观察[J/CD].中国肝脏病杂志(电子版),2011,3(2):10-13.
[10]梁丽,顾福嘉,黄国美,等.脐血干细胞移植治疗失代偿期肝硬化效果观察[J].郑州大学学报(医学版),2014,49(4):552-555.
[11]郭健,陈洪,王智.干细胞移植治疗肝硬化Meta分析[J].东南大学学报(医学版),2013,32(4):429-436
[12]郭子宽.间充质干细胞及其临床应用中的几个问题[J].中国组织工程研究,2012,16(1):1-10.
[13]Rodríguez R,García-Castro J,Trigueros C,et al.Multipotent mesenchymal stromal cells:clinical applications and cancer modeling[J]. Adv Exp Med Biol,2012,741:187-205.
[14]Berair R,Saunders R,Brightling CE.Origins of increased airway smooth muscle mass in asthma[J].BMC Med,2013,11:145.
[15]Gilgenkrantz H,Collin de l'Hortet A.New insights into liver regeneration[J].Clin Res Hepatol Gastroenterol,2011,35(10):623-629.
[16]周晓玲,谢胜,陈峭,等.脐血干细胞移植结合补益肾气利湿法治疗ChildA、B级肝硬化的疗效及机制探讨[J].实用临床医药杂志, 2014,18(17):25-28.
[17]高琳琳,关方霞,郑鹏远,等.人羊膜脐带源性间充质干细胞对大鼠肝硬化的治疗作用[J].世界华人消化杂志,2012,20(11):916-922
[18]Carolyn A,Holladay,Aoife M,et al.Recovery of cardiac function mediated by MSC and interleukin-lO plasmid functionalized scaffold [J].Biomaterials,2012,33(5):1303-1314.
[19]Luo Y,Wang Y,Poynter JA,et al.Pretreating mesenchymal stem cells with interlenkin-ipand transforming growth factor-1 Psynergistically increases vascular endothelial growth factor production and improves mesenchymal stem cell-mediated myocardial protection after acute ischemia[J].Surgery,2012,151(3):353-363.
[20]Ronzani C,Casset A,Pons F.Exposure to multi-walled carbon nanotubes results in aggravation of airway inflammation and remodeling and in increased production of epithelium-derived innate cytokines in a mouse model of asthma[J].Arch Toxicol,2014,88(2):489-499.
Experimental study of umbilical cord blood stem cell transplantation and augmenter of liver regeneration in the treatment of acute liver failure.
TIAN Jia,ZHANG Mo-yang,ZHOU Zhong-yi,XIE Xiao-hong.Intensive Care Unit, People's Hospital of Hainan Province,Haikou 570010,Hainan,CHINA
ObjectiveTo observe the effect of umbilical cord blood stem cell transplantation and augmenter of liver regeneration(ALR)in the treatment of acute liver failure,in order to provide the basis for liver tissue engineering.MethodsForty rat models with liver failure,according to the random number table,were randomly divided into control group(intraperitoneal injection of normal saline),transplantation group(intraperitoneal transplantation of 2×107umbilical cord blood stem cells),combination group(intraperitoneal transplantation of 2×107umbilical cord blood stem cells combined with intraperitoneal injection ofALR 50 μg·kg-1·d-1)andALR group(intraperitoneal injection ofALR 50 μg·kg-1·d-1),with 10 rats in each group.Liver cells were labeled with DAPI.One month after treatment,liver tissue of the rats in the four groups were taken for frozen sections,and cell count was observed in liver tissue under fluorescence microscope based on DAPI label.ResultsThe stem cells of homing and colonization in combination group were(18.1±3.4)cells/100 magnification,which were significantly more than that in transplantation group of(12.6±2.0)cells/100 magnification,ALR group of (8.1±3.4)cells/100 magnification and control group of(3.1±3.4)cells/100 magnification,with statistically significant difference between each two of the four groups(P<0.05).ConclusionDifferent intervention means had different effect on the homing and colonization of umbilical cord blood stem cells,and the homing rate of stem cells in the combination group was better than transplantation group and ALR group.Therefore,umbilical cord blood stem cell transplantation combined withALR is an ideal treatment for the treatment of acute liver failure.
Umbilical cord blood stem cells;Liver homing;Acute liver failure;Augmenter of liver regeneration (ALR);Colonization
R657.3
A
1003—6350(2016)19—3105—04
10.3969/j.issn.1003-6350.2016.19.003
2016-03-05)
田佳。E-mail:tianjia8898@sina.com

