乙醛脱氢酶1和抗癌一号在眼睑板腺癌中的表达及临床意义
王爱莲,周蕾,李宁
(蚌埠医学院第一附属医院1眼科,2病理科,蚌埠 233003)
乙醛脱氢酶1和抗癌一号在眼睑板腺癌中的表达及临床意义
王爱莲1,周蕾2*,李宁1
(蚌埠医学院第一附属医院1眼科,2病理科,蚌埠 233003)
目的检测眼睑板腺癌(meibomian gland carcinoma,MGC)中乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)和抗癌一号(Kangai1,KAI1)的免疫组织化学表达及其与MGC患者临床病理参数之间的关系。方法应用免疫组织化学ElivisionTMplus法检测60例MGC和10例眼炎性假瘤组织中ALDH1和KAI1免疫反应性。结果在MGC组织中,ALDH1的阳性表达率为38.3%,明显高于炎性假瘤组织(10.0%);KAI1的阳性表达率为45.0%,明显低于炎性假瘤组织(100%)。ALDH1阳性率在肿瘤直径≥2.0cm组、伴有周围组织浸润和淋巴结转移组以及Ⅲ+Ⅳ组明显增高;而KAI1阳性率在肿瘤直径≥2. 0cm组、伴有周围组织浸润和淋巴结转移组、肿瘤低分化组以及Ⅲ+Ⅳ组明显降低。二者的阳性率均与MGC患者的年龄、性别、肿瘤位置等无关。此外,ALDH1的表达与KAI1表达之间呈负相关。结论ALDH1阳性和KAI1阴性的MGC更易浸润和转移;在MGC患者中联合检测ALDH1和KAI1蛋白的表达有助于预测其浸润和转移。
眼睑板腺癌;ALDH1;KAI1;免疫组织化学;转移
眼睑板腺癌(meibomian gland carcinoma,MGC)又名麦氏腺癌,是眼科较常见的恶性肿瘤[1],其来源可以是睑板腺,也可以是睫毛的皮脂腺。睑板腺癌的好发年龄为50~70岁,女性常见,上睑多于下睑。睑板腺癌可因恶性程度的不同而预后差别很大,恶性程度低的患者可历时多年,恶性程度高的患者可能会出现早期转移。睑板腺癌发生浸润和转移的机制目前还尚不清楚,可能与肿瘤起源细胞(tumor initiating cells,TICs)即肿瘤干细胞(cancer stem cells,CSCs)有关。所谓CSCs是指肿瘤细胞群体中一小部分能够自我更新、促进肿瘤分化、浸袭转移及复发的细胞群[2]。乙醛脱氢酶1(Aldehyde dehydrogenase 1,ALDH1)是乙醛脱氢酶家族重要成员之一,该家族成员是一组主要位于细胞核、细胞质和线粒体内的酶。ALDH1不仅参与体内的乙醛的代谢解毒作用,还是肿瘤干细胞的重要标记物之一[3-5]。ALDH1主要参与视黄醛向视黄酸转化的反应,其表达异常增高,可以促进恶性肿瘤的形成及侵袭。肿瘤发生转移的另一种机制可能与肿瘤转移抑制基因表达缺失有关。抗癌一号(Kangai1,KAI1)属于肿瘤转移抑制基因家族,最早发现于前列腺癌中,其基因位于人染色体11p11. 2。KAI1通过调节肿瘤细胞的运动、黏附、聚合及增殖而抑制肿瘤的转移[6]。KAI1基因异常会促进肿瘤细胞的浸润和转移,患者通常预后不佳[7]。本研究通过免疫组织化学方法检测60例眼睑板腺癌组织中ALDH1和KAI1的表达,并分析它们之间的相互关系及其与MGC浸润和转移的关系。
材料与方法
1 材料
收集安徽省蚌埠医学院第一附属医院病理科2002年1月-2010年12月间存档石蜡包埋眼睑板腺癌组织标本60例(活检前未行任何放、化疗及其它抗肿瘤治疗等)和眼眶炎性假瘤组织标本10例(对照组)。在60例睑板腺癌患者中,男性24例,女性36例;年龄48~78岁,中位年龄58岁。位于上眼睑者35例,下眼睑者25例;肿瘤长径<2.0cm有50例,≥2.0cm有10例;分化好的有40例,分化差的有20例;浸润周围组织的有12例,未浸润周围组织的有48例;淋巴结转移的有10例,淋巴结无转移的有10例;TNM分期Ⅰ+Ⅱ期有50例,Ⅲ+Ⅳ期有10例。
2 试剂
鼠抗人单克隆KAI1购自美国Santa Cruz公司,鼠抗人ALDH1购自美国Abcam公司,ElivisionTMplus试剂盒和DAB试剂盒均购自福州迈新生物开发有限公司。
3 ElivisionTMplus法免疫组织化学染色
所有的MGC标本和眼眶炎性假瘤标本均经4%中性福尔马林溶液固定,石蜡包埋,4μm厚连续切片,于二甲苯溶液及梯度浓度的乙醇溶液中脱蜡至水洗。免疫组织化学染色按照ElivisionTMplus试剂盒说明书步骤进行。使用高压对抗原进行修复,修复液为pH6.0的柠檬酸缓冲液,一抗按1:100稀释后滴加。DAB显色后水洗,再经苏木素染细胞核、分化、返蓝、脱水透明和树胶封片等。用加了同一抗相同种属的非免疫IgG的PBS液作阴性对照,采用已知阳性片作阳性对照。
4 免疫组织化学染色结果判读
ALDH1主要是以细胞浆内出现黄色或棕黄色颗粒为阳性;KAI1主要是以细胞膜和浆内出现黄色或棕黄色颗粒为阳性。ALDH1和KAI1的阳性结果主要通过着色的强度和范围的乘积综合计分得出。具体计分步骤如下,先计算着色强度,0分无着色,1分淡黄色,2分黄色,3分为棕黄色;再计算范围,随机选取10个高倍视野,计算阳性细胞所占百分比,<10%为0分,11%-25%为1分,26%-50%为2分,51%-75%为3分,>75%为4分,最后将两次计分相乘,得出积分结果,若积分<3分为阴性,若积分≥3分则为阳性。免疫组化染色结果由两位病理医师通过独立双盲法来判定。
5 统计学分析
本实验所获得的所有数据均通过统计软件SPSS20.0进行分析。在MGC组中,ALDH1和KAI1的表达与对照组及各临床病理参数之间的相关性采用χ2、Spearman等级相关等方法检验,P<0.05为差异有统计学意义。
结 果
1 表达ALDH1的MGC更易浸润和转移
为了明确ALDH1在MGC和对照组眼眶炎性假瘤组织中的表达情况,我们应用免疫组织化学方法检测MGC和对照组ALDH1的表达。结果显示:在对照组中,ALDH1主要表达在黏膜上皮细胞的细胞质中,ALDH1表达阳性率为10.0%(1/10);在MGC组中,ALDH1主要表达在肿瘤细胞的细胞质中,ALDH1表达阳性率为38.3%(23/60)(图1),提示在MGC中ALDH1阳性率显著高于对照组。接着,我们应用卡方检验对ALDH1蛋白的阳性率与MGC肿瘤周围组织浸润、淋巴结转移及TNM分期等相关性进行分析,结果提示:ALDH1表达阳性的MGC更易浸润周围组织及发生淋巴结转移、肿瘤生长更大及TNM分期更高,但ALDH1的表达与否与MGC患者的性别、年龄、肿瘤位置及分化程度等无明显相关性(表1)。
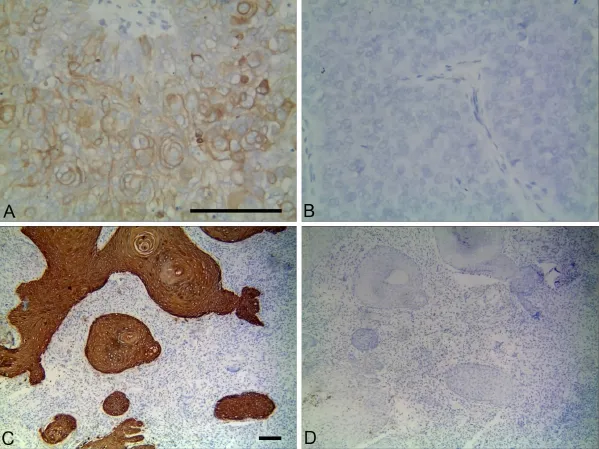
图1 ALDH1在MGC和炎性假瘤组织中的表达。A,ALDH1染色阳性的MGC组织,ALDH1定位于肿瘤细胞的细胞质;B,ALDH1阴性的MGC组织;C,ALDH1染色阳性的炎性假瘤组织,ALDH1定位于黏膜上皮细胞的细胞质;D,ALDH1染色阴性的炎性假瘤组织;比例尺:A和B,100μm;C和D,100μmFig.1 ALDH1 expression in MGC and OIPT.A,ALDH1-positive MGC,ALDH1 located in the cytoplasm of the tumor cells;B,ALDH1-negative MGC;C,ALDH1-positive OIPT,ALDH1 located in the cytoplasm of themucosal epithelial cells;D,ALDH1-negative OIPT;scale bar,100μm
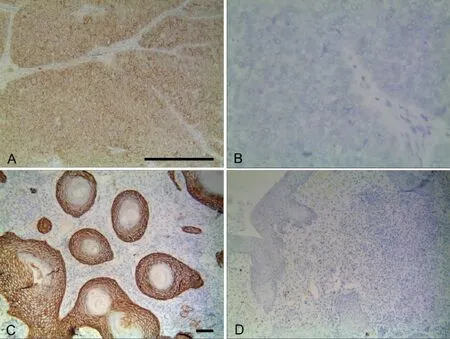
图2 KAI1在MGC和炎性假瘤组织中的表达。A,KAI1染色阳性的MGC组织,KAI1定位于肿瘤细胞的细胞膜和细胞质;B,KAI1染色阴性的MGC组织;C,KAI1染色阳性的炎性假瘤组织,KAI1定位于黏膜上皮细胞的细胞膜和细胞质;D,KAI1染色阴性的炎性假瘤组织;比例尺:A和B,100μm;C和D,100μmFig.2 KAI1 expression in MGC and OIPT.A,KAI1-positive MGC,KAI1 located in themembrane and cytoplasm of the tumor cells;B,KAI1-negative MGC;C,KAI1-positive OIPT,KAI1 located in themembrane and cytoplasm of themucosal epithelial cells;D,KAI1-negative OIPT;scale bar,100μm
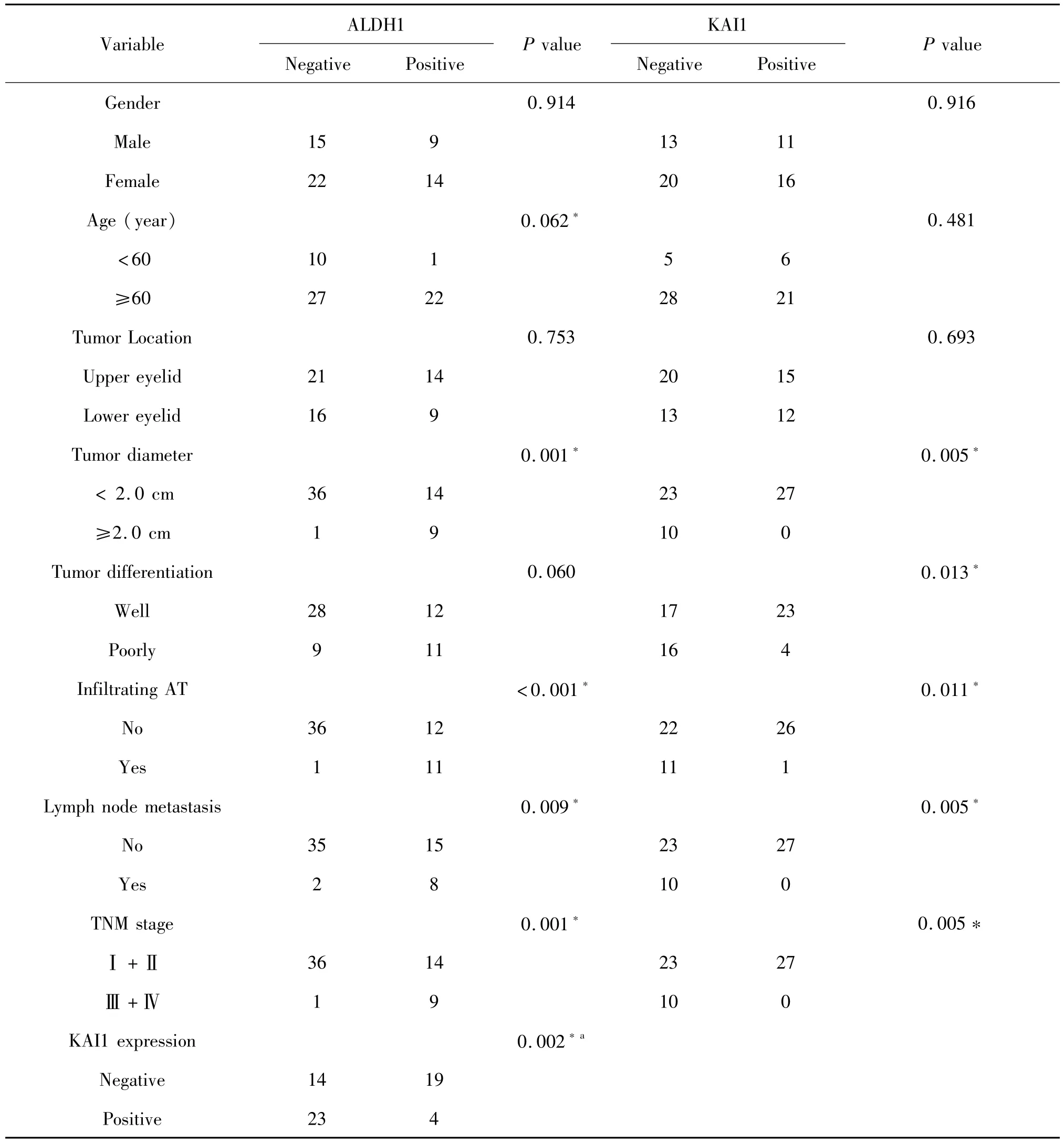
表1 MGC中ALDH1和KAI1的表达及其与临床各病理因素之间的关系Tab.1 The expression of ALDH1 and KAI1 in MGC and their correlation w ith clinicopathological characteristics
2 KAI1表达呈阴性的MGC更易浸润和转移
为了明确KAI1在MGC和对照组眼眶炎性假瘤组织中的表达情况,我们应用免疫组织化学方法检测MGC和对照组KAI1的表达。结果显示:在对照组中,所有的组织块均为KAI1免疫反应阳性,KAI1主要表达在黏膜上皮细胞的细胞膜中;而在MGC组,仅45.0%(27/60)的组织块中可见KAI1免疫反应阳性产物,主要表达在肿瘤细胞的细胞膜中(图2)。这些结果提示在MGC中KAI1蛋白表达阳性率显著降低。应用卡方检验对KAI1的阳性率与MGC肿瘤周围组织浸润、淋巴结转移及TNM分期等相关性进行分析,结果提示:KAI1免疫反应呈阴性的EDMG更易浸润其周围组织及发生淋巴结转移、肿瘤生长更大、分化更差及TNM分期更高(表1);此外,KAI1的表达与否与MGC患者的性别、年龄及肿瘤位置等均无相关性(表1)。
3 MGC组织中ALDH1和KAI1蛋白表达呈负相关
Spearman等级相关分析显示,EDMG组织中ALDH1的阳性表达率与KAI1的阳性表达率呈负相关(表1)。
讨 论
侵袭和转移是恶性肿瘤的主要生物学特征,同时也是恶性肿瘤治疗失败和术后复发的主要原因。近年来,大量研究表明,肿瘤组织中存在肿瘤干细胞(cancer stem cells,CSCs)[8-10]。肿瘤干细胞是肿瘤组织中的一群可以自我更新和无限复制,并可以导致肿瘤侵袭、转移及抵抗放、化疗的细胞。ALDH1是CSCs的重要标记物之一,广泛分布于人体组织中,与干细胞分化及增殖相关。ALDH1通过参与视黄醇氧化为视黄酸的反应而参与细胞的增殖与分化[11,12],从而维持正常组织的发育和内环境的稳定。ALDH1基因突变可引起细胞的异常增殖和分化,从而导致肿瘤的发生。自从ALDH1在乳腺癌中被证实为具有干细胞特性后[13],后来在结肠癌、胰腺癌、前列腺癌和肺癌等恶性肿瘤中均发现其可以作为干细胞的标记物。在本研究中,我们发现在MGC组织中ALDH1蛋白的阳性率显著高于其在对照组中的阳性率,并且随着ALDH1的阳性率的增高,MGC患者越容易发生淋巴结转移、侵犯其周围组织、肿瘤增长越大以及TNM分期越高,说明ALDH1蛋白表达的异常增高可能参与了MGC的发生、发展、侵袭及转移等过程,与文献报道一致[14]。
肿瘤发生转移的一个重要基础是肿瘤转移抑制基因的表达降低或缺失,导致其抑制肿瘤转移的功能丧失。常见的肿瘤转移抑制基因有nm23,KAI1和KISS-1等。KAI1基因曾被认为是前列腺癌特异性的转移抑制基因,后来在多种肿瘤均可发现其表达降低或缺失。KAI1发挥功能主要通过调节细胞表面的黏附分子的结构来实现[15]。KAI1可通过抑制β-catenin酪氨酸激酶的活性来稳定E-cadherin/β-catenin复合体的稳定性而阻止肿瘤细胞从原发部位脱离[16]。KAI1在肿瘤中的异常形式主要有基因突变、等位基因缺失和表达水平的改变等,其中表达水平异常最为常见。本研究发现KAI1蛋白在肿瘤组织中的表达水平显著低于其在对照组中的表达水平,且随着肿瘤分化越差、TNM分期越高,其表达水平也越低,差异均有统计学意义。侵犯周围组织和发生淋巴结转移的MGC患者KAI1表达水平均较没有侵犯周围组织和无淋巴结转移的低,提升KAI1蛋白表达降低或缺失参与了MGC的发生、发展及侵袭和转移,与其他学者研究结果一致[7,15,16]。
Spearman相关分析发现ALDH1的表达与KAI1的表达呈负相关,提示在MGC的发生、发展过程中它们之间可能存在某种联系。在各种致瘤因素的作用下,导致ALDH1被异常激活,导致MGC的发生,由于CSCs的存在,可以促进MGC的进一步发展;此时KAI1的表达降低或缺失,丧失了稳定E-cadherin/β-catenin复合体的功能,从而导致细胞间的黏附力降低,使肿瘤细胞易于脱离原发肿瘤而发生局部浸润甚至淋巴结转移[7]。
综上所述,ALDH1的表达异常增高和KAI1的表达降低或缺失均促进了MGC的发生、发展以及侵袭和转移等过程。因此,可以通过联合检测MGC患者中ALDH1和KAI1蛋白的表达,作为预测MGC患者侵袭和转移的指标之一。
[1]Kale SM,Patil SB,Khare N,et al.Clinicopathological analysis of eyelid maligancies-a review of cases.Indian J Plast Surg,2012,45(1):22-28.
[2]Balic A,Dorado J,Alonso-Gómez M,et al.Stem cells as the rootof pancreatic ductal adenocarcinoma.Exp Cell Res,2012,318(6):691-704.
[3]Zhang S,Cui B,Lai H,et al.Ovarian cancer stem cells express ROR1,which can be targeted for anti-cancer-stemcell therapy.Proc Natl Acad Sci USA,2014,111(48):17266-17271.
[4]Jiang F,Qiu Q,Khanna A,et al.Aldehyde dehydrogenase 1 is a tumor stem cell-associatedmarker in lung cancer.Mol Cancer Res,2009,7(3):330-338.
[5]Kim IG,Lee JH,Kim SY,etal.Fibulin-3 negatively regulates ALDH1 via c-MET suppression and increase c-radiation-induced sensitivity in some pancreatic cancer cell lines. Biochem Biophy Res Commun,2014,454(3):369-375.
[6]Smith SC,Theodorescu D.Learning therapeutic lessons from metastasis suppressor proteins.NatRev Cancer,2009,9(4):253-264.
[7]武世伍,承泽农,俞岚,等.CD82/KAI1和HIF-1α在非小细胞肺癌中的表达及其与血管生成拟态的关系.中国肺癌杂志,2011,14(12):918-25.
[8]O'brien CA,Pollett A,Gallinger S,et al.A human colon cancer cell capable of initiating tumour growth in immunodeficientmice.Nature,2007,445(7123):106-110.
[9]Chiba T,Kamiya A,Yokosuka O,et al.Cancer stem cells in hepatocellular carcinoma:Recent progress and perspective.Cancer Lett,2009,286(2):145-153.
[10]Sugihara E,Saya H.Complexity of cancer stem cells.Int JCancer,2013,132(6):1249-1259.
[11]Zhao D,Mo Y,Li MT,et al.NOTCH-induced aldehyde dehydrogenase 1A1 deacetylation promotes breast cancer stem cells.J Clin Invest,2014,124(12):5453-5465.
[12]Singh S,Brocker C,Koppaka V,et al.Aldehyde dehydrogenase in cellular response to oxidative/electrophilic stress.Free Radic Biol Med,2013,56:89-101.
[13]Ginestier C,Hur MH,Charafe-Jauffret E,et al. ALDH 1 is amarker of normal and malignant humanmammary stem cells and proctor of poor clinical outcome.Cell Stem Cell,2007,1(5):555-567.
[14]Senol S,Yildlrlm A,Akalin I,et al.Relation of stem cellmarkers ALDH1 and CD44 with clinicopathological factors in urothelial carcinomas of urinary bladder.Int JClin Exp Med,2015,8(3):4195-4203.
[15]Lei Zhou,Lan Yu,Shiwu Wu,et al.Clinicopathological significance of KAI1 expression and epithelial-mesenchymal transition in non-small cell lung cancer.World J Surg Oncol,2015,13:324.
[16]Abe M,Sugiura T,Takahashi M,et al.A novel function of CD82/KAI1 on E-cadherin-mediated homophilic cellular adhesion of cancer cells. Cancer Lett,2008,266(2):163-170.
The expression and clinicopathological significance of ALDH1 and KAI1 in meibom ian gland carcinoma
Wang Ailian1,Zhou Lei2*,Li Ning1
(1Department of Ophthalmology;2Department of Pathology,the First Affiliated Hospital of Bengbu Medical College,Bengbu 233003,China)
ObjectiveTo investigate the immunohistochemicalexpression of aldehyde dehydrogenase 1(ALDH1)and Kangai1(KAI1)inmeibomian gland carcinoma(MGC)and their association with the clinicopathological characteristics ofMGC.M ethodsThe expression of ALDH1 and KAI1 was detected by ElivisionTM plus immunohistochemistry in 60 cases of MGC tissue and 10 cases of ophthalmic inflammatory pseudo tumor(OIPT)tissue.ResultsThe positive rate of ALDH1 was 38.3%in MGC tissue,significantly higher than that in OIPT tissue(10.0%),while the positive rate of KAI1 was 45.0%in MGC,which was obviously lower than in OIPT(100%).The positive rate of ALDH1 wasmuch higher in the groups of tumor≥2.0cm in diameter,infiltrating adjacent tissue,with lymph nodemetastasis or belonging to TNM stage IIIand IV,while thatof KAI1 was significantly lower in these groups.The positive rates of ALDH1 and KAI1 were negatively associated,and both were unrelated to the gender and age ofMGC patients aswellas the location of the tumor.ConclusionALDH1-positive and KAI1-negative MGC has a larger tendency towards invasion and metastasis. The combined detection of ALDH1 and KAI1 expressionmay facilitate the estimation of MGC invasion and metastasis.
Meibomian gland carcinoma;ALDH1;KAI1;immunohistochemistry;metastasis
R730.21
A
10.16705/j.cnki.1004-1850.2016.06.010
2015-10-01
2016-12-14
王爱莲,女(1975年),汉族,副主任医师
*通讯作者(To whom correspondence should be addressed):zhou_lei03@163.com

