TGF-β1在乳腺癌中下调E-cadherin、上调N-cadherin和促进侵袭转移
袁静萍,袁修学,陈创,高利昆,何惠华,饶洁,阎红琳*
(1武汉大学人民医院病理科,武汉 430060;2武汉科技大学基础医学院,武汉 430065;3武汉大学人民医院乳腺甲状腺外科,武汉 430060)
TGF-β1在乳腺癌中下调E-cadherin、上调N-cadherin和促进侵袭转移
袁静萍1,袁修学2,陈创3,高利昆1,何惠华1,饶洁1,阎红琳1*
(1武汉大学人民医院病理科,武汉 430060;2武汉科技大学基础医学院,武汉 430065;3武汉大学人民医院乳腺甲状腺外科,武汉 430060)
目的探讨乳腺癌中转化生长因子-β1(transforming growth factor-β1,TGF-β1)与上皮性钙粘蛋白E-cadherin和神经性钙粘蛋白N-cadherin水平的关系及在肿瘤侵袭、转移中的临床意义。方法采用免疫组织化学染色检测230例乳腺癌组织芯片及相应癌旁组织中TGF-β1、E-cadherin和N-cadherin的免疫组织化学表达,与乳腺癌临床病理资料进行对照分析,并比较三者表达水平的相关性。将不同浓度的TGF-β1处理乳腺癌细胞检测E-cadherin和N-cadherin免疫反应性,并通过Transwell实验检测TGF-β1对乳腺癌细胞侵袭能力的影响。结果免疫组织化学染色显示,在乳腺癌组织中,TGF-β1和N-cadherin的阳性率明显高于癌旁组织,而E-cadherin的阳性率明显低于癌旁组织。TGF-β1的阳性率随着组织学分级的升高而升高,且在5年后复发的病人中的阳性率显著高于没有复发的病人;E-cadherin的表达与组织学分级呈负相关,且在有淋巴结转移和5年后复发的病人中的阳性率显著低于无淋巴结转移和未复发的病人;与E-cadherin相反,N-cadherin在有淋巴结转移和5年后复发的病人中的阳性率显著高于无淋巴结转移和5年未复发的病人。E-cadherin表达与N-cadherin和TGF-β1表达水平呈显著负相关,而N-cadherin表达与TGF-β1表达具有显著正相关性。TGF-β1处理可降低MCF-7乳腺癌细胞和MDA-MB-231乳腺癌细胞中E-cadherin水平及上调N-cadherin水平,并显著增加两种乳腺癌细胞的侵袭和迁移能力。结论乳腺癌组织中TGF-β1、E-cadherin、N-cadherin的表达与肿瘤上皮间质转化引起的侵袭转移和预后密切相关,检测其免疫组织化学表达对临床指导预后具有重要意义。
乳腺癌;转化生长因子-β1;上皮性钙粘蛋白;神经性钙粘蛋白;上皮间质转化
乳腺癌是女性常见肿瘤之一,肿瘤的转移是患者死亡的主要原因,探讨肿瘤侵袭转移机制已成为肿瘤治疗的热点问题。近年来,上皮-间质转化(epithelial-mesenchymaltransition,EMT)和肿瘤微环境在恶性肿瘤的浸润和转移中的作用备受关注。EMT常表现为上皮表型的钙粘蛋白E-cadherin的丢失及间质表型的神经性钙粘蛋白N-cadherin的表达升高,转化生长因子-β1(transforming growth factor-β1,TGF-β1)可通过下调E-cadherin参与EMT过程。为了阐明EMT在乳腺癌侵袭转移中的作用,我们应用免疫组织化学方法在230例乳腺癌组织芯片及相应癌旁组织中检测TGF-β1、E-cadherin及N-cadherin蛋白的表达,分析这些标记物之间的表达相关性,并通过体外细胞实验观察TGF-β1对E-cadherin、N-cadherin的表达与肿瘤上皮间质转化引起的侵袭转移的影响进一步探讨三者在乳腺癌侵袭转移中的作用。
材料与方法
1 标本资料
收集武汉大学人民医院、武汉大学中南医院、武汉市中心医院病理科230例具有详尽临床病理资料的乳腺癌样本制作成组织芯片,同时收集相应的癌旁组织作为对照。患者术前均未行化疗、放疗及内分泌治疗。均为女性,年龄自29岁至78岁,平均年龄48.9岁。主要为浸润性癌(浸润性导管癌175例,浸润性小叶癌27例,其他28例)。其他临床病理资料详见表1。
2 试剂
兔抗人多克隆抗体TGF-β1、E-cadherin以及鼠抗人单克隆抗体N-cadherin,免疫组织化学SP试剂盒,DAB显色剂均购自DAKO公司。TGF-β1购自美国R&D公司。
3 细胞株及细胞培养
人乳腺癌细胞系MCF-7和MDA-MB-231由武汉大学人民医院孙圣荣教授提供。乳腺癌细胞系培养于含10%胎牛血清的RPMI-1640培养液中,37℃、5%CO2培养箱中培养。待细胞密度达到80%~90%覆盖瓶底时,通过胰酶消化更换培养基传代。
4 免疫组织化学染色及结果判读
组织连续切片(4μm),脱蜡至水。3%H2O2室温孵育,10min以阻断内源性过氧化物酶,PBS漂洗5min×3,pH6.0的柠檬酸盐缓冲液隔热高压抗原修复20min,自然冷却20min以上,PBS漂洗5min×3,正常山羊血清封闭非特异性蛋白20min,然后一抗37℃孵育1~2h,PBS漂洗5min×3,生物素标记的二抗37℃孵育30min,PBS漂洗5min×3,滴加辣根过氧化物酶标记的链霉素卵白素工作液,37℃孵育30min,PBS漂洗5min×3,DAB反应显色,自来水充分冲洗后,苏木素复染,常规脱水,透明,干燥,封片。阳性对照为已知的阳性切片,将PBS代替一抗的处理组作为阴性对照。TGF-β1、E-cadherin、N-cadherin在乳腺癌组织中主要定位于细胞膜和(或)细胞质内,而TGF-β1在细胞核偶见表达。TGF-β1和N-cadherin以细胞出现褐色或棕褐色颗粒为阳性,根据阳性细胞数和着色深度计分,每例均随机观察计数5个高倍视野(400×),确定每个视野的阳性率,取平均数,按下列计分:阳性细胞≤5%为0分,>5%至25%为1分,>25%至50%为2分,>50%至75%为3分,>75%为4分。阳性细胞表达的着色深度:基本不着色为0分,黄色为1分,棕黄色为2分,棕褐色为3分。将两项积分相乘:≥1为阳性,<1为阴性。E-cadherin以细胞膜和(或)细胞质出现淡黄色或棕黄色颗粒为阳性,参照Mahler-Araujo等[1]的评分方法判断结果:阳性细胞0%~10%为0分;阳性细胞>10%~25%为1分;阳性细胞>25%~50%为2分;阳性细胞>50%~75%为3分;阳性细胞>75%为4分,0~3分为表达阴性,≥3分为表达阳性。
5 TGF-β1给药实验
用灭菌双蒸水将TGF-β1粉剂配置成50mg/ml的贮存液(-20℃保存)。用PBS配置2mg/ml的BSA溶液,用0.22μm的过滤头过滤灭菌。将50mg/ml的贮存液用过滤后的BSA稀释100倍,得到TGF-β1母液(浓度:500ng/ml)。待细胞生长至合适浓度,更换培养基时,将TGF-β1用培养基稀释至4ng/ml、6ng/ml、8ng/ml、10ng/ml和12ng/ml,给药48h后进行后续实验。
6 Transwell实验
应用24孔Transwell进行侵袭试验,并在Transwell小室中加入不同浓度的TGF-β1,各实验组连续培养48h后,取出Transwell,轻轻擦去上面的细胞,用甲醛固定,HE染色,高倍镜下计数穿膜细胞数,并计算穿膜细胞率(穿膜细胞数/总细胞数×100%)。
7 统计学分析
计数资料应用SPSS19.0软件进行统计分析,采用χ2检验比较TGF-β1、E-cadherin、N-cadherin的表达与临床病理参数的关系,TGF-β1、E-cadherin、N-cadherin的表达相关性分析采用Spearman相关性分析法,Transwell细胞穿膜计量资料均采用均数±标准差表示,两两比较采用t检验,P<0.05为差异有统计学意义。
结 果
1 TGF-β1、E-cadherin和N-cadherin在乳腺癌组织中异常表达
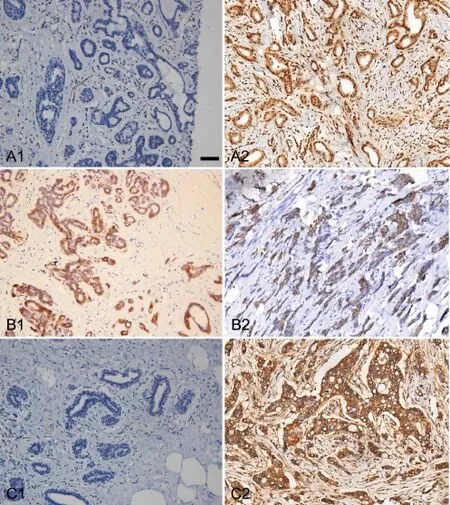
图1 TGF-β1、E-cadherin及N-cadherin在乳腺癌组织及癌旁组织的免疫组织化学表达比较。A1,癌旁组织TGF-β1染色;A2,乳腺癌组织TGF-β1染色;B1,癌旁组织E-cadherin染色;B2,乳腺癌组织E-cadherin染色;C1,癌旁组织N-cadherin染色;C2,乳腺癌组织N-cadherin染色;比例尺,100μmFig.1 Comparison of the immunohistochemicalexpressions of TGF-β1,E-cadherin and N-cadherin in breast cancer tissue and adjacent tissue.A1,TGF-β1 expression in adjacent tissue;A2,TGF-β1 expression in breast cancer tissue;B1,E-cadherin expression in adjacent tissue;B2,E-cadherin expression in breast cancer tissue;C1,N-cadherin expression in adjacent tissue;C2,N-cadherin expression in breast cancer tissue;scale bar,100μm
TGF-β1主要表达于细胞质,部分表达于细胞核,在癌旁组织中呈弱阳性或阴性表达(图1A1)。其在癌旁组织中阳性率为21.3%(49/230),在乳腺癌组织中阳性率为72.6%(167/230),显著高于癌旁组织(图1A2)。E-cadherin主要表达于细胞膜和(或)细胞质,其在癌旁组织中表达水平较高(图1B1),阳性率为99.1%(228/230);而在乳腺癌组织中E-cadherin表达明显减少,阳性表达率为29.1%(67/230),有的以胞质着色为主,细胞膜表达降低(图1B2)。N-cadherin主要表达于细胞膜和细胞质,在癌旁组织中呈弱阳性或阴性表达(图1C1),在乳腺癌组织中阳性率为75.7%(174/230)显著高于癌旁组织中的阳性率17.0%(39/230)(图1C2)。
2 TGF-β1、E-cadherin、N-cadherin的表达与乳腺癌临床病理参数的关系
对TGF-β1、E-cadherin、N-cadherin的表达与乳腺癌临床病理参数的关系分析显示(表1),TGF-β1在乳腺癌组织中的表达与乳腺癌的组织学分级和5年是否复发密切相关,而与年龄、是否绝经、临床分期、淋巴结转移无关。当组织学分级较高时TGF-β1阳性率也随之升高,且在5年后复发的病人中TGF-β1阳性率显著高于没有复发的病人,提示TGF-β1是一个不良预后因子。E-cadherin在乳腺癌组织中的表达与组织学分级、淋巴结转移、5年是否复发密切相关,而与乳腺癌患者的年龄、是否绝经、临床分期无关:随着组织学分级的升高,E-cadherin阳性率逐渐降低,在有淋巴结转移和5年后复发的病人中E-cadherin阳性率显著低于无淋巴结转移和5年未复发的病人,提示E-cadherin表达的降低或丢失是乳腺癌患者发生远端转移过程中的一个重要事件。N-cadherin在乳腺癌组织中的表达与淋巴结是否转移、5年是否复发密切相关,而与乳腺癌患者的年龄、是否绝经、临床分期、组织学分级无关。与E-cadherin相反,N-cadherin在有淋巴结转移和5年后复发的病人中的阳性率显著高于无淋巴结转移和5年未复发的病人,提示在E-cadherin表达降低或丢失的过程中N-cadherin表达是升高的,在肿瘤细胞侵袭转移过程中可能存在上皮向间质转化的过程。

表1 TGF-β1、VEGF蛋白表达与乳腺癌临床病理特征的关系Tab.1 Relationship between the expression of TGF-β1 and VEGF and the clinical pathological parameters of breast cancer
3 TGF-β1、E-cadherin、N-cadherin表达的相关性分析
对TGF-β1、E-cadherin和N-cadherin在乳腺癌中表达的相关性进行经Spearman秩和相关分析显示,E-cadherin与N-cadherin表达呈负相关,与TGF-β1表达呈负相关,N-cadherin与TGF-β1表达呈正相关(表2)。

表2 乳腺癌中TGF-β1、E-cadherin、N-cadherin表达相关性Tab.2 Correlation between the expressions of TGF-β1,E-cadherin and N-cadherin in breast cancer
4 TGF-β1在乳腺癌细胞中下调E-cadherin和上调N-cadherin
基于TGF-β1和N-cadherin在乳腺癌组织中表达上调,E-cadherin在乳腺癌组织中表达下调,且TGF-β1与E-cadherin表达呈负相关,与N-cadherin表达呈正相关,我们推测TGF-β1可通过下调E-cadherin参与EMT过程。为证明这一假设,继而检测了不同浓度的TGF-β1(4ng/ml、6ng/ml、8ng/ml、10ng/ml和12ng/m l)对MCF-7乳腺癌细胞和MDAMB-231乳腺癌细胞中E-cadherin和N-cadherin免疫反应性的影响。结果显示,10ng/ml或12ng/ml的TGF-β1处理细胞48h后,无论是MCF-7细胞还是MDA-MB-231细胞的突起均呈现不同程度的增多,尤其是MDA-MB-231细胞变得更加细长,呈EMT样改变(图2)。此外,随着TGF-β1浓度的升高(4ng/ml、6ng/ml、8ng/ml、10ng/ml和12ng/ml),两种乳腺癌细胞中E-cadherin免疫反应性均逐渐减弱,特别是当TGF-β1浓度为10ng/ml时,足以使两种不同乳腺癌细胞系中E-cadherin免疫反应性明显减弱或消失(图2)。与E-cadherin免疫反应性的减弱或消失相反,随着TGF-β1浓度的升高,N-cadherin免疫反应性明显增强(图2)。

图2 TGF-β1(10ng/ml)对乳腺癌细胞形态和E-cadherin和N-cadherin免疫反应性影响的免疫组织化学检测。比例尺,50μmFig.2 Immunohistochemical detection of the effect of TGF-β1(10ng/ml)on themorphology of breast cancer cells and the immunoreactivitiy of E-cadherin and N-cadherin in the cells;scale bar,50μm.
5 TGF-β1促进乳腺癌细胞侵袭和迁移
为进一步探讨TGF-β1诱导的EMT在乳腺癌浸润转移中的作用,我们应用24孔Transwell侵袭小室实验检测TGF-β1对乳腺癌细胞侵袭能力的影响。结果显示,与不给予TGF-β1处理的对照组相比较,不同浓度的TGF-β1(4ng/ml、6ng/ml、8ng/ml、10ng/ml、12ng/ml)处理MCF-7乳腺癌细胞48h后Transwell穿膜率均显著提高(图3A),且当TGF-β1量为12ng/ml时,MCF-7细胞Transwell穿膜率最高。MDA-MB-231乳腺癌细胞也显示类似结果(图3B),当TGF-β1量为10ng/ml时,MDA-MB-231细胞Transwell穿膜率最高。因此,TGF-β1能够促进乳腺癌细胞侵袭和迁移。
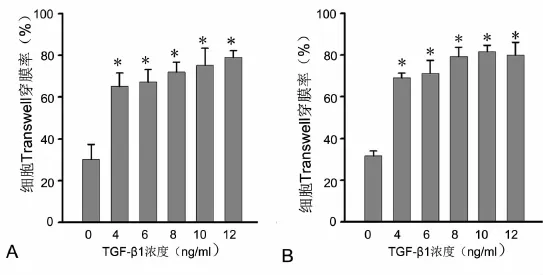
图3 TGF-β1促进乳腺癌细胞侵袭和迁移。A,MCF-7细胞Transwell穿膜率的统计学分析;B,MDA-MB-231细胞Transwell穿膜率的统计学分析;*,与未用TGF-β1处理的对照组比较,0.01<P<0.05Fig.3 TGF-β1 promotes the invasion and migration of breast cancer cells.A,statistical analysis of the percentage of the MCF-7 breast cancer cells penetrating transwell;B,statistical analysis of the percentage of the MDA-MB-231 breast cancer cells penetrating transwell.*,0.01<P<0.05,compared with the cells without TGF-β1 treatment.
讨 论
乳腺癌是一种具有高度异质性的肿瘤,即使是不同患者的相同阶段也往往有着不同组织病理学特征、遗传基因组变异和预后。虽然近年来乳腺癌患者的死亡率有所下降,但是仍有许多患者经初期的内分泌或化学药物治疗后发生了转移,而乳腺癌预后的好坏与肿瘤的侵袭转移密切相关。EMT是肿瘤发生远端转移的首要步骤:肿瘤细胞获得分子学改变而导致功能异常,细胞与细胞间的粘连逐渐丧失,细胞骨架发生重组,所有这些改变将导致细胞失去极向并获得更加梭形的形态,在EMT的过程中,上皮细胞逐渐获得间质细胞的形态、结构和功能,这些过程将最终促进肿瘤细胞穿过基底膜及向周围微环境浸润[2,3]。
TGF-β信号已被证实可在体外诱导EMT。TGF-β细胞因子包括三个亚型:TGF-β1,TGF-β2和TGF-β3,其中TGF-β1是TGF-β家族的主要成员。TGF-β1在肿瘤中的作用更像一把双刃剑,在肿瘤发生的早期,TGF-β1作为肿瘤抑制因子发挥作用,而在肿瘤的进展期TGF-β1又通过促进血管新生促进肿瘤的侵袭和转移。关于TGF-β1增加肿瘤的侵袭及浸润能力的机制仍未有统一的定论。研究显示,TGF-β1通过Smad依赖的和非Smad依赖的两种途径作用于细胞间的连接而诱导EMT[4]。阻滞EMT发生的主要分子之一是细胞与细胞间的粘附受体,E-cadherin。E-cadherin丢失是EMT发生的早期事件,同时也是重要的EMT诱发因素。E-cadherin在许多肿瘤中表达下调,其过度表达可以抑制肿瘤细胞的入侵,TGF-β诱导的EMT与E-cadherin表达的丢失相关[5-7]。在本研究中,TGF-β1在乳腺癌组织中的阳性率显著高于癌旁组织,而E-cadherin在乳腺癌组织中的阳性率显著低于癌旁组织,这与文献报道的TGF-β诱导EMT过程中E-cadherin的丢失是一致的。而在体外细胞实验中,我们同样发现应用10ng/ml或12ng/ml的TGF-β1处理细胞48h后,无论是MCF-7乳腺癌细胞还是MDA-MB-231乳腺癌细胞均发生EMT样改变,且当TGF-β1的浓度≥10ng/ml时,两种不同乳腺癌细胞系中的E-cadherin的表达消失,进一步提示TGF-β1能够诱导乳腺癌细胞EMT过程中E-cadherin的丢失。关于其机制,研究认为TGFβ信号通过Smad介导表达高迁移率蛋白A族2(high mobilitygroup A2,HMGA2)而诱导Snail和Slug的表达,而Snail和Slug是抑制E-cadherin基因重要的锌指转录因子[8]。最近的研究也同样指出TGF-β通过Snail信号通路下调E-cadherin调控EMT,而Snail的表达反过来可上调TGF-β信号通道基因的表达,二者之间存在正向反馈循环机制[9,10]。也有研究认为TGF-β通过Notchl和其配体Jaggedl的介导促进Slug的表达,从而减少E-cadherin的表达,加速EMT发生的进程[11]。
N-cadherin与E-cadherin同属于经典钙粘蛋白,E-cadherin是细胞维持上皮表型的重要黏附分子,当E-cadherin表达下调时,细胞骨架改变,基底膜降解,继而细胞连接松散,使肿瘤细胞更易迁移到细胞外基质,而与之相反的是N-cadherin在上皮组织中表达上调,进一步影响上皮细胞的形态和行为,两种钙粘蛋白表达的动态变化既可以诱导上皮向间质转化也可以反过来诱导间质向上皮转化。本研究中发现N-cadherin在乳腺癌中阳性率显著高于癌旁组织,而E-cadherin在乳腺癌组织中的阳性率明显降低,与TGF-β1表达呈正相关,提示肿瘤进展过程中TGF-β1不仅诱导了EMT过程中上皮标志物E-cadherin的丢失,使癌细胞间的粘附性减弱,还促进了间质型钙粘蛋白N-cadherin的表达升高使细胞具有间质特性,从而脱离原发灶发生远端转移。体外细胞实验也显示TGF-β1可显著上调MCF-7乳腺癌细胞和MDA-MB-231乳腺癌细胞中N-cadherin的表达。
那么,TGF-β1诱导的E-cadherin下调,N-cadherin上调是否与乳腺癌侵袭转移相关呢?我们的研究显示TGF-β1、E-cadherin与N-cadherin在乳腺癌组织中的表达均与5年是否复发密切相关,其中E-cadherin与N-cadherin在乳腺癌组织中的表达还与淋巴结转移有关。而检测细胞侵袭迁移能力的Transwell实验显示TGF-β1显著增强了MCF-7乳腺癌细胞和MDA-MB-231乳腺癌细胞的迁移能力。综合组织和细胞实验,TGF-β1、E-cadherin与N-cadherin三者的表达与预后密切相关,N-cadherin是一个高转移性的风险因子,联合检测E-cadherin和N-cadherin有利于指导乳腺癌预后。
综上所述,乳腺癌中E-cadherin的表达降低与N-cadherin的表达上调预示着乳腺癌发生发展过程中存在上皮向间质转化的现象,TGF-β1对EMT可能存在调控作用,三者的表达与乳腺癌侵袭转移和预后密切相关,而乳腺癌的侵袭转移是一个多基因参与,多因素影响的多步骤复杂过程,对于TGF-β1、E-cadherin与N-cadherin在侵袭转移中的机制及可能存在的其他与转移相关的信号分子还有待进一步发掘和探讨。
[1]Mahler-Araujo B,Savage K,Parry S,et al.Reduction of E-cadherin expression is associated with non-lobular breast carcinomas of basal-like and triple negative phenotype.J Clin Pathol,2008,61(5):615-620.
[2]Felipe Lima J,Nofech-Mozes S,Bayani J,et al.EMT in Breast Carcinoma-A Review.JClin Med,2016,5(7).pii:E65.doi:10.3390/jcm5070065.
[3]Smith BN,Bhowmick NA.Role of EMT in Metastasis and Therapy Resistance.JClin Med,2016,5(2).pii:E17. doi:10.3390/jcm5020017.
[4]Padua D,Massague J.Roles of TGFβin metastasis.Cell Res,2009,19(1):89-102.
[5]Truong HH,Xiong J,Ghotra VP,etal.β1 integrin inhibition elicits a prometastatic switch through the TGFβ-miR-200-ZEB network in E-cadherin-positive triple-negative breast cancer.Sci Signal,2014,7(312):ra15.
[6]Eberlein C,Rooney C,Ross SJ,etal.E-Cadherin and Ep-CAM expression by NSCLC tumour cells associate with normal fibroblast activation through a pathway initiated by integrinαvβ6 and maintained through TGFβsignalling.Oncogene,2015,34(6):704-716.
[7]Vogelmann R,Nguyen-Tat MD,Giehl K,et al.TGFβ-induced downregulation of E-cadherin-based cell-cell adhesion depends on PI3-kinase and PTEN.J Cell Sci,2005,118(Pt20):4901-4912.
[8]Siegel PM,Massague J.Cytostatic and apoptotic actions of TGF-βin homeostasis and cancer.Nat Rev Cancer,2003,3(11):807-821.
[9]Yu H,Shen Y,Hong J,et al.The contribution of TGF-β in Epithelial-Mesenchymal Transition(EMT):Down-regulation of E-cadherin via snail.Neoplasma,2015,62(1):1-15.
[10]Dhasarathy A,Phadke D,Mav D,et al.The transcription factors Snail and Slug activate the transforming growth factor-βsignaling pathway in breast cancer.PloSOne,2011,6(10):e26514.
[11]Leong KG,Niessen K,Kulic I,et al.Jagged1-mediated Notch activation induces epithelial-to-mesenchymal transition through Slug-induced repression of E-cadherin.J Exp Med,2007,204(12):2935-2948.
Downregulation of E-cadherin,upregulattion of N-cadherin and promotion of invasion and m igration by TGF-β1 in breast cancer
Yuan Jingping1,Yuan Xiuxue2,Chen Chuang3,Gao Likun1,He Huihua1,Rao Jie1,Yan Honglin1*
(1Department of Pathology,Renmin Hospital ofWuhan University,Wuhan 430060,China;2Medical College ofWuhan University of Science and Technology,Wuhan 430065,China;3Department of Breast and Thyroid Surgery,Renmin Hospital ofWuhan University,Wuhan 430060,China)
ObjectiveTo explore the relationship between the expression of transforming growth factor-β1(TGF-β1)and the levels of E-cadherin and N-cadherin in breast cancer aswell as the clinical significance of these three proteins in the invasion and metastasis of breast cancer.M ethodsThe expression levels of TGF-β1,E-cadherin and N-cadherin were detected by immunohistochemical staining in amicroarray of 230 cases of breast cancer tissue and corresponding adjacent tissue.The results were compared between each other and with the clinical pathological parameters of breast cancer,and the correlations analyzed.Breast cancer cellswere treated with TGF-β1 of different concentrations and the immunoreactivity of N-cadherin and E-cadherin in the cellswas detected.The influence of TGF-β1 on the invasiveness of breast cancer cells was detected by Transwell assay.ResultsImmunohistochemical staining results showed that the positive rates of TGF-β1 and N-cadherin were significantly higher,while that of E-cadherin significantly lower in breast cancer tissue than in adjacent tissue.The positive rate of TGF-β1 increased with higher histological grading and was significantly higher in patients who relapsed after5 years than in patientswithout relapse.The expression of E-cadherin was negatively correlated with histological grading,and its positive rate was significantly lower in patients with than without lymph nodemetastasis and in those who re-lapsed after 5 years than without relapse.In contrast with E-cadherin,the positive rate of N-cadherin was significantly higher in patientswith than without lymph nodemetastasis and in those who relapsed after 5 years than without relapse.The expression of E-cadherin was negatively correlated with that of N-cadherin and TGF-β1,while the expression of N-cadherin was positively correlated with that of TGF-β1.TGF-β1 treatment down-regulated the expression of E-cadherin and up-regulated the expression of N-cadherin in MCF-7 and MDA-MB-231 breast cancer cells,and significantly increased the invasiveness and metastasis of these two types of breast cancer cells.Conclusion The expression of TGF-β1,E-cadherin and N-cadherin in breast cancer tissue is closely related to the invasion,metastasis and prognosis of breast cancer which are induced by epithelial-mesenchymal transition(EMT).The immunohistochemical detection of their expression is of great significance in the clinical evaluation of prognosis.
Breast cancer;transforming growth factor-β1;E-cadherin;N-cadherin;epithelial-mesenchymal transition
R737.9
A
10.16705/j.cnki.1004-1850.2016.06.011
2016-07-25
2016-12-12
湖北省教育厅科学研究计划指导性项目(B2015350);武汉大学自主科研项目(2042016kf0116)
袁静萍,女(1974年),汉族,主任医师
*通讯作者(To whom correspondence should be addressed):honglin1229@163.com

