四川北部地区AGT、XRCC1基因多态性与食管癌风险的关系*
刘 芳, 谭榜宪△, 彭小东
(1.川北医学院附属医院,四川 南充 637000; 2.成都市第二人民医院, 成都 610017)
四川北部地区AGT、XRCC1基因多态性与食管癌风险的关系*
刘 芳1, 谭榜宪1△, 彭小东2
(1.川北医学院附属医院,四川 南充 637000; 2.成都市第二人民医院, 成都 610017)
目的:探讨DNA损伤修复酶基因XRCC1Arg194Trp多态性和AGT基因第三外显子Leu84Phe多态性与食管癌易感性的关系。方法: 采用病例-对照研究方法分析四川北部地区食管癌病例(n=155)和年龄、性别分布无差异的对照组(n=127)XRCC1基因Arg194Trp多态性和AGT基因第三外显子Leu84Phe多态性,两个基因多态的交互作用和基因多态与吸烟、饮酒之间的交互作用对食管癌易感性的影响。结果: XRCC1基因194位点各基因型在两组间的分布无统计学差异(χ2=0.614;P=0.736)。AGT基因第三外显子第 84 位密码子各基因型在两组间的分布无统计学差异(χ2=1.826;P=0.177),吸烟、饮酒与AGT基因第三外显子第 84 位密码子突变基因型TT存在正交互作用,交互作用指数(the synergy index S, S)分别为7.375、17.67。结论: 四川北部地区XRCC1基因194位点基因多态性与AGT基因第三外显子Leu84Phe多态性可能与食管癌的易感性无关,但AGT基因第三外显子Leu84Phe多态性可能与吸烟、饮酒与食管癌的易感性之间存在协同作用。
食管癌; 基因多态性; 交互作用; XRCC1; AGT
人体正常细胞内存在一套完整的DNA修复系统来维护DNA的损伤。一旦这个修复系统遭到破坏,会使细胞发生恶变,从而引起肿瘤[1]。目前发现人体内DNA损伤修复基因有130余种,主要有XRCC1基因(X-ray repair cross complementary 1 gene)、O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)基因、核苷酸切除修复(nucleotide excision repair,NER)基因、DNA双链断裂修复(double strand break repair,DSBR)基因等,它们在人体DNA受到损伤时发挥重要作用。其中,XRCC1是通过其编码的蛋白质与DNA连接酶Ⅲ相互作用,来修复DNA单链断裂,并与DNA聚合酶β一起进行碱基切除修复[2]。研究表明XRCC1单核苷酸多态性(single nucleotide polymorphism,SNP)与肿瘤易感性有关[3-5]。目前已发现可能与肿瘤易感性有关的XRCC1基因编码区有3个单核苷酸多态位点,它们分别是C26304T(Arg194Trp)、G27466A(Arg280His)和G28152A(Arg399Gln)[6]。O6- 烷基鸟嘌呤是环境中烷基化化学物质产生的一种重要的前突变病变。O6- 烷基鸟嘌呤-DNA烷基转移酶(O6-alkylguanine-DNA alkyltransferase,AGT)是DNA的另一种主要修复蛋白,它在保护细胞免受烷基化物质诱导的突变和细胞毒侵袭方面起着关键作用。AGT在哺乳类动物中是由MGMT基因编码,人类MGMT基因定位于10q26,含有5个外显子和4个内含子。研究报道AGT基因第3外显子的84突变体在修复DNA损伤过程中导致酶活性降低,从而认为AGT基因多态性可能与肿瘤易感性有关[7]。不同个体之间AGT活性有一定差异,这种差异源于甲基鸟嘌呤甲基转移酶(MGMT)基因多态性。一项Meta分析的研究也认为MGMT基因Leu84Phe位点多态性与多种肿瘤易感性的关系有关,而针对食管癌的研究结果显示其易感性与Leu84Phe位点多态性呈正相关[8]。四川北部地区是食管癌的高发区,食管癌的主要危险因素包括烟酒嗜好、亚硝胺摄入、不良饮食习惯等[9-12]。然而,食管癌的发生有着明显的个体差异,说明个体遗传因素也是食管癌发病的重要原因。国内外学者普遍认为多种环境因素和个体遗传因素的交互作用是食管癌发生发展的主要原因,也是当前肿瘤流行病学研究的理论基础[13-14]。因此,我们采用病例-对照的研究方法研究食管癌高发区四川北部地区XRCC1、AGT多态与食管癌易感性的关系;两个基因多态相互之间及其与环境因素之间的关联。
1 材料与方法
1.1 研究对象
本研究收集2012年8月至2013年8月间在川北医学院附属医院、阆中市人民医院、遂宁市中心医院确诊为食管鳞癌的患者(均来自川北地区)共155例。纳入标准:①手术切除的肿瘤组织或内镜活检组织的病理学检查为依据,均经组织病理学确诊为食管鳞癌。②未行放疗或化疗。排除标准:既往有恶性肿瘤病史或食管转移恶性肿瘤者。对照组127例来自同地区经内镜检查排除食管病变且无恶性肿瘤病史的健康人群。所有研究对象均自愿参加调查,并在确诊后接受面对面的流行病学问卷调查。吸烟定义为每天至少一支,持续6个月以上。累计吸烟量(包·年)定义为:(每日吸烟支数/20)×吸烟年数。饮酒定义为每周饮用至少一次并持续6个月以上[15]。病例组在手术或放化疗前,对照组在流行病学问卷调查时采用真空抗凝采血管收集外周静脉血5ml,-80℃超低温冰箱长期保存用于基因组DNA提取。
1.2 AGT 第三外显子Leu84Phe基因多态性分析
采用聚合酶链式反应-限制性片段长度(PCR-RFLP)的方法进行基因多态分析,AGT 第三外显子第 84 位密码子PCR引物序列[16]上游为5’-CCAGAGGTTTACTAAGCCCC- 3’和下游5’-TTACCGACCTTGCTGGAAAAC- 3’,25μl扩增反应体系中包含12.5μl Go Taq Green Master Mix 2×,2.5μl DNA模板,8μl Nuclease-Free Water和引物各1μl,反应条件为94℃预变性2min,94℃变性 30s,55℃退火30s,72℃延伸30s,循环34次,最终72℃延伸7min,产物为194bp。然后取5μlPCR产物,加入9μlNuclease-Free Water,1μl 10×Buffer Tango,1μl限制性内切酶Eam11041,建立16μl的反应体积,混匀后离心9s,置于37℃水浴箱中水浴孵育12hour。酶切反应结束后,取8μl酶切产物,加样于已混有Goldview染色剂3%琼脂糖凝胶中电泳(100V电压,1×TAE电泳缓冲液)40min,待电泳结束后,以凝胶成像分析仪观察分析电泳结果。AGT基因第三外显子第 84 位密码子核苷酸位点发生C-T碱基置换的多态改变。当为突变型时,PCR产物被Eam11041消化后可产生144bp和50bp两个新的片段。当为野生型时,可产生144bp、20bp和30bp三个新的片段。其中20bp的片段由于太短而在胶上无法清楚显示,故琼脂糖凝胶上只可清晰见到144bp和30bp两条片段(详见图1)。

图1 AGT第三外显子Leu84Phe酶切结果图
Figure 1 AGT exon3 gene Leu84Phe analyzed by polymerase chain reaction-restrictive fragment length polymorphism (PCR-RFLP)
Lanes 1-8、14:CC wild genotype for AGT exon3; lanes, 9、11、13:CT heterozygous genotype for AGT exon3; lanes 10、12: TT mutant heterozygous genotype for AGT exon3; lane M:50 bp DNA marker.
1.3 XRCC1 194位密码子基因多态性分析
同样采取PCR-RFLP的方法进行基因多态分析,PCR的引物序列[17]为上游5’-GCCAGGGCCCCTCCTTCAA- 3’和下游5’-TACCCTCAGACCCACGAGT- 3 ’,反应总体积25μl,包括12.5μl Go Taq Green Master Mix 2×,2.5μl DNA模板,8μl Nuclease-Free Water和各1μl上下游引物(10μM),上述反应体系混匀离心9s后再进行扩增。扩增条件为95℃预变性5min,95℃变性30s,61℃退火30s,72℃延伸45s,共循环35次,最后72℃延伸10min,PCR反应产物大小为485bp。取5μl PCR反应产物,分别加入12.3μl Nuclease-Free Water,2μl 10×Buffer,0.2μl BSA,0.5μl PvuⅡ酶,建立20μl的酶切体系,离心混匀后,置于37℃水浴箱中水浴孵育12h。酶切反应结束后,取8μl酶切产物,加样于已混有Goldview染色剂3%琼脂糖凝胶中电泳(100V电压,1×TAE电泳缓冲液)40min。XRCC1基因第194位密码子上出现Arg-Trp突变后可被PvuⅡ酶识别,酶切产物有396bp和89bp两个新的片段。当为野生型时,只有485 bp一个片段。当为突变型时,则产生485 bp 、396bp和89bp三种片段(详见图2)。
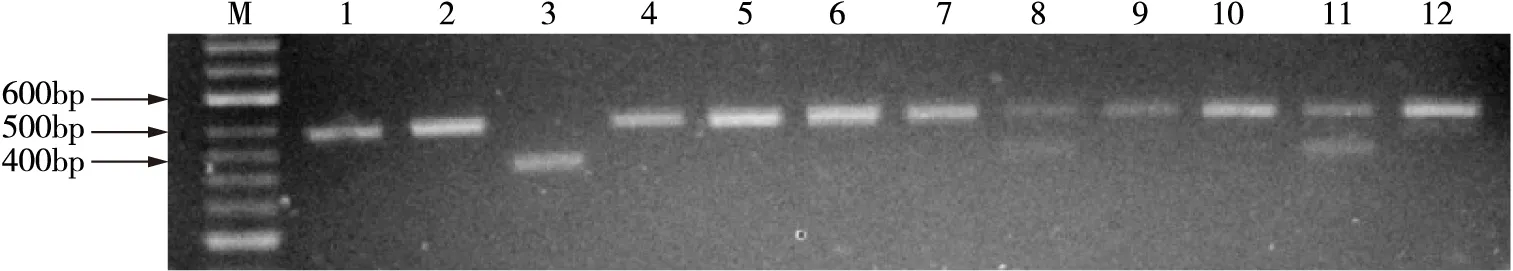
图2 XRCC1 Arg194Trp酶切结果图
Lanes1,2,4,5,6,7,9,10,12:CC wild genetype for XRCC1Arg194Trp; lanes 8、11:CT heterozygous genotype for XRCC1Arg194Trp; lane 3: TT mutant heterozygous genotype for XRCC1Arg194Trp; lane M:100bp DNA marker.
1.4 数据统计分析方法
数据录入、管理、资料分析均采用SPSS13.0统计软件,采用FisherExactχ2检验对照组人群各基因型分布是否符合Hardy-Weinberg平衡(详见表1),采用χ2检验比较人口学特征、吸烟状况、饮酒状况在病例组和对照组分布的差异。采用单因素χ2检验比较XRCC1基因第194位密码子各基因型和AGT第三外显子第 84 位密码子各基因型在病例组和对照组分布的差异。运用多因素非条件Logistic回归模型评估两基因多态性和环境因素与食管鳞癌患病风险之间的关系。按吸烟、饮酒分层后分析两基因多态性与食管癌易感性的关系。(所有的统计检验均为双侧概率检验,P=0.05为差异有显著的统计学意义)

表1 遗传平衡性检验(Hardy-Weinberg平衡)
2 结 果
2.1 研究对象基本特征
本研究病例组平均年龄为(61.8±7.35)岁,其中男性95例(61.3%),女性60例(38.7%)。对照组共127例,平均年龄57±11.8岁,其中男性65例(51.2%),女性62例(48.8%)。两组的平均年龄与性别分布差异均无统计学意义(P>0.05)。病例组吸烟率64.7%,对照组46.4%,差异有统计学意义(P=0.002)。男性食管癌患者共95人,其中吸烟者83人(87.4%)。男性吸烟者患食管鳞癌的风险是不吸烟者的2.857倍。且吸烟包年≥20者患食管鳞癌的风险显著大于吸烟包年<20者,这表明吸烟年限及吸烟数量多者患食管鳞癌的风险更大。并未发现吸烟与女性食管鳞癌患病的关系(P=0.294)。病例组饮酒率与对照组比较差异有统计学意义(OR=2.805;95%CI=1.673-4.704)。男性中有饮酒习惯者明显增加了食管癌患病风险(OR=2.863;95%CI=1.488-5.508)。对于女性来说,饮酒不是食管癌发病的危险因素(P>0.05)。在调整了其他混杂因素后吸烟、饮酒显著影响川北地区食管癌的易感性(P<0.05),且吸烟和饮酒影响ESCC的发病在男性表现得更加突出。针对女性来说,吸烟与饮酒对食管癌的发病没有影响,提示烟酒嗜好可能不是女性食管鳞癌的主要危险因素(详见表2和表3)。

表2 155例食管癌患者和127例正常对照人群的基本特征
注:病例组吸烟率显著高于对照组,χ2=9.562,P=0.002,OR=2.121,95%可信区间1.313~3.427;病例组饮酒率显著高于对照组,χ2=15.758,P=0.00,OR=2.805,95%可信区间1.673~4.704。

表3 按性别分层后危险因素的调整比值比OR及95%可信区间
2.2 XRCC1基因194位点多态性与食管鳞癌易感性的关系
C和T等位基因在病例组和对照组中所占比例为61%、39%和63.2%、36.8%。两组间差异无统计学意义(χ2=0.212,P=0.645),与野生等位基因C相比,突变等位基因T不是食管鳞癌的易感等位基因(OR=0.910,95%CI=0.609~1.360)。突变型TT、杂合型CT、野生型CC在病例组和对照组中分布频率为10.3%、47.1%、42.6%和9.4%、43.3%、47.2%。三者在两组间的分布差异无统计学意义(χ2=0.614,P=0.736)。将杂合型和野生型合并后分析,突变型在病例组中占57.4%,在对照组中占52.8%,差异没有统计学意义(χ2=0.614,P=0.433),说明突变基因T与食管鳞癌发病可能没有关系(见表4)。按吸烟进行分层后,吸烟组和不吸烟组突变基因型对食管鳞癌的发病风险没有影响(P>0.05)。且吸烟与XRCC1基因194位点多态性没有交互效应。按饮酒进行分层后,饮酒组和不饮酒组突变基因型对食管鳞癌的发病风险没有影响(P>0.05)。通过叉生分析提示饮酒与XRCC1基因194位点多态性没有交互效应(详见表5、6)。
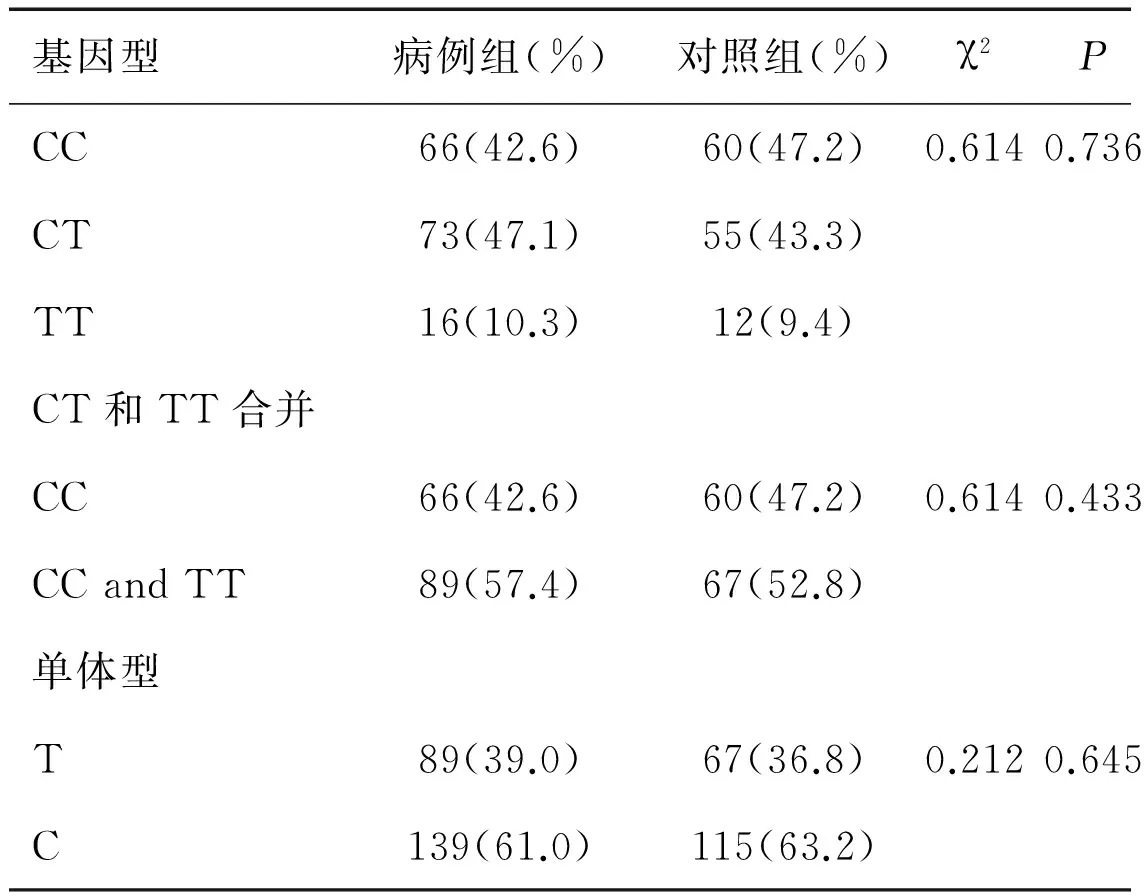
表4 XRCC1基因型与食管鳞癌易感性的关系

表5 XRCC1Arg194Trp基因型与吸烟作用叉生分析结果

表6 XRCC1Arg194Trp基因型与饮酒作用叉生分析结果
2.3 AGT基因第三外显子Leu84Phe多态性与食管鳞癌易感性的关系
由表7可见,C和T等位基因在病例组和对照组中所占比例为58.6%、41.4%和65.3%、34.7%。可见突变基因型在病例组出现率更高,但是两组间差异无统计学意义(χ2=1.826,P=0.177),与野生等位基因C相比,突变等位基因T与食管鳞癌的易感性无关。突变型TT、杂合型CT、野生型CC在病例组和对照组中分布频率为20.6%、35.5%、43.9%和11.0%、36.2%、52.8%,病例组中纯合突变基因型TT的比率比对照组高,但是三个基因型在两组间的分布差异无统计学意义(χ2=5.123,P=0.077)。将含突变基因T的基因型合并后分析,含突变基因型T的基因型与纯合基因型CC相比,病例组与对照组之间差异没有统计学意义(P>0.05)。也就是说,突变基因型可能并没有增加食管癌的患病风险。本实验还研究了吸烟、饮酒分别与AGT第三外显子Leu84Phe基因型的相互作用关系。研究发现吸烟与突变基因型TT存在交互作用(详见表8),交互作用指数(the synergy index S,S)=(A-1)/[(B-1)+(C-1)]=7.375,说明吸烟与突变基因型TT存在正交互作用。饮酒与突变基因型TT也存在正交互作用(详见表9),S为17.67,即两者在提高食管癌的发病风险方面有较强的协同促进作用。在XRCC1基因和AGT基因交互作用方面,本实验采用XRCC1Arg194Trp基因型(突变型和野生型)与AGT第三外显子Leu84Phe基因型(突变型和野生型)进行叉生分析,并没有发现两者有交互作用,S为1.05(详见表10)。
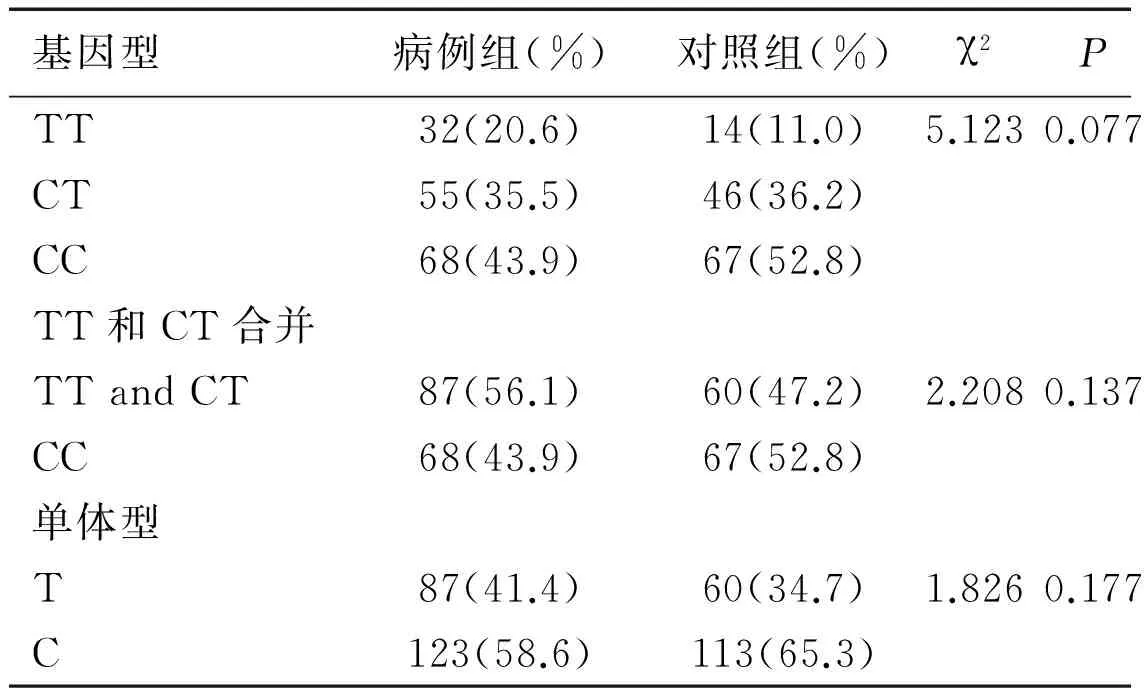
表7 AGT第三外显子Leu84Phe基因型与食管鳞癌易感性的关系

表8 AGT第三外显子Leu84Phe基因型与吸烟作用叉生分析结果

表9 AGT第三外显子Leu84Phe基因型与饮酒作用叉生分析结果
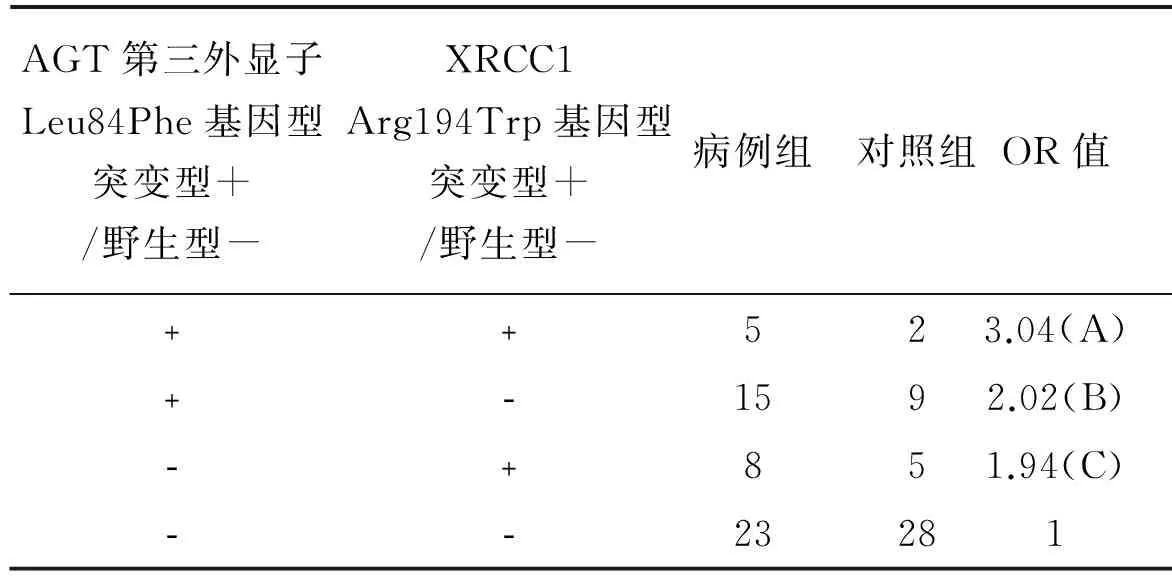
表10 AGT第三外显子Leu84Phe基因型与XRCC1Arg194Trp基因型叉生分析结果
3 讨 论
XRCC1基因是一种重要的DNA修复基因,在人类染色体上位于19q13.2-19q13.3,大小为33kb,包含17个外显子和16个内含子。XRCC1等位基因频率存在着种族和地域差异,有研究表明高加索人、非洲裔美国人和台湾人的194Trp等位基因频率分别为6%、5%和27%[18]。Ladiges等[1]研究认为XRCC1单核苷酸(Arg194Trp和 Arg399Gln)的多态性与年龄相关性疾病,特别是肿瘤有关。Xing等[19]研究了433 例食管癌患者和524例正常对照的XRCC1多态( Arg194Trp和Arg399Gln)与食管癌发生危险性的关系,结果显示XRCC1 Arg194Trp 位点为Trp/Trp基因型比Arg/Arg和Arg/Trp基因型者发生食管癌的危险增加2.07倍( 95%CI=1.34-3.20)。但是,有研究对中国食管癌的调查研究表示Arg194Trp多态与食管鳞癌易感性无关联[20]。张文翠等[21]对淮安籍汉族人群调查研究也发现XRCC1基因Arg194Trp 多态性与食管癌无关,而携带XRCC1 399Gln/Gln基因型个体患食管癌的危险性约为对照人群的3倍。本实验的结果认为川北地区XRCC1基因Arg194Trp多态与食管鳞癌的易感性无关,与张文翠等的研究结果一致。进一步的研究发现XRCC1基因Arg194Trp多态与吸烟、饮酒之间没有交互作用。这与Pandeya等[22]的报道一致。
1998年,王立东等[16]在中国人群中首先证实了AGT基因第三外显子第84位密码子多态性的存在,通过调查该多态性在中国食管癌患者、中国非癌人群及高加索非癌人群中的分布分别为16%(20/125)、20%(27/137)、36%( 28/110),表明AGT基因第三外显子Leu84Phe基因型的分布在人群中存在着差异。很多报道都认为不同种族间AGT基因多态性存在显著差异,即使在我国南北地区汉族人群中表现也不一致[23-24]。迄今发现,AGT基因多态性包括Leu84Phe、Ile143Val和Gly160Arg等。刘淑慧等[25]研究广东潮汕地区100例食管癌患者及65例对照的AGT基因Leu84Phe、Ile143Val的多态性,Leu84Phe各基因型在两组间的分布并无显著性差异,但Leu84PheC>T突变纯合型(TT)仅见于食管癌,因此认为AGT多态性可能与食管癌相关。贺新伟等[26]认为AGTExon3 Leu84Phe突变基因型在安阳地区正常人群的高频提示该基因多态与食管癌高易感性有关。然而,针对新疆哈萨克族食管癌的研究结果显示MGMT基因的Leu84PheC>T SNPs在两组间的分布无显著差异,因此认为该基因多态与食管癌无关[27]。本研究结果发现:与对照组相比,纯合突变基因型(TT)在病例组的比例更高,但是无统计学差异(P>0.05)。环境因素是食管癌发病的重要原因之一,AGT蛋白在保护细胞免受外界环境损伤(如吸烟产生的烷基化化学物质)的过程中起着关键作用[28]。而AGT多态性和吸烟与食管癌的易感性之间是否存在相互作用呢?冯向先等[29]研究了MGMT 84C>T(L84F)与食管癌相关危险因素的协同作用,结果表明MGMT易感基因型与吸烟、饮酒之间没有交互作用。而我们的研究却观察到纯合突变基因型(TT)与吸烟之间有交互效应,为正交互作用。纯合突变基因型(TT)与饮酒之间也存在正交互作用。这与冯向先等的研究结论不一致,可能与地域差异有关。而目前就AGT多态性与吸烟、饮酒的交互作用之间的研究不多,可能尚需更多的研究来阐明它们之间的关系。
莫丽等[30]研究食管癌组织、Barrett,s食管组织和正常食管黏膜中 MGMT及 XRCC1的表达时对两种蛋白表达进行了相关分析, 结果发现 MGMT与 XRCC1蛋白表达之间没有相关关系,提示两者修复损伤途径可能相互独立。本研究结果也表明XRCC1Arg194Trp基因型与AGT第三外显子Leu84Phe基因型之间不存在交互作用,说明两者在进行DNA修复的过程中可能各自有着自己独立的一套修复机制,相互之间可能没有交集。
综上所述, 基因多态性与食管癌发生的关系目前日益受到研究者的重视,从国内外的研究报道来看,DNA损伤修复酶XRCC1基因Arg194Trp多态性和AGT基因第三外显子Leu84Phe多态性与食管鳞癌易感性关系的研究结果目前存在着很大的分歧。本研究提示DNA损伤修复基因XRCC1基因194位点多态性与AGT基因第三外显子Leu84Phe多态性与川北地区食管鳞癌的易感性无关,AGT基因第三外显子Leu84Phe多态性可能与吸烟、饮酒与食管癌的易感性存在协同作用,这与部分学者的研究结果不一致,可能与基因分布存在人群差异有关,也可能与样本含量有关。对于基因多态性的研究往往采用病例-对照研究,样本量的多少对结果的判定存在很大的影响。因此,更多大样本、多中心、高水平的研究有望能解决目前基因多态性与肿瘤易感性之间的争议。
[1] Ladiges W, Wiley J, Macauley A. Polymorphisms in the DNA repair gene XRCC1 and age-related disease [J]. Mech Ageing Dev, 2003,124 (1):27-32.
[2] Tompson LH, West MG. XRCC1 keeps DNA from getting stranded[J]. Mutat Res, 2000, 459(1):1-18.
[3] Guo LY,Jin XP,Niu W,et al.Association of XPD and XRCC 1 genetic polymorphisms with hepatocellular carcinoma risk [J]. Asian Pac J Cancer Prev,2012,13( 9): 4423-4426.
[4] 许崇安,李 嵚,王小杰,等.ERCC 1 和 XRCC 1 多态性与进展期非小细胞肺癌对铂类化疗的敏感性[J]. 实用肿瘤杂志,2012,27( 3): 245-250.
[5] Xue H,Ni P,Lin B,et al.X-ray repair cross complementing group 1 (XRCC 1) genetic polymorphisms and gastric cancer risk: a HuGE review and meta-analysis [J].Am J Epidemiol,2011,173( 4): 363-375.
[6] Shen MR, Jones IM, Mobrenweiser H. Nonconservative amino acid substitution variants exist at polymorphic frequency in DNA repair genes in healthy humans[J]. Cancer Res, 1998, 58(4): 604-608.
[7] 孙 莉,何晓阳,江 伟,等. O6烷基鸟嘌呤DNA烷基转移酶基因多态性与肿瘤易感性的关系[J].中山大学学报(医学科学版),2004,25(4):330-333,346.
[8] Liu J, Zhang RX, Chen F.MGMT Leu84Phe polymorphism contributes to cancer susceptibility: evidence from 44 case-control studies[J]. PLoS One, 2013, 8(9): p.e75367.
[9] Parkin DM,Bray FI,Devesa SS.Cancer burden in the year 2000.The global picture[J].Eur J Cancer,2001,37(Suppl 8):S4-66.
[10]Layke JC,Lopez PP.Esophageal cancer:a review and update[J].Am Fam Physician,2006,73(12):2187-2194.
[11]林东昕,谭 文,陆士新,等.中国食管癌分子流行病学研究[J].中华流行病学杂志,2003,24(10):939-943.
[12]Wang JM,Xu B,Hsieh CC,et al. Longitudinal trends of stomach cancer and esophageal cancer in Yangzhong County:a high-incidence rural-area of China[J].Eur J Gastroenterol Hepatol,2005,17(12):1339-1344.
[13]Yang CX,Matsuo K,Ito H,et al. Gene-environment interactions between alcohol drinking and the MTHFRC677T polymorphism impact on esophageal cancer risk:results of a case-control study in Japan[J].Carcinogenesis,2005,26(7):1285-1290.
[14]杨晓梅,叶晓锋,薛 麟,等.XRCC1基因多态性和饮酒的交互作用与食管癌的关联性研究[J].宁夏医学杂志,2013,35(10):889-891.
[15]陈梦如,王建明,郭国平,等.DNA损伤修复基因XPD Lys751Gln、XRCC1 Arg399Gln单核苷酸多态与食管癌遗传易感性[J].复旦学报(医学版),2008,35(2):273-277,281.
[16]王立东,邹建湘,洪钧言,等.食管癌患者O6-烷基鸟嘌呤-DNA烷基转移酶基因多态性研究[J].华人消化杂志,1998,6(7):560-563.
[17]Sturgis EM, Castillo EJ, Li L,et al. Polymorphisms of DNA repair gene XRCC1 in squamous cell carcinoma of the head and neck[J].Carcinogenesis,1999,20(11):2125-2129.
[18]Lunn RM, Langlois RG, Hsieh LL,et al. XRCC1 polymorphisms:effects on aflatoxin B1-DNA adducts and glycophorin A variant frequency[J]. Cancer Res, 1999, 59(11):2557-2561.
[19]Xing D, Qi J, Miao X,et al. Polymorphisms of DNA repair genes XRCC1 and APD and their associations with risk of esophageal squamous cell carcinoma in a Chinese population[J].Int J Cancer,2002,100(5):600-605.
[20]吴 昊,谢裕安.XRCC1基因多态性与肿瘤易感性的研究进展[J].现代肿瘤医学,2009,17(5):969-972.
[21]张文翠,尹立红,浦跃朴,等.修复酶基因多态性与食管癌易感性关系[J].中国公共卫生,2006,22(5):557-558.
[22]Pandeya N, Olsen CM, Whiteman DC.Sex differences in the proportion of esophageal squamous cell carcinoma cases attributable to tobacco smoking and alcohol consumption[J].Cancer Epidemiol, 2013,37(5):579-84.
[23]Ford BN,Ruttan CC,Kyle VL,et al. Identification of single nueleotide polymorphisms in human DNA repair genes[J].Carcinogenesi.2000,21(11):1977-1981.
[24]刘汝青,庄志雄,何春华,等.O6-甲基鸟嘌呤-DNA甲基转移酶基因多态性与肿瘤易感性的关系[J].癌变·畸变·突变,2002,14(2):l01-106.
[25]刘淑慧,苏 敏,程 璐,等.潮汕地区食管癌患者O6-甲基鸟嘌呤-DNA甲基转移酶基因多态性的分析[J].癌变·畸变·突变,2006,18(2):100-104.
[26]贺新伟,梁 冰.河南食管癌高发区AGT Exon3与食管癌高易感性关系分析[J].中国实用医药,2006,1 (6):6-8.
[27]余 亮,吕国栋,艾尼瓦尔·吐米尔.O6-甲基鸟嘌呤-DNA甲基转移酶基因多态性与新疆哈萨克族食管癌易感性关系的研究[J].地方病通报,2008,23 (6):1-6.
[28]Bartsch H, Montesano R. Relevance of nitrosamines to human cancer[J]. Carcinogenesis, 1984, 5(11):1381-1393.
[29]冯向先,李志芳,王丽冰,等.MGMT基因多态性与食管癌易感性关系[J].中国公共卫生,2008,24(6):697-699.
[30]莫 丽,陈远能.DNA修复基因MGMT、XRCC1在食管癌中表达的研究[J]. 现代肿瘤医学,2010,18(10):1953-1956.
The Association between the AGT、XRCC1 Genetic Polymorphism and the Risk of Esophageal Carcinoma in Northern Sichuan Area*
Liu Fang1, Tan Bangxian1△, Peng Xiaodong2
(1.AffiliatedHospitalofNorthSichuanMedicalCollege,Nanchong617000,Sichuan,China;2.TheSecondPeople’sHospitalofChengdu,Chengdu610017,Sichuan,China)
Objective: This study was aimed to investigate the relationship between the risk of esophageal carcinoma and genetic polymorphisms of DNA damage repair genes (XRCC1 gene Arg194Trp and AGT exon 3 gene Leu84Phe). Methods: A case-control study was conducted to analysis XRCC1 gene Arg194Trp polymorphisms and AGT exon 3 gene Leu84Phe polymorphisms between case group(n=155)and control group(n=127)in northern Sichuan area,and the distribution of age and gender between the two groups had no differences. Interaction effects between two genes’ polymorphisms and the interaction effects between genetic polymorphisms and exogenous factors(smoking,alchohol abuse)were researched. Results: The distribution of XRCC1Arg194Trp genetic polymorphisms and AGT exon 3 Leu84Phe genetic polymorphisms in these two groups had no statistically significant difference (χ2=0.614,P=0.736;χ2=1.826;P=0.177, respectively).Positive interactions between smoking,alcohol abuse and the mutation genotype TT of AGT exon 3 gene Leu84Phe polymorphisms were observed by crossover analysis, the synergy index S was 7.375 and 17.67 respectively. Conclusion: XRCC1 gene 194 genetic polymorphisms and AGT gene exon 3 Leu84Phe polymorphisms may not correlated with the susceptibility of esophageal cancer in northern Sichuan area, however, the AGT gene exon 3 Leu84Phe polymorphisms may have synergistic effect with smoking and drinking which are related with the susceptibility of esophageal cancer.
Esophageal Carcinoma; Genetic Polymorphisms; Interaction Effect; XRCC1; AGT
2015- 09- 25
2015- 11- 30
*四川省青年科技基金项目(2102JQ0051);南充市科技支撑项目(基金号:南市科文2010-44);川北医学院重点实验室基金项目(基金号:KFJJ(10)-08)
刘 芳(1986-),女,四川泸州人,硕士研究生,主要研究方向:肿瘤学。
△谭榜宪,主任医师,E-mail:tbx_nsmc@126.com
R735.1;R73-31;R730.2
A
10.3969/j.issn.1674- 0904.2016.01.002

